修回日期: 2012-03-14
接受日期: 2012-03-25
在线出版日期: 2012-05-08
目的: 探讨慢性乙型肝炎病毒(hepatitis B virus, HBV)感染不同阶段患者外周血CD4+T淋巴细胞中CD4+CXCR5+Tfh细胞及CD4+CD25+FoxP3+Treg细胞的百分比及其意义.
方法: 应用流式细胞术检测15例慢性无症状HBV携带者(chronic asymptomatic HBV carriers, AsC)、42例慢性乙型肝炎(chronic hepatitis B, CHB)患者(HBeAg阳性25例、HBeAg阴性17例)、11例非活动性HBsAg携带者(inactive HBsAg carriers, InC)外周血CD4+CXCR5+Tfh细胞及CD4+CD25+FoxP3+Treg细胞占CD4+T淋巴细胞的百分比, 并与15例健康对照(healthy control, HC)进行比较.
结果: AsC、HBeAg(+)CHB、HBeAg(-)CHB组外周血CD4+CXCR5+Tfh细胞占CD4+T淋巴细胞的比例分别为17.66(15.34%-20.56%), 21.95(19.60%-26.32%), 22.33(17.58%-24.85%), 显著高于HC组的13.67(9.80%-15.32%), 差异具有统计学意义(P<0.001). 与AsC及InC组的16.11(12.33%-19.73%)相比, HBeAg(+)、HBeAg(-)CHB组外周血CD4+CXCR5+Tfh细胞占CD4+T淋巴细胞的比例显著升高(P<0.05). 此外, AsC组外周血CD4+CD25+FoxP3+Treg细胞占CD4+T淋巴细胞的比例为7.70(6.35%-9.13%), 显著高于HC组的6.53(5.54%-7.35%), P<0.05. HBeAg(+)CHB组外周血CD4+T淋巴细胞中CD4+CD25+FoxP3+Treg细胞的频率为7.52(6.09%-8.49%), 与AsC组相比呈降低的趋势. 外周血CD4+CXCR5+Tfh细胞占CD4+T淋巴细胞的比例与HBV DNA载量呈负性相关(r = -0.275, P<0.05); 而与血清ALT水平、HBsAg滴度无相关性.
结论: CD4+CXCR5+Tfh细胞可能参与了慢性HBV感染所介导的免疫反应, 外周血CD4+CD25+FoxP3+Treg细胞及CD4+CXCR5+Tfh细胞的消长可能与疾病的活动性相关.
引文著录: 李凤惠, 吕洪敏, 王芳, 向慧玲, 王凤梅, 李晓爽, 泽塔多吉, 王鹏. 慢性HBV感染者外周血CXCR5+CD4+Tfh细胞的测定及其与FoxP3+Treg细胞的相关性. 世界华人消化杂志 2012; 20(13): 1100-1106
Revised: March 14, 2012
Accepted: March 25, 2012
Published online: May 8, 2012
AIM: To investigate the correlation between the percentages of blood CD4+CXCR5+Tfh cells and those of CD4+CD25+FoxP3+Treg cells in patients with chronic hepatitis B virus (HBV) infection.
METHODS: Fresh peripheral blood samples were collected from 15 chronic asymptomatic HBV carriers (AsC), 42 chronic hepatitis B (CHB) patients, of whom 25 were seropositive and 17 seronegative for HBeAg, 11 inactive HBsAg carriers (InC), and 15 healthy controls. The percentages of CD4+CXCR5+Tfh cells and CD4+CD25+FoxP3+Treg cells were measured by flow cytometry.
RESULTS: The percentages of CD4+CXCR5+Tfh cells in total CD4+T cells isolated from AsC, HBeAg(+)CHB and HBeAg(-)CHB patients were significantly higher than that from healthy controls [17.66 (15.34%-20.56%), 21.95 (19.60%-26.32%), 22.33 (17.58%-24.85%) vs 13.67 (9.80%-15.32%), all P < 0.001]. The percentages of CD4+CXCR5+Tfh cells in HBeAg(+)CHB or HBeAg(-)CHB patients were elevated significantly compared to those in AsC or InC patients, 16.11 (12.33%-19.73%), P < 0.05. The percentage of CD4+CD25+FoxP3+Treg cells in AsC patients was significantly higher than that in healthy controls, 7.70 (6.35%-9.13%) vs 6.53 (5.54%-7.35%), P < 0.05. Meanwhile, there was a decreasing tendency of the percentages of CD4+CD25+FoxP3+Treg cells in HBeAg(+)CHB patients, 7.52 (6.09%-8.49%) compared to AsC patients. A negative correlation was found between the percentages of circulating CD4+CXCR5+Tfh cells and the HBV DNA load (r = -0.275, P < 0.05), while no significant correlation was found between the percentages of circulating CD4+CXCR5+Tfh cells and ALT or HBsAg levels.
CONCLUSION: CD4+CXCR5+Tfh cells may participate in chronic HBV-related immune response, and the relative bias between CD4+CD25+FoxP3+Treg cells and CD4+CXCR5+Tfh cells may correlate with disease activity.
- Citation: Li FH, Lv HM, Wang F, Xiang HL, Wang FM, Li XS, Zeta DJ, Wang P. Correlation between percentages of peripheral blood CD4+CXCR5+Tfh cells and those of FoxP3+Treg cells in patients with chronic hepatitis B virus infection. Shijie Huaren Xiaohua Zazhi 2012; 20(13): 1100-1106
- URL: https://www.wjgnet.com/1009-3079/full/v20/i13/1100.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i13.1100
慢性乙型肝炎病毒(hepatitis B virus, HBV)感染的转归主要取决于病毒和机体免疫应答2个方面, 机体免疫功能紊乱, 尤其是T淋巴细胞亚群与其细胞因子的失调与慢性肝病的发生、发展密切相关[1-3]. 滤泡辅助性T细胞(follicular T helper cell, Tfh)是新近认识到的CD4+T细胞亚群中的一种, 是B细胞最主要的辅助细胞[4,5]. Tfh功能的异常与多种疾病的发生有关[6-9]. 研究发现, Tfh细胞可能参与了慢性病毒感染所介导的免疫反应[10,11]. FoxP3+调节性T细胞(regulatory T cell, Treg)是一类具有免疫抑制作用的T细胞亚群, 能够抑制免疫应答的强度从而维持机体的免疫平衡[12,13]. 近来发现, Treg细胞能够对Tfh细胞的功能及生发中心的反应进行调节[14,15]. 因此, Tfh细胞与Treg细胞在分化发育和功能发挥上可能存在相互抑制的作用. 为研究CD4+CXCR5+Tfh细胞在慢性HBV感染不同阶段的特征及其与CD4+CD25+FoxP3+Treg细胞的相关性, 我们应用流式细胞仪对慢性HBV感染不同阶段患者及健康志愿者外周血中的2种细胞进行了测定.
收集2010-12/2011-11就诊于天津市第三中心医院的慢性HBV感染者78例, 包括慢性HBV携带者(chronic asymptomatic HBV carriers, AsC)15例, 慢性乙型肝炎(chronic hepatitis B, CHB)患者42例(HBeAg阳性25例, HBeAg阴性17例), 非活动性HBsAg携带者(inactive HBsAg carriers, InC)11例. 入选标准: (1)所有患者的诊断均符合2010版《慢性乙型肝炎防治指南》[16]; (2)CHB患者入选前均未接受过干扰素及核苷类似物抗病毒治疗; 非活动性HBsAg携带者为既往HBV感染, 经抗病毒治疗或自发病变静息后, HBeAg转阴并已停用抗病毒药物1年以上; (3)排除同时合并其他肝炎病毒感染者; 排除合并肝硬化、肝细胞癌、脂肪肝、酒精性肝病、自身免疫性肝病等慢性肝脏疾病者. 另选取15例血清丙氨酸转氨酶(alanine transaminase, ALT)正常, HBsAg阴性的健康查体者作为对照组(healthy control, HC). 鼠抗人CD4-FITC抗体、CD25-PECY5抗体及各自同型对照购自美国Beckman公司; 鼠抗人FoxP3-PE抗体及其同型对照购自eBioscience公司; 鼠抗人CXCR5-Percp抗体及其同型对照购自RD公司; 流式细胞仪及其配套软件购自美国Beckman公司.
1.2.1 流式细胞术检测外周血CD4+CXCR5+Tfh细胞: 试验对象均于清晨空腹抽取外周静脉血1 mL, 经枸橼酸钠(EDTA)抗凝后, 静置送检. 检测步骤如下: 取新鲜抗凝外周血100 µL, 加入CD4-FITC、CXCR5-Percp抗体各10 µL, 另取新鲜抗凝外周血100 µL加入10 µL CD4-FITC, CXCR5同型对照-Percp抗体作对照. 室温避光孵育30 min, 分别加入溶血素4.5 mL, 37 ℃气浴振荡10 min, 裂解红细胞, 1 600 r/min离心6 min, 弃上清. 每管加入PBS洗液2 mL, 1 600 r/min离心5 min, 弃上清, 重复洗1遍. 加入1%多聚甲醛固定, 上机检测. Expo32软件收获细胞并进行数据分析, 记录CD4+CXCR5+Tfh细胞占CD4+T细胞的百分比.
1.2.2 流式细胞术检测外周血CD4+CD25+FoxP3+Treg细胞: 取新鲜抗凝外周血100 µL加入10 µL CD4-FITC、CD25-PECY5抗体, 另取新鲜抗凝外周血100 µL加入10 µL CD4-FITC, CD25-同型对照PECY5抗体作对照. 室温避光孵育30 min, 分别加入溶血素4.5 mL裂解10 min, 1 600 r/min离心6 min, 弃上清. 加入新配置的破膜剂1 mL, 4 ℃冰箱孵育1 h, 1 600 r/min离心6 min, 弃上清. 加入破膜缓冲液2 mL进行洗涤, 1 600 r/min离心5 min, 弃上清, 重复洗1遍. 样品管中加入FoxP3-PE抗体5 µL, 对照管内加入FoxP3同型对照-PE抗体5 µL, 4 ℃避光孵育30 min. 加入破膜缓冲液洗涤2遍, 离心弃上清, 加入1%多聚甲醛固定. Expo32软件收获细胞并进行数据分析, 记录CD4+CD25+FoxP3+Treg细胞占CD4+T细胞的百分比.
1.2.3 血清标记物的检测: 使用全自动生物化学分析仪对ALT进行检测, 正常值范围为≤40 U/L; HBV血清学标志物(HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc)采用酶联免疫吸附法检测; HBV DNA定量检测采用ABIPrism7000荧光定量PCR法检测, 正常值范围为≤1 000 copies/mL, 检测下限为100 copies/mL; HBsAg定量检测采用ARCHITECT i2000系统化学发光法检测, HBsAg检测值<0.05 IU/mL为阴性.
统计学处理 采用SPSS13.0软件进行统计分析, 结果以中位数(四分位数点)[median(IQR)]表示, 多组间的比较采用Kruskal-Wallis检验, 两组间的比较采用Mann-Whitney U检验, 相关分析采用Spearman秩检验, P<0.05为差异具有统计学意义.
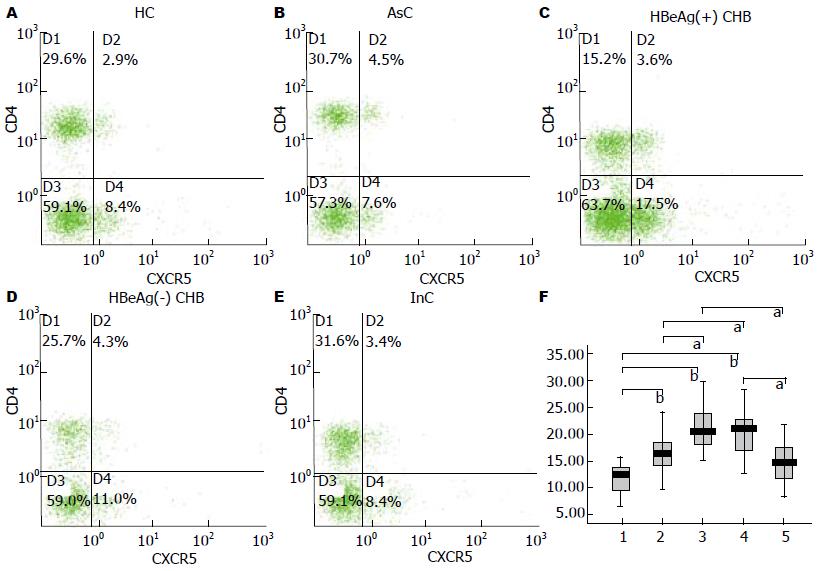
患者的基本资料见表1.
| HC(n = 15) | AsC(n = 15) | HBeAg(+)CHB(n = 25) | HBeAg(-)CHB(n = 17) | InC(n = 11) | |
| 年龄(岁) | 33(27-44) | 28(23-38) | 32(25-42) | 49(45-57) | 39(34-48) |
| 性别(男/女) | 8/7 | 6/9 | 14/11 | 9/8 | 4/7 |
| ALT(U/L) | 24.4(19.8-30.1) | 23.0(19.0-29.0) | 155.0(107.0-320.5) | 172.0(63.0-299.5) | 23.0(14.0-31.0) |
| HBsAg(+/-) | 0/15 | 15/0 | 25/0 | 17/0 | 11/0 |
| HBsAg(log10 IU/mL) | ND1 | 4.28(3.94-4.62) | 3.95(3.24-4.21) | 3.42(2.31-3.99) | 2.27(1.61-3.55) |
| HBeAg(+/-) | 0/15 | 15/0 | 25/0 | 0/17 | 0/11 |
| HBV DNA (log10 copies/mL) | ND1 | 7.5(7.0-8.4) | 7.1(6.6-7.6) | 4.6(4.1-6.5) | NA2 |
HC、AsC、HBeAg(+)CHB、HBeAg(-)CHB、InC组外周血CD4+CXCR5+Tfh细胞占CD4+T淋巴细胞的比例分别为: 13.67(9.80%-15.32%), 17.66(15.34%-20.56%), 21.95(19.60%-26.32%), 22.33(17.58-24.85), 16.11(12.33%-19.73%). 与HC组相比, AsC、HBeAg(+)CHB、HBeAg(-)CHB组外周血CD4+T细胞中CD4+CXCR5+Tfh细胞频率显著升高(P<0.001), 差异具有统计学意义. 此外, HBeAg(+)及HBeAg(-)CHB组外周血CD4+CXCR5+Tfh细胞占CD4+T淋巴细胞的比例均高于AsC与InC组(P<0.05), 差异具有统计学意义. 而该比例在HBeAg(+)CHB组与HBeAg(-)CHB组之间的差异无统计学意义(图1).
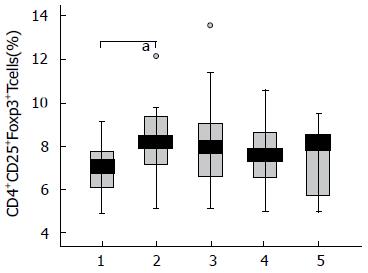
各组外周血CD4+CD25+FoxP3+Treg细胞占CD4+T淋巴细胞的比值分别为: HC 6.53(5.54%-7.35%), AsC 7.70(6.35%-9.13%), HBeAg(+)CHB 7.52(6.09%-8.49%), HBeAg(-)CHB 7.17(5.72%-8.13%), InC 7.59(5.13%-8.06%). AsC组外周血CD4+T淋巴细胞中CD4+CD25+FoxP3+Treg细胞的频率显著高于HC组(P<0.05), 差异具有统计学意义. HBeAg(+)CHB组外周血CD4+T淋巴细胞中CD4+CD25+FoxP3+Treg细胞的频率较AsC组有降低的趋势, 差异无统计学意义(图2).
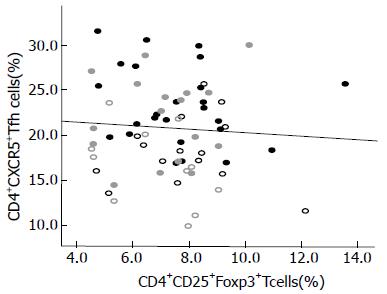
慢性HBV感染者外周血CD4+CXCR5+Tfh细胞与CD4+CD25+FoxP3+Treg细胞之间无相关性. 此外, AsC、HBeAg(+)CHB、HBeAg(-)CHB、InC组外周血CD4+CXCR5+Tfh细胞与CD4+CD25+FoxP3+Treg细胞之间亦无明显相关性(图3).
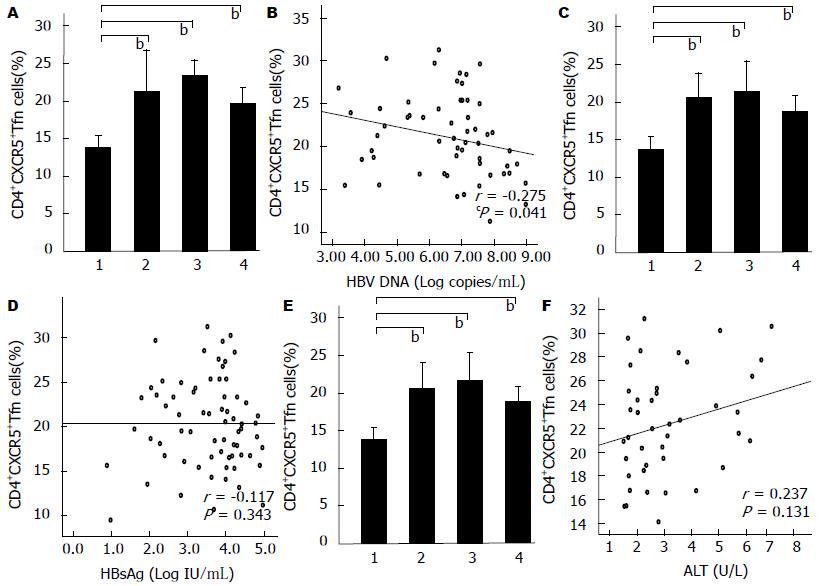
DNA、HBsAg、ALT的相关性 将AsC、CHB组按血清HBV DNA载量的高低分为: HBV DNA<105(n = 11), 105-107(n = 22), >107(n = 24)3组, 3组患者外周血CD4+CXCR5+Tfh细胞占CD4+T淋巴细胞的百分比分别为: 21.21%(18.43%-24.36%), 23.34%(18.34%-25.83%), 19.48%(16.78%-21.89%), 较HC组均有不同程度升高(P<0.001); 与HBV DNA<105, 105-107组比较, HBV DNA>107组外周血CD4+CXCR5+Tfh细胞的频率虽无统计学差异, 但有降低的趋势(图4A). 外周血CD4+CXCR5+Tfh细胞占CD4+T淋巴细胞的百分比与血清HBV DNA载量呈负性相关(r = -0.275, P = 0.041, 图4B).
将AsC、CHB、InC组按血清HBsAg滴度的高低分为: HBsAg<1 600(n = 22), 1 600-15 000(n = 27), >15 000(n = 19)3组[1], 3组患者外周血CD4+CXCR5+Tfh细胞占CD4+T细胞的百分比分别为: 20.54%(16.59%-23.98%), 21.56%(16.60%-26.75%), 18.87%(16.76%-20.89%), 较HC组均有不同程度升高(P<0.001); 与HBsAg<1 600, 1 600-15 000组比较, HBsAg>15 000组外周血CD4+CXCR5+Tfh细胞的频率虽无统计学差异, 但有降低的趋势(图4C). 慢性HBV感染者外周血CD4+CXCR5+Tfh细胞占CD4+T淋巴细胞的百分比与血清HBsAg滴度无相关性(图4D).
将CHB组按血清ALT水平的高低分为: ALT<2 ULN(n = 11), 2-8 ULN(n = 22), >8 ULN(n = 9)3组, 3组患者外周血CD4+CXCR5+Tfh细胞占CD4+T淋巴细胞的百分比分别为20.89%(16.76%-25.11%), 22.14%(18.76%-25.03%), 23.87%(20.66%-28.20%), 较HC组均有不同程度升高(P<0.001); 3组患者外周血CD4+CXCR5+Tfh细胞占CD4+T淋巴细胞的百分比呈递增的趋势, 组间差异无统计学意义(图4E). 外周血CD4+CXCR5+Tfh细胞占CD4+T淋巴细胞的百分比与血清ALT水平无相关性(图4F).
随着血清HBV DNA载量、HBsAg滴度的增高及ALT水平的降低, 外周血CD4+T淋巴细胞中CD4+CXCR5+Tfh细胞的频率虽无统计学差异, 但呈降低的趋势; 外周血CD4+CXCR5+Tfh细胞占CD4+T淋巴细胞的百分比与血清HBV DNA载量呈负性相关(P<0.05), 而与血清HBsAg滴度、ALT水平无相关性.
CD4+CXCR5+Tfh细胞是新近发现的、不同于Th1、Th2和Th17的辅助性T细胞亚群, 因其定位于淋巴滤泡生发中心, 能辅助B细胞产生长久的、高亲和力的抗体而被命名, 2000年由Schaerli和Breitfeld首次报道[17,18]. 目前认为, Tfh细胞具有独立的分化和调节机制, 能够持续表达CXCR5和高水平的ICOS及PD-1产生效应因子IL-21[19-22]. Tfh细胞功能失调与多种自身免疫性疾病的发生有关[7,9,23,24]. 研究发现, 系统性红斑狼疮(systemic lupus erythematosus, SLE)及干燥综合征(Sjøgren's syndrome, SS)患者外周血CD4+CXCR5+T细胞数量明显增高, 并且与生发中心Tfh细胞一样能同时表达ICOS或PD-1, 故将其称为循环型Tfh细胞. 同时发现循环型Tfh细胞数量与SLE患者病情严重程度相关[9]. Feng等[11]报道, CHB患者外周血CD4+CXCR5+, CD4+CXCR5+ICOS+及CD4+CXCR5+PD-1+Tfh细胞数目升高, 推测Tfh细胞可能参与了CHB的免疫紊乱.
在本研究中, 慢性HBV感染患者体内均存在不同程度CD4+CXCR5+Tfh细胞的升高, 而处于免疫清除期的CHB患者水平最高, 提示CD4+CXCR5+Tfh细胞可能参与了慢性HBV感染所介导的免疫反应, 并与疾病的活动性相关. 此外, 通过相关分析发现, CD4+CXCR5+Tfh细胞的频率与HBV DNA载量呈负性相关, 提示CD4+CXCR5+Tfh细胞的增高可能有利于机体对HBV的清除. 因此, 外周血CD4+CXCR5+Tfh细胞的测定, 可能为慢性HBV感染患者治疗时机的选择提供依据.
FoxP3+Treg细胞是一群专职的主动抑制针对自身抗原或外来抗原免疫反应的细胞, 在维持机体免疫平衡中发挥重要作用[12,13]. Treg细胞不仅能够抑制Th1、Th2、Th17等效应T细胞所介导的免疫反应[25-27], 还能迁移到淋巴滤泡对Tfh细胞的功能进行调节[14,15]. Aoki等[28]在研究NTx-PD-1-/-小鼠模型时发现, FoxP3+Treg细胞的减少及CD4+CXCR5+Tfh细胞的异常聚集导致了自身免疫性肝炎(autoimmune hepatitis, AIH)的发生. 因此CD4+CXCR5+Tfh细胞与FoxP3+Treg细胞平衡失调可能参与了AIH异常自身免疫过程. 在本研究中, 与AsC比较, HBeAg(+)CHB患者外周血FoxP3+Treg细胞数有降低的趋势, 而CD4+CXCR5+Tfh细胞数有增高的趋势. 提示由AsC进展到HBeAg(+)CHB的过程中, FoxP3+Treg细胞降低, 使得AsC打破免疫耐受进入免疫清除期, 同时伴有CD4+CXCR5+Tfh细胞的增多, 以便对B细胞提供更有利的辅助. 因此CD4+CXCR5+Tfh细胞及FoxP3+Treg细胞的消长可能与疾病的活动性有关.
近来发现位于生发中心的Tfh细胞具有部分Th1、Th2及Th17细胞的特征, 能产生Th1, Th2及Th17相关细胞因子[29-31]. Morita等[32]发现人类外周血CD4+CXCR5+Tfh细胞具有不均一性, 包含Th1、Th2及Th17样Tfh细胞. 其中Th2及Th17样Tfh细胞能够对B细胞提供辅助, 而Th1样Tfh细胞则不能辅助B细胞. 青少年皮肌炎(juvenile dermatomyositis, JDM)患者体内Th2及Th17样Tfh细胞过度表达, 使得Th2、Th17/Th1样Tfh细胞比例严重失衡, 并发现Th2、Th17样Tfh细胞而非CD4+CXCR5+Tfh细胞总量与JDM患者体内自身抗体滴度及浆母细胞数相关. 与上述研究结果相似, 本研究中慢性HBV感染者外周血CD4+CXCR5+Tfh细胞数与血清HBsAg滴度无相关性. 我们还发现随着血清ALT水平的增高, 外周血CD4+CXCR5+Tfh细胞的频率随之增高, 推测可能与CD4+CXCR5+Tfh细胞中Th17样Tfh细胞的增高有关. 此外, 本研究中非活动性HBsAg携带者血清HBeAg虽已转阴, 但外周血CD4+CXCR5+Tfh细胞数与HBeAg(+)CHB患者相比有降低的趋势. 研究也发现, 经阿德福韦酯抗病毒治疗后, 随着HBeAb的产生, CHB患者外周血CD4+CXCR5+Tfh细胞数反而有所下降[19]. 因此推测慢性HBV感染的过程中, 尤其是经抗病毒治疗后, 患者体内的CD4+CXCR5+Tfh细胞不仅数量发生了变化, 内部亚群(Th2、Th17/Th1样Tfh细胞)的比例也可能发生了改变.
总之, CD4+CXCR5+Tfh细胞可能参与了慢性HBV感染所介导的免疫反应, 患者由免疫耐受期进入免疫清除期的过程中, 伴有CD4+CD25+FoxP3+Treg细胞降低及CD4+CXCR5+Tfh细胞的升高, 二者的消长可能与疾病的活动性有关. 因此, 外周血CD4+CXCR5+Tfh细胞协同FoxP3+Treg细胞的检测, 不仅有助于患者免疫状态的判断, 亦可能为慢性HBV感染患者治疗时机的选择提供依据. 而慢性HBV感染者体内是否存在Th2、Th17及Th1样Tfh细胞的比例失衡及其在抗病毒治疗过程中的意义还需要扩大样本的进一步研究加以明确.
滤泡辅助T细胞(Tfh)作为B细胞产生抗体的最主要辅助性T细胞, 对于机体免疫稳态的维持起着重要作用. 而慢性HBV感染者体内存在一系列免疫紊乱, Tfh细胞是否参与其中尚不清楚.
杨江华, 副教授, 安徽省芜湖市皖南医学院弋矶山医院感染科
滤泡辅助性T细胞是B细胞最主要的辅助细胞, 可能参与了慢性病毒感染所介导的免疫反应; FoxP3+调节性T细胞是一类具有免疫抑制作用的T细胞亚群, 能够抑制免疫应答的强度从而维持机体的免疫平衡.
Feng等应用流式细胞术对不同组别患者外周血D4+CXCR5+Tfh细胞进行检测, 发现处于免疫清除期的CHB患者外周血D4+CXCR5+Tfh细胞的频率显著高于处于免疫耐受期的CHB患者及健康对照组.
本研究从疾病进展的角度出发, 对慢性HBV感染不同阶段患者外周血滤泡辅助性T细胞及调节性T细胞进行检测, 从而发现Treg及Tfh细胞的消长可能与疾病的活动性相关.
外周血CD4+CXCR5+Tfh细胞协同FoxP3+Treg细胞的检测, 不仅有助于患者免疫状态的判断, 亦可能为慢性HBV感染患者治疗时机的选择提供依据.
本研究内容较为新颖, 文中所涉及的研究内容对慢性肝脏疾病尤其是慢性乙型肝炎患者的临床预后判断具有一定指导意义.
编辑: 张珊珊 电编:鲁亚静
| 1. | Hui CK, Lau GK. Immune system and hepatitis B virus infection. J Clin Virol. 2005;34 Suppl 1:S44-S48. [PubMed] [DOI] |
| 2. | Ren F, Hino K, Yamaguchi Y, Funatsuki K, Hayashi A, Ishiko H, Furutani M, Yamasaki T, Korenaga K, Yamashita S. Cytokine-dependent anti-viral role of CD4-positive T cells in therapeutic vaccination against chronic hepatitis B viral infection. J Med Virol. 2003;71:376-384. [PubMed] [DOI] |
| 3. | 闫 杰, 谢 雯, 冯 鑫, 蔺 亚辉, 王 蓓蓓, 肖 江, 欧 蔚妮, 王 艳斌, 成 军. HBcAg特异性CTL在急性乙型肝炎与慢性乙型肝炎急性发作患者外周血中的数量差异. 世界华人消化杂志. 2011;19:404-406. |
| 4. | Murphy KM, Reiner SL. The lineage decisions of helper T cells. Nat Rev Immunol. 2002;2:933-944. [PubMed] [DOI] |
| 5. | Nurieva RI, Chung Y, Hwang D, Yang XO, Kang HS, Ma L, Wang YH, Watowich SS, Jetten AM, Tian Q. Generation of T follicular helper cells is mediated by interleukin-21 but independent of T helper 1, 2, or 17 cell lineages. Immunity. 2008;29:138-149. [PubMed] [DOI] |
| 6. | Yu D, Batten M, Mackay CR, King C. Lineage specification and heterogeneity of T follicular helper cells. Curr Opin Immunol. 2009;21:619-625. [PubMed] [DOI] |
| 7. | de Leval L, Rickman DS, Thielen C, Reynies A, Huang YL, Delsol G, Lamant L, Leroy K, Brière J, Molina T. The gene expression profile of nodal peripheral T-cell lymphoma demonstrates a molecular link between angioimmunoblastic T-cell lymphoma (AITL) and follicular helper T (TFH) cells. Blood. 2007;109:4952-4963. [PubMed] [DOI] |
| 8. | Coraglia A, Felippo M, Schierloh P, Malbran A, de Bracco MM. CD4+ T Lymphocytes with follicular helper phenotype (T(FH)) in patients with SH2D1A deficiency (XLP). Clin Immunol. 2011;141:357-364. [PubMed] [DOI] |
| 9. | Simpson N, Gatenby PA, Wilson A, Malik S, Fulcher DA, Tangye SG, Manku H, Vyse TJ, Roncador G, Huttley GA. Expansion of circulating T cells resembling follicular helper T cells is a fixed phenotype that identifies a subset of severe systemic lupus erythematosus. Arthritis Rheum. 2010;62:234-244. [PubMed] [DOI] |
| 10. | Harker JA, Lewis GM, Mack L, Zuniga EI. Late interleukin-6 escalates T follicular helper cell responses and controls a chronic viral infection. Science. 2011;334:825-829. [PubMed] [DOI] |
| 11. | Feng J, Lu L, Hua C, Qin L, Zhao P, Wang J, Wang Y, Li W, Shi X, Jiang Y. High frequency of CD4+ CXCR5+ TFH cells in patients with immune-active chronic hepatitis B. PLoS One. 2011;6:e21698. [PubMed] [DOI] |
| 12. | Banham AH, Powrie FM, Suri-Payer E. FOXP3+ regulatory T cells: Current controversies and future perspectives. Eur J Immunol. 2006;36:2832-2836. [PubMed] [DOI] |
| 13. | Tan AT, Koh S, Goh W, Zhe HY, Gehring AJ, Lim SG, Bertoletti A. A longitudinal analysis of innate and adaptive immune profile during hepatic flares in chronic hepatitis B. J Hepatol. 2010;52:330-339. [PubMed] [DOI] |
| 14. | Linterman MA, Pierson W, Lee SK, Kallies A, Kawamoto S, Rayner TF, Srivastava M, Divekar DP, Beaton L, Hogan JJ. Foxp3+ follicular regulatory T cells control the germinal center response. Nat Med. 2011;17:975-982. [PubMed] [DOI] |
| 15. | Wollenberg I, Agua-Doce A, Hernández A, Almeida C, Oliveira VG, Faro J, Graca L. Regulation of the germinal center reaction by Foxp3+ follicular regulatory T cells. J Immunol. 2011;187:4553-4560. [PubMed] [DOI] |
| 17. | Schaerli P, Willimann K, Lang AB, Lipp M, Loetscher P, Moser B. CXC chemokine receptor 5 expression defines follicular homing T cells with B cell helper function. J Exp Med. 2000;192:1553-1562. [PubMed] [DOI] |
| 18. | Breitfeld D, Ohl L, Kremmer E, Ellwart J, Sallusto F, Lipp M, Förster R. Follicular B helper T cells express CXC chemokine receptor 5, localize to B cell follicles, and support immunoglobulin production. J Exp Med. 2000;192:1545-1552. [PubMed] [DOI] |
| 19. | Zhu J, Yamane H, Paul WE. Differentiation of effector CD4 T cell populations (*). Annu Rev Immunol. 2010;28:445-489. [PubMed] [DOI] |
| 20. | Johnston RJ, Poholek AC, DiToro D, Yusuf I, Eto D, Barnett B, Dent AL, Craft J, Crotty S. Bcl6 and Blimp-1 are reciprocal and antagonistic regulators of T follicular helper cell differentiation. Science. 2009;325:1006-1010. [PubMed] [DOI] |
| 21. | Nurieva RI, Chung Y, Martinez GJ, Yang XO, Tanaka S, Matskevitch TD, Wang YH, Dong C. Bcl6 mediates the development of T follicular helper cells. Science. 2009;325:1001-1005. [PubMed] [DOI] |
| 22. | King C, Tangye SG, Mackay CR. T follicular helper (TFH) cells in normal and dysregulated immune responses. Annu Rev Immunol. 2008;26:741-766. [PubMed] [DOI] |
| 23. | Zhu C, Ma J, Liu Y, Tong J, Tian J, Chen J, Tang X, Xu H, Lu L, Wang S. Increased frequency of follicular helper T cells in patients with autoimmune thyroid disease. J Clin Endocrinol Metab. 2012;97:943-950. [PubMed] [DOI] |
| 24. | Linterman MA, Rigby RJ, Wong RK, Yu D, Brink R, Cannons JL, Schwartzberg PL, Cook MC, Walters GD, Vinuesa CG. Follicular helper T cells are required for systemic autoimmunity. J Exp Med. 2009;206:561-576. [PubMed] [DOI] |
| 25. | Koch MA, Tucker-Heard G, Perdue NR, Killebrew JR, Urdahl KB, Campbell DJ. The transcription factor T-bet controls regulatory T cell homeostasis and function during type 1 inflammation. Nat Immunol. 2009;10:595-602. [PubMed] [DOI] |
| 26. | Zheng Y, Chaudhry A, Kas A, deRoos P, Kim JM, Chu TT, Corcoran L, Treuting P, Klein U, Rudensky AY. Regulatory T-cell suppressor program co-opts transcription factor IRF4 to control T(H)2 responses. Nature. 2009;458:351-356. [PubMed] [DOI] |
| 27. | Chaudhry A, Rudra D, Treuting P, Samstein RM, Liang Y, Kas A, Rudensky AY. CD4+ regulatory T cells control TH17 responses in a Stat3-dependent manner. Science. 2009;326:986-991. [PubMed] [DOI] |
| 28. | Aoki N, Kido M, Iwamoto S, Nishiura H, Maruoka R, Tanaka J, Watanabe T, Tanaka Y, Okazaki T, Chiba T. Dysregulated generation of follicular helper T cells in the spleen triggers fatal autoimmune hepatitis in mice. Gastroenterology. 2011;140:1322-1333. e1-e5. [PubMed] |
| 29. | Leavy O. T cells: The TFH-like transition of TH1 cells. Nat Rev Immunol. 2012;12:74. [PubMed] [DOI] |
| 30. | Zaretsky AG, Taylor JJ, King IL, Marshall FA, Mohrs M, Pearce EJ. T follicular helper cells differentiate from Th2 cells in response to helminth antigens. J Exp Med. 2009;206:991-999. [PubMed] [DOI] |
| 31. | Bauquet AT, Jin H, Paterson AM, Mitsdoerffer M, Ho IC, Sharpe AH, Kuchroo VK. The costimulatory molecule ICOS regulates the expression of c-Maf and IL-21 in the development of follicular T helper cells and TH-17 cells. Nat Immunol. 2009;10:167-175. [PubMed] [DOI] |
| 32. | Morita R, Schmitt N, Bentebibel SE, Ranganathan R, Bourdery L, Zurawski G, Foucat E, Dullaers M, Oh S, Sabzghabaei N. Human blood CXCR5(+)CD4(+) T cells are counterparts of T follicular cells and contain specific subsets that differentially support antibody secretion. Immunity. 2011;34:108-121. [PubMed] [DOI] |