修回日期: 2012-03-15
接受日期: 2012-03-20
在线出版日期: 2012-04-28
目的: 研究小容量高渗盐羟乙基淀粉液(HSH)复苏失血性休克大鼠时肠黏膜形态的变化和血清NO浓度变化.
方法: SD大鼠麻醉后放血致平均动脉压40 mmHg±5 mmHg, 维持30 min, SD大鼠随机分成3组: (1)高渗盐羟乙基淀粉复合液+回输失血(HSH组); (2)乳酸林格液复苏+回输失血(LR组); (3)假休克组, 只进行血管置管; 观察休克前后血浆NO浓度的动态变化, 并留取小肠组织观察病理改变.
结果: HSH组大鼠复苏后血浆NO无明显下降, 复苏前(30.03 μmol/L±4.77 μmol/L)和复苏后(27.33 μmol/L±8.76 μmol/L)比较, 无显著差异(P>0.05), 小肠的病理损伤也显著减轻. LR组血浆NO浓度明显降低, 复苏前(28.37 μmol/L±6.24 μmol/L)和复苏后(17.48 μmol/L±5.24 μmol/L)比较, 有显著差异(P<0.05), 小肠的病理损伤无明显改善.
结论: 应用HSH有助于改善失血休克引起的肠道损伤; 其机制可能与HSH减少内皮细胞功能损害有关.
引文著录: 李震, 欧阳军. 高渗盐胶体对失血性休克大鼠小肠黏膜形态的影响. 世界华人消化杂志 2012; 20(12): 1041-1045
Revised: March 15, 2012
Accepted: March 20, 2012
Published online: April 28, 2012
AIM: To evaluate the effect of small-volume hypertonic sodium chloride hydroxyethyl starch injection on histopathological changes in the intestinal mucosa and plasma levels of NO in rats with hemorrhagic shock.
METHODS: Male SD rats were hemorrhaged to the mean arterial pressure of 40 mmHg ± 5 mmHg for 30 min to induce hemorrhagic shock. Animals were randomly divided into three groups: rats resuscitated with 4 mL/kg of 5.0% hypertonic sodium chloride hydroxyethyl starch injection and retransfused shed blood, those resuscitated with lactated Ringer's solution (two times the volume of shed blood) and retransfused shed blood, and those undergoing sham hemorrhage. The dynamic changes in plasma NO concentrations were monitored, and pathological changes in the small intestine were observed.
RESULTS: After resuscitation with hypertonic sodium chloride hydroxyethyl starch injection, NO showed no significant changes (P > 0.05), and pathological changes in the small intestine were significantly reduced. In contrast, plasma NO concentration significantly decreased (P < 0.05) and pathological damage to the small intestine showed no significant improvement in rats resuscitated with lactated Ringer's solution.
CONCLUSION: Resuscitation with hypertonic sodium chloride hydroxyethyl starch injection reduces intestinal damage in rats hemorrhagic shock possibly via a mechanism associated with protection of endothelial cell function.
- Citation: Li Z, Ouyang J. Hypertonic sodium chloride hydroxyethyl starch injection reduces histopathological changes in the intestinal mucosa of rats with hemorrhagic shock. Shijie Huaren Xiaohua Zazhi 2012; 20(12): 1041-1045
- URL: https://www.wjgnet.com/1009-3079/full/v20/i12/1041.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i12.1041
失血性休克液体复苏可以引起肠缺血再灌注损伤, 从而导致肠黏膜损伤并破坏黏膜细胞的胃屏障作用, 肠道内细菌和内毒素通过通透性增加的黏膜入侵机体, 具有强烈致炎物质的刺激源肠道持续输送到机体, 诱发多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)和脓毒症的最重要原因之一就是这一过程[1]. 大量等渗晶体溶液复苏是传统复苏方法, 组织容易水肿, 尤其是发生肺水肿. 小容量高渗盐溶液是近年来在创伤失血性休克复苏逐渐形成的又一新的休克复苏途径. NO作为强大的血管扩张剂和血管完整性的保护者发挥着有益的作用. 许多研究显示NO降低缺血再灌注后黏膜损伤[2]和减少肠缺血引起的肺损伤[3]. 另一方面, NO与超氧阴离子结合生成过氧亚硝基阴离子(ONOO-), 他是可以导致组织损伤的强氧化剂[4]. 本研究的目的是以高容量的乳酸林格氏溶液为对照, 探讨小容量高渗盐羟乙基淀粉复合液对失血性休克大鼠早期全身血流动力学、肠道组织灌注和血清NO的影响.
♂SD大鼠30只, 体质量为250 g±50 g, 由石河子大学医学院动物实验中心提供.
1.2.1 失血性休克动物模型建立: SD大鼠称质量后, 给予腹腔注射10%水合氯醛0.5 mL/100 g麻醉, 右颈内静脉置入套管针输液, 左侧颈动脉置入套管针监测有创平均动脉压, 右侧股动脉置管备用放血和采血, 15 min内分次放血容量占总血容量40%, 使平均动脉压(MAP)稳定维持在35-45 mmHg 30 min, 进入实验组.
1.2.2 分组: SD大鼠30只被随即分成A、B、C组, 每组10只. A组(正常组)大鼠只进行动静脉置管测血压处理. B组(HSH组)用5%高渗盐羟乙基淀粉混合液进行容量复苏. C组(LR组)采用二倍失血量的乳酸林格氏溶液进行容量复苏. 所有液体均在30 min内输入, 复苏溶液输注完毕后在30 min内回输失血.
1.2.3 血流动力学监测: 成都泰盟电子有限公司BL-420智能型生物信号采集与处理系统换能器连接左侧颈总动脉插管连续监测血压.
1.2.4 肠黏膜组织形态学观察: 实验组大鼠处死后取距回盲部4 cm处的小肠组织标本, 标本约3 cm×3 cm大小, 保存在10%甲醛溶液中. 以同样的方法取正常组相同大小的小肠标本.
1.2.5 血清NO含量的检测: 在各时间点采集血样后, 1 500 r/min离心15 min后取血清备测. 检测试剂盒购自南京建成生物医学工程研究所, 严格按试剂盒说明进行操作.
统计学处理 统计学分析应用SPSS17.0统计软件包. 计量资料数据用mean±SD表示, 血流动力学及血清NO前后比较应用自身配对t检验, 多组均数比较采用单因素方差分析的方法, 均数间两两比较采用q检验, 等级资料两样本比较采用秩和检验, P<0.05为差异有显著性.
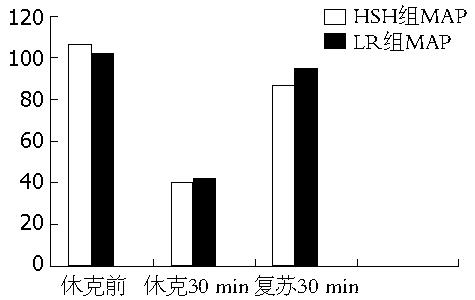
2组动物在放血形成失血性休克模型后, MAP较基础正常明显下降, 两组容量复苏所用液体量分别是: LR组2倍失血量; HSH组4 mL/kg. 两组溶液复苏完毕30 min, 每组的平均动脉压均得到明显的改善, 与休克时相比较均有明显的统计学差异(P<0.05), 复苏30 min后, LR组和HSH组相比较平均动脉压回升稍高, 但无统计学意义(P>0.05, 图1).
在休克前正常组血清NO浓度为30.98 μmol/L±5.99 μmol/L, HSH组为31.14 μmol/L±5.57 μmol/L, LR组为31.47 μmol/L±5.27 μmol/L, 休克30 min后血清NO浓度HSH组为30.03 μmol/L±4.77 μmol/L, LR组为28.37 μmol/L±6.24 μmol/L, 正常组血清NO浓度为29.06 μmol/L±5.93 μmol/L, 复苏1 h, LR组血清NO含量明显降低, 与正常组、HSH组相比较有统计学意义(P<0.05, 表1).
| 分组 | Pre-s | 休克30 min | 复苏60 min |
| 正常组 | 30.98±5.99 | 29.06±5.93 | 28.92±6.03 |
| HSH组 | 31.14±5.57 | 30.03±4.77 | 27.33±8.76 |
| LR组 | 31.47±5.27 | 28.37±6.24 | 17.48±5.24 |
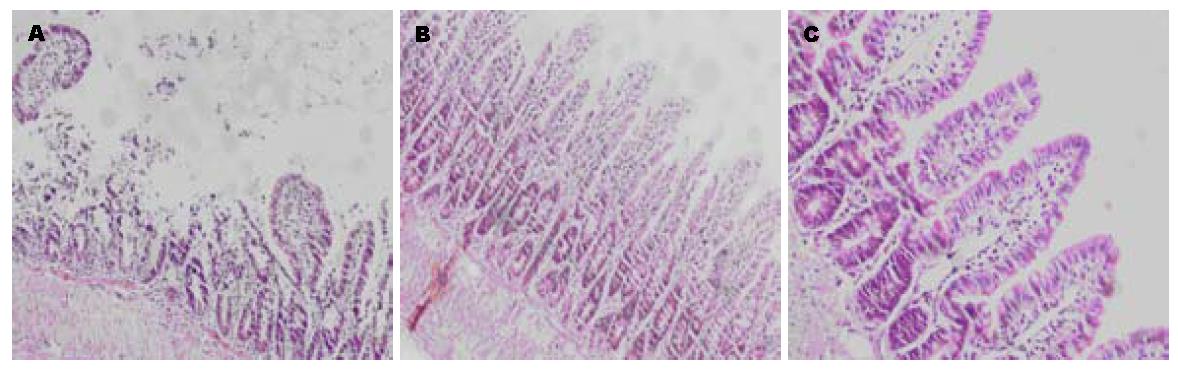
回肠黏膜病理分析, Chiu等[5]对正常组、HSH组、LR组评分分别为0.34±0.260、2.03±0.438、3.50±0.361, 正常组回肠表现为正常黏膜结构(图2); HSH组回肠黏膜受损明显轻于LR组, 所得数据使用非参数Kruskal-Wallis检验, P<0.05, 提示三组之间有显著性差异. HSH组间与LR组, HSH组与正常组比较采用Dunnps Q检验, HSH组间与LR组, HSH组与正常组之间比较有显著性差异(P<0.05).
创伤导致大量失血是创伤患者和军事战斗人员死亡的首要原因. 休克导致血管不成比例的收缩和心输出量的再分配, 并由复苏、再灌注肠道触发的全身炎症反应引起邻近和远处器官的损伤.
休克的创伤患者的传统治疗方法是用等渗林格氏液和输血快速恢复血容量. 从理论上讲, 休克患者晶体液和血液输入可以改善心脏充盈和输出, 并减少用于增加循环外周阻力而维持有效血压的药物使用. 传统的复苏方法常常只恢复和维持血流动力学而不能恢复肠道的灌注, 其导致的肠道缺血再灌注损伤在休克后肠源性的全身炎症反应加重和器官障碍的发展中起作用, 因此, 防止肠道缺血再灌注损伤导致的肠屏障功能障碍尤其重要. 自1980年以来, 大量的研究证明高渗溶液复苏失血性休克具有扩充血浆容量、改善心输出量、局部血流和微循环的生理效应[6]. 近期高渗盐溶液的免疫调节效应研究表明, 高渗盐溶液单独或与右旋糖酐溶液能抑制中性粒细胞呼吸暴发和减少β2整合素表达, 超氧化物生产和弹性蛋白酶的释放[7]. 高渗盐复苏通过增强TLR4表达和NF-κB活化降低烧伤后炎性细胞凋亡和增强了宿主对细菌的防御[8]. 本研究结果显示, 大量乳酸林格液再灌注后, 回肠黏膜严重损伤, 表现为回肠黏膜绒毛水肿、明显脱落, 而且白细胞浸润黏膜. 小容量高渗盐胶体复苏效果较好, 表现为回肠黏膜绒毛水肿轻、脱落较少. 说明高渗盐胶体复苏对小肠失血再灌注有保护作用, 这与普遍认为高渗盐复苏可以减少失血性休克后肠道损伤和细胞凋亡相符合[9]. 有研究发现, 即使平均动脉压接近休克水平, 小容量高渗盐可以依靠选择性扩张毛细血管前微动脉改善小肠灌[10]. Shi等[11]研究发现高渗盐可以改善创伤性休克后肠道黏膜屏障功能. Cox等[12]发现小容量高渗盐复苏可以防止大容量复苏肠道水肿引起的肠道组织间隙压力升高; 另外Lu等[13]研究还表明, 高渗盐复苏诱导血红素氧合酶(HO-1)的过度表达以防止肠道缺血再灌注损伤; 此外, 得出这样的结论: 抑制中性粒细胞有助于在体外经上皮跨膜迁移和在结肠炎小鼠模型体内的肠道组织损伤. 因此, 高渗盐可能有降低中性粒细胞介导的肠道损伤的临床应用价值[14]; 最后Radhakrishnan等[15]研究发现高渗盐水复苏引起肠道黏膜水通道蛋白4基因和蛋白表达上调, 可减轻肠道水肿发展和促进流体再分配, 增加浆肌和黏膜表面细胞膜导电性;高渗信号系统广泛存在于多种哺乳动物细胞说明, 高渗盐复苏凭借提高血浆渗透压除了上面描述影响外, 还有其他不为人知的影响.
高渗盐维持时间较短暂, 采用羟乙基淀粉溶液配伍, 可以通过提高血管内胶体渗透压和胶体在血管内的存留时间从而使高渗盐溶液的血流动力学效应增强和延长. Lobo等[16]研究发现低容量晶体液和羟乙基淀粉溶液复苏可以减少兔子缺血肠道的水肿.
在失血性休克休克病理生理过程中NO浓度的变化说法不同, 较早的研究认为NO在休克后合成减少. Szabó等[17]研究证明在创伤性休克时结构性NOS合成NO减少. 较近的研究: Xia等[18]研究认为血清NO浓度在缺血再灌注后升高. 值得注意的是影响血清NO浓度不是休克本身, 而是主要由再灌注后组织代谢变化引起的, 他可能为次要损伤器官的保护机制. 本实验结果表现为休克缺血期NO水平没有显著改变, 大容量复苏组复苏1 h后血清NO浓度和小容量高渗盐胶体组、正常组比较显著下降, 其下降的原因可能是: 大量乳酸林格液再灌注早期导致内皮细胞损伤, 内皮细胞eNOS合成NO减少[19]; 大量乳酸林格液复苏降低血液黏滞度, 血流对血管壁切应力下降内皮细胞受刺激合成NO减少[20]; 大量乳酸林格液复苏稀释血液影响NO浓度[21]; 大量乳酸林格液复苏早期内源性NO合成降低, iNOS还没大量合成NO[22].
高渗盐胶体复苏早期NO无明显下降, 并且从病理方面观察高渗盐胶体复苏组回肠黏膜绒毛水肿轻、脱落较少. Molnár等[23]研究发现: HSD复苏显著提高冠脉流量和心肌收缩力, 心脏指数, 血浆NO和内皮素-1的水平. eNOS派生的NO是一个许多重要的胃肠黏膜功能稳态的调节因子, 如维持足够的灌注, 调节微血管和上皮的通透性. eNOS来源的NO是野生型小鼠循环中的亚硝酸盐的主要来源[24]. 而Dezfulian等[25]研究显示亚硝酸盐对不同的I/R组织具有细胞保护作用, 包括肝脏、心脏、肾脏和脑. NO供体吗多明减轻小肠肠缺血后再灌注损伤, 同时恢复肠道微循环血流和组织学损伤[26]. 提高灌注是一个很重要的因素, 因为稀释缓冲了灌注损伤小肠的酸化固有层和清除毒素穿过上皮的媒介.
总之, 在使用不同液体复苏过程中血清NO的水平变化和回肠组织形态学的改变, 高渗盐胶体复苏减少血管内皮细胞再灌注损伤, 内源性NO合成无明显减少, NO和高渗盐胶体协同发挥保护肠黏膜的作用, 也许NO在高渗盐引起的血流动力学变化和肠道黏膜灌注中发挥着部分重要的作用, 这有待我们去研究.
小容量高渗盐溶液是近年来在创伤失血性休克复苏逐渐形成的又一新的休克复苏途径. NO作为强大的血管扩张剂和血管完整性的保护者发挥着有益的作用.
汪波, 主任医师, 北京大学第一医院急诊科
传统的复苏方法常常只恢复和维持血流动力学而不能恢复肠道的灌注, 其导致的肠道缺血再灌注损伤在休克后肠源性的全身炎症反应的加重和器官障碍的发展中起作用, 因此, 防止肠道缺血再灌注损伤导致的肠屏障功能障碍尤其重要.
Charles等发现小容量高渗盐复苏可以防止大容量复苏肠道水肿引起的肠道组织间隙压力升高; 另外Lu等研究还表明, 高渗盐复苏诱导血红素氧合酶(HO-1)的过度表达以防止肠道缺血再灌注损伤.
本研究探讨了小容量高渗盐羟乙基淀粉复合液对失血性休克大鼠早期全身血流动力学、肠道组织灌注和血清NO的影响, 具有一定的临床医用价值.
编辑: 曹丽鸥 电编: 闫晋利
| 1. | Mythen MG, Webb AR. Intra-operative gut mucosal hypoperfusion is associated with increased post-operative complications and cost. Intensive Care Med. 1994;20:99-104. [PubMed] [DOI] |
| 2. | Kubes P, Granger DN. Nitric oxide modulates microvascular permeability. Am J Physiol. 1992;262:H611-H615. [PubMed] |
| 3. | Takada K, Yamashita K, Sakurai-Yamashita Y, Shigematsu K, Hamada Y, Hioki K, Taniyama K. Participation of nitric oxide in the mucosal injury of rat intestine induced by ischemia-reperfusion. J Pharmacol Exp Ther. 1998;287:403-407. [PubMed] |
| 4. | Cuzzocrea S, Zingarelli B, Caputi AP. Role of constitutive nitric oxide synthase and peroxynitrite production in a rat model of splanchnic artery occlusion shock. Life Sci. 1998;63:789-799. [PubMed] [DOI] |
| 5. | Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg. 1970;101:478-483. [PubMed] [DOI] |
| 6. | Dubick MA, Bruttig SP, Wade CE. Issues of concern regarding the use of hypertonic/hyperoncotic fluid resuscitation of hemorrhagic hypotension. Shock. 2006;25:321-328. [PubMed] |
| 7. | Pascual JL, Khwaja KA, Ferri LE, Giannias B, Evans DC, Razek T, Michel RP, Christou NV. Hypertonic saline resuscitation attenuates neutrophil lung sequestration and transmigration by diminishing leukocyte-endothelial interactions in a two-hit model of hemorrhagic shock and infection. J Trauma. 2003;54:121-30; discussion 130-2. [PubMed] [DOI] |
| 8. | Chen LW, Su MT, Chen PH, Liu WC, Hsu CM. Hypertonic saline enhances host defense and reduces apoptosis in burn mice by increasing toll-like receptors. Shock. 2011;35:59-66. [PubMed] [DOI] |
| 9. | Murao Y, Hata M, Ohnishi K, Okuchi K, Nakajima Y, Hiasa Y, Junger WG, Hoyt DB, Ohnishi T. Hypertonic saline resuscitation reduces apoptosis and tissue damage of the small intestine in a mouse model of hemorrhagic shock. Shock. 2003;20:23-28. [PubMed] [DOI] |
| 10. | Zakaria el R, Tsakadze NL, Garrison RN. Hypertonic saline resuscitation improves intestinal microcirculation in a rat model of hemorrhagic shock. Surgery. 2006;140:579-587; discussion 587-588. [PubMed] [DOI] |
| 11. | Shi HP, Deitch EA, Da Xu Z, Lu Q, Hauser CJ. Hypertonic saline improves intestinal mucosa barrier function and lung injury after trauma-hemorrhagic shock. Shock. 2002;17:496-501. [PubMed] [DOI] |
| 12. | Cox CS, Radhakrishnan R, Villarrubia L, Xue H, Uray K, Gill BS, Stewart RH, Laine GA. Hypertonic saline modulation of intestinal tissue stress and fluid balance. Shock. 2008;29:598-602. [PubMed] |
| 13. | Lu YQ, Gu LH, Huang WD, Mou HZ. Effect of hypertonic saline resuscitation on heme oxygenase-1 mRNA expression and apoptosis of the intestinal mucosa in a rat model of hemorrhagic shock. Chin Med J (Engl). 2010;123:1453-1458. [PubMed] |
| 14. | Tillinger W, McCole DF, Keely SJ, Bertelsen LS, Wolf PL, Junger WG, Barrett KE. Hypertonic saline reduces neutrophil-epithelial interactions in vitro and gut tissue damage in a mouse model of colitis. Am J Physiol Regul Integr Comp Physiol. 2008;295:R1839-R1845. [PubMed] [DOI] |
| 15. | Radhakrishnan RS, Shah SK, Lance SH, Radhakrishnan HR, Xue H, Radhakrishnan GL, Ramaswamy US, Walker PA, Uray KS, Laine GA. Hypertonic saline alters hydraulic conductivity and up-regulates mucosal/submucosal aquaporin 4 in resuscitation-induced intestinal edema. Crit Care Med. 2009;37:2946-2952. [PubMed] [DOI] |
| 16. | Lobo SM, Orrico SR, Queiroz MM, Contrim LM, Cury PM. Comparison of the effects of lactated Ringer solution with and without hydroxyethyl starch fluid resuscitation on gut edema during severe splanchnic ischemia. Braz J Med Biol Res. 2008;41:634-639. [PubMed] |
| 17. | Szabó C, Thiemermann C. Invited opinion: role of nitric oxide in hemorrhagic, traumatic, and anaphylactic shock and thermal injury. Shock. 1994;2:145-155. [PubMed] [DOI] |
| 18. | Xia G, Lara-Marquez M, Luquette MH, Glenn S, Haque A, Besner GE. Heparin-binding EGF-like growth factor decreases inducible nitric oxide synthase and nitric oxide production after intestinal ischemia/reperfusion injury. Antioxid Redox Signal. 2001;3:919-930. [PubMed] [DOI] |
| 19. | Hansen PR. Inflammatory alterations in the myocardial microcirculation. J Mol Cell Cardiol. 1998;30:2555-2559. [PubMed] [DOI] |
| 20. | 赵 克森, 金 丽娟. 休克的细胞和分子基础. 北京: 科学出版社 2002; 26-28. |
| 21. | Gebhard F, Nüssler AK, Rösch M, Pfetsch H, Kinzl L, Brückner UB. Early posttraumatic increase in production of nitric oxide in humans. Shock. 1998;10:237-242. [PubMed] [DOI] |
| 22. | Kelly E, Shah NS, Morgan NN, Watkins SC, Peitzman AB, Billiar TR. Physiologic and molecular characterization of the role of nitric oxide in hemorrhagic shock: evidence that type II nitric oxide synthase does not regulate vascular decompensation. Shock. 1997;7:157-163. [PubMed] [DOI] |
| 23. | Molnár G, Csonka E, Vass A, Boros M, Kaszaki J. Circulatory consequences of reduced endogenous nitric oxide production during small-volume resuscitation. Acta Physiol Hung. 2011;98:393-408. [PubMed] [DOI] |
| 24. | Lundberg JO, Weitzberg E, Gladwin MT. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nat Rev Drug Discov. 2008;7:156-167. [PubMed] [DOI] |
| 25. | Dezfulian C, Raat N, Shiva S, Gladwin MT. Role of the anion nitrite in ischemia-reperfusion cytoprotection and therapeutics. Cardiovasc Res. 2007;75:327-338. [PubMed] [DOI] |
| 26. | Oztürk H, Aldemir M, Dokucu AI, Yağmur Y, Kilinç N, Sahin AH. The nitric oxide donor molsidomine prevents ischemia/reperfusion injury of the adult rat small intestine. Pediatr Surg Int. 2003;19:305-308. [PubMed] [DOI] |