修回日期: 2012-01-29
接受日期: 2012-03-25
在线出版日期: 2012-04-28
目的: 观察细胞外基质蛋白Lumican在胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDA)中表达特征, 分析Lumican与Ki-67、VEGF、突变型P53等肿瘤恶性表型相关分子的关联.
方法: 采用免疫组织化学染色(IHC)和逆转录-聚合酶链式反应(RT-PCR)检测PDA原发灶及对应癌旁胰腺组织中Lumican表达. IHC检测PDA原发灶Ki-67、VEGF及突变型P53表达. 用SPSS软件行统计学分析.
结果: PDA原发灶中, Lumican表达在mRNA及蛋白质水平均明显高于癌旁胰腺组织. 就该蛋白在癌灶中的分布特性而言, Lumican蛋白主要定位于癌间质, 阳性表达率为83.0%(83/100). 低分化PDA中, 癌间质过表达Lumican与TNM分期相关(χ2 = 6.446, P<0.05), 与年龄、性别、淋巴结转移、远处转移等无明显相关. 高中分化PDA中, 癌间质过表达Lumican与临床病理特征无关, 而与Ki-67(r = -0.28, P = 0.017)、VEGF(r = -0.264, P = 0.025)及突变型P53(r = -0.253, P = 0.032)表达呈明显负相关.
结论: Lumican在PDA原发灶中表达高于癌旁胰腺组织, 主要分布于癌间质. Lumican在癌间质过表达与低分化PDA的TNM分期相关, 与高、中分化PDA的Ki-67、VEGF及突变型P53表达呈负相关.
引文著录: 袁菲, 周尘飞, 金晓龙. Lumican蛋白在胰腺导管腺癌间质中的表达及其与Ki-67、VEGF及突变型P53表达的相关性. 世界华人消化杂志 2012; 20(12): 1018-1024
Revised: January 29, 2012
Accepted: March 25, 2012
Published online: April 28, 2012
AIM: To detect the expression of Lumican in pancreatic ductal adenocarcinoma and to analyze its correlation with expression of Ki-67, VEGF and mutated P53.
METHODS: One hundred surgically resected cancer samples collected from patients with pathologically confirmed pancreatic ductal adenocarcinoma and 15 tumor-adjacent pancreatic tissue samples were used in the study. Lumican expression in these tissue samples was detected by immunohistochemistry (IHC) and reverse transcription-polymerase chain reaction (RT-PCR). Expression of Ki-67, VEGF and mutated P53 was detected by IHC.
RESULTS: The expression levels of Lumican mRNA and protein in cancer tissue were significantly higher than those in tumor-adjacent tissue. The positive rate of Lumican expression in tumor stroma was 83.0% (83/100). In poorly differentiated samples, stromal expression of Lumican was significantly correlated with TNM stage (χ2 = 6.446, P < 0.05), but not with age, gender, lymph node metastasis or distant metastasis. In well differentiated samples, stromal expression of Lumican had a significant negative correlation with expression of Ki-67 (r = -0.28, P = 0.017), VEGF (r = -0.264, P = 0.025) and mutated P53 (r = -0.253, P = 0.032), but had no correlation with pathological characteristics of pancreatic ductal adenocarcinoma.
CONCLUSION: Lumican expression is higher in pancreatic ductal adenocarcinoma than in tumor-adjacent tissue and correlates with TNM stage in poor differentiated samples. There is a negative correlation between expression of Lumican and that of Ki-67, VEGF and mutated P53 mutation in well differentiated samples.
- Citation: Yuan F, Zhou CF, Jin XL. Lumican protein expression in pancreatic ductal adenocarcinoma: clinical significance and correlation with expression of Ki-67, VEGF and mutated P53. Shijie Huaren Xiaohua Zazhi 2012; 20(12): 1018-1024
- URL: https://www.wjgnet.com/1009-3079/full/v20/i12/1018.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i12.1018
胰腺癌发病率及死亡率均居我国恶性肿瘤前列[1], 起病隐匿, 恶性程度高, 总体5年生存率不超过5%[2], 其中90%左右为胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDA)[3]. PDA的发生、发展受众多因素调控, 肿瘤基质微环境异常是其中重要因素之一[4]. 富亮氨酸小分子蛋白聚糖(small leucine-rich proteoglycan, SLRP)家族是细胞外基质的主要组成部分, 其成员包括decorin、biglycan、Lumican等[5,6], 研究显示decorin能抑制肿瘤细胞增殖及迁移[7]. Lumican亦被发现在包括胰腺癌、乳腺癌、结直肠癌及肺癌等肿瘤中呈异常表达[8-11], 可能影响肿瘤生物学行为, 但其确切生物学功能尚存争议. Lumican与胰腺癌细胞增殖、血管生成等恶性生物学行为的关系鲜见报道. 本研究通过构建组织芯片, 观察PDA间质中Lumican的表达特征, 分析其与临床病理特征的关系, 并研究Lumican与Ki-67、VEGF及突变型P53表达的相关性[12], 以初步探明Lumican与PDA癌细胞恶性表型的关系, 为后续研究积累基础.
收集上海交通大学医学院附属瑞金医院2002-2007年手术切除的100例PDA癌组织标本, 40 g/L甲醛溶液固定, 石蜡包埋. 其中15例同时留取癌旁非肿瘤胰腺组织, 离体后即刻取部分成对组织于液氮冻存. 所有病例均有完整的临床病理资料. TNM分期按美国癌症联合会(AJCC)第6版胰腺癌分期标准进行[13].
1.2.1 组织芯片构建: 采用组织芯片(tissue microarray, TMA)制作仪, 穿取100例PDA癌组织, 制成组织微阵列蜡块, 4 μm连续切片, 40 ℃贴片(载玻片经0.1%多聚赖氨酸防脱片处理), 56 ℃烤片3 h后至37 ℃恒温箱中过夜, 常温蜡封后保存备用.
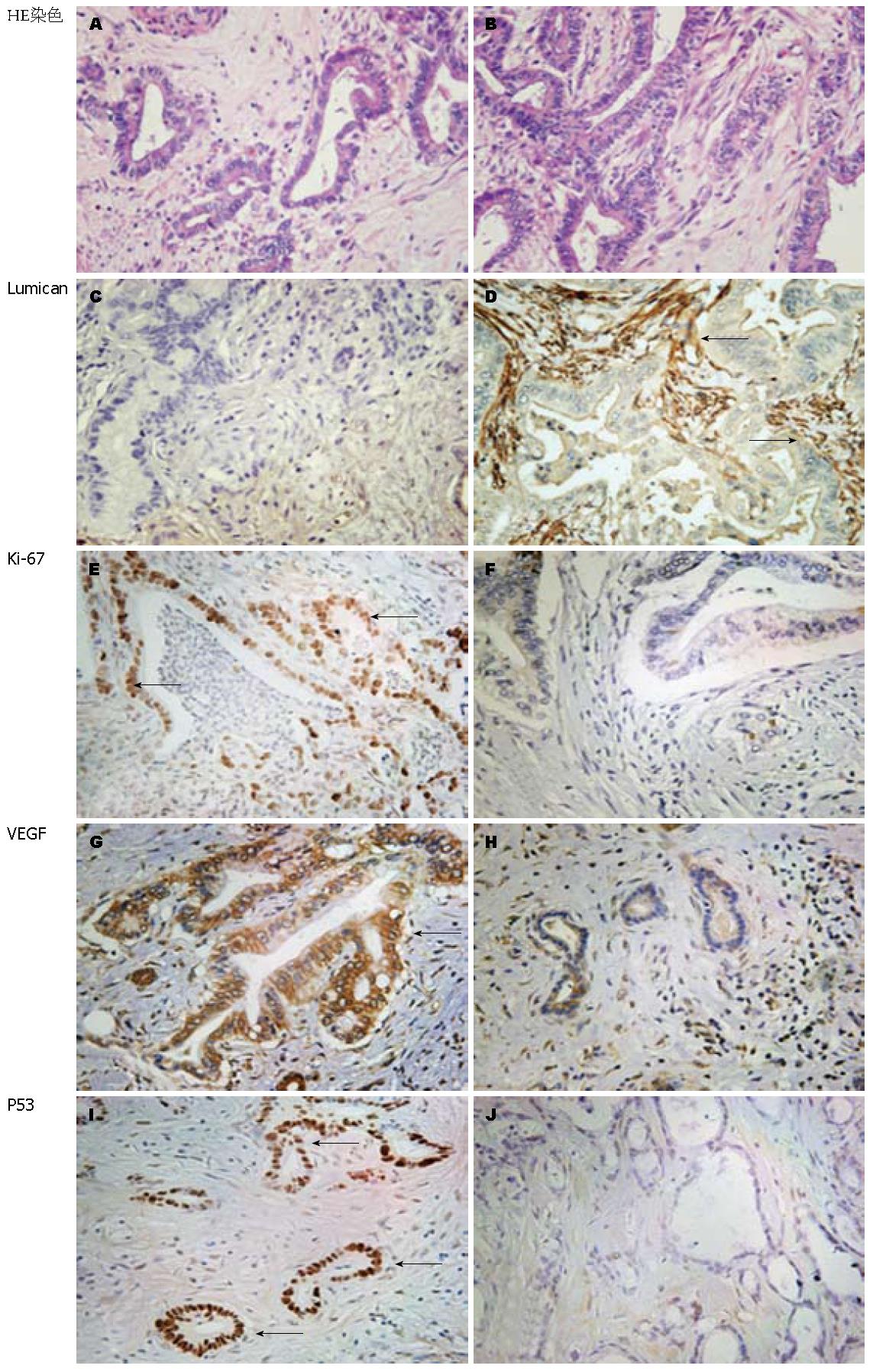
1.2.2 免疫组织化学染色(immunohistochemistry, IHC): 切片经脱蜡至水, 微波煮沸修复抗原, 3%H2O2封闭内源性过氧化酶, 磷酸盐缓冲液洗涤后, 正常血清封闭20 min. 分别滴加一抗, Lumican(购自R&D Systems公司, 工作浓度1∶100); Ki-67、VEGF、P53(购自DAKO公司, 工作浓度1∶50), 4 ℃孵育过夜. PBS洗涤后, 生物素二抗室温孵育10 min. PBS洗涤后, 链霉素-生物素-过氧化物酶室温孵育10 min. DAB显色, 光镜下观察及时终止显色反应. 苏木素复染细胞核, 常规分化、脱水、透明、封片. IHC标记结果判定: Lumican蛋白定位于组织间质, VEGF定位于细胞质, Ki-67及P53定位于细胞核. Lumican、VEGF、P53阳性强度评价: 阳性细胞数<5%为-; <25%为+; <50%为++; ≥50%为+++. Lumican表达评价: -为阴性表达; + - ++为阳性表达; +++为强阳性表达[8]. Ki-67选取阳性细胞相对密集的10个高倍视野计算阳性细胞百分数.
1.2.3 逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction, RT-PCR)检测Lumican基因表达: 将液氮中冻存的15例新鲜癌组织和癌旁非肿瘤胰腺组织匀浆, 抽提总RNA, 逆转录cDNA后行PCR扩增(以β-actin为内参). Lumican引物序列, 正义链: 5'-CCACAACAA CCTGACAGAGT-3'; 反义链: 5'-CAAGTTGATTGACCTCCAGG-3', 产物469 bp. 反应体系为: 10×buffer 2.5 μL, Mg2+ 2.5 μL, dNTP 0.5 μL, Lumican上下游引物各1 μL(5 μmoL/L), Taq酶 0.1 μL, ddH2O 16.4 μL, cDNA 1 μL; 反应条件: 95 ℃预变性5 min; 95 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸30 s, 共36次循环; 最后72 ℃延伸10 min, 4 ℃保存. 取PCR扩增产物5 μL, 行凝胶电泳检测. 用Sysgene软件定量分析, 检测并计算Lumican与β-actin表达的吸光度比值.
统计学处理 采用χ2检验分析等级资料, 配对t检验分析吸光度(A)比值, Spearman相关性检验分析表达相关性. 所有检验均采用双侧P<0.05为有统计学意义. 统计分析使用SPSS13.0统计软件进行.
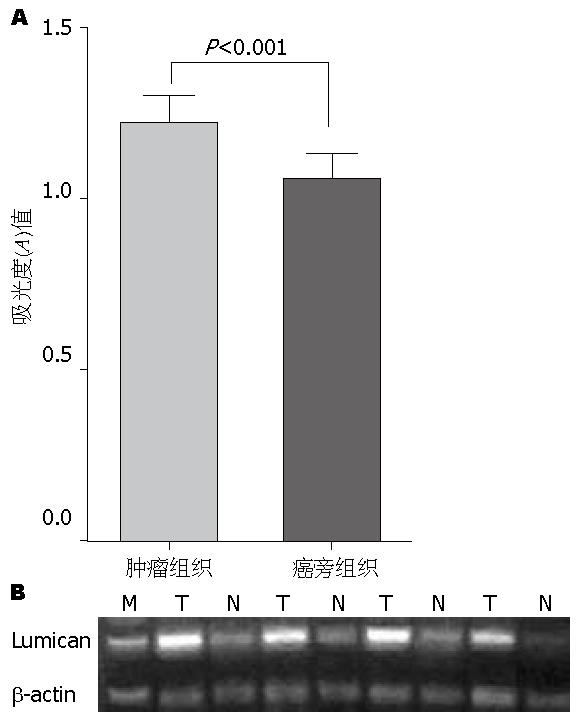
Lumican在PDA癌组织中表达水平高于癌旁胰腺组织, 主要分布于癌间质. 将取自15对组织的PCR产物进行凝胶电泳分析显示, Lumican mRNA相对表达量在癌组织中明显高于癌旁胰腺组织(A值1.22±0.07 vs 1.05±0.06, P<0.001, 图1). IHC显示, Lumican蛋白主要定位在组织间质中, 并在癌间质中呈高表达, 阳性率为83.0%(83/100), 在癌旁胰腺组织间质中呈低表达(图2).
100例PDA患者中, 男性60例, 女性40例; 中位年龄59岁(31-79岁); 根据AJCC 肿瘤TNM分期, Ⅰ-Ⅱ期患者83例, Ⅲ-Ⅳ期患者17例; 高中分化腺癌72例, 低分化腺癌28例. Lumican在低分化PDA癌间质中表达率为78.6%(22/28), 高中分化癌间质表达率为84.7%(61/72), 两者无明显差异(P>0.05). 低分化癌间质中Lumican蛋白表达与肿瘤TNM分期相关; Ⅲ-Ⅳ期PDA中, Lumican癌间质表达水平明显高于Ⅰ-Ⅱ期(6/6比16/22, χ2 = 6.446, P = 0.031). 而与患者年龄、性别、淋巴结转移、远处转移等临床病理特征无关. 在高中分化癌中, Lumican癌间质表达与患者临床病理特征无明显相关性(表1).
| 临床病理因素 | 高中分化(n = 72) | χ2值 | P值 | 低分化(n = 28) | χ2值 | P值 | |||||
| 阴性 | 阳性 | 强阳性 | 阴性 | 阳性 | 强阳性 | ||||||
| 年龄 | |||||||||||
| <60 | 5 | 30 | 4 | 0.717 | 0.699 | 1 | 9 | 2 | 3.804 | 0.143 | |
| ≥60 | 6 | 25 | 2 | 5 | 11 | 0 | |||||
| 性别 | |||||||||||
| 男 | 7 | 30 | 4 | 0.561 | 0.755 | 4 | 14 | 1 | 0.785 | 1.000 | |
| 女 | 4 | 25 | 2 | 2 | 6 | 1 | |||||
| T分期 | |||||||||||
| T2-3 | 9 | 49 | 6 | 1.066 | 0.654 | 6 | 16 | 0 | 6.446 | 0.031 | |
| T4 | 2 | 6 | 0 | 0 | 4 | 2 | |||||
| 淋巴结转移 | |||||||||||
| N0 | 7 | 40 | 4 | 0.422 | 0.905 | 4 | 12 | 0 | 2.547 | 0.318 | |
| N1 | 4 | 15 | 2 | 2 | 8 | 2 | |||||
| 远处转移 | |||||||||||
| M0 | 11 | 52 | 6 | 0.488 | 1.000 | 6 | 19 | 2 | 1.586 | 1.000 | |
| M1 | 0 | 3 | 0 | 0 | 1 | 0 | |||||
| TNM分期 | |||||||||||
| I-II | 9 | 46 | 6 | 0.806 | 0.728 | 6 | 16 | 0 | 6.446 | 0.031 | |
| III-IV | 2 | 9 | 0 | 0 | 4 | 2 | |||||
| 神经/脉管侵犯 | |||||||||||
| 无 | 3 | 21 | 1 | 1.423 | 0.491 | 3 | 2 | 0 | 4.520 | 0.077 | |
| 有 | 8 | 34 | 5 | 3 | 18 | 2 | |||||
癌组织Ki-67、VEGF及突变型P53阳性表达率在高中分化PDA分别为54.2%、80.6%及94.4%, 在低分化PDA为78.6%、82.1%及96.4%. 低分化癌Ki-67表达阳性率明显高于高中分化癌(P = 0.025), 而VEGF及突变型P53表达无明显差异(P = 0.456, P = 0.804). 相关性分析显示, 高中分化腺癌中, Lumican癌间质表达强度与Ki-67(r = -0.28, P = 0.017)、VEGF(r = -0.264, P = 0.025)及突变型P53(r = -0.253, P = 0.032)表达均呈负相关, 而在低分化腺癌中未显示明显相关性(表2, 图3).
| 检测项目 | 高中分化(n = 72) | 低分化(n = 28) | ||||||
| n | % | r值 | P值 | n | % | r值 | P值 | |
| Ki-67 | ||||||||
| <5% | 33 | 45.8 | -0.280 | 0.017 | 6 | 21.4 | 0.140 | 0.478 |
| ≥5% | 39 | 54.2 | 22 | 78.6 | ||||
| VEGF | ||||||||
| - | 14 | 19.4 | -0.264 | 0.025 | 5 | 17.9 | 0.180 | 0.359 |
| + | 8 | 11.1 | 2 | 7.1 | ||||
| ++ | 21 | 29.2 | 5 | 17.9 | ||||
| +++ | 29 | 40.3 | 16 | 57.1 | ||||
| P53 | ||||||||
| - | 4 | 5.6 | -0.253 | 0.032 | 1 | 3.6 | 0.091 | 0.645 |
| + | 10 | 13.8 | 6 | 21.4 | ||||
| ++ | 18 | 25.0 | 7 | 25.0 | ||||
| +++ | 40 | 55.6 | 14 | 50.0 | ||||
本研究结果显示, Lumican蛋白在PDA癌间质中过表达, 并且在不同分化程度肿瘤的间质中表达特征存在差异. 在低分化腺癌中, Lumican癌间质过表达与肿瘤不良分期相关, 而在高中分化腺癌中, 则与肿瘤细胞增殖、血管生成等恶性表型相关因素Ki-67、VEGF及突变型P53表达水平呈负相关.
Lumican为分泌型蛋白, 属SLRP家族Ⅱ型成员之一, 定位于染色体12q21.3-q22区, 其核心蛋白分子量为37 kDa, 连接硫酸角质素或聚乙酰氨基乳糖侧链, 可形成相应的蛋白聚糖及糖蛋白结构[5]. Lumican在角膜组织、皮肤、肺、肾、脑等多脏器细胞外间质中广泛表达, 其基因同源缺失可导致小鼠眼角膜混浊及皮肤松弛[14]. 胰腺癌中, 肿瘤细胞及间质星形细胞均可表达Lumican蛋白[8,15,16]. 本研究亦显示, Lumican在PDA癌间质中过表达, 且明显高于癌旁非肿瘤胰腺组织.
由于Lumican蛋白直接参与细胞外间质的构成, 分析其在组织间质中的表达特征能够较准确地反映Lumican蛋白潜在生物学活性. 本研究结果显示, 低分化PDA癌间质中Lumican蛋白过表达与肿瘤较大及较晚的TNM分期相关. 提示Lumican癌间质的异常表达可能促进了低分化癌的恶性表型. Ishiwata等[8]亦发现胰腺癌间质中Lumican过表达与肿瘤不良分期、后腹膜及十二指肠侵犯等因素相关. 在肺鳞状细胞癌中, Lumican在肿瘤间质的过表达则与肿瘤血管侵犯相关[11].
Ki-67、VEGF过表达及突变型P53均为胰腺癌患者预后不良相关因素[17,18], 本研究显示, 在高中分化PDA中, Lumican蛋白间质表达与Ki-67、VEGF过表达及突变型P53呈负相关. 既往文献显示了Lumican作为肿瘤抑制相关基因的潜在可能, 体外研究发现, Lumican基因同源缺失小鼠胚胎成纤维细胞增殖能力增强而凋亡减少[19]; 纤维肉瘤细胞在含Lumican蛋白的培养基中增殖能力下降, 抑癌相关基因p21表达增加[20]; 小鼠胰腺癌细胞中过表达Lumican蛋白可抑制其体内成瘤能力, 并减少肿瘤血管生成[21]. Lumican还可抑制内皮细胞增殖、脉管形成及侵袭能力[22]. 结合文献及本研究结果, 提示Lumican蛋白在高中分化PDA癌间质中的过表达亦可能参与抑制了肿瘤细胞增殖及血管生成等. 在低分化PDA中, Lumican表达与Ki-67、VEGF过表达及P53突变相关性虽无统计学意义, 但相关系数(r)均为正值, 结合其与肿瘤不良分期的相关性, 提示Lumican与低分化PDA恶性生物学行为的潜在联系. 综上所述, Lumican蛋白在不同分化程度PDA癌间质中潜在生物学行为可能不同. 在对不同分化程度的人骨肉瘤细胞研究中发现, 敲低Lumican在细胞内表达后, 高分化Saos2细胞增殖能力增强, 而中分化MG-63增殖能力无明显改变[23].
造成Lumican蛋白功能差异的原因可能与其本身特征相关, Lumican侧链基团修饰是影响其生物学功能的重要因素之一, 其糖蛋白及蛋白聚糖形式在肿瘤研究中均有报道. 胰腺癌细胞株分泌低硫酸角质素修饰的Lumican糖蛋白[16], 黑色素瘤细胞株WM9及M5则表达硫酸角质素修饰的Lumican蛋白聚糖[24]. 转染外源性Lumican基因至小鼠B16F1黑色素瘤细胞中使Lumican糖蛋白分泌增加, 并抑制B16F1细胞的体内成瘤能力[25]. 然而, Lumican糖蛋白在角膜胚胎发育及促角膜上皮损伤后修复中起重要作用[5,14]. 显示了Lumican蛋白侧链修饰的组织特异性及功能差异, 本研究中, 不同分化程度的PDA肿瘤间质中Lumican蛋白是否存在侧链修饰的差异, 进而影响其生物学功能尚待明确.
此外, SLRP家族蛋白通过结合细胞膜受体, 调控细胞内信号, 影响正常细胞增殖、分化、细胞黏附及迁徙等生物学行为. 在胰腺癌中, Lumican受体及其相关下游信号通路尚未明确. 细胞外Lumican蛋白结合至黑色素瘤细胞膜α2β1整联蛋白后, 可抑制肿瘤细胞迁移[26]. 而在胰腺癌中, α2β1整联蛋白与细胞外基质成分Ⅰ型胶原蛋白相作用后, 则促进了细胞增殖及侵袭[27].
本研究结果提示, Lumican蛋白在PDA中异常表达, 且不同分化的肿瘤、癌间质中Lumican表达特征不同. 因此, Lumican在PDA中的生物学功能尚待阐明, 明确其侧链修饰特异性及功能相关信号通路改变, 将有助于揭示其在不同分化PDA中差异表达机制及功能.
胰腺癌恶性程度高, 预后不佳. 肿瘤基质微环境在其发生发展中起重要作用. Lumican蛋白是细胞外间质成分之一, 属富亮氨酸小分子蛋白聚糖家族. Lumican蛋白在肿瘤中表达特征及生物学功能研究结论尚存分歧.
谷俊朝, 主任医师, 首都医科大学附属北京友谊医院普外科
Lumican蛋白在不同分化程度的胰腺导管腺癌中表达特征不同, 其具体生物学功能亟待明确.
Lu等发现, Lumican蛋白定位于胰岛α细胞及胰腺组织间质, 胰腺癌细胞表达聚乙酰氨基乳糖侧链修饰的Lumican糖蛋白. Ishiwata等发现, 胰腺癌间质Lumican阳性表达与女性患者、不良分期、后腹膜及十二指肠侵犯等临床病理因素相关.
除临床病理特征外, 本文进一步研究了在不同分化程度胰腺导管腺癌中, Lumican蛋白与肿瘤Ki-67、VEGF及突变型P53表达相关性.
通过对胰腺导管腺癌中Lumican蛋白与肿瘤增殖、血管生成等相关因素分析, 为进一步生物学功能研究的提供线索.
本研究内容较新, 并对其在高中分化和低分化胰腺癌组织中的表达特征进行分析, 论述思路清晰, 语言较流畅.
编辑: 曹丽鸥 电编: 闫晋利
| 1. | Zhao P, Dai M, Chen W, Li N. Cancer trends in China. Jpn J Clin Oncol. 2010;40:281-285. [PubMed] [DOI] |
| 2. | Maitra A, Hruban RH. Pancreatic cancer. Annu Rev Pathol. 2008;3:157-188. [PubMed] [DOI] |
| 3. | Mihaljevic AL, Michalski CW, Friess H, Kleeff J. Molecular mechanism of pancreatic cancer--understanding proliferation, invasion, and metastasis. Langenbecks Arch Surg. 2010;395:295-308. [PubMed] [DOI] |
| 4. | Farrow B, Albo D, Berger DH. The role of the tumor microenvironment in the progression of pancreatic cancer. J Surg Res. 2008;149:319-328. [PubMed] [DOI] |
| 5. | Nikitovic D, Katonis P, Tsatsakis A, Karamanos NK, Tzanakakis GN. Lumican, a small leucine-rich proteoglycan. IUBMB Life. 2008;60:818-823. [PubMed] [DOI] |
| 6. | Nikitovic D, Berdiaki K, Chalkiadaki G, Karamanos N, Tzanakakis G. The role of SLRP-proteoglycans in osteosarcoma pathogenesis. Connect Tissue Res. 2008;49:235-238. [PubMed] [DOI] |
| 7. | Bi X, Pohl NM, Qian Z, Yang GR, Gou Y, Guzman G, Kajdacsy-Balla A, Iozzo RV, Yang W. Decorin-mediated inhibition of colorectal cancer growth and migration is associated with E-cadherin in vitro and in mice. Carcinogenesis. 2012;33:326-330. [PubMed] [DOI] |
| 8. | Ishiwata T, Cho K, Kawahara K, Yamamoto T, Fujiwara Y, Uchida E, Tajiri T, Naito Z. Role of lumican in cancer cells and adjacent stromal tissues in human pancreatic cancer. Oncol Rep. 2007;18:537-543. [PubMed] [DOI] |
| 9. | Troup S, Njue C, Kliewer EV, Parisien M, Roskelley C, Chakravarti S, Roughley PJ, Murphy LC, Watson PH. Reduced expression of the small leucine-rich proteoglycans, lumican, and decorin is associated with poor outcome in node-negative invasive breast cancer. Clin Cancer Res. 2003;9:207-214. [PubMed] |
| 10. | Seya T, Tanaka N, Shinji S, Yokoi K, Koizumi M, Teranishi N, Yamashita K, Tajiri T, Ishiwata T, Naito Z. Lumican expression in advanced colorectal cancer with nodal metastasis correlates with poor prognosis. Oncol Rep. 2006;16:1225-1230. [PubMed] [DOI] |
| 11. | Matsuda Y, Yamamoto T, Kudo M, Kawahara K, Kawamoto M, Nakajima Y, Koizumi K, Nakazawa N, Ishiwata T, Naito Z. Expression and roles of lumican in lung adenocarcinoma and squamous cell carcinoma. Int J Oncol. 2008;33:1177-1185. [PubMed] |
| 12. | Greenblatt MS, Bennett WP, Hollstein M, Harris CC. Mutations in the p53 tumor suppressor gene: clues to cancer etiology and molecular pathogenesis. Cancer Res. 1994;54:4855-4878. [PubMed] |
| 13. | Bilimoria KY, Bentrem DJ, Ko CY, Ritchey J, Stewart AK, Winchester DP, Talamonti MS. Validation of the 6th edition AJCC Pancreatic Cancer Staging System: report from the National Cancer Database. Cancer. 2007;110:738-744. [PubMed] [DOI] |
| 14. | Naito Z. Role of the small leucine-rich proteoglycan (SLRP) family in pathological lesions and cancer cell growth. J Nippon Med Sch. 2005;72:137-145. [PubMed] [DOI] |
| 15. | Köninger J, Giese T, di Mola FF, Wente MN, Esposito I, Bachem MG, Giese NA, Büchler MW, Friess H. Pancreatic tumor cells influence the composition of the extracellular matrix. Biochem Biophys Res Commun. 2004;322:943-949. [PubMed] [DOI] |
| 16. | Ping Lu Y, Ishiwata T, Asano G. Lumican expression in alpha cells of islets in pancreas and pancreatic cancer cells. J Pathol. 2002;196:324-330. [PubMed] [DOI] |
| 17. | Garcea G, Neal CP, Pattenden CJ, Steward WP, Berry DP. Molecular prognostic markers in pancreatic cancer: a systematic review. Eur J Cancer. 2005;41:2213-2236. [PubMed] [DOI] |
| 18. | Ai KX, Lu LY, Huang XY, Chen W, Zhang HZ. Prognostic significance of S100A4 and vascular endothelial growth factor expression in pancreatic cancer. World J Gastroenterol. 2008;14:1931-1935. [PubMed] [DOI] |
| 19. | Vij N, Roberts L, Joyce S, Chakravarti S. Lumican suppresses cell proliferation and aids Fas-Fas ligand mediated apoptosis: implications in the cornea. Exp Eye Res. 2004;78:957-971. [PubMed] [DOI] |
| 20. | Iozzo RV, Schaefer L. Proteoglycans in health and disease: novel regulatory signaling mechanisms evoked by the small leucine-rich proteoglycans. FEBS J. 2010;277:3864-3875. [PubMed] [DOI] |
| 21. | Williams KE, Fulford LA, Albig AR. Lumican reduces tumor growth via induction of fas-mediated endothelial cell apoptosis. Cancer Microenviron. 2010;4:115-126. [PubMed] [DOI] |
| 22. | Albig AR, Roy TG, Becenti DJ, Schiemann WP. Transcriptome analysis of endothelial cell gene expression induced by growth on matrigel matrices: identification and characterization of MAGP-2 and lumican as novel regulators of angiogenesis. Angiogenesis. 2007;10:197-216. [PubMed] [DOI] |
| 23. | Nikitovic D, Berdiaki A, Zafiropoulos A, Katonis P, Tsatsakis A, Karamanos NK, Tzanakakis GN. Lumican expression is positively correlated with the differentiation and negatively with the growth of human osteosarcoma cells. FEBS J. 2008;275:350-361. [PubMed] [DOI] |
| 24. | Sifaki M, Assouti M, Nikitovic D, Krasagakis K, Karamanos NK, Tzanakakis GN. Lumican, a small leucine-rich proteoglycan substituted with keratan sulfate chains is expressed and secreted by human melanoma cells and not normal melanocytes. IUBMB Life. 2006;58:606-610. [PubMed] [DOI] |
| 25. | Vuillermoz B, Khoruzhenko A, D'Onofrio MF, Ramont L, Venteo L, Perreau C, Antonicelli F, Maquart FX, Wegrowski Y. The small leucine-rich proteoglycan lumican inhibits melanoma progression. Exp Cell Res. 2004;296:294-306. [PubMed] [DOI] |
| 26. | Zeltz C, Brézillon S, Käpylä J, Eble JA, Bobichon H, Terryn C, Perreau C, Franz CM, Heino J, Maquart FX. Lumican inhibits cell migration through α2β1 integrin. Exp Cell Res. 2010;316:2922-2931. [PubMed] [DOI] |
| 27. | Grzesiak JJ, Bouvet M. The alpha2beta1 integrin mediates the malignant phenotype on type I collagen in pancreatic cancer cell lines. Br J Cancer. 2006;94:1311-1319. [PubMed] [DOI] |