修回日期: 2012-01-10
接受日期: 2012-03-15
在线出版日期: 2012-04-28
目的: 探讨人参皂苷Rg3对小鼠原发瘤切除后肝内转移瘤生长的荧光成像及血管生成的影响, 阐明人参皂苷Rg3抑制原发瘤切除促进转移瘤生长的内在机制.
方法: 慢病毒转染建立稳定表达绿色荧光蛋白(green fluorescent protein, GFP)基因的BALB/c小鼠结肠腺癌细胞株(BALB/c mice colon adenocarcinoma cell line, CT-26), 用细胞悬液法构建结肠癌肝转移瘤模型, 分为原发瘤切除组、原发瘤未切除组、人参皂苷Rg3组. 采用切除原发瘤及人参皂苷Rg3治疗10 d, 通过小动物活体成像系统观察肝转移瘤的生长情况. 应用组织切片苏木素-伊红染色法, 观察肿瘤转移灶情况. SP免疫组织化学法检测转移瘤MVD及细胞增殖, TUNEL技术检测转移瘤细胞凋亡.
结果: 应用慢病毒转染获得稳定表达高强度绿色荧光的CT-26-GFP细胞株. 结肠癌肝转移模型治疗结束后, 用波长470 nm的蓝光激发, 通过荧光活体成像系统观察剖离肝脏转移灶发出绿色荧光. 原发瘤切除后, 人参皂苷Rg3组平均肝转移灶荧光值较原发瘤未切除组及原发瘤切除组有明显的下降(314.17±54.23, 388.82±25.97, 427.18±44.31); 人参皂苷Rg3组、原发瘤未切除组和原发瘤切除组转移瘤发生率分别为40%, 50%, 100%; 平均肝脏质量分别为2.92 g±0.60 g, 3.80 g±0.33 g, 3.98 g±0.52 g; 转移瘤血管密度分别为27.10±3.41, 42.60±8.42, 62.40±5.08; 转移瘤细胞Ki67的表达分别为34.70±6.46, 54.30±8.98, 65.20±3.82; 转移瘤细胞凋亡指数分别为28.37±3.86, 12.50±2.99, 9.90±2.88.
结论: 稳定表达绿色荧光蛋白的CT-26-GFP细胞系及其动物模型可以为原发瘤切除研究提供理想的实验材料, 应用小动物活体成像系统能够客观定量评价肿瘤在小鼠肝脏的生长情况. 人参皂苷Rg3明显抑制小鼠原发瘤切除后肝内转移瘤的生长, 明显抑制转移瘤的血管生成及细胞增殖, 促进细胞凋亡.
引文著录: 郭刚, 许建华, 孙珏, 范忠泽. 人参皂苷Rg3对小鼠结肠癌原发瘤切除后肝转移瘤生长的抑制作用. 世界华人消化杂志 2012; 20(12): 1004-1011
Revised: January 10, 2012
Accepted: March 15, 2012
Published online: April 28, 2012
AIM: To investigate the effect of 20(R)-Ginsenoside Rg3 on the growth of hepatic metastasis in nude mice after surgical removal of primary tumor.
METHODS: BALB/c mouse colon adenocarcinoma CT-26-GFP cell line was established by transfection of CT-26 cells with a lentiviral vector containing the enhanced green fluorescent protein (eGFP) gene. A nude mouse model of hepatic metastasis was then developed, and the mice were randomly divided into three groups: primary tumor resection group, primary tumor preservation group and Ginsenoside Rg3 group. After resection of the primary tumor and treatment with Ginsenoside Rg3 for 10 days, microvascular density (MVD) and cell multiplication of liver metastases were detected by immunohistochemistry, and tumor apoptosis was detected by TUNEL assay. The green fluorescence was observed using a fluorescence in vivo imaging system.
RESULTS: The average fluorescence intensity of liver metastases in the Ginsenoside Rg3 group was significantly lower than that in the primary tumor preservation group and primary tumor resection group (314.17 ± 54.23 vs 388.82 ± 25.97, 427.18 ± 44.31). The incidences of metastases in the Ginsenoside Rg3 group, primary tumor preservation group and primary tumor resection group were 40%, 50% and 100%, respectively. The average weight of the liver, MVD, and labeling index of Ki67 were lower and TUNEL apoptotic index was higher in the Ginsenoside Rg3 group than in the primary tumor preservation group and primary tumor resection group (liver weight: 2.92 ± 0.60 vs 3.80 ± 0.33, 3.98 ± 0.52; MVD: 27.10 ± 3.41 vs 42.60 ± 8.42, 62.40 ± 5.08; labeling index of Ki67: 34.70 ± 6.46 vs 54.30 ± 8.98, 65.20 ± 3.82; apoptotic index: 28.37 ± 3.86 vs 12.50 ± 2.99, 9.90 ± 2.88).
CONCLUSION: 20(R)-Ginsenoside-Rg3 could inhibit metastatic tumor growth, angiogenesis, proliferation and promote apoptosis in mice after surgical removal of primary tumor.
- Citation: Guo G, Xu JH, Sun J, Fan ZZ. Ginsenoside Rg3 inhibits growth of liver metastases in nude mice after surgical removal of primary tumor. Shijie Huaren Xiaohua Zazhi 2012; 20(12): 1004-1011
- URL: https://www.wjgnet.com/1009-3079/full/v20/i12/1004.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i12.1004
结直肠癌在发达国家是最常见的恶性实体肿瘤之一, 全世界每年有一百万新登记患者, 结直肠癌的发病率和死亡率逐年升高. 手术切除是结直肠癌首选的治疗方法, 但不幸的是首诊时大约有25%-33%已发生转移, 还有25%-30%根治性手术时, 虽没有可见的转移证据, 但将在5年内发生转移[1]. 虽然手术是结直肠癌的首选治疗, 但临床研究表明, 手术切除可能并不总是有益, 对部分患者来说, 对已有可见或不可见转移灶, 原发瘤的切除可加速转移灶的发展[2]. 荧光成像技术是利用激发光使得荧光基团达到较高的能量水平, 然后发射出波长较长的光进行检测[3]. 绿色荧光蛋白(green fluorescent protein, GFP)基因是目前在光学分子成像中应用较多的一种报告基因, 广泛应用于各种蛋白质和细胞的标记以及特定基因表达的研究[4,5]. 利用光学成像对GFP标记细胞的组织分布进行定位, 能够提供高灵敏度、特意、便捷的观测手段.
小动物荧光成像系统购自日本NIKON公司, MA200型, 分析软件为WinLight32. 荧光倒置显微镜(日本Olympus公司CKX41SF), CO2恒温培养箱(英国Galaxy公司170200 PLUS), 手术显微镜(苏州医疗器械厂YZ-20T4), 电动升降手术台(苏州医疗器械厂YT-2A), 显微外科手术器械包(上海手术器械厂SSW-3), 慢病毒载体系统包装质粒PLV120-EGFP-Neo、PCMV-delta8.91、PMD.G及新霉素(G418)抗性基因购自Trono lab公司, RPMI-1640培养基和DMEM培养基(美国GIBCO公司), 胎牛血清(美国GIBCO公司). 山羊抗小鼠CD34mAb、Ki67单克隆抗体工作液(美国R&D公司), 超敏SP鼠试剂盒(美国R&D公司), TUNEL试剂盒(德国Boehringer Mannheim公司), 20(R)-人参皂苷Rg3纯品由吉林亚泰制药股份有限公司惠赠(批号: 200075), 按20 g/kg体质量给药.
1.2.1 细胞株培养: 小鼠结肠癌CT-26细胞株, 购自中国医学科学院实验动物研究所, 合格证号: (SCXK(京)2004-0001), 液氮冷冻保存. 细胞培养于含100 mL/L胎牛血清(FBS, 美国Gibco公司)、青霉素100 U/mL、链霉素100 μg/mL的RPMI-1640培养基中, 在37 ℃、含50 mL/L CO2饱和湿度培养箱中培养. SPF级BALB/c nu/nu裸鼠30只, 均为4-6周龄, ♂, 体质量18-22 g, 由上海西普尔-必凯实验动物有限公司提供(SCXK(沪)2008-0016), 裸鼠实验操作及动物饲养严格按照SPF级标准进行.
1.2.2 细胞转染与筛选: 病毒包装细胞293T于含100 mL/L胎牛血清DMEM培养基中培养. 病毒包装: 将293T细胞铺板于10 cm培养皿, 每10 cm培养皿含(2-2.5)×106个细胞, 第2天进行细胞转染. 3种质粒PLV120-EGFP-Neo 10 μg、PCMV-delta8.91 7.5 μg、PMD.G 5 μg分别加水至500 μg, 加入500 μg 2×HBS混匀. 加入50 μL 2 mol/L CaCl2轻轻混匀, 室温放置15-25 min后, 滴加培养液中. 6-8 min后, 更换培养液. 48 h和72 h分别收集病毒, 利用超滤浓缩管浓缩病毒, 分装后置于-80 ℃保存. 病毒感染: 将CT-26细胞平铺于24孔板, 每孔1×104个细胞, 待细胞汇合度达到70%-80%时, 移去培养液, 加入慢病毒PLV-EGFP-neo, MOI = 1 000. 荧光显微镜观察细胞GFP表达, 转染符合要求, 换用正常CT-26细胞培养液培养传代. 经有限稀释法获得细胞单克隆并扩增培养, 经观察倍增时间等细胞生物学行为和流式细胞仪检测后, 挑选出荧光强度最强, 细胞生物学行为无明显改变的一株用于动物实验.
1.2.3 细胞株阳性率的检测: 利用流式细胞仪(FACSCAL IBAR, Becton Dickinson Company)计数样品细胞群中阳性细胞所占比例. 将上述完成基因转染的肿瘤细胞制备成2×106/mL的细胞悬液, 调整流式细胞仪的工作条件: 激发光波长488 nm, 发射波长510 nm, 将所获得的5个阳性细胞株进行测定, 同样的细胞株进行正常传代, 传代后再次检测, 共检测3代, 每次每个样品获取细胞总数为10 000个.
1.2.4 小鼠结肠癌肝转移瘤模型的制作及剖离肝脏成像: 取对数生长期的小鼠结肠癌细胞CT-26, 以适当的浓度混悬在PBS中, 制成单细胞悬液, 台盼蓝检测活细胞数>95%. 取0.2 mL悬液(约含5×106个细胞)接种于BALB/c裸小鼠右腋部皮下视作原发瘤. 当皮下肿瘤生长至500 mm3左右时, 1%戊巴比妥钠(40 mg/kg)腹腔内注射麻醉后, 取仰卧位固定四肢, 无菌条件下中线切口部位行剖腹术, 切开腹壁和腹膜, 暴露十二指肠, 用1 mL注射器(接29号针头)经门静脉注射小鼠结肠癌细胞CT-26, 浓度为3×106/mL, 每只0.1 mL, 针头取出后用无菌可吸收棉条置于注射位置, 防止出血和肿瘤细胞溢出[6]. 3 d后, 随机选取20只小鼠切除原发瘤, 分为原发瘤切除组及人参皂苷Rg3组, 每组10只, 另取10只作为原发瘤未切除组. 原发瘤切除组和原发瘤未切除组分别灌注生理盐水0.4 mL/d, 人参皂苷Rg3组灌注人参皂苷Rg3 0.4 mL/d, 连续治疗10 d, 第11天摘除眼球取血, 处死小鼠, 剥出肝脏, 由488 nm氩离子激光(INNOVA70, Coherent Corp.)激发, 经520 nm长通滤光片滤光, Nikon活体成像仪下进行荧光成像. 将小鼠肝脏固定于40 g/L甲醛液, 48 h常规石蜡包埋切片, 倒置显微镜(日本Olympus公司)观察病理变化.
1.2.5 肿瘤组织苏木素-伊红染色: 取材组织块, 经40 g/L甲醛溶液固定后, 常规石蜡包埋, 取完整的组织蜡块以最大面积5 μm厚切片. 在100倍光镜下随机选择3个高倍视野进行拍照, 在专业图像处理软件Image Pro Plus6.0的辅助下观察肿瘤组织及血管形态学.
1.2.6 SP免疫组织化学染色观察CD34、Ki67表达: 取存档蜡块制成4 μm连续切片, 二甲苯、梯度乙醇脱蜡水化, 将切片依次经阻断灭活内源性过氧化物酶清除、0.01 mol/L枸橼酸缓冲液抗原修复、正常血清封闭、抗体结合、3, 3'-二氨基联苯胺(3, 3'-diaminobenzidine, DAB)染色、蒸馏水洗涤, 再经苏木素衬染, 盐酸酒精分化, 稀氨水蓝化, 递增梯度乙醇脱水, 二甲苯透明, 常规树脂封片. 所用一抗为1∶50稀释的山羊抗小鼠CD34mAb、Ki67单克隆抗体工作液, 二抗为1∶200生物素标记(针对Ki67二抗为1∶100快捷型酶标羊抗鼠IgG聚合物), 显色时加入1∶200辣根过氧化物酶标记的链霉卵白素工作液. 微血管密度(microvascular density, MVD)的检测方法按Weidner等的方法进行. CD34阳性以血管内皮细胞呈棕色或棕黄色染色为标准; 切片在100倍光镜下观察整张切片的血管分布情况, 确定肿瘤区域内微血管分布最高密度的5个区域, 在200倍光镜下计数不重复视野中被CD34染成棕黄色的微血管数, 取5个区域的平均值作为MVD. 每个与邻近微血管明显分离的阳性染色的血管内皮细胞或血管内皮细胞簇都视为独立的微血管; 只要结构不相连, 其分支结构也计作一个血管计数. Ki67以细胞核染色呈棕褐色或棕黄色颗粒为阳性, 每例标本观察10个高倍视野, 计算其中Ki67标记指数(labeling index, Ki67-LI).
1.2.7 TUNEL法检测肿瘤凋亡: 取存档蜡块制成4 μm连续切片, 采用TUNEL法检测细胞凋亡指数. 光镜下观察切片的染色反应, 结果判断标准为以细胞核有明显棕黄色为阳性细胞, 计数细胞数不少于1 000个, 计算TUNEL阳性标记指数(TUNEL labeling index, TUNEL-LI), 即凋亡指数, TUNEL-LI = (表达阳性细胞数/总细胞数)×100%.
统计学处理 将所有数据用SAS8.2软件进行处理, 荧光值按公式进行计算: 平均荧光光子数 = 总光子数/荧光面积, 相关性采用Spearman等级相关进行分析. 计量资料以mean±SD表示, 先采用方差分析比较各组均数, 再用最小显著性差异法分析每2组之间差异, 以P<0.05为具有统计学显著性差异.
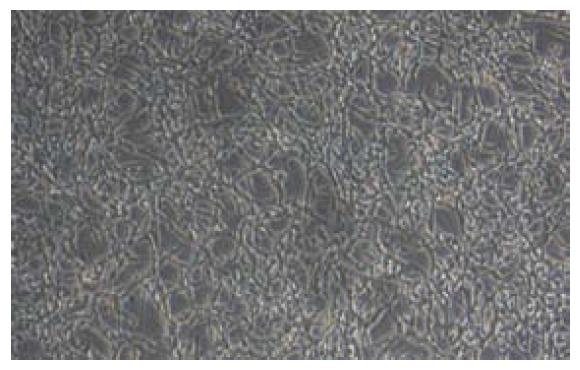
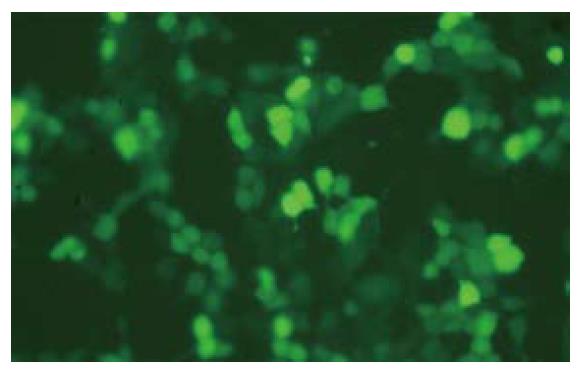
将表达GFP的慢病毒表达载体转染病毒包装细胞293T后, 通过筛选培养收集上清液获得病毒并用来感染CT-26细胞, 在含有G418 800 mg/L的RPMI-1640培养基中筛选培养, 获得了稳定表达亮绿色荧光的CT-26细胞株, 并在撤除G418筛选压力后继续培养2 mo, 细胞仍能稳定表达GFP. 细胞贴壁生长, 荧光显微镜观察可见细胞表达的荧光信号较强, 荧光较为均匀地分布于整个细胞内, 转染率接近100%, 细胞在体外能够稳定表达绿色荧光蛋白, 并且随体外长期传代培养无明显消退(图1, 图2).
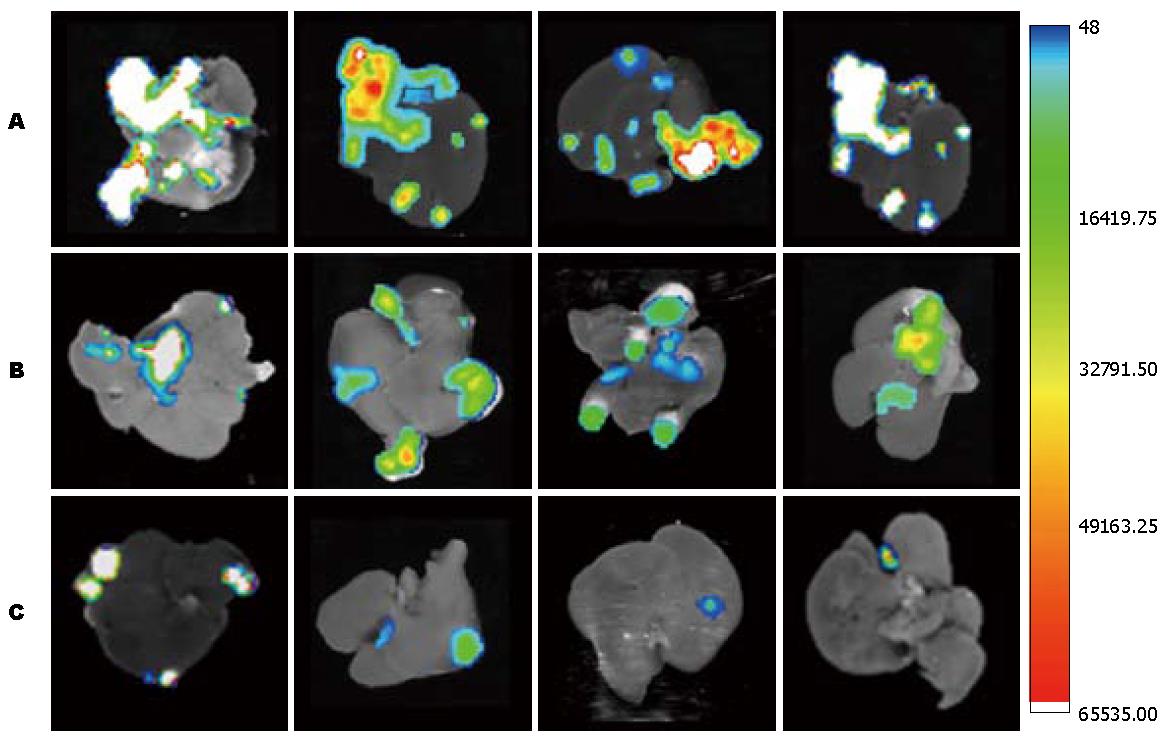
转移瘤组织发出强烈的绿色荧光, 说明肿瘤细胞在体内增殖过程中有GFP稳定、高水平的表达. 应用小动物荧光成像系统可监测到GFP在裸小鼠剥离肝脏的稳定表达, 转移瘤面积与荧光光子数成正相关. 各组小鼠治疗后平均转移灶荧光值经方差分析有显著性差异, 人参皂苷Rg3组较原发瘤切除组及原发瘤未切除组平均肝转移灶荧光值明显降低(P<0.01), 原发瘤未切除组平均肝转移灶荧光值明显低于原发瘤切除组(P<0.01, 表1, 图3, 图4).
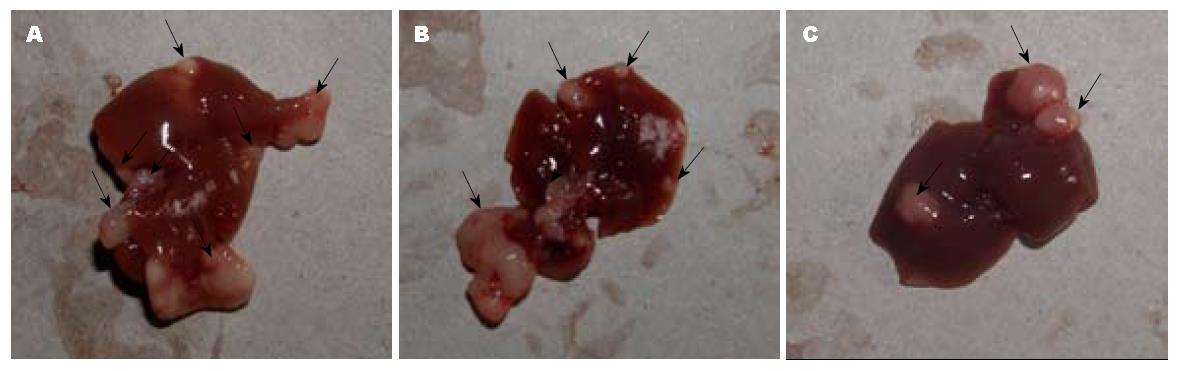
各组裸小鼠初次接种CT-26细胞后7-11 d皮下全部成瘤, 肿瘤大小无统计学差异. 各组小鼠治疗10 d后, 原发瘤切除组10只小鼠均出现肝转移灶, 转移瘤发生率100%, 平均肝脏质量为3.98 g±0.52 g, 腹水2例(20%); 原发瘤未切除组10只小鼠中, 有5只出现肝转移灶, 转移瘤发生率50%, 平均肝脏质量为3.80 g±0.33 g, 腹水3例(30%); 人参皂苷Rg3组10只小鼠中, 有4只出现肝转移灶, 转移瘤发生率40%, 平均肝脏质量为2.92 g±0.60 g, 无腹水. 第11天, 处死小鼠, 肝脏称质量, 人参皂苷Rg3组平均肝脏质量明显低于原发瘤切除组(P<0.01)及原发瘤未切除组(P<0.01), 原发瘤未切除组平均肝脏质量明显低于原发瘤切除组(P<0.01, 表1).
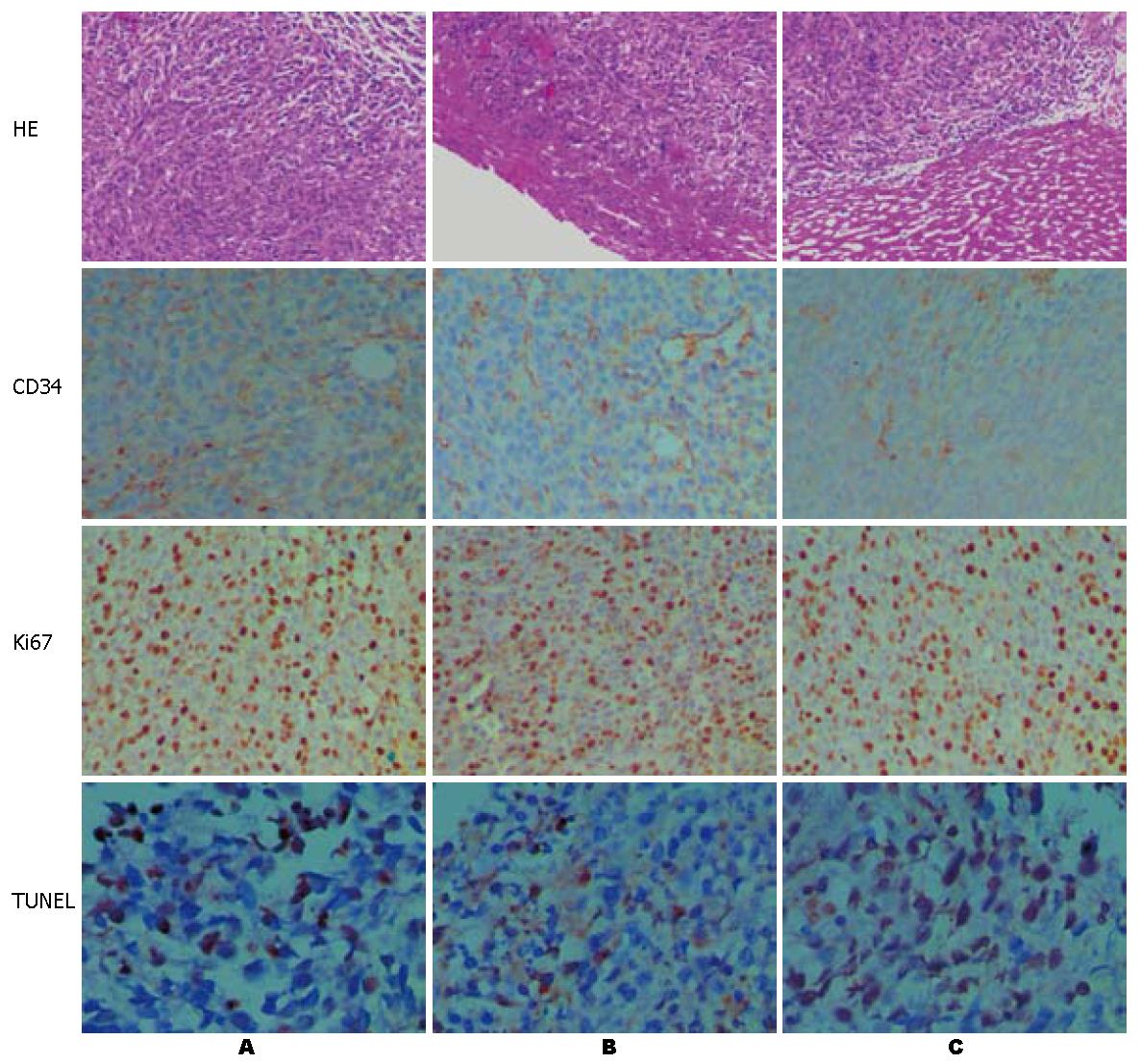
原发瘤切除组及原发瘤未切除组肿瘤组织中细胞排列紧密, 核质比增大, 肿瘤实质和间质分界不清, 细胞形状不规则, 病理性核分裂象多见. 肿瘤间质内可见新生血管, 但基底膜不完整, 偶见肿瘤细胞侵入血管形成癌栓. 人参皂苷Rg3组肿瘤组织排列疏松, 瘤灶内出现片状坏死, 位于组织中心有许多空隙, 其间可见蛋白样物质及细胞碎片, 并可见血管轮廓被破坏(图5).
各组小鼠治疗后转移瘤微血管密度经方差分析有显著性差异. 镜下可见肿瘤组织血管内皮细胞呈棕色或棕黄色染色. 治疗后人参皂苷Rg3组微血管新生抑制作用明显高于原发瘤切除组(P<0.01), 且微血管分布较稀疏, 原发瘤未切除组微血管新生抑制作用明显高于原发瘤切除组(P<0.01), 抑制作用不及人参皂苷Rg3显著(表2, 图5).
转移瘤从形态上是一个孤立的病灶, 其实原发瘤与转移瘤之间存在着复杂的调控关系. 原发性肿瘤(先前接种)抑制或减缓继发肿瘤(次后接种)生长的现象称作伴发性肿瘤抵抗(concomitant tumor resistance, CR), 1906年由Ehrlich等[7]首先提出在双侧接种肉瘤的大鼠模型中, 次后接种的肿瘤生长明显滞后于先前接种(原发)的肿瘤. 这种现象被忽视了将近60年[8], 在随后的临床实践及基础研究中发现, 对人类及小鼠的原发瘤切除后, 常导致转移瘤的发生[9-15]. 一个世纪前, 临床及实验研究均发现人类和小鼠肿瘤切除后加快转移肿瘤的生长[16,17]. Peeters等[18-20]发现结直肠癌患者原发瘤切除后, 之前较稳定的肝转移灶活性增加, 肝脏转移灶血管密度增加, 肿瘤细胞凋亡减少, 肿瘤增大. Bashford等[21]提出"伴随免疫"的假说, 肿瘤生长产生特异的免疫反应, 抑制次后接种的继发肿瘤生长. 我们应用免疫缺陷的裸鼠建立模型, 发现原发肿瘤切除后肝转移瘤发生率增高且转移灶较原发瘤未切除组增大, 说明免疫反应并非主要影响因素.
Naylor等[22,23]研究维多利亚水母(Aequorea Victoria)发光现象中分离纯化出GFP基因, 由于荧光稳定, 检测方便, 对活细胞无伤害等优点, 作为一种标记基因已经广泛应用到生物学研究的各个领域, 是目前细胞生物学示踪研究中的一种重要手段. 研究表明, 这种荧光蛋白在接受蓝光或紫外辐射时引发生物发光反应(bioluminescence reaction)并辐射出绿光, 其吸收峰为λmax = 395 nm和λmin = 470 nm, 发射峰为λ = 509 nm. 光激发GFP荧光是一种特异性的独立过程, 不需要任何的协同因子、底物或其他的基因表达产物. 当能量由Ca2+激活光蛋白(aequorin)传递给GFP时引发荧光. GFP的克隆及其在异源系统中的表达使其成为一种新的遗传标记系统[24,25]. GFP与β-半乳糖苷酶(LacZ)、萤火虫荧光素酶(Luc)等报告基因相比, GFP基因表达的绿色荧光蛋白受到蓝光或紫光照射时可自发出高强度的绿色荧光信号, 易于捕获, 无需辅助因子或其他底物的协助, 直接通过活体成像系统、激光共聚焦显微镜或流式细胞仪等检测, 观察简便[26]. 此外, 他还具有稳定性好、耐受性强、对组织或细胞无毒性和易于构建载体等优势. 活体成像系统具有较高的灵敏性, 能够客观评价CT-26-GFP细胞在裸小鼠原发瘤切除后肝转移情况, 为成像系统在肠癌发展机制、药物治疗等方便研究提供重要的参考依据.
本实验应用慢病毒将携带GFP基因的质粒转染到小鼠肠癌细胞株中, 在体内和体外均能表达GFP, 通过活体成像系统检测证实该细胞能够稳定、持续、高效地表达绿色荧光, 但由于GFP的发射波长较短且穿透力较差, 对深部组织的原发与远处转移瘤灶的研究存在一定局限性. 因此我们将治疗结束的裸小鼠剖离肝脏成像, 成像系统测得荧光光子数客观准确反应转移瘤的大小, 有利于减少人为误差, 获得的实验结果较直观可靠. 本实验建立的荧光成像技术是一个初步模型, 为深入研究肿瘤的发生、迁移及早期诊断奠定基础.
基础医学及流行病学研究结果显示, 20(R)-人参皂苷Rg3属原人参二醇型皂苷, 为五加科植物人参(Panax ginseng C.A.Meyer)的主要有效成分之一, 在体内外具有很高的抗肿瘤活性, 对多种肿瘤均有抑制作用, 其抗癌活性引起广泛关注[27]. 人参皂苷Rg3可选择性抑制癌细胞的浸润[28], 并对高转移性的小鼠黑色素瘤细胞(B16FE7)肺转移及BALB/c小鼠结肠癌细胞(26-M3.1)肺转移具有抑制作用[29]. 当肿瘤细胞进入靶器官后, 可以长期处于静息状态, 保持细胞生长和凋亡的相对平衡. 研究表明, 当转移瘤超过数毫米后进一步生长就必须依赖新生血管, 根据转移瘤新生血管形成情况, 可以将其分为无血管期(avascular phase)和血管期(vascular phase), 无血管期肿瘤为隐匿的亚临床病变, 直径<1-2 mm, 保持增生和凋亡的动态平衡, 转移瘤一旦引入血管期, 肿瘤呈对数生长. 原发瘤切除可以激活无血管期转移瘤进入血管期. 血管生成(Angiogenesis)是指在已存在的血管床产生新血管的过程. 血管能携带氧气、营养物质(如氨基酸、电解质)、激素及血细胞到机体各个组织器官维持代谢、更新和生长, 对胚胎器官发育和成人伤口愈合等非常重要. 本研究发现结肠癌原发瘤切除后肝转移瘤发生率及大小均较未切除组明显增大, 血管密度也明显增加, 提示结肠癌原发瘤的切除可触发转移瘤的生长. 我们发现人参皂苷Rg3在原发瘤切除模型中均有明显下调CD34的表达继而降低血管密度的作用. 本研究采用TUNEL技术, 通过DNA末端转移酶将带标记的dNTP(多为dUTP)间接(通过地高辛)或直接连接到DNA片段的3'-OH端, 再通过酶联显色或荧光检测定量分析结果. 判断细胞发生凋亡的形态学特征为: 染色质固缩, 向核周移动, 核膜崩溃及形成凋亡小体等[30]. Ki67是反映肿瘤细胞增殖活性的良好指标, 是判断肿瘤侵袭力及肿瘤预后的有效指标[31]. 本研究还发现凋亡指数表达与Ki67表达呈负相关趋势. 实验结果发现人参皂苷Rg3治疗后转移瘤细胞增殖抑制, 同时出现凋亡指数上升、Ki67表达下降, 提示肿瘤细胞增殖减少, 细胞凋亡增加是人参皂苷Rg3抑制原发瘤切除后转移瘤生长的部分机制.
总之, 人参皂苷Rg3对小鼠结肠癌原发瘤切除后转移瘤生长有明显的抑制作用, 其机制可能是通过直接或间接的作用, 减少血管生成, 诱导细胞凋亡, 抑制细胞增殖. 结合实验结果, 我们认为结肠癌患者在原发瘤切除后, 及时应用人参皂苷Rg3对抑制临床或亚临床转移灶生长具有潜在的临床价值.
20(R)-人参皂苷Rg3 (20(R)-Gins-enodide-Rg3)属原人参二醇型皂苷, 为五加科植物人参的主要有效成分之一, 在体内外具有很高的抗肿瘤活性.
曹秀峰, 教授, 南京医科大学附属南京第一医院肿瘤中心
手术治疗是结直肠癌的首选, 但临床研究表明, 手术切除可能并不总是有益的, 对部分患者来说, 手术也可触发肿瘤的生长, 促进转移的发生, 对已有可见或不可见转移灶的结肠癌患者, 原发瘤的切除也可加速转移灶的发展.
Mochizuki研究显示人参皂苷Rg3对高转移性的小鼠黑色素瘤细胞(B16FE7)肺转移及BALB/c小鼠结肠癌细胞(26-M3.1)肺转移具有抑制作用.
结肠癌患者在原发瘤切除后, 及时应用人参皂苷Rg3对抑制临床或亚临床转移灶生长具有潜在的临床价值.
伴发性肿瘤抵抗(concomitant tumor resistance, CR): 原发瘤抑制转移瘤生长的现象.
绿色荧光蛋白基因蛋白: 维多利亚水母(Aequorea Victoria)发光现象中分离纯化出绿色荧光蛋白基因, 荧光稳定, 检测方便, 对活细胞无伤害等优点, 作为一种标记基因已经广泛应用到生物学研究的各个领域, 是目前细胞生物学示踪研究中的一种重要手段.
本文主题明确, 实验方法科学合理, 结果可靠, 论述详细, 有一定的科学应用价值.
编辑: 曹丽鸥 电编: 闫晋利
| 1. | Tsoulfas G, Pramateftakis MG, Kanellos I. Surgical treatment of hepatic metastases from colorectal cancer. World J Gastrointest Oncol. 2011;3:1-9. [PubMed] [DOI] |
| 2. | van der Bij GJ, Oosterling SJ, Beelen RH, Meijer S, Coffey JC, van Egmond M. The perioperative period is an underutilized window of therapeutic opportunity in patients with colorectal cancer. Ann Surg. 2009;249:727-734. [PubMed] [DOI] |
| 3. | Maggi A, Ciana P. Reporter mice and drug discovery and development. Nat Rev Drug Discov. 2005;4:249-255. [PubMed] [DOI] |
| 4. | O'Reilly MS, Holmgren L, Shing Y, Chen C, Rosenthal RA, Moses M, Lane WS, Cao Y, Sage EH, Folkman J. Angiostatin: a novel angiogenesis inhibitor that mediates the suppression of metastases by a Lewis lung carcinoma. Cell. 1994;79:315-328. [PubMed] [DOI] |
| 5. | Cheng L, Fu J, Tsukamoto A, Hawley RG. Use of green fluorescent protein variants to monitor gene transfer and expression in mammalian cells. Nat Biotechnol. 1996;14:606-609. [PubMed] [DOI] |
| 6. | Ohnishi Y, Fujii H, Hayakawa Y, Sakukawa R, Yamaura T, Sakamoto T, Tsukada K, Fujimaki M, Nunome S, Komatsu Y. Oral administration of a Kampo (Japanese herbal) medicine Juzen-taiho-to inhibits liver metastasis of colon 26-L5 carcinoma cells. Jpn J Cancer Res. 1998;89:206-213. [PubMed] [DOI] |
| 7. | Ehrlich P. Arbeiten Aus Dem Koniglichen Institut Fur Experimentelle Therapie Zu Frankfurt (1906). Whitefish: Kessinger Publishing 1906; 77-103. |
| 8. | Gershon RK, Carter RL, Kondo K. On concomitant immunity in tumour-bearing hamsters. Nature. 1967;213:674-676. [PubMed] [DOI] |
| 9. | Sugarbaker EV, Ketcham AS. Mechanisms and prevention of cancer dissemination: an overview. Semin Oncol. 1977;4:19-32. [PubMed] |
| 10. | Lange PH, Hekmat K, Bosl G, Kennedy BJ, Fraley EE. Acclerated growth of testicular cancer after cytoreductive surgery. Cancer. 1980;45:1498-1506. [PubMed] [DOI] |
| 11. | Liotta LA, Hart IR. Tumor invasion and metastasis. The Hague: Martinus Nijhoff Publisher 1982; 113-131. [DOI] |
| 12. | Bonfil RD, Ruggiero RA, Bustuoabad OD, Meiss RP, Pasqualini CD. Role of concomitant resistance in the development of murine lung metastases. Int J Cancer. 1988;41:415-422. [PubMed] [DOI] |
| 13. | Di Gianni P, Franco M, Meiss RP, Vanzulli S, Piazzon I, Pasqualini CD, Bustuoabad OD, Ruggiero RA. Inhibition of metastases by a serum factor associated to concomitant resistance induced by unrelated murine tumors. Oncol Rep. 1999;6:1073-1084. [PubMed] [DOI] |
| 14. | Qadri SS, Wang JH, Coffey JC, Alam M, O'Donnell A, Aherne T, Redmond HP. Can surgery for cancer accelerate the progression of secondary tumors within residual minimal disease at both local and systemic levels? Ann Thorac Surg. 2005;80:1046-1050; discussion 1046-1050;. [PubMed] [DOI] |
| 15. | Beecken WD, Engl T, Jonas D, Blaheta RA. Expression of angiogenesis inhibitors in human bladder cancer may explain rapid metastatic progression after radical cystectomy. Int J Mol Med. 2009;23:261-266. [PubMed] |
| 16. | Demicheli R, Retsky MW, Hrushesky WJ, Baum M, Gukas ID. The effects of surgery on tumor growth: a century of investigations. Ann Oncol. 2008;19:1821-1828. [PubMed] [DOI] |
| 17. | Retsky MW, Demicheli R, Hrushesky WJ, Baum M, Gukas ID. Dormancy and surgery-driven escape from dormancy help explain some clinical features of breast cancer. APMIS. 2008;116:730-741. [PubMed] [DOI] |
| 18. | Peeters CF, de Geus LF, Westphal JR, de Waal RM, Ruiter DJ, Wobbes T, Oyen WJ, Ruers TJ. Decrease in circulating anti-angiogenic factors (angiostatin and endostatin) after surgical removal of primary colorectal carcinoma coincides with increased metabolic activity of liver metastases. Surgery. 2005;137:246-249. [PubMed] [DOI] |
| 19. | Peeters CF, de Waal RM, Wobbes T, Ruers TJ. Metastatic dormancy imposed by the primary tumor: does it exist in humans? Ann Surg Oncol. 2008;15:3308-3315. [PubMed] [DOI] |
| 20. | Peeters CF, de Waal RM, Wobbes T, Westphal JR, Ruers TJ. Outgrowth of human liver metastases after resection of the primary colorectal tumor: a shift in the balance between apoptosis and proliferation. Int J Cancer. 2006;119:1249-1253. [PubMed] [DOI] |
| 21. | Bashford E. Third scientific report on the investigation of the Imperial Cancer Research Fund. London: Taylor and Francis 1908; 262-268. |
| 22. | Naylor LH. Reporter gene technology: the future looks bright. Biochem Pharmacol. 1999;58:749-757. [PubMed] [DOI] |
| 23. | Ogawa H, Inouye S, Tsuji FI, Yasuda K, Umesono K. Localization, trafficking, and temperature-dependence of the Aequorea green fluorescent protein in cultured vertebrate cells. Proc Natl Acad Sci USA. 1995;92:11899-11903. [PubMed] [DOI] |
| 24. | Hastings JW. Chemistries and colors of bioluminescent reactions: a review. Gene. 1996;173:5-11. [PubMed] [DOI] |
| 25. | Inouye S, Tsuji FI. Aequorea green fluorescent protein. Expression of the gene and fluorescence characteristics of the recombinant protein. FEBS Lett. 1994;341:277-280. [PubMed] [DOI] |
| 26. | Winnard PT, Kluth JB, Raman V. Noninvasive optical tracking of red fluorescent protein-expressing cancer cells in a model of metastatic breast cancer. Neoplasia. 2006;8:796-806. [PubMed] [DOI] |
| 27. | Wang CZ, Zhang B, Song WX, Wang A, Ni M, Luo X, Aung HH, Xie JT, Tong R, He TC. Steamed American ginseng berry: ginsenoside analyses and anticancer activities. J Agric Food Chem. 2006;54:9936-9942. [PubMed] [DOI] |
| 28. | Xu TM, Xin Y, Cui MH, Jiang X, Gu LP. Inhibitory effect of ginsenoside Rg3 combined with cyclophosphamide on growth and angiogenesis of ovarian cancer. Chin Med J (Engl). 2007;120:584-588. [PubMed] |
| 29. | Mochizuki M, Yoo YC, Matsuzawa K, Sato K, Saiki I, Tono-oka S, Samukawa K, Azuma I. Inhibitory effect of tumor metastasis in mice by saponins, ginsenoside-Rb2, 20(R)- and 20(S)-ginsenoside-Rg3, of red ginseng. Biol Pharm Bull. 1995;18:1197-1202. [PubMed] [DOI] |
| 30. | Mignotte B, Vayssiere JL. Mitochondria and apoptosis. Eur J Biochem. 1998;252:1-15. [PubMed] [DOI] |
| 31. | Bayrak A, Saadat P, Mor E, Chong L, Paulson RJ, Sokol RZ. Pituitary imaging is indicated for the evaluation of hyperprolactinemia. Fertil Steril. 2005;84:181-185. [PubMed] [DOI] |