修回日期: 2012-01-31
接受日期: 2012-03-15
在线出版日期: 2012-04-18
目的: 体研究膜联蛋白A2(Annexin A2, ANXA2)、膜联蛋白A4(Annexin A4, ANXA4)在人体胃腺癌(gastric adenocarcinoma cells, GAC)的表达, 探讨其表达与GAC生物学行为的关系及两种蛋白的相关性.
方法: 免疫组织化学SP法检测组织芯片中75对配对的GAC和其相应癌旁组织ANXA2和ANXA4的表达.
结果: 在GAC和癌旁组织中ANXA2、ANXA4的表达分别为: 33.1%(25) vs 1.3%(1)、68.0%(51) vs 25.5%(13), 二者在GAC的表达显著高于癌旁组织(χ2 = 24.448, P = 0.000; χ2 = 39.353, P = 0.000); ANXA2和ANXA4在GAC表达呈正相关(r = 0.335, P = 0.003); 两种蛋白的表达与GAC的浸润深度、淋巴结转移、TNM分期和分化程度有关(P<0.05), 与年龄、性别和远处转移无关(P>0.05); 肿瘤大小与ANXA2表达有关(P<0.01), 与ANXA4表达无关(P>0.05).
结论: ANXA2和ANXA4的表达上调可能共同参与了GAC的发生、发展、浸润和转移, 可作为临床预测GAC预后的标志物和治疗靶点.
引文著录: 张志强, 聂永梅, 李秀娟, 夏宇, 胡翠梨, 苏丽萍, 李建洲, 宋娜, 蒋海, 张洁. ANXA2和ANXA4在胃腺癌中的表达及临床意义. 世界华人消化杂志 2012; 20(11): 930-935
Revised: January 31, 2012
Accepted: March 15, 2012
Published online: April 18, 2012
AIM: To investigate the expression of annexin A2 (ANXA2) and annexin A4 (ANXA4) in human gastric adenocarcinoma (GAC) and to explore the relationship between their expression and biological behaviors of GAC.
METHODS: The expression of ANXA2 and ANXA4 was detected by immunohistochemistry in a tissue microarray containing 75 pairs of GAC and matched tumor-adjacent tissue specimens.
RESULTS: The positive rates of ANXA2 and ANXA4 expression in GAC were significantly higher than those in tumor-adjacent tissue (33.1% vs 1.3%, 68.0% vs 25.5%, both P < 0.05). The expression of ANXA2 was positively correlated with that of ANXA4 in GAC (r = 0.335, P = 0.003). The expression of ANXA2 and ANXA4 was closely associated with invasion depth, lymph node metastasis, TNM stage and differentiation grade in GAC (all P < 0.05), but not with sex, age or distant metastasis (all P > 0.05). Tumor size had a correlation with the expression of ANXA2 (P < 0.05), but not with that of ANXA4 (P > 0.05).
CONCLUSION: Overexpression of ANXA2 and ANXA4 may play a synergistic role in the carcinogenesis, invasion and metastasis of GAC. ANXA2 and ANXA4 may be used as targets for GAC therapy and markers for prognostic prediction.
- Citation: Zhang ZQ, Nie YM, Li XJ, Xia Y, Hu CL, Su LP, Li JZ, Song N, Jiang H, Zhang J. Clinical significance of expression of ANXA2 and ANXA4 in gastric adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(11): 930-935
- URL: https://www.wjgnet.com/1009-3079/full/v20/i11/930.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i11.930
胃癌死亡率居恶性肿瘤第2位[1,2], 每年全世界有75万人死于胃癌[3], 大多胃癌确诊时已中晚期, 5年生存率仅20%-30%, 早期胃癌根治术5年生存率达90%-95%[4,5]. 分子标志物是肿瘤诊断、复发转移预测和预后评估最敏感、有效的指标, 因此寻找与胃癌发生发展密切相关的分子标志物, 探讨其发病机制, 对胃癌的早期诊断和治疗效果的提高具有重要意义[6]. 在前期工作中, 本课题组应用激光捕获显微切割技术(laser capture microdissection, LCM)及18O标记结合纳升级反向液相色谱串联质谱(Nano-RPLC-MS/MS)定量蛋白质组技术, 筛选胃癌和正常胃黏膜的差异蛋白. 结果发现膜联蛋白A2(Annexin A2, ANXA2)、膜联蛋白A4(Annexin A4, ANXA4)在胃癌中明显上调[7-9]. 近年研究发现这两种蛋白参与了多种肿瘤的生物学行为[10]. 为进一步探讨他们在胃癌中的作用和可能机制, 本研究应用免疫组织化学技术检测组织芯片中的75对人体胃腺癌(gastric adenocarcinoma, GAC)和癌旁组织中ANXA2和ANXA4的表达特点, 分析蛋白表达与年龄、性别、分化程度、浸润深度、转移、临床TNM分期和肿瘤大小等GAC临床病理指标的关系, 并探讨两种蛋白在GAC表达的相关性.
人类胃癌组织芯片购自上海芯超科技有限公司(批号: OD-CT-DgStm01), 含配对的胃癌组织和癌旁组织各75例, 男50例, 女25例, 年龄30-84岁, 平均63.6岁; 其中Ⅰ期病例12例, Ⅱ期病例25例, Ⅲ期病例32例, Ⅳ期病例4例(按照2009年国际抗癌联盟制定的第7版TNM分期标准). 临床病理资料完整, 肿瘤侵及黏膜下层、肌层、浆膜和浆膜外分别为6、13、46和10例; 高-中分化腺癌34例, 低-未分化腺癌41例; 无淋巴结转移者30例, 有淋巴结转移者45例; 未发现远处转移者69例, 有远处转移者6例; 38例肿瘤最大径≤5 cm, 37例肿瘤最大径>5 cm.
鼠抗人ANXA2单克隆抗体(sc-28385)购自Santa Cruz公司; 兔抗人多克隆ANXA4抗体(HPA007393)购自Sigma-Aldrich公司, S-P超敏免疫组织化学试剂盒(KIT-9701)和DAB酶显色试剂盒(DAB-0031)购自福州迈新生物技术公司; HRP标记的羊抗鼠二抗(ZB-2305)购自北京中杉金桥生物技术有限公司.
1.2.1 免疫组织化学染色检测ANXA2、ANXA4: 严格按照试剂盒说明书操作, 采用SP法: 组织芯片经常规脱蜡水化, 枸橼酸盐抗原修复, 3%H2O2-甲醛阻断内源性过氧化物酶, 加1∶100 ANXA2或1∶50 ANXA4一抗, 4 ℃孵育过夜. 加生物标记的二抗, 加链霉素抗生物素-过氧化物酶溶液. 每步用PBS冲洗, 室温孵育; DAB显色, 苏木素复染、蓝化、梯度酒精脱水, 中性树胶封固. 用PBS液代替一抗作阴性对照, 用已知阳性反应片做阳性对照.
1.2.2 IHC染色评分判定标准: 每点随机选取至少10个高倍镜视野(×200), 至少计数1 000个细胞, 采用Fromowitz综合计分法[11], 根据染色强度和阳性细胞百分率判断染色结果, 双盲评分. 染色强度评分: 无染色0分, 浅黄色1分, 棕黄色2分, 棕褐色3分. 细胞中染色阳性细胞数5%为0分, 5%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分. 两项评分之和小于2为阴性(-), 记为1; 2-3分为弱阳性(+), 记为2; 4-5分为中度阳性(++), 记为3; 6-7分为强阳性(+++), 记为4. ≤(++)低表达, (+++)高表达.
统计学处理 实验数据用SPSS17.0统计软件分析: 不同组织间蛋白差异表达与胃腺癌临床病理参数间关系采用χ2检验及Fisher确切概率法, ANXA2与ANXA4蛋白表达的关系用Spearman等级相关, P<0.05表示差异有统计学意义.
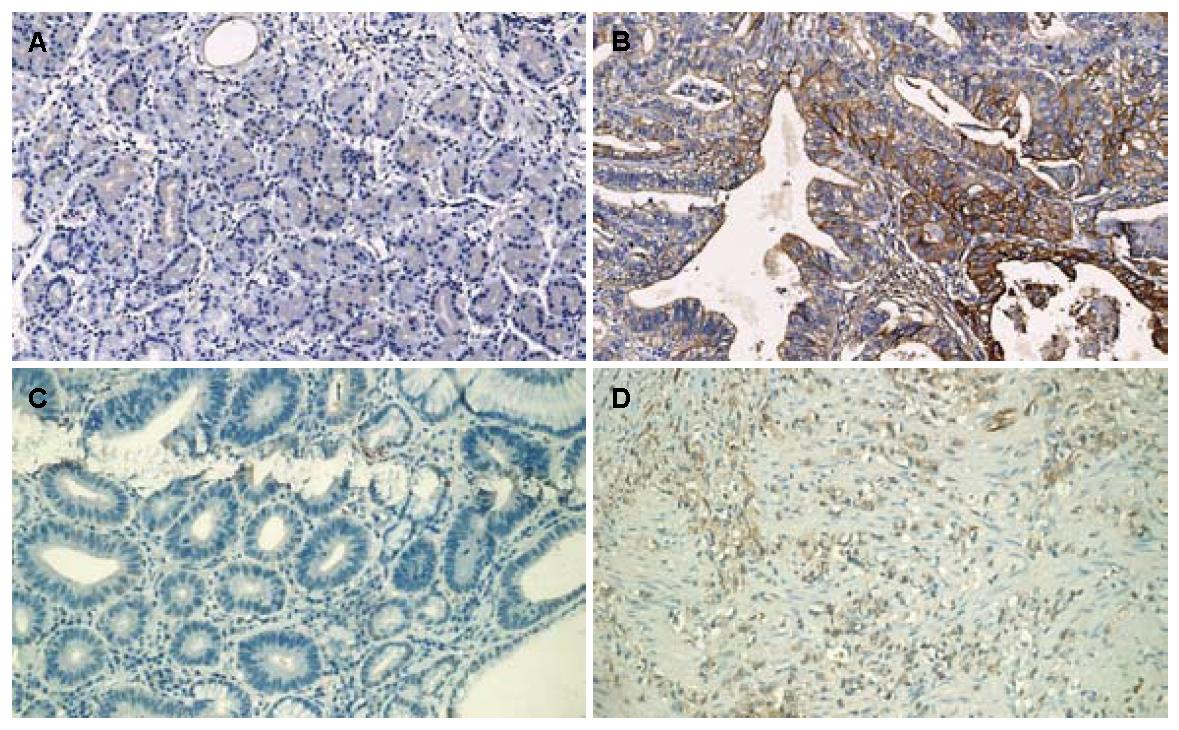
75例GAC中, 25例ANXA2高表达, 51例ANXA4高表达; 75例癌旁组织中, 1例ANXA2高表达, 13例ANXA4高表达. ANXA2在GAC的胞浆和胞膜呈阳性表达, 而癌旁组织只在胞浆表达; ANXA4在GAC的胞浆和胞核阳性表达, 在癌旁组织的胞浆表达, 胞核为阴性(图1); ANXA2、ANXA4在GAC的表达显著高于其在癌旁组织的表达, 差异有统计学意义(P<0.01, 表1).
| 组织类型 | ANXA2 n(%) | χ2值 | P值 | ANXA4 n(%) | χ2值 | P值 |
| GAC | 25(33.3) | 24.448 | 0.000 | 51(68.0) | 39.353 | 0.000 |
| 癌旁组织 | 1(1.3) | 13(17.3) |
ANXA2、ANXA4的表达与GAC的浸润深度、淋巴结转移、TNM分期和分化程度有关(P<0.05), 随着肿瘤浸润深度的增加、淋巴结转移的发生、TNM分期的提高及肿瘤分化程度的降低, 两种蛋白表达均增高. ANXA2、ANXA4的表达与性别、年龄及肿瘤有无远处转移无关(P>0.05). ANXA2在GAC最大径>5 cm的表达高于GAC最大径≤5 cm的表达(P<0.05), ANXA4的表达与肿瘤大小无关(P>0.05, 表2).
| 参数 | n | AnnexinA2 | χ2值 | P值 | AnnexinA4 | χ2值 | P值 | ||
| 低 | 高 | 低 | 高 | ||||||
| 性别 | |||||||||
| 男 | 50 | 35 | 15 | 0.750 | 0.386 | 18 | 32 | 1.103 | 0.294 |
| 女 | 25 | 15 | 10 | 6 | 19 | ||||
| 年龄(岁) | |||||||||
| ≤60 | 24 | 18 | 6 | 1.103 | 0.294 | 10 | 14 | 1.516 | 0.218 |
| >60 | 51 | 32 | 19 | 14 | 37 | ||||
| 组织分化 | |||||||||
| 高/中 | 34 | 27 | 7 | 4.546 | 0.033 | 15 | 19 | 4.197 | 0.041 |
| 低 | 41 | 23 | 18 | 9 | 32 | ||||
| 浸润深度 | |||||||||
| T1-2 | 19 | 17 | 2 | 4.599 | 0.032 | 10 | 9 | 4.978 | 0.026 |
| T3-4 | 56 | 33 | 23 | 14 | 42 | ||||
| N期 | |||||||||
| N0 | 30 | 24 | 6 | 4.000 | 0.045 | 14 | 16 | 4.943 | 0.026 |
| N1-3 | 45 | 26 | 19 | 10 | 35 | ||||
| M期 | |||||||||
| M0 | 69 | 46 | 23 | 0.201 | 0.654 | 21 | 48 | 0.971 | 0.324 |
| M1 | 6 | 4 | 2 | 3 | 3 | ||||
| TNM分期 | |||||||||
| Ⅰ-Ⅱ | 37 | 29 | 8 | 4.508 | 0.034 | 17 | 20 | 6.527 | 0.011 |
| Ⅲ-Ⅳ | 38 | 21 | 17 | 7 | 31 | ||||
| 肿瘤大小 | |||||||||
| ≤5 cm | 38 | 30 | 8 | 5.228 | 0.022 | 15 | 23 | 1.977 | 0.160 |
| >5 cm | 37 | 20 | 17 | 9 | 28 | ||||
膜联蛋白(Annexins)是一类与Ca2+结合的钙依赖性磷脂结合蛋白, 结构上均有保守的C-末端核心区和可变的N-末端结构域, 前者与膜相关磷脂结合, 后者决定了Annexins的特异性生物学功能[12]. Annexins具有参与膜的形成、膜转运、细胞信号转导及膜表面其他一系列依赖于钙调蛋白的细胞活动, 如胞吞、胞吐、细胞增殖、分化和凋亡等多种功能[13,14]. 近年来, Annexins在肿瘤学中的作用备受重视, 成为研究的热点. 研究显示: ANXA2在肝癌[15]、胰腺癌[16]、肺癌[17]、肾细胞癌[18]和神经胶质瘤等多种肿瘤组织表达上调[19,20]; Shen等[21]发现ANXA4在胰腺癌中表达升高, 陈滨等[22]发现ANXA4 mRNA在正常肝-肝硬化-肝癌组织表达逐渐上升, Annexins参与了肿瘤发生发展, 与肿瘤浸润转移及预后相关.
本研究前期我们应用Nano-RPLC-MS/MS定量蛋白质组技术筛选胃癌差异蛋白, 并用Western-blot免疫印迹验证, 发现ANXA2和ANXA4在胃癌中明显上调[7,8]. 为了进一步探讨两种蛋白表达和胃癌临床病理参数的关系以及两种蛋白表达是否有相关性, 本研究扩大样本量, 采用组织芯片和免疫组织化学证实ANXA2和ANXA4在GAC高表达; 并发现两种蛋白的表达和胃癌患者的年龄、性别和肿瘤是否有远处转移无关, 而与胃癌的分化程度、浸润深度、淋巴结转移和临床分期密切相关. 分化程度越低、浸润越深的GAC, ANXA2、ANXA4就越高表达, 两种蛋白在有淋巴结转移的GAC中的表达高于无淋巴结转移者, Ⅲ-Ⅳ期GAC患者ANXA2、ANXA4的表达高于Ⅰ-Ⅱ期患者. 此外, 胃癌最大径>5 cm的ANXA2表达显著高于其在肿瘤直径≤5 cm的表达, ANXA4的表达在两组无差异, 与肿瘤体积大小无关. Emoto等[23]通过免疫组织化学研究发现人原发性大肠癌中ANXA2表达与肿瘤组织型、体积、分期及侵袭有关; Ducan等[24]用蛋白质组学证实Annexins(ANXA1、A2、A4)与结肠癌的分期、转移等密切相关. 本研究与相关研究结果基本一致, 说明ANXA2、ANXA4参与了GAC的发生发展、侵袭转移; ANXA2、ANXA4在GAC的高低表达可间接反映胃癌的预后, 提示ANXA2、ANXA4可作为肿瘤分级评判和预后估计的指标. 两种蛋白在GAC表达关系分析显示: 二者呈正相关, r = 0.335, 提示ANXA2和ANXA4在GAC的发生发展中具有协同效应.
目前, ANXA2、ANXA4参与GAC的生物学行为机制尚不明确. 浸润和转移是恶性肿瘤的特征, 瘤细胞由其原发部位侵入血管、淋巴管, 并被血流、淋巴流带到另一部位或器官, 在该处繁殖生长. ANXA2作为细胞表面受体, 可与组织型纤维蛋白溶解酶原激活物(type plasminogen activator, t-PA)和纤溶酶原(plasminogen, PLG)结合[25], 3者在内皮细胞表面的共区域化促使PLG蛋白水解, 生成纤溶酶(plasmin, PL), 促进纤维蛋白的降解. 其结果一方面可能导致肿瘤细胞易出血和转移, 如白血病细胞表面以及由急性早幼粒细胞白血病衍生的细胞系中, ANXA2过表达与出血的临床表现及白血病细胞在活体外产生纤溶酶的能力相关[17,26]; 另一方面PLG被ANXA2激活并生成的PL可能通过活化促进金属蛋白酶(matrix metalloproteinases, MMPs)和各种生长因子的活化、膜蛋白的水解、细胞外基质的降解等, 加速血管生成可促进肿瘤的浸润和转移[25,27].
ANXA2和S100A10结合形成异源四聚体(AIIt), 此形式有助于ANXA2和S100A10转定位于膜上; 肿瘤细胞分泌的S100A4可以刺激ANXA2转定位于内皮细胞表面, S100A10、S100A4与ANXA2的结合和相互作用可促使t-PA依赖的PLG活化及PL产生等反应的起始及级联放大[28]. 本研究发现ANXA2在GAC的胞浆和胞膜均阳性表达, 而只在癌旁组织胞浆阳性表达, 胞膜呈阴性表达, 说明可能与S100A10、S100A4的参与有关, 他们可能介导了ANXA2在胞质-胞膜的转位, 诱导PL的生成, 导致胞外基质的重塑、促进肿瘤新生血管生成, 增强恶性肿瘤的侵袭和转移能力[29]. ANXA4在良性胃黏膜组织中的细胞浆表达, 但在胃癌组织癌细胞核亦可见强阳性表达, 这可能与癌细胞的扩散有关. ANXA4在Ca2+作用下具有促肾上腺髓质颗粒聚集的作用, 即通过与膜结合、自身聚合、形成疏水蛋白桥, 从而实现膜与膜的联接, 这提示ANXA4可能参与细胞的生长、分化及转化; 通过运用人乳腺癌细胞系进行研究证实, 过表达的ANXA4与ανβ5介导的人乳腺癌细胞(MCF27)与粘连蛋白的附着有关, 整连蛋白ανβ5是玻璃粘连蛋白的主要受体, 其运动性与肿瘤在人体内的分布和转移有关[30]. 以上从某些方面解释了ANXA2、ANXA4参与GAC生物学行为的可能机制.
GAC的发生、发展是一个复杂的过程, 是多因素多机制共同参与、相互作用的结果[31]. 目前关于GAC的病因学和发病学研究较多, 但临床应用效果并不理想. 本实验通过组织芯片研究发现ANXA2、ANXA4参与GAC的生物学行为. 目前对ANXA2、ANXA4的了解尚不全面, 其参与GAC发生发展、浸润转移的具体机制和二者在GAC中的协同作用机制, 值得进一步研究. 随着相关研究的不断深入, ANXA2、ANXA4基因的表达、生物学功能及在肿瘤中的角色将会逐步明朗化, 两种蛋白有望应用于肿瘤的早期检测、诊断和治疗, 成为肿瘤预测预后的标志物和治疗靶点.
ANXA2、ANXA4参与了多种肿瘤的生物学行为, 研究两种蛋白在胃癌的表达特点和二者的相关性, 探讨胃癌发病机制, 对胃癌早期诊断、预后评估及治疗靶标方面具有重要意义.
郑鹏远, 教授, 主任医师, 郑州大学第二附属医院消化科
ANXA2、ANXA4因参与肿瘤发生发展、浸润转移而备受关注, 有望被开发为肿瘤及其转移的早期检测、辅助诊断及治疗的靶点, 故他们在肿瘤中的具体作用机制有待明确化.
本研究证明, ANXA2、ANXA4与GAC的浸润、转移、分期、分化程度等有关, 且ANXA2和ANXA4在GAC表达呈正相关, 可以为进一步探索他们在肿瘤中的作用机制及抗胃癌发生发展的研究积累资料.
本文针对临床常见的胃癌分子生物学特性进行研究, 具有一定的理论意义和潜在的临床价值. 本研究方法先进、结论中肯.
编辑: 张姗姗 电编: 鲁亚静
| 1. | Zhang J, Guo SB, Duan ZJ. Application of magnifying narrow-band imaging endoscopy for diagnosis of early gastric cancer and precancerous lesion. BMC Gastroenterol. 2011;11:135. [PubMed] [DOI] |
| 3. | Murray CJ, Lopez AD. Mortality by cause for eight regions of the world: Global Burden of Disease Study. Lancet. 1997;349:1269-1276. [PubMed] [DOI] |
| 4. | Peddanna N, Holt S, Verma RS. Genetics of gastric cancer. Anticancer Res. 1995;15:2055-2064. [PubMed] |
| 6. | Abbaszadegan MR, Moaven O, Sima HR, Ghafarzadegan K, A'rabi A, Forghani MN, Raziee HR, Mashhadinejad A, Jafarzadeh M, Esmaili-Shandiz E. p16 promoter hypermethylation: a useful serum marker for early detection of gastric cancer. World J Gastroenterol. 2008;14:2055-2060. [PubMed] [DOI] |
| 7. | Zhang Z, Li M, Zhang G, Fang P, Yao H, Xiao Z, Chen Z. Identification of human gastric carcinoma biomarkers by differential protein expression analysis using 18O labeling and nanoLC-MS/MS coupled with laser capture microdissection. Med Oncol. 2010;27:296-303. [PubMed] [DOI] |
| 8. | 张 志强, 李 茂玉, 张 桂英, 彭 芳, 姚 慧欣, 李 美香, 肖 志强, 陈 主初. 激光捕获显微切割技术结合18O标记定量蛋白质组技术在胃癌标志物筛查中的应用研究. 生物化学与生物物理进展. 2009;36:311-322. |
| 11. | Fromowitz FB, Viola MV, Chao S, Oravez S, Mishriki Y, Finkel G, Grimson R, Lundy J. ras p21 expression in the progression of breast cancer. Hum Pathol. 1987;18:1268-1275. [PubMed] [DOI] |
| 12. | 黄 昀, 傅 松滨. AnnexinⅡ的遗传学研究. 国外医学·遗传学分册. 2004;27:330-333. |
| 13. | Laohavisit A, Davies JM. Annexins. New Phytol. 2011;189:40-53. [PubMed] [DOI] |
| 14. | Monastyrskaya K, Babiychuk EB, Draeger A. The annexins: spatial and temporal coordination of signaling events during cellular stress. Cell Mol Life Sci. 2009;66:2623-2642. [PubMed] [DOI] |
| 15. | Frohlich M, Motté P, Galvin K, Takahashi H, Wands J, Ozturk M. Enhanced expression of the protein kinase substrate p36 in human hepatocellular carcinoma. Mol Cell Biol. 1990;10:3216-3223. [PubMed] [DOI] |
| 16. | Chen R, Brentnall TA, Pan S, Cooke K, Moyes KW, Lane Z, Crispin DA, Goodlett DR, Aebersold R, Bronner MP. Quantitative proteomics analysis reveals that proteins differentially expressed in chronic pancreatitis are also frequently involved in pancreatic cancer. Mol Cell Proteomics. 2007;6:1331-1342. [PubMed] [DOI] |
| 18. | Domoto T, Miyama Y, Suzuki H, Teratani T, Arai K, Sugiyama T, Takayama T, Mugiya S, Ozono S, Nozawa R. Evaluation of S100A10, annexin II and B-FABP expression as markers for renal cell carcinoma. Cancer Sci. 2007;98:77-82. [PubMed] [DOI] |
| 19. | 樊 素珍, 苑 中甫. 钙磷脂结合蛋白annexinA2与肿瘤发生发展. 国际生殖健康/计划生育杂志. 2009;28:55-58. |
| 20. | 维 峰, 汪 昱. Annexins在恶性肿瘤中的表达及其临床意义. 中国现代普通外科进展. 2010;13:302-305. |
| 21. | Shen J, Person MD, Zhu J, Abbruzzese JL, Li D. Protein expression profiles in pancreatic adenocarcinoma compared with normal pancreatic tissue and tissue affected by pancreatitis as detected by two-dimensional gel electrophoresis and mass spectrometry. Cancer Res. 2004;64:9018-9026. [PubMed] [DOI] |
| 23. | Emoto K, Yamada Y, Sawada H, Fujimoto H, Ueno M, Takayama T, Kamada K, Naito A, Hirao S, Nakajima Y. Annexin II overexpression correlates with stromal tenascin-C overexpression: a prognostic marker in colorectal carcinoma. Cancer. 2001;92:1419-1426. [PubMed] [DOI] |
| 24. | Duncan R, Carpenter B, Main LC, Telfer C, Murray GI. Characterisation and protein expression profiling of annexins in colorectal cancer. Br J Cancer. 2008;98:426-433. [PubMed] [DOI] |
| 27. | Sharma MR, Koltowski L, Ownbey RT, Tuszynski GP, Sharma MC. Angiogenesis-associated protein annexin II in breast cancer: selective expression in invasive breast cancer and contribution to tumor invasion and progression. Exp Mol Pathol. 2006;81:146-156. [PubMed] [DOI] |
| 28. | Madureira PA, Surette AP, Phipps KD, Taboski MA, Miller VA, Waisman DM. The role of the annexin A2 heterotetramer in vascular fibrinolysis. Blood. 2011;118:4789-4797. [PubMed] [DOI] |
| 29. | Semov A, Moreno MJ, Onichtchenko A, Abulrob A, Ball M, Ekiel I, Pietrzynski G, Stanimirovic D, Alakhov V. Metastasis-associated protein S100A4 induces angiogenesis through interaction with Annexin II and accelerated plasmin formation. J Biol Chem. 2005;280:20833-20841. [PubMed] [DOI] |