修回日期: 2012-01-29
接受日期: 2012-03-15
在线出版日期: 2012-04-08
目的: 比较食物不耐受(food intolerance, FI)在腹泻型肠易激综合征患者(diarrhea-dominant irritable bowel syndrome, D-IBS)及健康人群中的存在情况, 分析D-IBS患者食物不耐受严重程度、症状指数与回盲部肥大细胞数量变化之间的关系, 以探讨食物不耐受在D-IBS发病中的意义及可能机制.
方法: 选取符合罗马Ⅲ诊断标准的D-IBS患者22例为病例组, 无消化系症状的健康体检者21例为对照组, 分别接受结肠镜检查. 应用食物不耐受状况评价问卷对2组进行食物不耐受状况评分; 用功能性肠病症状严重指数(functional bowel disorder severity index, FBDSI)和IBS病情尺度调查表(IBS symptom severity scale, IBS-SSS)对病例组进行IBS症状严重程度评分. 所有研究对象均接受结肠镜检查, 在距回盲瓣4 cm处取活检组织2块, 采用甲苯胺蓝染色法计数黏膜肥大细胞数量, 并与食物不耐受严重程度指数、IBS症状严重程度评分进行相关性分析.
结果: D-IBS患者回盲部肠黏膜肥大细胞计数(4.68±0.55)个/高倍镜视野, 健康对照组为(1.33±0.54)个/高倍镜视野, P<0.001, 差异具有统计学意义; 病例组食物不耐受存在情况明显高于对照组(P<0.05); 食物不耐受严重程度与IBS症状严重程度指数间呈正相关(FBDSI: r = 0.992, P<0.001; IBS-SSS: r = 0.970, P<0.001); 回盲部肥大细胞计数与IBS症状严重程度指数间呈正相关(FBDSI: r = 0.957, P<0.001; IBS-SSS: r = 0.985, P<0.001); 食物不耐受严重程度与IBS患者回盲部肥大细胞计数间呈正相关(r = 0.964, P<0.001), 健康对照组中食物不耐受者回盲部肥大细胞计数明显高于无食物不耐受者(P<0.05).
结论: D-IBS临床症状与肠道肥大细胞数量增多密切相关, 食物抗原的刺激作用可能是D-IBS患者回盲部肥大细胞数目增多的原因之一; D-IBS患者食物不耐受存在情况普遍, 食物不耐受可加重D-IBS患者肠道症状.
引文著录: 庄莹, 林志辉. 腹泻型肠易激综合征患者食物不耐受、症状指数及回盲部肥大细胞变化的相关性. 世界华人消化杂志 2012; 20(10): 883-887
Revised: January 29, 2012
Accepted: March 15, 2012
Published online: April 8, 2012
AIM: To analyze the relationship among food intolerance, severity of symptoms and the number of mucosal mast cells (MCs) in the ileocecal junction (ICJ) in patients with diarrhea-predominant irritable bowel syndrome (D-IBS), and to explore the influence of food intolerance on the pathogenesis of D-IBS.
METHODS: Twenty-two patients with D-IBS fulfilling the Rome III criteria and 21 asymptomatic healthy controls underwent colonoscopy in which two adjacent biopsy samples were taken from the ICJ. Mucosal MCs were detected by toluidine blue staining. The Food Intolerance Questionnaire was used to evaluate the perceived food intolerance status of D-IBS patients and controls. The Functional Bowel Disorder Severity Index (FBDSI) and IBS Symptom Severity Scale (IBS-SSS) were used to evaluate the severity of symptoms in D-IBS patients. The relationship among the scores of FBDSI and IBS-SSS, the number of MCs and the scores of food intolerance in D-IBS patients was analyzed.
RESULTS: The number of mucosal MCs in the ICJ was significantly higher in patients with D-IBS than in controls (4.68 ± 0.55/HP vs 1.33 ± 0.54/HP, P < 0.001). Compared to controls, perceived FI was more frequent in patients with D-IBS (P < 0.05). The scores of FBDSI and IBS-SSS were positively correlated with that of food intolerance in D-IBS patients (FBDSI: r = 0.992, P < 0.001; IBS-SSS: r = 0.970, P < 0.001), and with the number of mucosal MCs in the ICJ (FBDSI: r = 0.957, P < 0.001; IBS-SSS: r = 0.985, P < 0.001). The scores of food intolerance in D-IBS patients were positively correlated with the number of mucosal MCs in the ICJ (r = 0.964, P < 0.001). The number of mucosal MCs in the ICJ were significantly higher in healthy subjects with self-reported food intolerance than in those without food intolerance (P < 0.05).
CONCLUSION: The symptoms of D-IBS are positively correlated with increased number of enteric mucosal MCs which might be caused by food antigen. Food intolerance is more frequent in D-IBS patients than in controls. D-IBS symptoms may be caused or exacerbated by food intolerance.
- Citation: Zhuang Y, Lin ZH. Relationship among food intolerance, severity of symptoms and the number of mast cells in the ileocecal junction in patients with diarrhea-predominant irritable bowel syndrome. Shijie Huaren Xiaohua Zazhi 2012; 20(10): 883-887
- URL: https://www.wjgnet.com/1009-3079/full/v20/i10/883.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i10.883
肠易激综合征(irritable bowel syndrome, IBS)是一种常见的功能性肠病, 以腹痛或腹部不适为主要症状, 排便后可缓解, 常伴有排便习惯改变, 缺乏可解释症状的形态学和生化异常. IBS的病因和发病机制尚不十分清楚. 研究表明IBS的发病机制可能与一些因素有关, 这些因素包括胃肠动力学异常[1], 内脏敏感性增高[2], 脑肠轴调节紊乱[3,4], 肠道感染与炎症反应[5,6], 肠黏膜渗透性改变[7], 肠道菌群[8], 应激[9]和心理疾病[10]. 此外, 食物不耐受对IBS发生、发展、治疗等方面的影响不容忽视[11-15]. 研究证实, 食物不耐受与多种慢性病有关, 可累及消化、皮肤、神经、心血管等全身多个系统, 其中以消化系统症状最为常见[16,17]. 研究显示[18], 约1/4的IBS患者可因特定食物成分而导致临床症状加重. 一项针对IBS患者食物不耐受情况的研究[19]显示, 患者腹部症状约50%在餐后加重, 提示食物不耐受与IBS关系密切. 本研究主要以调查问卷形式了解食物不耐受在IBS患者与健康者中的存在情况以及IBS患者症状的严重程度, 并通过甲苯胺蓝染色对病例组及对照组回盲部黏膜肥大细胞进行检测, 研究食物不耐受严重程度、IBS症状指数与回盲部肥大细胞含量变化的关系, 探讨食物不耐受在IBS发病中的意义, 为IBS的饮食治疗提供新的依据.
病例组为2010-10/2010-12由福建省立医院消化内科或内镜中心收治的符合罗马Ⅲ诊断标准D-IBS患者22例, 年龄24-61岁, 平均46.36岁±10.34岁, 男12例, 女10例; 对照组为同期无长期腹痛、腹胀、便秘、腹泻等消化道症状的健康体检者、志愿者21例, 年龄17-58岁, 平均41.52岁±11.22岁, 男8例, 女l3例. 病例组和对照组的一般情况具有可比性.
1.2.1 问卷调查: 本研究采用了3个问卷调查表. 食物不耐受检测健康状况评估表为福建省立医院体检中心提供. 该表的问题包括食物消费的数量和频率、进食与消化系统症状出现的关系、是否存在食物不耐受相关各系统慢性疾病或亚健康状态. 此外, 还根据中国青少年生活事件检查表主观加权记分方式[20]建立食物不耐受严重程度指数, 指数值愈高表明食物不耐受情况愈严重. 功能性肠道疾病严重指数(functional bowel disorder severity index, FBDSI)量表的问题包括腹痛程度, 过去3 mo内因腹部症状就医次数及诊断情况. 由此计算出腹部症状严重程度评分, 轻度<37, 中度37-110, 重度>110. IBS患者采用IBS病情尺度调查表(IBS symptom severity scale, IBS-SSS)以评估腹部症状的严重程度. 所包括的问题有腹痛的严重程度、腹痛发作的天数、腹胀程度, 最近3 mo来大便性状和腹痛对患者生活的影响. IBS症状严重程度分为轻(75-175)、中(175-300)和重(>300).
1.2.2 组织学检测: 所有研究对象均接受结肠镜检查, 在距回盲瓣4 cm处取活检组织2块, 经甲醛溶液固定、常规脱水, 石蜡包埋, 做连续切片, 甲苯胺蓝染色. 在OLYMPUS CH20显微镜高倍镜下(×400)观察, 每张切片随机选取6个不重叠视野, 计算每张切片肥大细胞的数量, 以6个高倍视野的平均值表示.
统计学处理 用SPSS19.0软件进行统计分析. 所有实验数据以mean±SD表示, 两个样本均数之间的比较采用t检验, 两组间食物不耐受存在情况的比较采用χ2检验. 食物不耐受严重程度指数、IBS症状严重程度指数、回盲部肥大细胞计数之间关系采用Spearman秩相关分析, P<0.05为差异具有显著性.
比较病例组与对照组食物不耐受存在情况, χ2 = 29.733, 差异具有显著性(P<0.05), 提示食物不耐受与IBS的发病有关.
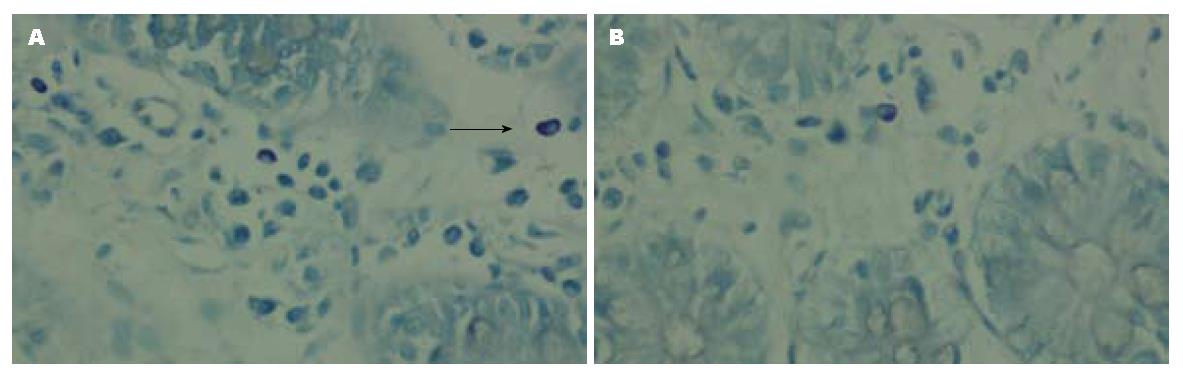
高倍光镜下(×400, 图1)肥大细胞经甲苯胺蓝染色后呈紫红色, 胞核呈蓝色, 散在分布于黏膜固有层, 细胞呈圆形或梭形, 紫蓝色颗粒围绕细胞核散在分布. 病例组回盲部肠黏膜的肥大细胞数量(4.68±0.55)个/高倍镜视野明显多于对照组(1.33±0.54)个/高倍镜视野, P<0.001, 差异具有统计学意义(表1).
病例组中, 根据Spearman秩相关分析表明, 食物不耐受严重程度与IBS症状严重程度指数间呈正相关(表2); 回盲部肥大细胞计数与IBS症状严重程度指数间呈正相关(表3); 食物不耐受严重程度与IBS患者回盲部肥大细胞计数间呈正相关(r = 0.964, P<0.001), 健康对照组中, 食物不耐受者回盲部肥大细胞计数明显高于无食物不耐受者(P<0.05).
| IBS症状严重程度评分 | r值 | P值 |
| FBDSI | 0.992 | <0.001 |
| IBS-SSS | 0.970 | <0.001 |
| IBS症状严重程度评分 | r值 | P值 |
| FBDSI | 0.957 | <0.001 |
| IBS-SSS | 0.985 | <0.001 |
食物不耐受对IBS症状的影响尚未受到广泛研究. 目前普遍认为食物不耐受是一种迟发型超敏反应, 其具有延时性、数量依赖性、进行性的特点. 理论上食物进入胃肠道后经降解形成氨基酸、甘油和单糖, 进而转化为能量被利用, 但由于部分人体内缺乏相应的消化酶致使食物以多肽或其他分子形式进入肠道, 诱发肠黏膜免疫反应, 产生低度炎症. 食物特异性的IgG抗体所介导的长期系统性低度炎症及免疫超负荷可引起机体代谢紊乱. 但也有研究认为IBS患者对食物的反应与免疫无关而与前列腺产物有关[21]. 一般说来, 食物有可能通过一些途径促进或引发IBS: (1)肠道对食物摄入的生理反应可能对一些IBS易感个体的症状有促进作用; (2)一些证据表明过敏或食物不耐受可引起IBS样症状; (3)某些食物可通过对细菌代谢直接或间接的影响或改变肠道管腔中的组成部分, 进而诱发症状; 最后一点, 随食物摄入的细菌也可能引发IBS[11]. Zar等[22]的研究显示, 根据食物特异性IgG4抗体进行饮食剔除可明显改善IBS症状及直肠顺应性, 提示食物不耐受与IBS症状相关.
现有证据表明IBS患者存在"低度的肠道炎症"[23], 且淋巴细胞与肥大细胞的增加与IBS出现的肠与神经系统间对话紊乱, 肠渗透性增加和微生物菌群的改变相关[24]. 特别是肠道中的肥大细胞, 作为神经-内分泌-免疫调节网络中的重要介质, 在IBS发病机制中显得特别重要[25]. 活化的肥大细胞可释放组胺、5-HT、血小板活化因子、前列腺素、细胞因子和白三烯等多种生物活性物质, 刺激邻近的神经组织, 并与肠神经系统(ENS)形成双向调节, 从而引起内脏高敏, 并导致肠道运动及分泌异常[26].
Dainese等[27]发现有半数以上的IBS患者可被某些食物或吸入物致敏而缺乏典型的临床表现, 且伴有食物不耐受患者的皮肤点刺试验(SPT)阳性率高于无食物不耐受的患者, 尽管该差异无统计学意义, 但提示有关联趋势(P<0.0610).
在本研究中D-IBS患者的食物不耐受存在情况明显高于健康对照组, 并且随着食物不耐受严重程度加重, D-IBS患者肠道症状亦加重, 二者之间呈显著正相关. 说明食物不耐受在D-IBS发病过程中具有重要意义.
此外, 本实验还显示在健康对照组中食物不耐受者回盲部肥大细胞计数较无食物不耐受者明显增多, 提示在感染因素外, 食物不耐受亦可通过激活肥大细胞参与D-IBS发病.
这些发现提示食物抗原刺激也可能引起D-IBS患者回盲部肥大细胞数目增多, 从而加重IBS的症状. 但由于本实验检测例数较少, 实验样本不能代表总体, 该结论尚有待扩大样本量进一步研究证实.
尽管IBS是一种多因素疾病, 其确切原因尚不清楚, 但我们认为食物不耐受在D-IBS发病中可能起了重要作用, 进一步加深对食物不耐受机制的认识将有助于提高饮食治疗方法的效果.
IBS是一种以腹痛或腹部不适伴排便习惯改变为特征的功能性肠病, 缺乏可解释症状的形态学和生化异常, 其病因和发病机制尚不十分清楚.食物不耐受与其发生、发展密切相关.
邢建峰, 副教授, 西安交通大学医学院
IBS的发病机制可能与多种因素有关, 包括胃肠动力学异常, 内脏敏感性增高, 脑肠轴调节紊乱, 肠道感染与炎症反应, 肠黏膜渗透性改变, 肠道菌群, 应激和心理疾病. 但确切的原因仍不清楚.有必要对其发病原因和治疗手段作进一步探讨.
Zar等对25例符合罗马Ⅱ标准的IBS患者饮食中的16种食物特异性IgG4抗体作了检测.结果显示, 根据抗体滴度>250 microg/L进行相关的食物剔除后可明显减轻IBS症状, 并使直肠顺应性获得改善.
在IBS症状与肠道黏膜低度炎症和肥大细胞浸润相关这一共识基础上, 首次探讨了食物不耐受与肠黏膜肥大细胞浸润的关系及其对IBS症状的影响, 为食物不耐受在IBS中的发病作用提供新的依据.
食物不耐受: 一种复杂的变态反应性疾病, 人的免疫系统把进入人体内的某种食物或食物成分当成有害物质, 从而针对这些物质产生过度的保护性免疫反应, 产生食物特异性IgG抗体, IgG抗体与食物颗粒形成免疫复合物(Ⅲ型变态反应), 可引起所有组织(包括血管)发生炎症反应, 并表现为全身各系统的症状与疾病.
本文对肠易激综合征患者食物不耐受、症状指数及回盲部肥大细胞变化的相关性进行研究, 为肠易激综合征治疗时的饮食配合提供了依据, 具有一定的实际意义.
编辑: 曹丽鸥 电编: 闫晋利
| 1. | Mönnikes H, Tebbe JJ, Hildebrandt M, Arck P, Osmanoglou E, Rose M, Klapp B, Wiedenmann B, Heymann-Mönnikes I. Role of stress in functional gastrointestinal disorders. Evidence for stress-induced alterations in gastrointestinal motility and sensitivity. Dig Dis. 2001;19:201-211. [PubMed] [DOI] |
| 2. | Azpiroz F, Bouin M, Camilleri M, Mayer EA, Poitras P, Serra J, Spiller RC. Mechanisms of hypersensitivity in IBS and functional disorders. Neurogastroenterol Motil. 2007;19:62-88. [PubMed] [DOI] |
| 3. | Torii A. [Pathophysiology of irritable bowel syndrome]. Nihon Rinsho. 2006;64:1452-1455. [PubMed] |
| 4. | Bonaz B, Sabate JM. [Brain-gut axis dysfunction]. Gastroenterol Clin Biol. 2009;33 Suppl 1:S48-S58. [PubMed] [DOI] |
| 5. | Dupont AW. Post-infectious irritable bowel syndrome. Curr Gastroenterol Rep. 2007;9:378-384. [PubMed] [DOI] |
| 6. | Akiho H, Ihara E, Nakamura K. Low-grade inflammation plays a pivotal role in gastrointestinal dysfunction in irritable bowel syndrome. World J Gastrointest Pathophysiol. 2010;1:97-105. [PubMed] [DOI] |
| 7. | Piche T. [Alterations of intestinal epithelial barrier and flora in the irritable bowel syndrome]. Gastroenterol Clin Biol. 2009;33 Suppl 1:S40-S47. [PubMed] [DOI] |
| 8. | Bolino CM, Bercik P. Pathogenic factors involved in the development of irritable bowel syndrome: focus on a microbial role. Infect Dis Clin North Am. 2010;24:961-975, ix. [PubMed] [DOI] |
| 9. | Chang L, Sundaresh S, Elliott J, Anton PA, Baldi P, Licudine A, Mayer M, Vuong T, Hirano M, Naliboff BD. Dysregulation of the hypothalamic-pituitary-adrenal (HPA) axis in irritable bowel syndrome. Neurogastroenterol Motil. 2009;21:149-159. [PubMed] [DOI] |
| 10. | Endo Y, Shoji T, Fukudo S, Machida T, Machida T, Noda S, Hongo M. The features of adolescent irritable bowel syndrome in Japan. J Gastroenterol Hepatol. 2011;26 Suppl 3:106-109. [PubMed] [DOI] |
| 11. | Morcos A, Dinan T, Quigley EM. Irritable bowel syndrome: role of food in pathogenesis and management. J Dig Dis. 2009;10:237-246. [PubMed] [DOI] |
| 12. | Vesa TH, Seppo LM, Marteau PR, Sahi T, Korpela R. Role of irritable bowel syndrome in subjective lactose intolerance. Am J Clin Nutr. 1998;67:710-715. [PubMed] |
| 13. | Lea R, Whorwell PJ. The role of food intolerance in irritable bowel syndrome. Gastroenterol Clin North Am. 2005;34:247-255. [PubMed] [DOI] |
| 14. | Atkinson W, Sheldon TA, Shaath N, Whorwell PJ. Food elimination based on IgG antibodies in irritable bowel syndrome: a randomised controlled trial. Gut. 2004;53:1459-1464. [PubMed] [DOI] |
| 15. | Drisko J, Bischoff B, Hall M, McCallum R. Treating irritable bowel syndrome with a food elimination diet followed by food challenge and probiotics. J Am Coll Nutr. 2006;25:514-522. [PubMed] [DOI] |
| 16. | Gíslason D, Bjœrnsson E, Gíslason T. [Allergy and intolerance to food in an Icelandic urban population 20-44 years of age.]. Laeknabladid. 2000;86:851-857. [PubMed] |
| 17. | Gaby AR. The role of hidden food allergy/intolerance in chronic disease. Altern Med Rev. 1998;3:90-100. [PubMed] |
| 18. | Heizer WD, Southern S, McGovern S. The role of diet in symptoms of irritable bowel syndrome in adults: a narrative review. J Am Diet Assoc. 2009;109:1204-1214. [PubMed] [DOI] |
| 19. | Ragnarsson G, Bodemar G. Pain is temporally related to eating but not to defaecation in the irritable bowel syndrome (IBS). Patients' description of diarrhea, constipation and symptom variation during a prospective 6-week study. Eur J Gastroenterol Hepatol. 1998;10:415-421. [PubMed] [DOI] |
| 21. | Jones VA, McLaughlan P, Shorthouse M, Workman E, Hunter JO. Food intolerance: a major factor in the pathogenesis of irritable bowel syndrome. Lancet. 1982;2:1115-1117. [PubMed] [DOI] |
| 22. | Zar S, Mincher L, Benson MJ, Kumar D. Food-specific IgG4 antibody-guided exclusion diet improves symptoms and rectal compliance in irritable bowel syndrome. Scand J Gastroenterol. 2005;40:800-807. [PubMed] [DOI] |
| 23. | Goral V, Kucukoner M, Buyukbayram H. Mast cells count and serum cytokine levels in patients with irritable bowel syndrome. Hepatogastroenterology. 2010;57:751-754. [PubMed] |
| 24. | Ortiz-Lucas M, Saz-Peiró P, Sebastián-Domingo JJ. Irritable bowel syndrome immune hypothesis. Part one: the role of lymphocytes and mast cells. Rev Esp Enferm Dig. 2010;102:637-647. [PubMed] |
| 25. | Ohman L, Simrén M. Pathogenesis of IBS: role of inflammation, immunity and neuroimmune interactions. Nat Rev Gastroenterol Hepatol. 2010;7:163-173. [PubMed] [DOI] |
| 26. | Zar S, Kumar D, Kumar D. Role of food hypersensitivity in irritable bowel syndrome. Minerva Med. 2002;93:403-412. [PubMed] |
| 27. | Dainese R, Galliani EA, De Lazzari F, Di Leo V, Naccarato R. Discrepancies between reported food intolerance and sensitization test findings in irritable bowel syndrome patients. Am J Gastroenterol. 1999;94:1892-1897. [PubMed] [DOI] |