修回日期: 2012-01-10
接受日期: 2012-03-15
在线出版日期: 2012-04-08
目的: 探讨抗凋亡因子存活素(survivin)在硫化氢(hydrogen sulfide, H2S)干扰的肝硬化大鼠肝脏中的表达量, 了解H2S在肝硬化过程中可能的作用机制.
方法: ♀SD大鼠经复合因素法复制肝硬化模型,造模结束后随机分为S组、P组、C组, 分别腹腔注射硫氢化钠(sodium hydrogen sulfide, NaSH)56 mg/(kg·d)、炔丙基甘氨酸(Propargylglycine, PPG)30 mg/(kg·d)及等量生理盐水, 用敏感硫电极法检测肝硬化大鼠门静脉中H2S的量, 用免疫组织化学及real time-PCR检测大鼠肝脏survivin蛋白及mRNA表达.
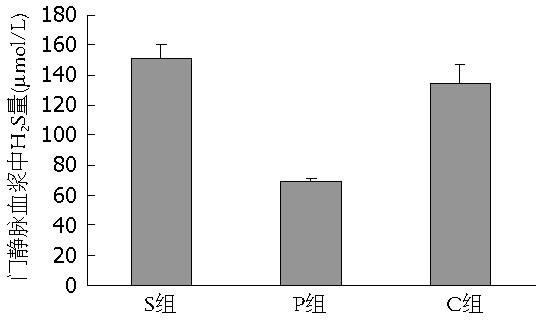
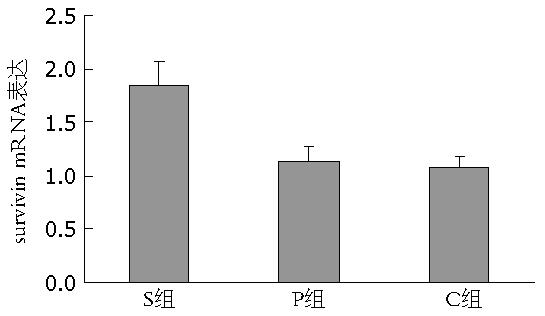
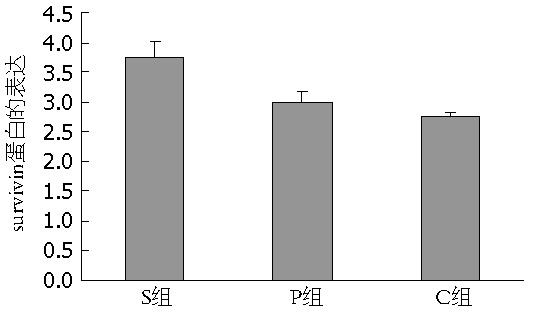
结果: S组、P组与C组相比, 门静脉血浆内H2S浓度显著改变(51.19 μmol/L±8.75 μmol/L, 68.97 μmol/L±2.69 μmol/L vs 134.49 μmol/L±12.25 μmol/L, P<0.05), 肝硬化H2S增加组大鼠survivin蛋白及mRNA表达显著增加(P<0.05), 肝硬化大鼠体内H2S与survivin表达有相关性.
结论: 在大鼠肝硬化模型中, 随着体内H2S浓度的变化, survivin蛋白及mRNA表达发生变化, 这可能是H2S调节肝硬化作用过程中的机制之一.
引文著录: 许广鑫, 郑勇, 陈卫刚, 张宁, 宋丽秀, 刘清华. 硫化氢对肝硬化大鼠肝脏survivin表达的影响. 世界华人消化杂志 2012; 20(10): 846-850
Revised: January 10, 2012
Accepted: March 15, 2012
Published online: April 8, 2012
AIM: To examine the expression of anti-apoptosis gene survivin in the liver of rats with hepatic cirrhosis treated with hydrogen sulfide (H2S) to understand the role of hydrogen sulfide in the pathogenesis of hepatic cirrhosis.
METHODS: Female Sprague-Dawley rats were used to induce hepatic cirrhosis by injecting carbon tetrachloride. The rats were randomly divided into three groups (S, P and C) and injected with sodium hydrogen sulfide (NaSH, 56 mg/(kg·d)), propargylglycine (PPG, 30 mg/(kg·d)) and normal saline, respectively. The concentration of H2S in portal vein blood was measured by sensitive sulphur electrode assay, and the expression of survivin protein and mRNA in the liver was measured by immunohistochemistry and real time-PCR, respectively.
RESULTS: Compared to group S, the concentration of H2S in portal vein blood increased significantly (51.19 μmol/L ± 8.75 μmol/L, 68.97 μmol/L ± 2.69 μmol/L vs 134.49 μmol/L ± 12.25 μmol/L, both P < 0.05), and the expression of survivin protein and mRNA was significantly up-regulated (both P < 0.05) in groups P and C. There is a significant correlation between the concentrations of hydrogen sulfide and survivin expression levels in rats with hepatic cirrhosis.
CONCLUSION: In rats with hepatic cirrhosis, the changes in the concentrations of H2S correlate with the expression of survivin. H2S regulates hepatic cirrhosis possibly by modulating the expression of survivin.
- Citation: Xu GX, Zheng Y, Chen WG, Zhang N, Song LX, Liu QH. Effect of hydrogen sulfide on the expression of survivin in the liver of rats with hepatic cirrhosis. Shijie Huaren Xiaohua Zazhi 2012; 20(10): 846-850
- URL: https://www.wjgnet.com/1009-3079/full/v20/i10/846.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i10.846
H2S是继一氧化氮(nitric oxide, NO)、一氧化碳(carbon monoxide, CO)之后人们所关注的第3个气体信号分子, 在消化系统、心血管系统、神经系统等中均发挥着重要的生物学功能. 本实验组前期研究发现, 随着肝硬化过程中肝功能减退和门脉压力增高, H2S浓度降低, H2S体系在肝硬化发生发展中起着保持血管舒张状态的作用[1]. 外源性给予H2S后可改善肝硬化门静脉高压, H2S对肝硬化发挥着重要调节作用[2]. survivin是凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)家族的一个新成员, 可以阻断多种刺激因子引起的凋亡, 具有调节细胞凋亡与增殖平衡的作用, 主要通过抑制凋亡酶(caspases)的作用阻断细胞的凋亡过程. McMurtry等[3]研究发现, survivin在肺动脉高压中可以调节肺动脉平滑肌的细胞增殖, 其表达的水平与肺血管重构的程度及进度有关. 有研究证实, survivin在活化的肝星状细胞(hepatic stellate cells, HSC)中高表达[4]. H2S可上调survivin的表达并显著减少缺血/再灌注心肌的损伤面积, 提示H2S的心肌保护作用与survivin的表达上调有密切关系[5]. 因此, 本次试验的目的就是评价H2S对肝脏的保护作用, 并检测在H2S诱导作用下肝硬化大鼠survivin的表达情况, 进一步了解H2S在肝硬化形成过程中与survivin表达的关系及可能的作用机制.
健康♀SD大鼠(新疆维吾尔自治区医学实验动物研究中心提供), 体质量200-250 g. 四氯化碳购自天津市化学试剂一厂; 胆固醇粉、PPG、NaHS试剂均购自美国Sigma公司; 兔抗鼠survivin一抗购自英国abcam公司; 生物素标记山羊抗兔二抗购自北京中杉金桥; TRIzol购自invitrogen公司; 逆转录试剂盒购自美国Fermentas公司; 实时荧光定量试剂盒购自大连宝生物工程有限公司; 扩增目的基因survivin及内参GAPDH引物由大连宝生物工程有限公司合成; 离子计及敏感硫电极(PXS-270 Pag/S1上海雷磁); real time-PCR扩增仪为Mx3000P(Stratagene); 余试剂为国产分析纯.
1.2.1 造模: 采用四氯化碳复合法制备肝硬化动物模型. 模型组大鼠皮下注射体积分数为40%四氯化碳(以棉子油稀释), 0.3 mL/100 g(首次剂量0.5 mL/100 g), 每隔4 d注射1次, 给予高脂高胆固醇饲料, 以体积分数15%乙醇作为饮用水. 第52天末肝硬化造模结束, 经病理学观察证实肝硬化模型制备成功.
1.2.2 分组: 将肝硬化大鼠24只随机分为3组(每组8只): C组为肝硬化组、S组为肝硬化+NaHS、P组为肝硬化+PPG组, P组大鼠腹腔注射H2S抑制剂PPG 30 mg/(kg·d), S组腹腔注射H2S供体NaHS 56 mg/(kg·d), C组每日腹腔注射等量生理盐水, 共1 wk, 各组大鼠饮食及饮水条件相同.
1.2.3 门静脉血浆H2S测定: 抽取门静脉血分离获得血浆. 利用敏感硫电极法[6]测定门静脉血浆H2S含量, 取血浆0.5 mL加入等体积抗氧化液后, 用PXS-270型离子计测定硫离子(S2-)含量, 根据S2-标准曲线计算H2S含量.
1.2.4 Real time-PCR测定survivin mRNA: 取冻存肝脏组织50-100 mg, 应用TRIzol试剂, 按说明书提取肝组织总RNA, 总RNA的测定: 吸光度扫描计算总RNA浓度并估算其纯度. (1)cDNA第一链合成. 逆转录使用RevertAidTM H Minus First Strand cDNA Synthesis Kit, 方法按手册建议进行; (2)real time-PCR反应. PCR扩增反应体系为25 μL, 其中cDNA 2 μL, 基因上下游引物各0.5 μL, SYBR Premix Ex TaqTM 12.5 μL, ROX Reference Dye Ⅱ 0.5 μL, 灭菌水9 μL; 根据参考文献[7]survivin引物序列: forward: 5'-CAACCTGGACCTGAGTGACAT-3', reverse: 5'-CCACCCATAGATCCTGTCAGA-3'; GAPDH引物序列为: forward: 5'-CAAGGTCATCCATGACAACTTTG-3', reverse: 5'-GTCCACCACCCTGTTGCTGTAG-3'. PCR扩增条件为: 50 ℃ 2 min, 95 ℃ 10 min, 95 ℃ 15 s, 58 ℃ 60 s, 40个循环; (3)采用2-△△Ct法[8]计算各组survivin mRNA表达的差异. Ct值为每个反应管内的荧光信号达到设定区域值时所经历的循环数, 2-△△Ct表示H2S浓度升高及降低组肝硬化大鼠肝脏survivin的表达相对于H2S不变组肝硬化大鼠肝脏变化的倍数, △△CT = △CT(S组或P组)-△△CT(C组), △CT = CT(目的基因survivin)-CT(内参基因GAPDH).
1.2.5 免疫组织化学测定survivin蛋白: 石蜡切片常规脱蜡至水; 体积分数3%H2O2去离子水室温孵育10 min, 以消除内源性过氧化物酶活性; 热修复抗原20 min PBS; 浸洗5 min×3次, 滴加适当比例稀释的survivin一抗(1:1 000), 4 ℃过夜; PBS浸洗5 min×3次, 滴加生物素化山羊抗兔IgG工作液, 37 ℃孵育30 min; PBS浸洗5 min×3次, 滴加辣根酶标记链霉卵白素工作液; 37 ℃孵育30 min; PBS浸洗5 min×3次, DAB显色, 镜下观察控制时间, 蒸馏水充分冲洗; 苏木素复染, 脱水, 透明, 中性树胶封片. 表达阳性的细胞浆有棕黄色颗粒. 阳性细胞的计量通过两种相对独立的方法进行, 每张切片在200倍显微镜下顺序找10个视野, 按每个视野中阳性细胞所占的百分数分为5级并给予打分: 0分, 阳性细胞≤5%; 1分, 阳性细胞在6%-25%; 2分, 26%-50%; 3分, 51%-75%; 4分, 阳性细胞≥76%. 其中0分按阴性处理. 同时按相应抗原的染色强度打分; 1分, 染色较弱; 2分, 中等强度; 3分, 染色强. 阳性表达率与表达强度的乘积就是该标本的表达权重.
统计学处理 采用SPSS13.0统计软件, 实验数据采用mean±SD形式表示, 多组间差别用单因素方差分析(ANOVA)进行统计, 以P≤0.05为差异有统计学意义.
分别给予H2S供体NaSH、等量生理盐水及抑制剂PPG 1 wk后, 抽取大鼠门静脉血测其H2S浓度(图1), 对照组(C组)H2S浓度为134.49 μmol/L±12.25 μmol/L; 与对照组相比, PPG处理组(P组)H2S浓度显著降低(P<0.05), 为68.97 μmol/L±2.69 μmol/L, NaSH处理组(S组)H2S浓度显著升高(P<0.05), 为151.19 μmol/L±8.75 μmol/L.
各组肝硬化大鼠肝脏中均检测到survivin表达(图2), 与对照组(C组)相比, NaSH处理组(S组)大鼠survivin mRNA表达水平显著升高(P<0.05), 提示survivin基因在高H2S浓度的条件下表达上调.
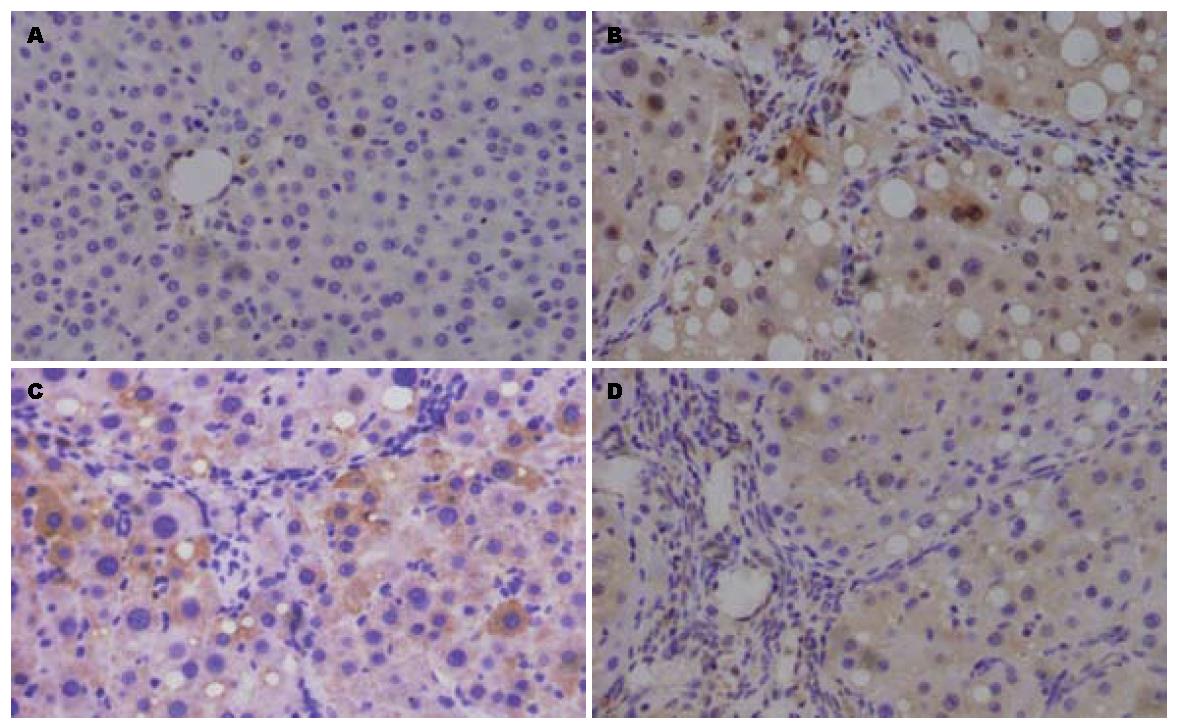
正常大鼠组织中无棕黄色颗粒, survivin几乎不表达, 肝硬化3组中均可见棕黄色颗粒(图3), NaSH处理组(S组)肝硬化大鼠survivin蛋白表达明显高于对照肝硬化组(C组)(P<0.05, 图4), 提示survivin的表达可能与H2S浓度有很大的关系, 由此推测H2S对肝硬化过程保护作用可能通过抗凋亡通路.
H2S是一种具有广泛生物学效应的气体信号分子, 有血管舒张、抑制血小板聚集、介导炎症反应、促进血管新生、调节细胞增殖与凋亡等生物学功能. 其在心血管系统中的作用已得到肯定, 在肝硬化门脉高压的发生发展中发挥重要调节的保护作用, 其作用可能与NO/NOS、CO/HO-1体系的改变有关[2]. H2S对主动脉平滑肌细胞增殖和凋亡具有调节作用, H2S可通过抑制促分裂原活化蛋白激酶信号途径抑制血清及内皮素诱导的血管平滑肌细胞增殖[9], 通过激活caspase-3途径诱导主动脉平滑肌细胞凋亡[10], 维持血管正常结构和功能.
survivin位于17号染色体q25上, 是一个16.5 kDa蛋白. survivin在细胞抗凋亡机制中起至关重要的作用, 其对凋亡的抑制作用较明确. survivin很少在正常的分化组织中表达, 在癌组织中高表达. survivin已证实在肝纤维化及肝癌中过表达[11], 在肝纤维化中激活的肝星状细胞高表达[4]. survivin参与了血管的生成过程, survivin通过PI3K-Akt信号通路有防止血管内皮细胞凋亡的作用[12]. Zhuo等[5]预处理缺血再灌注大鼠, H2S可上调survivin的表达并显著减少缺血/再灌注心肌的损伤面积. 在培养的内皮细胞上也观察到低浓度H2S可显著增加survivin的表达[12]. 有人通过研究PC12细胞H2S与survivin表达发现可H2S可上调PC12细胞survivin表达, 并与作用浓度或时间有关[13]. 由此我们推测在肝硬化大鼠中, H2S对肝脏起保护作用的同时, 可能对survivin的表达有影响.
本实验结果显示, 肝硬化大鼠肝组织可有survivin的表达, 提示survivin与肝硬化的发生、发展有关. 当外源性给予H2S的供体NaSH后, 血浆中H2S量明显升高, 而肝组织中survivin蛋白及mRNA的表达均增加, 此结果与Zhuo等[5]在心肌缺血再灌注大鼠中结果相似, 证实了在肝硬化组织中, H2S可以上调survivin蛋白及基因的表达. 推测H2S在肝硬化的发生发展过程中的作用机制, 可能与PI3K-Akt-survivin信号通路的抗凋亡作用有关系. H2S诱导survivin的高表达后, 通过survivin的其他抗凋亡途径, 引起正常肝脏组织肝细胞较低凋亡率, 诱导肝脏血管增殖及血管结构重建, H2S与survivin可能一起共同参与了肝细胞、肝星状细胞、门静脉血管平滑肌细胞凋亡与增殖之间平衡的维持.
H2S可以通过激活caspase-3诱导主动脉平滑肌细胞凋亡, 而survivin与caspase-3、caspase-7结合后并一直其活化, 并可以通过各种信号通路抑制细胞凋亡, 如通过抑制细胞色素C阻断凋亡信号的传导、促进IAP家族其他成员抗凋亡的功能[14,15], 但H2S与survivin具体其相互间的作用机制及其与其他信号通路间关系有待进一步研究.
H2S作为重要的血管活性物质, 具有血管舒张、介导炎症反应、促进血管新生、调节细胞增殖与凋亡等生物学功能, 在肝硬化门脉高压的发生发展中发挥重要的调节作用.
高润平, 教授, 吉林大学第一医院肝病科
Zhuo等预处理缺血再灌注大鼠, 发现H2S可上调survivin的表达, 并显著减少缺血/再灌注心肌的损伤面积; 在培养的内皮细胞上也观察到低浓度H2S可显著增加survivin的表达.
本研究将通过建立肝硬化大鼠模型, 改变H2S含量, 通过对肝硬化肝组织中survivin mRNA与蛋白表达进行检测, 进一步探讨H2S在肝硬化过程中可能的作用机制, 目前在国内外研究报道中甚少.
H2S量与肝硬化肝组织中survivin的表达有关系, 提示H2S对肝硬化门脉高压的保护作用可能通过survivin即抗凋亡通路起作用, 为H2S在肝硬化过程中作用机制的研究提供一新思路.
本研究内容比较新颖, 实验设计合理, 方法先进, 在H2S对肝硬化过程的作用机制研究方面具有一定的学术参考价值.
编辑: 曹丽鸥 电编: 闫晋利
| 1. | 张 宁, 郑 勇, 王 于理, 李 睿, 孙 侃, 常 向云, 陈 卫刚, 赵 瑾, 李 洪安. 内源性硫化氢在不同时期大鼠肝硬化中的作用. 世界华人消化杂志. 2009;17:307-311. [DOI] |
| 2. | 陈 卫刚, 郑 勇, 宋 丽秀, 刘 维国, 李 文娟, 刘 清华, 张 宁, 齐 翠花. 内源性H2S对大鼠实验性肝硬化门脉高压的影响. 世界华人消化杂志. 2011;19:467-471. [DOI] |
| 3. | McMurtry MS, Archer SL, Altieri DC, Bonnet S, Haromy A, Harry G, Bonnet S, Puttagunta L, Michelakis ED. Gene therapy targeting survivin selectively induces pulmonary vascular apoptosis and reverses pulmonary arterial hypertension. J Clin Invest. 2005;115:1479-1491. [PubMed] [DOI] |
| 4. | De Minicis S, Seki E, Uchinami H, Kluwe J, Zhang Y, Brenner DA, Schwabe RF. Gene expression profiles during hepatic stellate cell activation in culture and in vivo. Gastroenterology. 2007;132:1937-1946. [PubMed] [DOI] |
| 5. | Zhuo Y, Chen PF, Zhang AZ, Zhong H, Chen CQ, Zhu YZ. Cardioprotective effect of hydrogen sulfide in ischemic reperfusion experimental rats and its influence on expression of survivin gene. Biol Pharm Bull. 2009;32:1406-1410. [PubMed] [DOI] |
| 6. | 耿 彬, 杜 军保, 唐 朝枢. 敏感硫电极法在测定心血管组织细胞及血浆胱硫醚-γ-裂解酶/硫化氢的应用. 北京大学学报(医学版). 2005;47:545-548. |
| 7. | Hu Z, Sayeed MM. Activation of PI3-kinase/PKB contributes to delay in neutrophil apoptosis after thermal injury. Am J Physiol Cell Physiol. 2005;288:C1171-C1178. [PubMed] |
| 8. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] [DOI] |
| 9. | Du J, Hui Y, Cheung Y, Bin G, Jiang H, Chen X, Tang C. The possible role of hydrogen sulfide as a smooth muscle cell proliferation inhibitor in rat cultured cells. Heart Vessels. 2004;19:75-80. [PubMed] [DOI] |
| 10. | Yang G, Sun X, Wang R. Hydrogen sulfide-induced apoptosis of human aorta smooth muscle cells via the activation of mitogen-activated protein kinases and caspase-3. FASEB J. 2004;18:1782-1784. [PubMed] [DOI] |
| 11. | Takashima H, Nakajima T, Moriguchi M, Sekoguchi S, Nishikawa T, Watanabe T, Katagishi T, Kimura H, Minami M, Itoh Y. In vivo expression patterns of survivin and its splicing variants in chronic liver disease and hepatocellular carcinoma. Liver Int. 2005;25:77-84. [PubMed] [DOI] |
| 12. | Cai WJ, Wang MJ, Moore PK, Jin HM, Yao T, Zhu YC. The novel proangiogenic effect of hydrogen sulfide is dependent on Akt phosphorylation. Cardiovasc Res. 2007;76:29-40. [PubMed] [DOI] |
| 13. | 孟 金兰, 莫 利求, 王 建红, 刘 明姬, 董 艳芬, 杨 春涛, 兰 爱平, 杨 战利, 陈 培熹, 冯 鉴强. 硫化氢对PC12细胞存活素表达的影响及其神经保护作用. 中华神经医学杂志. 2010;9:586-589. |
| 14. | Sah NK, Khan Z, Khan GJ, Bisen PS. Structural, functional and therapeutic biology of survivin. Cancer Lett. 2006;244:164-171. [PubMed] [DOI] |
| 15. | Conte MS, Altieri DC. Survivin regulation of vascular injury. Trends Cardiovasc Med. 2006;16:114-117. [PubMed] [DOI] |