修回日期: 2012-01-10
接受日期: 2012-03-15
在线出版日期: 2012-04-08
目的: 建立大鼠克罗恩病动物模型, 从病理形态学改变、肺功能变化探讨克罗恩病发生肺损伤的情况.
方法: 采用2, 4, 6-三硝基苯磺酸/无水乙醇法造模, 将大鼠随机分为模型组和正常组. 分别于造模后第1、2、4周末杀检取材. 常规HE染色观察大鼠结肠黏膜、肺泡支气管的病理形态学变化. 在小动物肺功能测试仪上检测肺功能.
结果: 克罗恩病大鼠肺损伤的病理形态学变化: 可见典型间质性肺炎病变, 肺泡间隔增宽, 血管充血, 间质水肿, 炎性细胞浸润, 肺泡腔隙变小, 支气管壁增厚. 有的可见肺气肿病变, 极少数有支气管扩张. 肺功能变化: 气道阻力先降低后升高, 肺顺应性Cl先升高后降低, 最大通气量MVV显著降低, 用力肺活量FVC降低, 第0.2秒末呼出容积(Fev0.2)降低, Fev0.2/FVC无显著差异, 最大呼气流量PEF、PEF25-75%有下降趋势.
结论: 克罗恩病大鼠发生肺损伤, 主要是间质性肺炎等限制性通气障碍疾病. 少数亦有肺气肿、支气管扩张等病变兼杂出现.
引文著录: 周波, 王新月, 朱立, 杨雪, 景姗, 杨舒, 刘果, 朱陵群, 贾旭. 大鼠克罗恩病肺损伤的病理学和肺功能变化. 世界华人消化杂志 2012; 20(10): 824-830
Revised: January 10, 2012
Accepted: March 15, 2012
Published online: April 8, 2012
AIM: To observe pulmonary pathological and functional changes in rats with Crohn's disease and lung injury.
METHODS: Rats were randomly divided into model group and normal group. Crohn's disease was induced in rats using the 2, 4, 6-trinitrobenzenesulfonic acid/ethanol method. At weeks 1, 2, and 4 after induction of Crohn's disease, pulmonary function testing was performed, and rats were then killed to take samples for HE staining to examine pathological changes in the colon and lung.
RESULTS: Pulmonary pathological changes in rats with Crohn's disease include typical interstitial pneumonia, widening of alveolar septa, vascular congestion, interstitial edema, inflammatory cell infiltration, decrease in the size of alveolar cavities smaller, bronchial wall thickening, emphysema, and bronchiectasis occasionally. Pulmonary functional changes include an initial decrease followed by an increase in airway resistance, an initial increase followed by a decrease in Cl, lowering of MVV, FVC, Fev0.2, and a moderate decrease in PEF and PEF25-75%.
CONCLUSION: Rats with Crohn's disease may develop lung injury, which mainly manifests as interstitial pneumonia and restrictive ventilatory disorders.
- Citation: Zhou B, Wang XY, Zhu L, Yang X, Jing S, Yang S, Liu G, Zhu LQ, Jia X. Pulmonary pathological and functional changes in rats with Crohn's disease and lung injury. Shijie Huaren Xiaohua Zazhi 2012; 20(10): 824-830
- URL: https://www.wjgnet.com/1009-3079/full/v20/i10/824.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i10.824
克罗恩病(Crohn's disease, CD)是一种病因未明的慢性非特异性肠道炎症性疾病, 病变可累及胃肠道任何部位, 好发于回肠末端及右半结肠, 呈节段性或跳跃性分布. 患者临床表现以腹痛、腹泻、腹部包块、瘘管形成和肠梗阻为特点, 可伴有发热、营养不良、贫血、皮肤和关节病变等全身症状和肠外表现. CD肠外表现复杂, 累及全身各种器官, 并可早于肠道病变出现, 临床易漏诊、误诊. 40多年前国外研究已发现肺支气管病损为CD的又一重要肠外表现, 且发生率很高, 文献报道可达50%, 近年来我国也出现少量炎症性肠病(inflammatory bowel disease, IBD)合并肺部损害的病例报告, 然而国内外关于IBD肺支气管病损的内在机制研究仍旧空白, 随着我国IBD发病率的不断升高, 本病的发生率也会不断攀升, 因此有必要通过动物实验研究揭示其内在发生机制, 为寻求有效治疗途径提供依据. 本实验通过建立大鼠CD动物模型, 观察和检测大鼠CD肺损伤的病理形态学改变、肺功能变化, 获得CD发生肺支气管病损的实验证据.
清洁级健康♂SD大鼠, 体质量200 g±20 g, 购自北京维通利华实验动物技术有限公司, 许可证编号: SCXK(京)2007-0001; 实验大鼠分笼饲养于北京中医药大学SPF动物实验中心; 2, 4, 6-三硝基苯磺酸(TNBS)购自Sigma公司产品, 批号: 03111065; 乙醇等其他试剂购自北京化学试剂公司.
1.2.1 造模: 将大鼠禁食不禁水24 h后用10%水合氯醛(0.4 mL/100 g体质量)腹腔注射麻醉, 取蝶翼采血针, 剪去针头, 取其后软管, 制成直径2 mm, 长约10 cm的灌肠管由肛门轻缓插入约8-10 cm处的肠腔内, 模型组快速(5 s内)注入2:1体积比的TNBS(150 mg/kg)-无水乙醇液, 正常对照组注入等剂量生理盐水, 将大鼠倒置2 min以防药液溢出[1-4].
1.2.2 分组: 大鼠随机分为2组, 模型组80只, 予造模, 正常对照组40只, 不予造模, 2组同步禁食、麻醉、灌肠, 同步饲养观察.
1.2.3 取材: 分别于造模后第1、2、4周末, 禁食不禁水24 h后杀检取材, 各组18只. 其中8只以12%乌拉坦(2 mL/100 g体质量)腹腔注射麻醉后, 固定, 剪开颈部, 分离气管, 气管做T型切口并插管, 在小动物肺功能测试仪上检测肺功能. 其余以10%水合氯醛(0.4 mL/100 g体质量)腹腔注射麻醉后, 摘取右肺上叶, 截取自肛门以上2-10 cm结肠组织, 取其中严重病变结肠组织约1 cm投入至40 g/L多聚甲醛中常温保存. 将保存的标本修块、脱水、浸石蜡包埋、5 μm厚切片, 苏木精和伊红(hematoxylin and eosin, HE)染色后光学显微镜下观察病理形态学改变.
1.2.4 指标观察: 大鼠结肠黏膜、肺泡支气管的病理形态学变化, 常规HE染色后光学显微镜下观察病理改变, 显微镜放大相显示各组组织学结构或病变特征. 在小动物肺功能测试仪上严格按操作流程检测肺功能.
统计学处理 应用SPSS17.0统计软件对实验数据进行单因素方差分析, 实验数据用mean±SD表示, 组间比较用采用LSD-t检验方法. P<0.05表示有显著统计学差异, P<0.01表示有非常显著统计学差异.
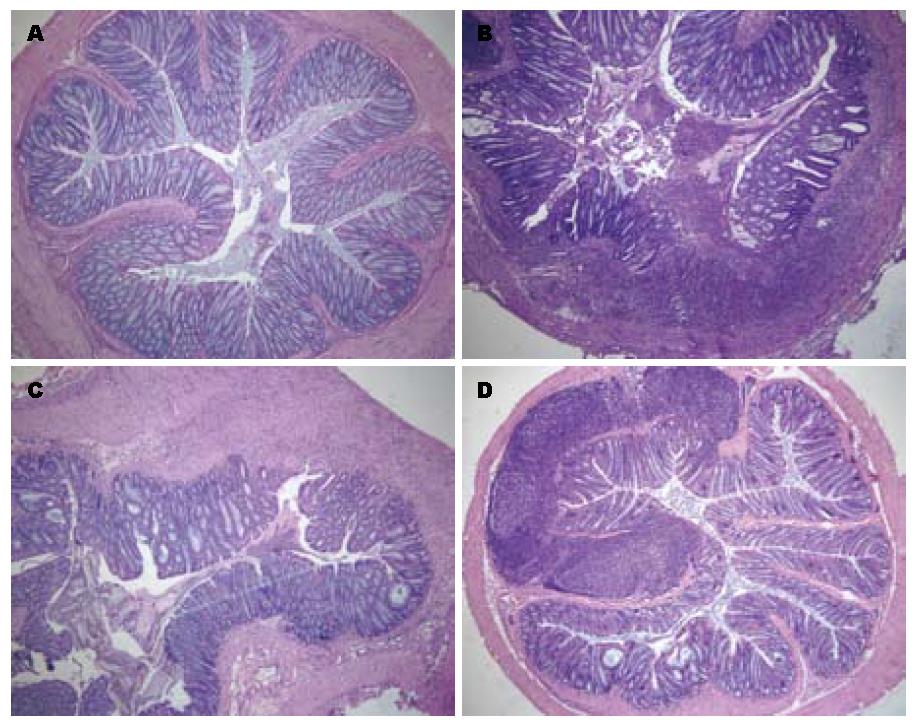
2.1.1 大鼠结肠黏膜病理形态学变化: 正常组结肠黏膜结构正常, 无充血、水肿, 无炎性细胞浸润, 无细胞损伤. 模型组第1、2、4周末均可见克罗恩病的典型病理变化: (1)非干酪坏死性肉芽肿, 由类上皮细胞和多核巨细胞构成, 可发生在肠壁各层和局部淋巴结; (2)裂隙溃疡, 呈缝隙状, 可深达黏膜下层甚至肌层, 糜烂或溃疡表面、管腔中央可有炎性渗出物; (3)肠壁各层炎症, 大量炎性细胞浸润, 固有膜内淋巴组织增生, 并出现以淋巴细胞、浆细胞、单核细胞为主的炎症细胞浸润, 也伴有少量中性粒细胞和嗜酸粒细胞、组织细胞、嗜中性白细胞及嗜酸性白细胞等多种急性和慢性炎症细胞浸润. 伴充血、水肿、淋巴管扩张、淋巴组织增生和纤维组织增生. 固有膜中炎症细胞浸润及黏膜下层增宽, 非干酪坏死性肉芽肿是CD主要的组织学特征. 第1周末可见透壁性炎症, 溃疡深达肌层, 淋巴细胞浸润较多, 偶见隐窝脓肿; 第2周末炎症减轻, 溃疡开始愈合, 黏膜下有大量炎性细胞浸润, 结缔组织增生伴腺体杯状细胞减少, 有典型肉芽肿形成; 第4周末黏膜基本正常, 但仍有黏膜下炎性细胞浸润, 结缔组织增生明显(图1).
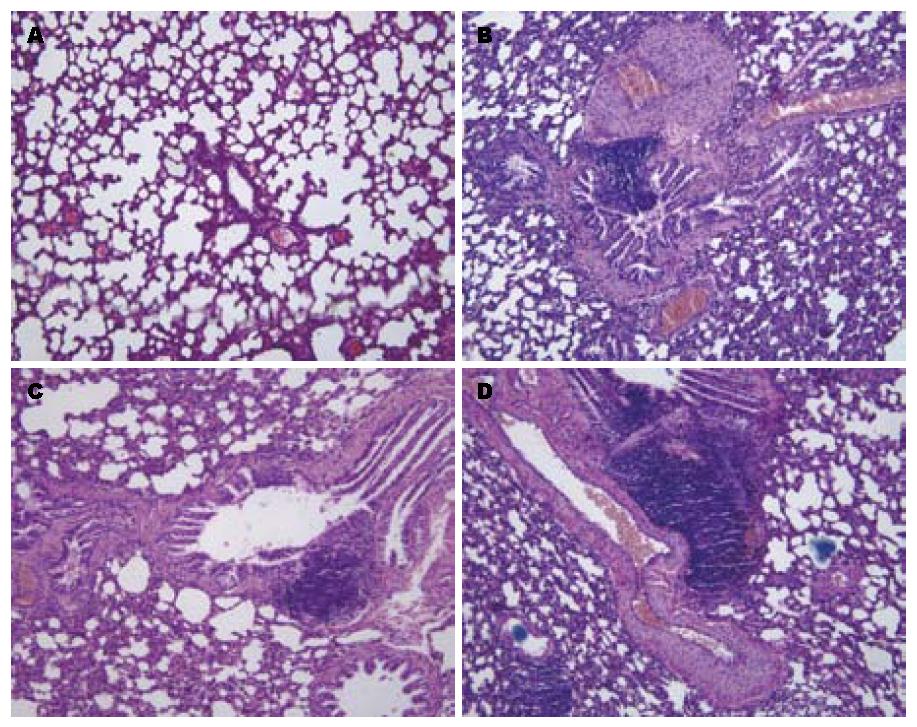
2.1.2 大鼠肺泡支气管的病理形态学变化: 正常组肺泡结构正常, 肺间质未见充血、渗出, 无炎性细胞浸润. 模型组第1周、2周、4周末均可见典型间质性肺炎病变, 亦称特发性肺纤维化; 肺泡间隔增宽, 血管充血, 间质水肿, 炎性细胞浸润, 主要为淋巴细胞、浆细胞和组织细胞与分散的嗜中性粒细胞, 嗜伊红粒细胞, 伴肺泡Ⅱ型细胞和细支气管上皮增生, 支气管壁增厚, 部分区域肺泡内可见吞噬细胞; 有的区域可见肺泡间隔有数量不等的胶原纤维沉积, 炎症细胞相对少, 肺泡间隔毛细血管床减少乃至完全消失, 在其中间肺泡腔隙变小, 内覆增生的Ⅱ型肺泡上皮细胞, 形成所谓假腺样结构, 1 wk、2 wk末较严重, 4 wk末稍有减轻; 有的可见肺气肿病变: 大鼠肺泡正常结构破坏, 肺泡扩张, 肺泡间隔变薄并断裂, 相邻肺泡融合形成较大囊腔; 极少数有支气管扩张(图2).
第1周、2周、4周末模型组大鼠与正常组大鼠比较, 气道阻力(包括吸气阻力Ri和呼气阻力Re)1 wk末显著降低, 4 wk末显著升高, 即先降低后升高; 肺顺应性Cl 1 wk末有升高趋势, 4 wk末显著降低, 即先升高后降低; 最大通气量MVV 1 wk末显著降低, 2 wk末极显著降低, 4 wk末有降低趋势; 用力肺活量FVC 1 wk末显著降低, 2 wk末极显著降低, 4 wk末有降低趋势; 第0.2秒末呼出容积(Fev0.2)1 wk末极显著降低, 2 wk末显著降低, 4 wk末有降低趋势; 第2秒末呼出容积/用力肺活量(Fev0.2/FVC)无显著差异; 最大呼气流量PEF、呼出肺活量中间50%的平均用力呼气流量(PEF25-75%)有下降趋势. 具体结果(表1).
| 分组 | 1 wk末 | 2 wk末 | 4 wk末 | |
| 吸气阻力Ri[cmH2O/(mL·s)] | 正常组 | 2.5870±0.5520 | 1.6890±0.2998 | 2.3886±0.1925 |
| 模型组 | 1.7999±0.6441a | 2.0429±0.4394 | 2.9260±0.2856a | |
| 呼气阻力Re[cmH2O/(mL·s)] | 正常组 | 2.5344±0.8004 | 2.0365±0.6135 | 2.0363±0.2411 |
| 模型组 | 1.9057±0.4619a | 2.5889±0.8309 | 3.0458±0.9177a | |
| 肺顺应性Cl(mL/cmH2O) | 正常组 | 0.1566±0.0328 | 0.1451±0.0499 | 0.1550±0.0178 |
| 模型组 | 0.1726±0.0289 | 0.1359±0.0407 | 0.1189±0.0161a | |
| 最大通气量MVV(mL/min) | 正常组 | 147.6996±38.1915 | 125.7502±14.3716 | 150.1645±21.7577 |
| 模型组 | 121.4860±17.0443a | 96.8771±18.0042b | 139.6298±6.0188 | |
| 用力肺活量FVC(mL) | 正常组 | 9.8426±1.2199 | 10.1935±0.3909 | 10.3657±0.7295 |
| 模型组 | 8.9280±0.2548a | 8.8920±0.5941b | 9.8248±0.3083 | |
| 第2秒末呼出容积Fev0.2(mL) | 正常组 | 5.8335±0.2606 | 5.7120±0.1482 | 5.7762±0.3291 |
| 模型组 | 5.4767±0.2111b | 4.9357±0.6494a | 5.5326±0.5308 | |
| Fev0.2/FVC(%) | 正常组 | 59.6440±6.0055 | 57.3538±4.0378 | 53.8725±7.8028 |
| 模型组 | 59.2922±4.3206 | 58.6441±5.6912 | 55.1153±5.8898 | |
| PEF25-75%(mL/min) | 正常组 | 34.2748±1.7543 | 34.1596±1.2688 | 31.3770±5.3866 |
| 模型组 | 33.4985±2.0030 | 31.2727±4.2396 | 32.7555±4.1334 | |
| 最大呼气流量PEF(mL/min) | 正常组 | 38.3130±1.8303 | 38.9430±1.6113 | 36.3790±5.7072 |
| 模型组 | 37.6310±1.7981 | 35.0788±4.0002a | 37.4485±3.8797 |
IBD出现肺支气管病损的报道已见诸国内外诸多文献. 1976年, Kraft等[5]报道了6例病程在3-13年的溃疡性大肠炎(ulcerative colitis, UC)患者出现肺支气管病损, 其中4例表现慢性支气管炎、支气管扩张, 5例有阻塞性肺功能下降, 且有2例是行全结直肠切除术后, 出现肺部损害. Kraft首次提出了IBD可累及肺脏的观点. 其后40余年里国外关于IBD累及肺支气管的报道很多, 总结起来, IBD患者易出现呼吸困难、咳嗽、咳痰或喘息等呼吸系统症状, 通过肺功能、支气管镜等检查可看到异常改变. 国外关于IBD患者的肺功能情况进行了大量研究, 绝大多数结果表明, IBD与肺功能下降有关. Douglas等[6]对44例IBD(CD22例, UC22例)的肺功能进行评价, 结果显示14例(32%)有异常改变, 其中7例(16%)为弥散障碍[CO转移因子(TLCO)和CO弥散量(KCO)降低]. 其肺功能异常与吸烟、疾病活动度、药物治疗和免疫学参数无关. 9例(20%)患者功能残气容积(FRV)与残气容积(RV)升高. 这些异常与疾病活动性有关, 其中4例治疗3 mo后IBD缓解, 肺容积亦恢复正常. Songür等[7]发现在36例IBD患者中有21例出现肺功能异常, IBD患者一氧化碳弥散力(DLCO)显著降低但RV/TLC与对照组相比显著升高. Karadag等[8]对15例临床无呼吸系统症状的UC患者进行胸部CT扫描, 发现25%的患者异常; 3例患者出现间质性肺疾病的毛玻璃样改变. Dierkes-Globisch等[9]调查了44例IBD患者的肺功能和胸部X线, 并用44名性别、年龄、吸烟状况相类似的正常人作为对照, 结果显示21%的UC患者和20%的CD患者有阻塞和/或限制性通气障碍, 与对照组相比有显著差异, 肺功能异常与活动度、吸烟、肠道疾病持续时间、药物治疗和免疫学参数无关. Ceyhan等[10]报道对30例IBD患者(UC19例, CD11例)持续调查发现15例患者出现呼吸困难、咳嗽、咳痰或喘息等症状长达1 mo以上. Heatley等[11]经过研究发现无肺部症状的IBD患者与对照组相比DLCO下降, 这一结果后来得到确证. Tzanzkis等[12]测定30例IBD患者(12例CD, 18例UC)和16例正常对照组的最大中期呼气流速(Vmax50)和等速容积(Visov)、肺活量及弥散功能, 结果表明CD和UC患者Vmax50、Visov、肺活量及弥散功能均较对照组明显升高, 另外活动期患者TLCO明显降低(P<0.05). 继而认为患者通气功能异常可能与小气道阻塞有关, 而活动期TLCO降低预示着可能有亚临床肺泡炎存在. Marvisi等[13]在小样本的UC患者中也得到了相似的结果. 这说明肺损伤的严重程度可能与肠道疾病炎症损伤程度有关. 许多研究评价了IBD患者的气道阻塞情况, 但结果不尽相同. Herrlinger等[14]对66例IBD(其中CD35例, UC31例)和30例正常对照组的肺功能进行评价, 发现与对照组相比, IBD组FEV1降低, 但差异较小, 且两组的FEV1的绝对值均在正常范围. Godet等[15]对55例UC患者进行研究, 发现30例(55%)患者出现肺功能异常, 这种异常与吸烟状况、呼吸系统疾病家族遗传史、职业情况、药物治疗无关. Pasquis等[16]发现一些CD患者功能残气量增加, 另有2项调查显示UC患者有肺部过度膨胀迹象, 表现在功能残气量和残气量增加, 而且, 过度膨胀的发生与UC的活动性呈正相关.
Black等[17]总结了55种英文期刊中关于IBD肺损伤的报道, 共有病例155例, 涉及病种如下: (1)气道受累疾病. 大气道是IBD最易受累的部位, 文献报道IBD肺损伤中累及大气道的发生率达39%. 支气管扩张在大气道受累疾病中居首位, 占66%, 其次为慢性支气管炎、化脓性大气道疾病和急性支气管炎, 且非吸烟者占81%. 临床表现上看, IBD很少累及小气道, 但近来HRCT的使用提高了小气道损伤的检出率. 相对于其他的气道表现, 小气道损伤往往发生在肠道疾病症状出现之前(占29%的被调查者). 病理上发现最常见的是细支气管炎, 其中肉芽肿性细支气管炎占58.8%, 其他较少见的有中性粒细胞、淋巴细胞或浆细胞浸润性细支气管炎、同心圆性小气道纤维化、弥漫性泛细支气管炎等多种病理改变; (2)哮喘. 加拿大马尼托巴大学一项大样本研究显示UC患者较正常人更易发生哮喘(8 072例UC, 41 815例对照). Ceyhan等[10]观察30例IBD患者(UC19例, CD11例), 并与16例无胃肠疾病者进行对照研究, 询问肺部及过敏症状, 检测肺功能, 支气管反应试验, 皮肤过敏试验, 外周血嗜酸细胞计数及IgE水平. 结果显示IBD组在过敏症状、呼吸系统症状、肺功能异常及皮肤过敏试验阳性方面明显高于对照组. Louis等[18]也报道CD患者可出现醋甲胆碱诱发支气管反应性提高和痰中嗜酸细胞增多. 且有证据显示IBD并发哮喘会加剧病情恶化, 斯德哥尔摩进行的人口调查显示1 547例UC中死于哮喘的人数较同种族同性别人群高6倍[19]. UC合并哮喘患者较单纯哮喘患者气道阻塞程度重, 小剂量醋甲胆碱即可诱发1秒末最大呼气量(FEV1)下降20%[20]; (3)肺实质疾病. 报道的肺实质损害有闭塞性细支气管炎伴机化性肺炎(BOOP)、非特异性间质性肺炎(NSIP)、脱屑性间质性肺炎、嗜酸性粒细胞肺浸润、肺气肿、纤维化肺泡炎等; (4)肺血管疾病. Wegener肉芽肿、Churg-Strauss综合征、肺血管炎等均有报道; (5)α1-抗胰蛋白酶缺乏症[21]; (6)静脉血栓栓塞症(VTE)[22,23].
肺功能各项指标的意义有以下[24]: 气道阻力指气流产生的黏性阻力, 是在呼吸过程中空气流经呼吸道时, 由气流和气道壁之间以及气流本身相互摩擦而造成的. 气道阻力与肺的容积变化呈相反的关系, 在肺容积扩大时, 气道增宽, 气道阻力减小. 气道阻力增高见于气道狭窄时, 如支气管哮喘、COPD. 气道阻力下降为支气管扩张的重要标准. 肺顺应性(CL)指单位压力改变引起的肺容积的改变. CL降低见于: (1)限制性肺疾病, 如肺纤维化患者; (2)肺炎实变、肺水肿使肺容积减少; (3)ARDS. CL增大常见于肺气肿. 最大通气量(MVV)是指每分钟能呼吸的最大气量. MVV降低见于以下情况: (1)阻塞性疾病; (2)呼吸肌功能不全; (3)限制性肺疾病. 用力肺活量(FVC)指深吸气后用力快速呼气时所呼出的最大气量. FVC降低见于限制性通气障碍、呼吸肌力减弱、重度COPD. 凡能使胸廓与肺呼吸动度受限的疾病均可使肺活量降低. FVC升高为肺支气管扩张的一个重要标准. 第0.2秒末呼出容积(Fev0.2): 深吸气后用力快速呼气, 第0.2秒钟呼出的气量. Fev0.2降低见于大小气道阻塞, 如肺气肿; Fev0.2降低也可见于限制性肺疾病, 如肺纤维化. Fev0.2降低而Fev0.2/FVC正常提示限制性病变, Fev0.2和Fev0.2/FVC均降低则提示阻塞性病变. 最大呼气流量(PEF), 又称峰流速, 深吸气后用力快速呼气时的最高呼气流量. 与其他指标相比, PEF更依赖于患者的表现-患者从一开始就必须尽全力呼吸, 才能获得重复性较好的数据.
本实验观察到CD大鼠肺损伤的病理形态学改变. 可见典型间质性肺炎病变, 肺泡间隔增宽, 血管充血, 间质水肿, 性细胞浸润, 肺泡腔隙变小, 支气管壁增厚. 有的可见肺气肿病变, 极少数有支气管扩张. 检测到肺功能变化: 气道阻力先降低后升高, 肺顺应性Cl先升高后降低,最大通气量MVV显著降低, 用力肺活量FVC降低, 第0.2秒末呼出容积(Fev0.2)降低, Fev0.2/FVC无显著差异, 最大呼气流量PEF、PEF25-75%有下降趋势. 结果与国外文献报道一致.
因此, 本研究证明大鼠发生CD时累及肺组织, 肺损伤主要是出现间质性肺炎等限制性通气障碍疾病, 少数亦有肺气肿、支气管扩张等病变兼杂出现. 从病理形态学改变、肺功能变化方面为CD发生肺支气管病损的提供了实验室证据.
40多年前国外研究已发现肺支气管病损为克罗恩病的又一重要肠外表现, 且发生率很高, 文献报道可达50%, 近年来我国也出现少量炎症性肠病合并肺部损害的病例报道, 然而国内外关于炎症性肠病肺支气管病损的内在机制研究仍旧空白.
程英升, 教授, 同济大学附属第十人民医院影像临床医学中心
国内外关于炎症性肠病肺支气管病损的内在机制研究、实验室证据仍旧空白, 治疗上多采用氨基水杨酸类药物和皮质类固醇药物治疗, 效果不理想.
1976年, Kraft报道了6例病程在3-13年的UC患者出现肺支气管病损, 其中4例表现慢性支气管炎、支气管扩张, 5例有阻塞性肺功能下降, 且有2例是行全结直肠切除术后, 出现肺部损害. Kraft首次提出了炎症性肠病可累及肺脏的观点.
本实验通过建立大鼠克罗恩病动物模型, 观察和检测大鼠克罗恩病肺损伤的病理形态学改变、肺功能变化, 获得克罗恩病发生肺支气管病损的实验证据.
炎症性肠病的治疗上多采用氨基水杨酸类药物和皮质类固醇药物治疗, 效果不理想. 本实验通过动物实验研究, 获得克罗恩病发生肺支气管病损的实验证据, 为揭示其内在发生机制, 寻求有效治疗途径提供依据.
本文从实验角度探讨克罗恩病的肺的变化, 有理论意义和实用价值.
编辑: 曹丽鸥 电编: 闫晋利
| 1. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 2. | Anthony D, Savage F, Sams V, Boulos P. The characterization of a rabbit model of inflammatory bowel disease. Int J Exp Pathol. 1995;76:215-224. [PubMed] |
| 3. | Mahadeva U, Martin JP, Patel NK, Price AB. Granulomatous ulcerative colitis: a re-appraisal of the mucosal granuloma in the distinction of Crohn's disease from ulcerative colitis. Histopathology. 2002;41:50-55. [PubMed] [DOI] |
| 5. | Kraft SC, Earle RH, Roesler M, Esterly JR. Unexplained bronchopulmonary disease with inflammatory bowel disease. Arch Intern Med. 1976;136:454-459. [PubMed] [DOI] |
| 6. | Douglas JG, McDonald CF, Leslie MJ, Gillon J, Crompton GK, McHardy GJ. Respiratory impairment in inflammatory bowel disease: does it vary with disease activity? Respir Med. 1989;83:389-394. [PubMed] [DOI] |
| 7. | Songür N, Songür Y, Tüzün M, Doğan I, Tüzün D, Ensari A, Hekimoglu B. Pulmonary function tests and high-resolution CT in the detection of pulmonary involvement in inflammatory bowel disease. J Clin Gastroenterol. 2003;37:292-298. [PubMed] [DOI] |
| 8. | Karadag F, Ozhan MH, Akçiçek E, Günel O, Alper H, Veral A. Is it possible to detect ulcerative colitis-related respiratory syndrome early? Respirology. 2001;6:341-346. [PubMed] [DOI] |
| 9. | Dierkes-Globisch A, Mohr H. Pulmonary function abnormalities in respiratory asymptomatic patients with inflammatory bowel disease. Eur J Intern Med. 2002;13:385. [PubMed] [DOI] |
| 10. | Ceyhan BB, Karakurt S, Cevik H, Sungur M. Bronchial hyperreactivity and allergic status in inflammatory bowel disease. Respiration. 2003;70:60-66. [PubMed] [DOI] |
| 11. | Heatley RV, Thomas P, Prokipchuk EJ, Gauldie J, Sieniewicz DJ, Bienenstock J. Pulmonary function abnormalities in patients with inflammatory bowel disease. Q J Med. 1982;51:241-250. [PubMed] |
| 12. | Tzanakis N, Samiou M, Bouros D, Mouzas J, Kouroumalis E, Siafakas NM. Small airways function in patients with inflammatory bowel disease. Am J Respir Crit Care Med. 1998;157:382-386. [PubMed] [DOI] |
| 13. | Marvisi M, Borrello PD, Brianti M, Fornarsari G, Marani G, Guariglia A. Changes in the carbon monoxide diffusing capacity of the lung in ulcerative colitis. Eur Respir J. 2000;16:965-968. [PubMed] [DOI] |
| 14. | Herrlinger KR, Noftz MK, Dalhoff K, Ludwig D, Stange EF, Fellermann K. Alterations in pulmonary function in inflammatory bowel disease are frequent and persist during remission. Am J Gastroenterol. 2002;97:377-381. [PubMed] [DOI] |
| 15. | Godet PG, Cowie R, Woodman RC, Sutherland LR. Pulmonary function abnormalities in patients with ulcerative colitis. Am J Gastroenterol. 1997;92:1154-1156. [PubMed] |
| 16. | Pasquis P, Colin R, Denis P, Baptiste P, Galmiche JP, Hecketsweiler P. Transient pulmonary impairment during attacks of Crohn's disease. Respiration. 1981;41:56-59. [PubMed] [DOI] |
| 17. | Black H, Mendoza M, Murin S. Thoracic manifestations of inflammatory bowel disease. Chest. 2007;131:524-532. [PubMed] [DOI] |
| 18. | Louis E, Louis R, Shute J, Lau L, Franchimont D, Lamproye A, Radermecker M, Djukanovic R, Belaiche J. Bronchial eosinophilic infiltration in Crohn's disease in the absence of pulmonary disease. Clin Exp Allergy. 1999;29:660-666. [PubMed] [DOI] |
| 19. | Persson PG, Bernell O, Leijonmarck CE, Farahmand BY, Hellers G, Ahlbom A. Survival and cause-specific mortality in inflammatory bowel disease: a population-based cohort study. Gastroenterology. 1996;110:1339-1345. [PubMed] [DOI] |
| 20. | Kanazawa H, Yoshikawa J. A case-control study of bronchial asthma associated with ulcerative colitis: role of airway microvascular permeability. Clin Exp Allergy. 2005;35:1432-1436. [PubMed] [DOI] |
| 21. | Biancone L, Fantini M, Tosti C, Bozzi R, Vavassori P, Pallone F. Fecal alpha 1-antitrypsin clearance as a marker of clinical relapse in patients with Crohn's disease of the distal ileum. Eur J Gastroenterol Hepatol. 2003;15:261-266. [PubMed] [DOI] |
| 22. | Miehsler W, Reinisch W, Valic E, Osterode W, Tillinger W, Feichtenschlager T, Grisar J, Machold K, Scholz S, Vogelsang H. Is inflammatory bowel disease an independent and disease specific risk factor for thromboembolism? Gut. 2004;53:542-548. [PubMed] [DOI] |
| 23. | Bernstein CN, Blanchard JF, Houston DS, Wajda A. The incidence of deep venous thrombosis and pulmonary embolism among patients with inflammatory bowel disease: a population-based cohort study. Thromb Haemost. 2001;85:430-434. [PubMed] |
| 24. | Hyatt RE, Scanlon PD, Nakamura M. Interpretation of Pulmonary Function Tests: a practical guide. 3rd ed. London:. Lippincott Williams & Wilkins. 2011;37-381. |