修回日期: 2011-10-25
接受日期: 2011-12-23
在线出版日期: 2012-01-08
目的: 探讨丙戊酸钠(VPA)对人肝癌SMMC-7721细胞增殖、细胞周期及对p21WAF1/CIP1 mRNA表达的影响.
方法: 实验分为空白对照组、PBS组、VPA 0.2 mmol/L组、VPA 1.0 mmol/L组和VPA 5.0 mmol/L组. 不同浓度VPA干预人肝癌SMMC-7721细胞24 h、48 h和72 h, 采用MTT法检测细胞存活率, 流式细胞仪检测细胞周期; 干预72 h后, 用Real-time PCR法检测VPA干预72 h 后p21WAF1/CIP1mRNA的表达情况.
结果: 与空白对照组及PBS组比较, 不同浓度的VPA作用24 h, 48 h及72 h时组肝癌SMMC-7721细胞增殖均出现了不同程度抑制(请将具体数据列出来P<0.05), 随着VPA药物浓度升高, 细胞增殖抑制作用逐渐增强, 随作用时间延长, 抑制程度逐渐增强(P<0.05). 随药物浓度升高, G1期细胞比例逐渐增多, S期细胞比例逐渐减少, 细胞发生G0/G1期阻滞. VPA干预肝癌SMMC-7721细胞72 h 后, VPA组p21WAF/CIP1 mRNA表达较空白对照组及PBS组表达明显升高(请将具体数据列出来P<0.01).
结论: VPA可抑制人肝癌SMMC-7721细胞的增殖, 且呈时间及剂量依赖性, 并诱导出现G0/G1细胞周期阻滞, 同时上调p21WAF1/CIP1mRNA的表达.
引文著录: 钱方方, 蒋小猛, 徐岷, 张尤历, 徐萍, 王晓燕, 吴莺. 丙戊酸钠对肝癌SMMC-7721细胞增殖和细胞周期的影响及机制. 世界华人消化杂志 2012; 20(1): 74-78
Revised: October 25, 2011
Accepted: December 23, 2011
Published online: January 8, 2012
AIM: To investigate the effect of valproic acid (VPA) on cell proliferation, cell cycle progression and expression of p21WAF1/CIP1 mRNA in human hepatoma cell line SMMC-7721 in vitro.
METHODS: SMMC-7721 cells were treated with different concentrations (0.2, 1.0 and 5.0 mmol/L) of VPA for different durations (24, 48 and 72 h). Cell growth was measured by MTT assay. Cell cycle analysis was performed by flow cytometry. The expression of p21WAF1/CIP1 mRNA in SMMC-7721 cells treated with VPA for 72 h was detected by RT-PCR.
RESULTS: Compared to the control group and PBS group, treatment with different concentrations of VPA for different durations significantly reduced cell growth to a varying extent (all P < 0.05). VPA administration suppressed cell proliferation in a time- and dose-dependent manner. After treatment with VPA, the percentage of cells in G1 phase increased significantly and that of cells in S phase decreased, suggesting an arrest in G0/G1 phrase. Significant up-regulation of p21WAF1/CIP1 mRNA was observed in SMMC-7721 cells 72 h after treatment with VPA.
CONCLUSION: VPA could significantly suppress cell proliferation in a time- and dose-dependent manner, and result in a cell cycle arrest in G0/G1 phase by inducing elevated expression of p21WAF1/CIP1 mRNA in SMMC-7721 cells.
- Citation: Qian FF, Jiang XM, Xu M, Zhang YL, Xu P, Wang XY, Wu Y. Effect of valproic acid on cell proliferation and cell cycle progression in human hepatoma cell line SMMC-7721. Shijie Huaren Xiaohua Zazhi 2012; 20(1): 74-78
- URL: https://www.wjgnet.com/1009-3079/full/v20/i1/74.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i1.74
丙戊酸钠(valproic acid, VPA)作为一种组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors, HDACIs), 可诱导多种肿瘤细胞分化与凋亡, 特别是血液系统肿瘤及神经系统肿瘤[1]. p21WAF1/CIP1基因是目前已知的具有最广泛活性的细胞周期抑制基因, 参与了细胞增殖、分化、衰老、凋亡以及DNA损伤修复等多种功能的调节[2]. 新近研究发现, HDACIs在转录后水平增加p21WAF1/CIP1的表达, 从而产生抗肿瘤作用[3]. 本研究以人肝癌SMMC-7721细胞系为靶细胞, 探讨不同浓度VPA对肝癌细胞增殖、细胞周期及p21WAF1/CIP1 mRNA表达的影响.
人肝癌SMMC-7721细胞购买于中科院上海细胞生物研究所细胞库; 小牛血清为美国Gibco BRL公司产品; 丙戊酸钠和噻唑兰(MTT)为美国Sigma公司产品; Annexin V-FITC流式试剂盒为晶美生物公司产品; RevertAidTM First Strand cDNA试剂盒为立陶宛Fermentas公司产品; Real-time PCR SYBR Green Master Mix为日本TOYOBO公司产品.
1.2.1 细胞培养和VPA干预: 收集对数生长期肝癌SMMC-7721细胞按细胞量1×104/孔接种于96孔板, 常规培养于DMEM中, 分别用VPA干预24 h、48 h或72 h, 实验组分为空白对照组、PBS组、VPA 0.2 mmol/L组、VPA 1.0 mmol/L组和VPA 5.0 mmol/L组. 空白对照组的DMEM培养基中加入等量的二甲基亚砜.
1.2.2 MTT法检测细胞增殖情况: 细胞接种于96孔培养板, 每组设6个复孔. VPA干预24 h、48 h或72 h后, 每孔加入浓度为5 mg/mL的MTT溶液10 mL, 再继续培养4 h, 弃上清后每孔加150 mL DMSO, 避光轻微震荡5 min使结晶充分溶解, 酶联免疫检测仪测定吸光度A值, 检测波长570 nm, 以不加细胞培养液孔调零. 根据A值计算细胞增殖情况.
1.2.3 流式细胞术检测细胞周期: 细胞接种于6孔培养板, 每组设3个复孔. VPA干预24 h、48 h和72 h后, 收集各组细胞, 预冷PBS洗涤细胞2次, 加入预冷700 mL/L乙醇固定, 4 ℃过夜. 加入浓度100 mg/L的RNase 10 mL, 浓度50 mg/L的碘化丙啶缓冲液300 mL, 4 ℃避光孵育30 min, 流式细胞仪(FACSCalibur, 美国Becton Dickinson公司)检测细胞周期.
1.2.4 Real-time PCR检测p21WAF1/CIP1mRNA的表达: 细胞培养和处理同前, VPA干预72 h后TRIzol法提取各组细胞的总RNA, 逆转录成cDNA, 应用Primer 5.0软件设计引物, 由上海生物工程公司合成. p21WAF1/CIP1引物: 5'-TTAGCAGCGGAACAAGGAGT-3'和5'-AGAAACGGGAACCAGGACAC-3', 扩增片段为252 bp; 内参GAPDH引物: 5'-GCACCGTCAAGGCTGAGAAC-3'和5'-ATGGTGGTGAAGACGCCAGT-3', 扩增片段为142 bp. PCR仪为7500型(美国Applied Biosystems公司). 扩增条件为: 95 ℃ 1 min; 95 ℃ 15 s, 60 ℃ 15 s, 72 ℃ 45 s, 共 40个循环, 实验重复3次. 以GAPDH作为内参照, 相对表达量(RQ) = 2-DDCT, 以空白对照组mRNA表达量的均数为1, 计算其他各组mRNA的相对表达量.
统计学处理 实验数据用mean±SD表示, 应用SPSS13.0统计软件, 多组比较进行单因素方差分析, 两两比较进行LSD-t检验, P<0.05为差异有统计学意义.
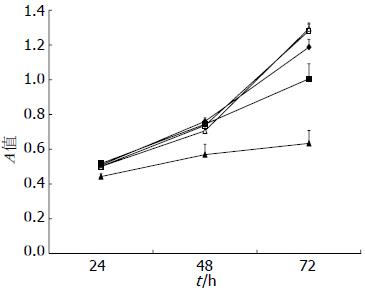
VPA作用24 h, 48 h及72 h后, 与空白对照组及PBS组比较, VPA 0.2 mmol/L组、1.0 mmol/L组及5.0 mmol/L组细胞增殖均出现了不同程度抑制(P<0.05), 随VPA药物浓度升高, 细胞增殖抑制作用逐渐增强, 同时随作用时间延长, 抑制程度逐渐增强(P<0.05, 图1).
不同浓度VPA作用于肝癌SMMC-7721细胞后, 在同一细胞周期, 与空白对照组及PBS组比较, VPA 1.0 mmol/L组及5.0 mmol/L组G1期及S期细胞比例发生统计学意义差别(P<0.05). 作用48 h及72 h后, 不同浓度VPA组间比较有统计学意义差别(P<0.05). 提示随药物浓度升高, G1期细胞比例逐渐增多, S期细胞比例逐渐减少, 细胞发生G1期阻滞. 同一药物浓度, 随作用时间延长, 各组间未发现统计学意义差别(表1).
| 分组 | 24 h(%) | 48 h(%) | 72 h | ||||||
| G1期 | S期 | G2期 | G1期 | S期 | G2期 | G1期 | S期 | G2期 | |
| 空白对照组 | 47.80± 2.53 | 32.71± 2.35 | 19.49± 0.94 | 49.22± 4.35 | 29.21± 2.35 | 21.57± 2.26 | 52.23± 0.07 | 29.12± 0.09 | 18.64± 0.08 |
| PBS组 | 49.04± 0.88 | 36.66± 1.32 | 14.30± 0.69 | 52.82± 1.31 | 29.41± 1.43 | 17.77± 1.69 | 53.00± 1.57 | 31.10± 0.14 | 15.90± 1.70 |
| VPA 0.2 mmol/L | 49.04± 1.15 | 32.52± 1.51 | 18.44± 2.55 | 49.25± 1.63c | 26.84± 2.32c | 23.91± 3.88c | 49.95± 2.96c | 29.61± 2.98c | 20.44± 0.95c |
| VPA 1.0 mmol/L | 60.47± 0.86a | 23.23± 1.81a | 16.30± 2.11 | 65.26± 2.34ac | 17.76± 3.92ac | 16.98± 1.76c | 63.44± 0.73ac | 19.50± 1.08ac | 17.05± 0.36c |
| VPA 5.0 mmol/L | 72.58± 0.79a | 10.12± 0.15a | 17.29± 0.90 | 83.13± 1.78ac | 3.38± 0.65ac | 13.48± 1.62c | 80.44± 1.01ac | 7.41± 0.49ac | 12.15± 1.40ac |
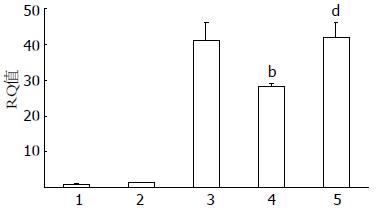
不同浓度VPA干预肝癌SMMC-7721细胞72 h 后, 发现VPA 0.2 mmol/L组、1.0 mmol/L组及5.0 mmol/L组p21WAF/CIP1 mRNA表达较空白对照组及PBS组明显增加(41.0959±4.9130, 28.4341±0.7497, 42.0588±4.1881 vs 1.0040±0.1267, 1.4907±0.1524), 差别有统计学意义(P<0.01, 图2).
在肿瘤细胞中, 调节细胞增殖、细胞周期及凋亡的基因通常发生突变或异常表达, 染色质重塑及组蛋白乙酰化修饰参与决定了这些基因的表达. 组蛋白乙酰化酶(histone acetyl transferases, HATs)与组蛋白去乙酰化酶(Histone deacetylases, HDACs)两者之间活性的平衡调控体内组蛋白乙酰化水平. 近期研究发现, HDACIs可抑制肿瘤细胞增殖, 诱导细胞周期阻滞及凋亡[4]. 组蛋白作为核小体重要组成成分, 除了包装DNA分子的作用外, 可通过乙酰化、甲基化等翻译后修饰在调控基因表达过程中发挥重要作用, 这称为组蛋白密码[5], 是表观遗传学新近研究热点. 组蛋白赖氨酸残基末端低水平乙酰化状态使得染色质保持翻译沉默, 组蛋白乙酰化改变会中和赖氨酸残基的正极性, 使核小体结构瓦解, DNA折叠伸展, 一些转录因子容易和DNA接触, 从而导致基因表达的改变[6]. 组蛋白乙酰化水平由HATs和 HDACs两者调控. HDACs活性的异常聚集与某些恶性肿瘤的发生、发展有关. 近期多项研究证实, HDACIs具有抑制肿瘤细胞增殖, 诱导细胞周期阻滞及凋亡的作用[4,7,8]. 可能机制在于HDACIs抑制HDACs活性, 导致组蛋白高乙酰化状态, 使得染色质保持更加开放的构型. 开放构型的染色质引起翻译沉默路径活化或通过募集一些阻遏蛋白抑制异常表达的基因, 进而引起肿瘤细胞生长抑制, 细胞周期阻滞及凋亡[9].
VPA作为HDACIs短链脂肪酸家族的一员, 临床上主要用于治疗癫痫. 近期多项体外研究报道他可抑制多种肿瘤细胞的生长, 比如乳腺癌、神经母细胞瘤、神经胶质瘤、白血病、前列腺癌及膀胱癌等. 本研究发现VPA作用肝癌SMMC-7721细胞24 h, 48 h及72 h后, VPA 0.2 mmol/L组、1.0 mmol/L组及5.0 mmol/L组细胞增殖均出现了不同程度抑制(抑制率2.2%-37.0%), 随VPA药物浓度升高, 细胞增殖抑制作用逐渐增强, 随作用时间延长, 抑制程度逐渐增强. 本研究结果提示的VPA对肿瘤细胞增殖抑制的时间和剂量依赖性与Byun等[10]研究VPA对膀胱癌细胞的增殖抑制作用相一致.
Wu等[11]用曲古霉素A和VPA诱导人子宫内膜基质细胞, 发现S期细胞比例减少, G0/G1期细胞比例增多, 细胞周期发生G0/G1阻滞, 同时P21蛋白表达增加. 张祥忠等[12]用VPA诱导慢性粒细胞白血病K562细胞, 同样发现VPA引起细胞周期阻滞在G0/G1期, 处理后的细胞株p21WAF1 mRNA表达增加. 本研究发现不同浓度VPA作用于肝癌SMMC-7721细胞后, 随药物浓度升高, G1期细胞比例逐渐增多, S期细胞比例逐渐减少, 细胞发生G0/G1期阻滞. VPA处理组, p21WAF/CIP1 mRNA表达较空白对照组及PBS组明显增加, 本研究结果与国内外已有研究结果一致. 细胞周期由周期蛋白和周期蛋白依赖激酶(cyclin-dependent kinase, CDKs)的相互作用而完成. 尤其是G1期过渡到S期受细胞周期负调节因子家族: 周期蛋白依赖激酶抑制因子(cyclin-dependent kinase inhibitors, CDKIs)的调节. 一旦细胞周期调节失控不能发现和修复损伤的DNA, 带有遗传不稳定性的细胞继续分裂增殖, 最终导致恶性肿瘤的发生. p21WAF/CIP1是CDKIs家族中的一员, 他可与CDKs结合, 抑制CDK活性, 使细胞周期发生G0/G1期阻滞, DNA复制受抑制, 从而使受损的细胞有充分的时间进行修复[13]. 由于p21WAF/CIP1基因在人类肿瘤细胞中很难突变, 目前认为他是一个潜在的肿瘤抑制基因. 研究证实VPA诱导多种肿瘤细胞系p21WAF/CIP1表达上调[14], 机制可能为VPA使得p21WAF/CIP1启动子区域组蛋白高乙酰化改变及在相同区域HDAC1选择性减少, 该基因染色质重塑为转录活化的类型, 从而导致p21WAF/CIP1转录上调. 因此p21WAF/CIP1表达上调是VPA等HDACIs作用于p21WAF/CIP1转录的直接后果[6]. 高表达的p21WAF/CIP1与CDKs结合, 从而诱导细胞周期停滞.
总之, VPA处理肝癌SMMC-7721细胞后, 细胞周期蛋白依赖性激酶抑制剂p21WAF/CIP1 mRNA表达上调, 细胞周期发生G0/G1期阻滞, 细胞增殖受到抑制. 本研究观察到, VPA在1.0 mmol/L时就可以发生明显的细胞周期阻滞及增殖抑制, 提示VPA发挥抗肿瘤效应具有高效、低剂量优势. 有研究报道, 通过诱导肿瘤细胞重分化及重建肿瘤细胞对凋亡刺激因子的敏感性, VPA能增强肝癌细胞对表柔比星的化疗敏感性[15], 提示VPA在抗肿瘤治疗方面是一个有广泛应用前景的药物.
丙戊酸钠(valproic acid, VPA)既往多用于治疗癫痫, 目前发现其作为一种组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors, HDACIs), 可诱导多种肿瘤细胞分化与凋亡, 对肝癌细胞的影响目前研究较少.
丁惠国, 主任医师, 教授, 首都医科大学附属北京佑安医院消化科
新近研究发现, HDACIs在转录后水平增加p21WAF1/CIP1的表达, 从而产生抗肿瘤作用.
本研究发现VPA可抑制人肝癌SMMC-7721细胞的增殖, 并诱导其出现G0/G1细胞周期阻滞. 推断其可能是通过上调p21WAF1/CIP1 mRNA的表达进而发挥抑增殖作用.
VPA在抗肿瘤治疗方面可能是一个有广泛应用前景的药物.
本研究设计合理, 方法正确, 结果可信, 具有一定的科学价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Göttlicher M. Valproic acid: an old drug newly discovered as inhibitor of histone deacetylases. Ann Hematol. 2004;83 Suppl 1:S91-S92. [PubMed] |
| 3. | Hirsch CL, Ellis DJ, Bonham K. Histone deacetylase inhibitors mediate post-transcriptional regulation of p21WAF1 through novel cis-acting elements in the 3' untranslated region. Biochem Biophys Res Commun. 2010;402:687-692. [PubMed] [DOI] |
| 4. | Kuendgen A, Schmid M, Schlenk R, Knipp S, Hildebrandt B, Steidl C, Germing U, Haas R, Dohner H, Gattermann N. The histone deacetylase (HDAC) inhibitor valproic acid as monotherapy or in combination with all-trans retinoic acid in patients with acute myeloid leukemia. Cancer. 2006;106:112-119. [PubMed] [DOI] |
| 5. | Young NL, Dimaggio PA, Garcia BA. The significance, development and progress of high-throughput combinatorial histone code analysis. Cell Mol Life Sci. 2010;67:3983-4000. [PubMed] [DOI] |
| 6. | Takai N, Narahara H. Human endometrial and ovarian cancer cells: histone deacetylase inhibitors exhibit antiproliferative activity, potently induce cell cycle arrest, and stimulate apoptosis. Curr Med Chem. 2007;14:2548-2553. [PubMed] [DOI] |
| 7. | Boyle GM, Martyn AC, Parsons PG. Histone deacetylase inhibitors and malignant melanoma. Pigment Cell Res. 2005;18:160-166. [PubMed] [DOI] |
| 8. | Mohana Kumar B, Song HJ, Cho SK, Balasubramanian S, Choe SY, Rho GJ. Effect of histone acetylation modification with sodium butyrate, a histone deacetylase inhibitor, on cell cycle, apoptosis, ploidy and gene expression in porcine fetal fibroblasts. J Reprod Dev. 2007;53:903-913. [PubMed] [DOI] |
| 9. | Richon VM, O'Brien JP. Histone deacetylase inhibitors: a new class of potential therapeutic agents for cancer treatment. Clin Cancer Res. 2002;8:662-664. [PubMed] |
| 10. | Byun SS, Kim FJ, Khandrika L, Kumar B, Koul S, Wilson S, Koul HK. Differential effects of valproic acid on growth, proliferation and metastasis in HTB5 and HTB9 bladder cancer cell lines. Cancer Lett. 2009;281:196-202. [PubMed] [DOI] |
| 11. | Wu Y, Guo SW. Histone deacetylase inhibitors trichostatin A and valproic acid induce cell cycle arrest and p21 expression in immortalized human endometrial stromal cells. Eur J Obstet Gynecol Reprod Biol. 2008;137:198-203. [PubMed] [DOI] |
| 12. | 张 祥忠, 尹 爱华, 刘 建华, 朱 小玉, 何 敏, 丁 倩, 陈 运贤. 丙戊酸钠诱导K562细胞周期阻滞和凋亡并上调p21WAF1基因mRNA的表达. 中国病理生理杂志. 2008;24:1726-1729. |
| 13. | Zhu H, Gooderham NJ. Mechanisms of induction of cell cycle arrest and cell death by cryptolepine in human lung adenocarcinoma a549 cells. Toxicol Sci. 2006;91:132-139. [PubMed] [DOI] |
| 15. | Schuchmann M, Schulze-Bergkamen H, Fleischer B, Schattenberg JM, Siebler J, Weinmann A, Teufel A, Wörns M, Fischer T, Strand S. Histone deacetylase inhibition by valproic acid down-regulates c-FLIP/CASH and sensitizes hepatoma cells towards CD95- and TRAIL receptor-mediated apoptosis and chemotherapy. Oncol Rep. 2006;15:227-230. [PubMed] |