修回日期: 2011-11-23
接受日期: 2011-12-23
在线出版日期: 2012-01-08
目的: 探求RNA技术干扰人结肠癌SW480细胞Nucleostemin(NS)基因后, 结肠癌SW480细胞Nucleostemin mRNA和蛋白水平的表达, 及细胞增殖情况变化.
方法: 构建Nucleostemin特异性真核表达载体, 和脂质体共同转染SW480细胞后, 采用Real-time PCR和Western blot方法检测NS基因mRNA和蛋白变化, MTT法检测细胞的增殖情况.
结果: 与对照组相比较, RNAi干扰细胞后NS mRNA表达明显下降; NS蛋白表达亦明显下降(1.069±0.368, 1.003±0.313, 1.901±0.817, P<0.05; 1.069±0.368, 1.003±0.313, 2.035±0.665, P<0.05), 空白对照组(仅加入脂质体)和阴性对照组(RNAi错义序列)间无显著差异(2.035±0.665, 1.9001±0.817, P>0.05). MTT显示RNA干扰后细胞增殖明显受到抑制.
结论: 通过特异性RNA干扰NS基因后, 结肠癌SW480细胞增殖受到抑制.
引文著录: 潘振国, 王园园, 范里, 钱伟, 宋宇虎, 朱良如. RNAi对结肠癌SW480细胞Nucleostemin基因表达的影响. 世界华人消化杂志 2012; 20(1): 70-73
Revised: November 23, 2011
Accepted: December 23, 2011
Published online: January 8, 2012
AIM: To investigate the effect of transfection of nucleostemin-specific small interfering RNA (siRNA) on nucleostemin expression and cell proliferation in human colorectal carcinoma cell line SW480.
METHODS: A plasmid containing siRNA targeting the nucleostemin gene was constructed and transfected into SW480 cells with Lipofectamine2000 Reagent. After transfection, nucleostemin expression was detected by real-time PCR and Western blot, and cell proliferation was determined by MTT assay.
RESULTS: Compared to the control groups, the levels of the nucleostemin mRNA and protein were obviously reduced in cells transfected with nucleostemin-specific RNA (protein: 1.069 ± 0.368, 1.003 ± 0.313 vs 1.901 ± 0.817, both P < 0.05; mRNA: 1.069 ± 0.368, 1.003 ± 0.313 vs 2.035 ± 0.665, both P < 0.05). There were no significant differences in the expression of nucleostemin mRNA and protein between the two control groups (both P > 0.05). SiRNA-mediated inhibition of nucleostemin expression significantly suppressed the proliferation of SW480 cells.
CONCLUSION: SiRNA-mediated inhibition of nucleostemin expression significantly suppressed the proliferation of SW480 cells.
- Citation: Pan ZG, Wang YY, Fan L, Qian W, Song YH, Zhu LR. RNAi-mediated down-regulation of expression of nucleostemin in human colorectal carcinoma cell line SW480. Shijie Huaren Xiaohua Zazhi 2012; 20(1): 70-73
- URL: https://www.wjgnet.com/1009-3079/full/v20/i1/70.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i1.70
结肠癌是常见的消化系肿瘤之一, 发病率在消化系肿瘤中仅次于胃癌和食管癌, 但结肠癌的发病机制尚不能完全明确. 目前的治疗手段主要依靠手术和化疗放疗, 但是疗效尚不能令人满意. Nucleostemin(NS)是2002年由美国学者Mckay和Tsai发现, 是一个和细胞增殖有关的基因, 他仅表达于干细胞和部分肿瘤细胞内, 当细胞分化后NS的表达几乎完全消失. 我们前期研究已经发现NS mRNA和蛋白在人结肠癌组织中高表达[1], 所以NS基因有可能为结肠癌基因治疗的靶位点. 本实验针对SW480细胞NS基因, 人工合成特异性的小分子干扰RNA, 转染SW480细胞, 检测细胞增殖, 从而为结肠癌的基因治疗提供理论依据.
SW480细胞由华中科技大学同济医学院附属协和医院消化内科胃肠病实验室保存; Lipofectamine 2000购自Invitrogen公司; 内参18sRNA和NS基因引物由Invitrogen公司合成; NS一抗购自Chemicon公司; NS二抗购自Invitrogen公司; 内参b-actin一抗、二抗购自武汉博士德生物工程有限公司.
1.2.1 合成siRNA序列: 从Pubmed数据库查出NS基因序列, 根据siRNA设计原则, 设计siRNA序列, 并从中选出2组序列, 由武汉晶赛公司合成相关质粒(S1组: AAAGCAGGGTCACAAGAAGCC, S2组: AAGAAGCCTAGGAAAGACCCA). 阴性对照序列和前2组siRNA序列组成相同, 但为错义序列.
1.2.2 细胞培养和转染: SW480细胞用含100 mL/L FBS的1640培养液培养, 按2×105/孔的浓度接种于6孔板, 37 ℃、50 mL/LCO2培养箱中培养24 h, 待细胞贴壁率达到50%后, 用Lipofectamine2000进行转染, 6 h后换为含100 mL/L FBS的1640培养液. 空白对照组仅加入脂质体(为N组), siRNA-1处理组为S1组, siRNA-2处理组为S2组, 阴性对照组为V组; 转染48 h后收集各组细胞进行分析.
1.2.3 MTT(噻唑兰)法检测细胞增殖: 取对数生长期细胞, 按照2×103/孔的浓度接种于96孔板, 37 ℃、50 mL/L CO2培养箱中培养24 h后, 弃去培养液, 加入200 mL无血清的培养基, Lipofectamine2000进行转染, 6 h后换为含100 mL/L FBS的1640培养液200 mL, 并于转染24 h、48 h、72 h后各加入20 mL MTT, 继续培养4 h, 弃去培养液, 分别加入150 mL DMSO, 震荡10 min后, 酶标仪检测吸光度(A). 细胞增殖抑制率 = 1-实验组吸光度值/正常对照组吸光度值
1.2.4 RNA提取和Real-time PCR: 按照2×105/孔的浓度将细胞接种于6孔板中, 37 ℃、50 mL/L CO2培养箱中培养24 h后, 进行转染(转染步骤同1.2.2). 48 h后用TRIzol提取细胞总RNA, 并进行逆转录, 采用20 mL体系进行Real-time PCR扩增. NS基因引物: Forward Primer: 5'-GTGGACAGGTGCCTCATTAGC-3', Reverse Primer: 5'-AAAATATGGAGGAGGAGTCCAAGA-3'; 18sRNA引物: Forward Primer: 5'-CGAACGTCTGCCCTATCAACTT-3', Reverse Primer: 5'-ACCCGTGGTCACCATGGTA-3'.
1.2.5 Western blot: 以2×105/孔的浓度将细胞接种于6孔板中, 培养24 h后, 进行转染(转染步骤同1.2.2). 48 h后, RIPA裂解液提取细胞总蛋白, BCA法测定蛋白浓度, 每孔按60 mg蛋白量点样于SDS-PAGE凝胶中, 120 V电泳2 h, 200 mA转膜60 min, 然后将NC膜放入含相应抗体的封闭液(NS一抗浓度1:10 000, b-actin一抗浓度1:400), 4 ℃孵育过夜. 次日TBST缓冲液漂洗10 min, 共3次. 加入相应二抗(NS二抗浓度1:10 000, b-actin二抗浓度1:4 000), 37 ℃孵育1 h, TBST缓冲液漂洗10 min, 共3次, 最后显影曝光.
统计学处理 所有数据用mean±SD表示; F检查比较方差齐性, 再进行方差分析. 本研究采用SPSS11.7软件进行统计分析.
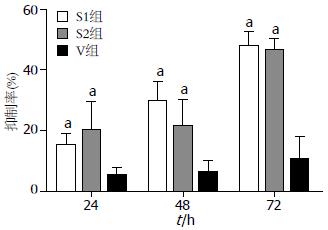
转染细胞24 h、48 h、72 h后, 相对于对照组, 转染NS基因siRNA的2个干扰组的细胞增殖率明显受到抑制, 证明该基因和结肠癌细胞的增殖存在着一定的相关性. 具体的各组细胞增殖抑制率见图1.
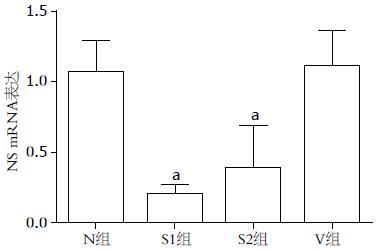
转染48 h后, 转染NS基因siRNA的干扰组中相应的NS基因的mRNA水平明显下降, 证明RNAi干扰载体构建成功, 具体的各组mRNA的表达倍数见图2.
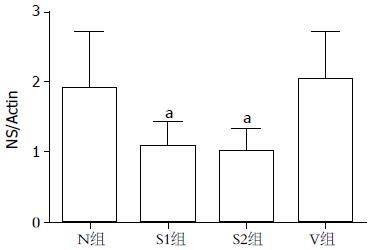
对Western blot结果采用软件(BandScan5.0)分析, 转染48 h后, S1组、S2组NS蛋白表达和N组相比明显下降(相对表达量分别为: 1.069±0.368, 1.003±0.313, 1.901±0.817, P<0.05). S1组、S2组NS蛋白表达和V组相比亦明显下降(相对表达量分别为: 1.069±0.368, 1.003±0.313, 2.035±0.665, P<0.05). V组和N组相比无显著差异(相对表达量分别为: 2.035±0.665, 1.9001±0.817, P>0.05). 表明siRNA下调NS蛋白的表达(图3, 图4).
结肠癌是一种常见的肠道恶性肿瘤之一, 占全部胃肠道肿瘤的第3位, 好发于直肠及直肠与乙状结肠交界处. 在我国结肠癌的发病率与死亡率低于胃癌、食管癌、肺癌等常见恶性肿瘤, 但资料显示随着人民生活水平的提高及饮食结构的改变, 结肠癌的发病率有上升的趋势. 目前手术治疗和化疗的疗效有限, 结肠癌的发病机制尚不完全清楚, 认为是环境和遗传因素共同起作用的, 因此寻找一种基因治疗位点, 可以为结肠癌的治疗提供理论依据.
NS基因是由美国学者Mckay和Tsai于2002年在中枢神经干细胞中发现的, 该基因位于人类的3号染色体上[2], 是一个和细胞增殖相关的基因. 他在干细胞和肿瘤细胞核内高表达, 当细胞开始分化以后, NS基因的表达下降甚至消失, 但在某些恶性程度高的肿瘤中表达量明显增加[2]. 研究发现在膀胱癌、肝癌、肺癌、食管癌等多种肿瘤组织中, NS基因表达含量较高[3,4]. 钱晖等[5]发现NS在多种肿瘤细胞如U937(人白血病细胞)、SW480细胞(人结肠癌细胞)都有表达.
NS基因表达的蛋白能与P53结合, 他由550个氨基酸组成. 免疫共沉淀和NS基因敲除小鼠实验发现NS和P53共同存在于一个蛋白复合体, 并可以在核质中检测有NS-P53蛋白复合体, 而核仁中未发现此种复合体, 因此研究者相信NS和P53的作用发生在核质中[2]. NS基因是如何发挥作用的? 研究者推断以下一个假定的工作模型[9-16]: NS蛋白可以由核仁转向核质, 且NS蛋白有2个能与GTP结合的位点, 结合GTP后, NS蛋白可以转运到核质中与P53蛋白结合, 形成NS-P53复合体(P53是一种公认的抑癌基因), 之后P53的功能被抑制, 从而使细胞增殖. 刘思金等[6]研究表明, NS特异性小分子RNA干扰可以使宫颈癌Hela细胞增殖受到抑制, 黄平等[8]发现NS特异小分子RNA干扰肺癌A549细胞后, 细胞增殖效率明显降低. 张志宏等[7]的研究表明, 运用RNAi技术干扰膀胱肿瘤细胞BIU287 NS基因表达后, 细胞增殖速率明显降低. 目前认为NS基因对细胞周期的调控主要体现在G0/G1期向S期的转变过程, 小分子RNA干扰后细胞周期阻滞在G0/G1期, 从而使细胞增殖受到抑制.
本实验通过NS基因特异性的小分子干扰RNA来阻断NS基因的表达, 进而阻断NS蛋白的表达. 可以看到应用特异性小分子RNA干扰后, 与N组及V组相比, S1和S2组的NS mRNA表达明显下降, NS蛋白的表达亦受到明显抑制; 此外, 转染细胞24 h、48 h、72 h后细胞增殖受到了明显抑制作用. 本实验采用质粒和脂质体共同瞬时转染细胞, 转染后抑制NS基因表达的作用可能会随时间的延长而逐渐减弱, 这可以通过稳定转染, 然后筛选出质粒稳定表达的细胞来解决. RNAi技术应用前景广阔, 可以为恶性肿瘤的进一步基因治疗提供方向, 目前认为NS基因主要是通过P53蛋白来发挥作用, 可能还存在其他和细胞增殖相关的蛋白, 这些还有待于进一步研究.
NS基因发挥作用主要是通过与P53蛋白结合, 而NS蛋白转至胞浆中需要和GTP结合, 因此我们也可以应用和NS蛋白竞争结合GTP的试剂, 也可减少NS蛋白和P53的结合, 从而影响NS蛋白的作用. 相关研究表明, NS基因在恶性程度高的肿瘤及低分化转移能力强的肿瘤组织中表达相对高些[3,4], NS基因和结肠癌的远处转移及预后有没有关系, 通过RNAi技术干扰NS基因表达是否可以减少远处转移的发生, 这些都还有待于进一步研究.
Nucleostemin(NS)基因是由美国学者Mckay和Tsai于2002年在中枢神经干细胞中发现的, 是一个和细胞增殖相关的基因, 研究表明该基因在多种肿瘤组织中表达含量相对于正常组织要高.
王娅兰, 教授, 重庆医科大学基础医学院病理教研室
王胜等发现NS基因在胃肠道肿瘤组织中表达上调, 且NS表达量和肿瘤组织分化程度有关; 另有研究表明, 特异性小分子RNA干扰NS基因可以使宫颈癌Hela细胞、食管癌细胞Eca-109、胃癌SGC-7901细胞的增殖受到明显抑制.
本文通过RNAi干扰人结肠癌SW480细胞NS基因, 探讨结肠癌细胞的mRNA和蛋白质水平的表达, 及细胞增殖情况的变化, 选题具有一定新意.
编辑: 张姗姗 电编:何基才
| 2. | Tsai RY, McKay RD. A nucleolar mechanism controlling cell proliferation in stem cells and cancer cells. Genes Dev. 2002;16:2991-3003. [PubMed] [DOI] |
| 4. | Liu SJ, Cai ZW, Liu YJ, Dong MY, Sun LQ, Hu GF, Wei YY, Lao WD. Role of nucleostemin in growth regulation of gastric cancer, liver cancer and other malignancies. World J Gastroenterol. 2004;10:1246-1249. [PubMed] |
| 5. | 钱 晖, 许 文荣, 王 文兵, 韩 崇旭, 郝 顺祖, 朱 伟, 孙 晓春, 胡 嘉波, 黄 诒森. 骨髓间充质干细胞和部分肿瘤细胞中Nucleostemin基因的表达. 中国生物化学与分子生物学报. 2005;21:8-13. |
| 6. | Sijin L, Ziwei C, Yajun L, Meiyu D, Hongwei Z, Guofa H, Siguo L, Hong G, Zhihong Z, Xiaolei L. The effect of knocking-down nucleostemin gene expression on the in vitro proliferation and in vivo tumorigenesis of HeLa cells. J Exp Clin Cancer Res. 2004;23:529-538. [PubMed] |
| 7. | 张 志宏, 刘 思金, 吴 长利, 劳 为德, 王 广有, 李 胜芝, 张 月, 马 志方, 赵 振理, 刘 秉乾. RNA干扰抑制膀胱肿瘤细胞BIU-87核干细胞因子基因表达对其增殖的影响. 中华泌尿外科杂志. 2006;4:22-25. |
| 9. | Ma H, Pederson T. Depletion of the nucleolar protein nucleostemin causes G1 cell cycle arrest via the p53 pathway. Mol Biol Cell. 2007;18:2630-2635. [PubMed] [DOI] |
| 10. | Tsai RY, McKay RD. A multistep, GTP-driven mechanism controlling the dynamic cycling of nucleostemin. J Cell Biol. 2005;168:179-184. [PubMed] [DOI] |
| 11. | Zhu Q, Yasumoto H, Tsai RY. Nucleostemin delays cellular senescence and negatively regulates TRF1 protein stability. Mol Cell Biol. 2006;26:9279-9290. [PubMed] [DOI] |
| 12. | Dai MS, Sun XX, Lu H. Aberrant expression of nucleostemin activates p53 and induces cell cycle arrest via inhibition of MDM2. Mol Cell Biol. 2008;28:4365-4376. [PubMed] [DOI] |
| 13. | Ma H, Pederson T. Nucleophosmin is a binding partner of nucleostemin in human osteosarcoma cells. Mol Biol Cell. 2008;19:2870-2875. [PubMed] [DOI] |
| 14. | Meng L, Zhu Q, Tsai RY. Nucleolar trafficking of nucleostemin family proteins: common versus protein-specific mechanisms. Mol Cell Biol. 2007;27:8670-8682. [PubMed] [DOI] |
| 15. | Romanova L, Grand A, Zhang L, Rayner S, Katoku-Kikyo N, Kellner S, Kikyo N. Critical role of nucleostemin in pre-rRNA processing. J Biol Chem. 2009;284:4968-4977. [PubMed] [DOI] |
| 16. | Meng L, Yasumoto H, Tsai RY. Multiple controls regulate nucleostemin partitioning between nucleolus and nucleoplasm. J Cell Sci. 2006;119:5124-5136. [PubMed] [DOI] |