修回日期: 2011-12-19
接受日期: 2011-12-24
在线出版日期: 2012-01-08
目的: 探讨细胞外基质金属蛋白酶诱导因子-EMMPRIN(extracellular matrix metalloproteinase inducer, EMMPRIN)、膜型基质金属蛋白酶-1(membrane-type matrix metalloproteinase-1, MT1-MMP)蛋白在原发胃癌和胃癌转移淋巴结中的表达差异及与人胃癌临床病理特征的关系, 以及二者之间是否有协同作用.
方法: 应用量子点免疫荧光组织化学技术检测人胃癌组织芯片(包括204例胃癌组织, 21例非癌性胃黏膜组织)和20例胃癌转移淋巴结组织中EMMPRIN和MT1-MMP的蛋白表达并评分.
结果: 在正常胃黏膜组织、慢性萎缩性胃炎伴肠上皮化生、胃癌和胃癌转移淋巴结组织中, EMMPRIN 和MT1-MMP蛋白表达呈逐渐递增的趋势, 正常胃黏膜组分别与胃癌组、胃癌转移淋巴结组相比, 2种蛋白表达的差异均有显著性. EMMPRIN蛋白表达与浸润深度、高TNM分期和淋巴结转移之间均呈显著正相关, 而与其他临床病理参数均无关. MT1-MMP蛋白表达仅与高TNM分期和伴有淋巴结转移呈显著正相关. EMMPRIN和MT1-MMP蛋白表达之间呈显著正相关(r = 0.584, P = 0.001).
结论: EMMPRIN与MT1-MMP蛋白在胃癌的发生与进展中有协同作用; 在胃癌转移淋巴结中的表达高于原发胃癌, 但差异无显著性.
引文著录: 刘修莉, 陈洪雷, 余保平, 郭明文, 李玲. EMMPRIN、MT1-MMP蛋白在原发胃癌和胃癌转移淋巴结中的表达及意义. 世界华人消化杂志 2012; 20(1): 27-33
Revised: December 19, 2011
Accepted: December 24, 2011
Published online: January 8, 2012
AIM: To investigate the expression of extracellular matrix metalloproteinase inducer (EMMPRIN) and membrane-type matrix metalloproteinase-1 (MT1-MMP) proteins in primary gastric carcinoma (GC) and associated lymph node metastases, and to analyze their correlation with clinicopathologic parameters of GC.
METHODS: Expression of EMMPRIN and MT1-MMP proteins were detected by quantum dot-based immunofluorescence technology on tissue microarrays including 204 cases of GC, 21 cases of non-cancerous gastric mucosa tissue, and 20 cases of metastatic lymph node tissue. The results were analyzed using a semiquantitative method.
RESULTS: The positive rates of EMMPRIN and MT1-MMP protein expression were highest metastatic lymph nodes, followed by GC, chronic atrophic gastritis with intestinal metaplasia, and normal gastric mucosa, which showed a decreasing trend. The positive rates of EMMPRIN and MT1-MMP protein expression were significantly higher in GC and lymph node metastases than in normal gastric mucosa. The expression of EMMPRIN protein was positively correlated with infiltration depth, higher TNM stage and lymph node metastasis, while expression of MT1-MMP protein was positively correlated with higher TNM stage and lymph node metastasis. A positive correlation was observed between EMMPRIN and MT1-MMP protein expression in GC (r = 0.584, P = 0.001).
CONCLUSION: EMMPRIN and MT1-MMP proteins may play a synergistic role in the development and progression of GC.
- Citation: Liu XL, Chen HL, Yu BP, Guo MW, Li L. Significance of expression of EMMPRIN and MT1-MMP in primary gastric carcinoma and associated lymph node metastases. Shijie Huaren Xiaohua Zazhi 2012; 20(1): 27-33
- URL: https://www.wjgnet.com/1009-3079/full/v20/i1/27.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i1.27
胃癌是严重危害人类健康的最常见消化道恶性肿瘤, 他的侵袭转移是导致患者死亡的重要原因. 细胞外基质金属蛋白酶刺激物(extracellular matrix metalloproteinase inducer, EMMPRIN/CD147)属于免疫球蛋白超家族, 可诱导基质金属蛋白酶(matrix metalloproteinase, MMP)的释放, 降解基质和基底膜而促进肿瘤细胞的浸润和转移[1]. 膜型-基质金属蛋白酶1(membrane type-1 matrix metalloproteinase, MT1-MMP)是第1个被发现的膜型蛋白酶, 也是最重要的一员, 其主要生物学功能在于他介导MMP-2酶原的激活以及通过其表达上调血管内皮生长因子促进血管生成, 协同参与了多种肿瘤的侵袭转移过程, 如三阴乳腺癌[2]. 本研究拟在高通量的胃癌组织芯片包括204例胃癌组织、11例正常胃黏膜、10例慢性萎缩性胃炎伴肠上皮化生和20例胃癌转移淋巴结上采用量子点免疫荧光组织化学(quantum dots-immunofluorescent histochemistry, QDs-IHC)技术检测EMMPRIN、MT1-MMP的表达以及与临床病理参数的关系, 为胃癌侵袭转移及预后判断提供参考.
收集三峡大学人民医院和武汉大学中南医院2008-2010年存档的蜡块245例, 其中包括204例胃癌组织, 21例非癌性胃黏膜组织(11例正常胃黏膜和10例慢性萎缩性胃炎伴肠上皮化生)和20例胃癌转移淋巴结组织, 所有标本术前均未进行放、化疗治疗. 兔抗人EMMPRIN多克隆抗体(Santa Cruz公司, 工作浓度为1:100)、兔抗人MT1-MMP多克隆抗体(Abcam公司, 工作浓度为1:50); 羊抗兔生物素化IgG; 量子点超敏荧光试剂盒; 以上试剂均购自武汉珈源量子点技术开发有限责任公司.
1.2.1 组织芯片的构建: 胃癌组织芯片, 每点直径1.1 mm, 4 mm厚, 其中包括204例胃癌组织, 21例非癌性胃黏膜组织(11例正常胃黏膜和10例慢性萎缩性胃炎伴肠上皮化生), 为了获得代表性的病例并把损失降到最低, 每例组织均有2点. 由于大多数胃癌转移淋巴结组织较小, 不适宜选取标本构建芯片. 组织芯片被固定于美国Superfrost Plus防脱载玻片上, 共构建3个各容有75例不同病例标本的150芯组织芯片. 首先根据HE切片选取存档组织蜡块, 再确定具有代表性的病变部位. 然后应用组织芯片构建仪(Beecher Instruments, Silver Spring, MD)制备组织芯片. 如下所示: 应用构建仪器在一个新的空白蜡块(40 mm×25 mm)中穿孔(直径1.1 mm), 然后在选取的组织蜡块中穿取组织(直径 1.1 mm), 准确放入空白蜡块的小孔内, 依次按序操作, 直至将所有组织标本种植于另一空白蜡块中, 并加以记录, 最后应用Leica切片机进行4 mm厚的连续切片. 上述方法由桂林泛谱生物技术有限公司协助完成.
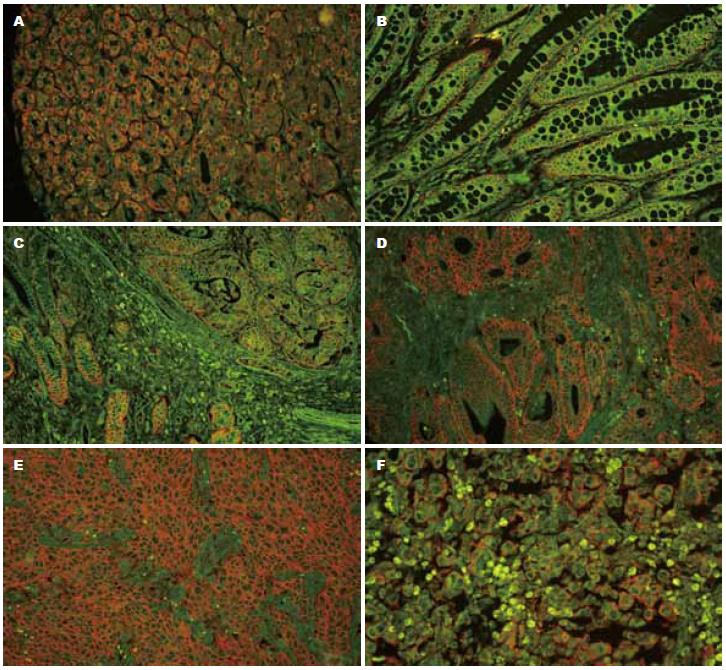
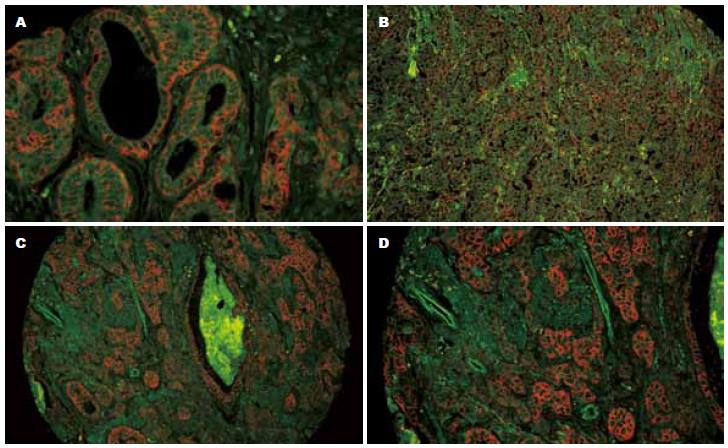
1.2.2 EMMPRIN和MT1-MMP蛋白表达的检测: 采用QDs-IHC方法检测胃癌组织芯片和胃癌转移淋巴结组织中EMMPRIN和MT1-MMP的蛋白表达. 操作步骤严格按试剂盒说明书进行. 组织芯片滴加90%甘油封片后, 上荧光显微镜(日本Olympus BX51荧光显微镜DP72 CCD)蓝光激发QDs信号, 以细胞内出现橙红色的荧光颗粒为阳性. 用TBS代替一抗作空白对照, 以已知阳性片作阳性对照. 镜下观察显示EMMPRIN蛋白阳性信号定位于细胞胞膜而MT1-MMP蛋白则定位于胞质. 在高倍镜下取4个不同视野, 各计数200个细胞, 按阳性细胞所占的百分比计算: "﹣"为阴性, "+"为阳性细胞≤10%, "++"为11%-50%, "+++"为>51%. "++"及以上则判断为阳性表达.
统计学处理 采用c2检验和四格表的精确概率法判断EMMPRIN、MT1-MMP蛋白表达与胃癌临床病理特征的关系, 并运用Spearman等级相关系数来判断EMMPRIN、MT1-MMP蛋白表达之间的相互关系. P<0.05具有统计学意义. 所有数据均在SPSS18.0软件上进行.
QDs-IHC实验完成后, 观察整个芯片, 非癌性胃黏膜组织没有缺失, 204例胃癌组织共有5例芯片缺失或无癌组织, 不纳入统计学处理, 芯片完整率达到95%以上. 病理诊断结果经2名以上病理医师再进行确认. WHO组织学类型包括: 管状腺癌161例、黏液腺癌9例、印戒细胞癌14例和未分化癌15例. 胃癌患者中, 男138例, 女61例, 年龄24-92(平均年龄57)岁. 参照2003年修改的国际抗癌联盟(UICC)和美国肿瘤联合会(AJCC)联合制定的TNM分期法: Ⅰ期47例, Ⅱ期61例, Ⅲ+Ⅳ期91例. 肿瘤浸润深度: T1+T2是64例, T3是135例. 伴有淋巴结转移的胃癌组织107例, 不伴有淋巴结转移的胃癌组织92例. 根据癌细胞分化程度进行病理分级: 高、中分化52例, 低分化109例(未包括黏液腺癌、印戒细胞癌和未分化癌).
EMMPRIN蛋白主要表达在癌细胞的胞膜和胞质, 尤其在肿瘤浸润的边缘部位阳性细胞数有相对增加的趋势, 而在正常胃黏膜腺体、肠上皮化生和间质细胞中也有少量表达(图1). 正常胃黏膜组织、慢性萎缩性胃炎伴肠上皮化生、胃癌和胃癌转移淋巴结组织中的EMMPRIN蛋白表达的阳性率分别为18.18%、40.00%、64.82%和75.00%, 呈逐渐递增的趋势, 正常胃黏膜组分别与胃癌组、胃癌转移淋巴结组相比, 差异均有显著性(P<0.05, 表1). 其他组别之间两两比较均无显著性差异(P>0.05). EMMPRIN蛋白表达与胃癌临床病理参数的关系见表2. EMMPRIN蛋白表达阳性率与胃癌患者年龄、性别、组织学类型和病理分级之间差异均无显著性(P>0.05). EMMPRIN蛋白表达阳性率在肿瘤侵出浆膜层(T3)组为71.11%, 高于肿瘤侵及浆膜下层以内组(T1+T2)51.56%, 差异有显著性(P = 0.007). EMMPRIN蛋白表达与高TNM分期(P = 0.001)和伴有淋巴结转移(P = 0.010)之间均呈显著正相关.
| 组织学类型 | n | CD147 | 阳性率(%) | χ2值 | P值 | |
| ﹣ | + | |||||
| 正常胃黏膜a | 11 | 9 | 2 | 18.18 | 9.663ac | 0.002 |
| 胃炎伴肠化b | 10 | 6 | 4 | 40.00 | 9.251ad | 0.007 |
| 胃癌c | 199 | 70 | 129 | 64.82 | 2.536bc | 0.175 |
| 淋巴结转移胃癌d | 20 | 5 | 15 | 75.00 | 3.517bd | 0.108 |
| 临床病理特征 | n | EMMPRIN | χ2值 | P值 | MT1-MMP | χ2值 | P值 | ||
| ﹣ | + | ﹣ | + | ||||||
| 性别 | 2.139 | 0.144 | 0.919 | 0.338 | |||||
| 男 | 138 | 44 | 94 | 60 | 78 | ||||
| 女 | 61 | 26 | 35 | 31 | 30 | ||||
| 年龄(岁) | 2.474 | 0.116 | 3.407 | 0.065 | |||||
| <57 | 93 | 38 | 55 | 49 | 44 | ||||
| ≥57 | 106 | 32 | 74 | 42 | 64 | ||||
| 肿瘤浸润深度 | 7.276 | 0.007 | 3.051 | 0.081 | |||||
| T1+T2 | 64 | 31 | 33 | 35 | 29 | ||||
| T3 | 135 | 39 | 96 | 56 | 79 | ||||
| 病理分级 | 3.066 | 0.080 | 0.493 | 0.483 | |||||
| 高、中分化 | 52 | 22 | 30 | 25 | 27 | ||||
| 低分化 | 109 | 31 | 78 | 46 | 63 | ||||
| TNM分期 | 14.288 | 0.001 | 8.824 | 0.012 | |||||
| I | 47 | 27 | 20 | 30 | 17 | ||||
| Ⅱ | 61 | 20 | 41 | 27 | 34 | ||||
| III+Ⅳ | 91 | 23 | 68 | 34 | 57 | ||||
| 淋巴结转移 | 6.615 | 0.010 | 13.617 | 0.000 | |||||
| 有 | 107 | 29 | 78 | 36 | 71 | ||||
| 无 | 92 | 41 | 51 | 55 | 37 | ||||
MT1-MMP蛋白主要表达在癌细胞的胞质, 而在非癌性胃黏膜腺体中几乎不表达(图2). 正常胃黏膜组织、慢性萎缩性胃炎伴肠上皮化生、胃癌和胃癌转移淋巴结组织中的MT1-MMP蛋白表达的阳性率分别为9.09%、30.00%、54.27%和65.00%, 呈逐渐递增的趋势, 正常胃黏膜组分别与胃癌组、胃癌转移淋巴结组相比, 差异均有显著性(P<0.05, 表3). MT1-MMP蛋白表达与胃癌临床病理参数的关系见表3. MT1-MMP蛋白表达阳性率与胃癌患者年龄、性别、不同组织学类型、病理分级和肿瘤浸润深度之间差异均无显著性(P>0.05), 但MT1-MMP蛋白表达与高TNM分期和伴有淋巴结转移均呈显著正相关(P1 = 0.012; P2 = 0.000).
| 组织学类型 | n | MT1-MMP | 阳性率(%) | χ2值 | P值 | |
| ﹣ | + | |||||
| 正常胃黏膜a | 11 | 10 | 1 | 9.09 | 8.524ac | 0.004 |
| 胃炎伴肠化b | 10 | 7 | 3 | 30.00 | 8.957ad | 0.007 |
| 胃癌c | 199 | 91 | 108 | 54.27 | 2.536bc | 0.175 |
| 淋巴结转移胃癌d | 20 | 7 | 13 | 65.00 | 2.252bd | 0.195 |
在199例人胃癌组织中有139例EMMPRIN蛋白呈阳性表达, 其中MT1-MMP有102例也呈阳性, EMMPRIN蛋白阴性表达的60例中, MT1-MMP有54例也呈阴性, 二者呈显著正相关(P = 0.001, r = 0.584). EMMPRIN与MT1-MMP蛋白共同阳性的102例胃癌中, 淋巴结转移率为69.61%(71/102), 二者共同阴性的54例胃癌中, 淋巴结转移率为24.07%(13/54), 差异有显著性(c2 = 29.456, P = 0.001).
肿瘤的侵袭和转移是多步骤发生的结果, 包括基底膜的降解(进入血管)、穿透循环(播散)、到达血管外、侵袭靶器官和形成转移的特征, 这涉及增殖、迁移、蛋白溶解和血管生成[3]. MMPs是蛋白水解酶, 主要降解细胞外基质成分, 与多种因子相互作用, 参与这些过程, 在肿瘤转移中起很重要的作用. 有证据表明, 部分与肿瘤相关的蛋白水解酶是源于周围的间质而不是肿瘤细胞本身.
EMMPRIN是个重要的细胞外基质MMPs诱导剂, 是高度糖基化的细胞表面跨膜蛋白, 属于免疫球蛋白超家族. EMMPRIN在人体内广泛分布, 具有多种不同的功能, 而他在肿瘤的生长、浸润和转移中的作用是目前肿瘤细胞生物学领域的研究热点之一. EMMPRIN在许多肿瘤中高表达如乳腺癌[4]、鼻咽癌[5]、食管和宫颈鳞癌[6]、结肠癌和卵巢癌等, 通过诱导周围间质细胞合成MMPs包括MT1-MMP和MT2-MMP而增加肿瘤的侵袭.
关于EMMPRIN在人胃癌组织中的研究国内外报道少见, Zheng等[7]在胃癌中的研究认为, EMMPRIN的表达水平与MVD(微血管密度)呈正相关, EMMPRIN表达的上调有助于胃癌的发生、发展和局部浸润. EMMPRIN表达也是肠型胃癌具有高增殖和发生肝转移的分子基础[8]. 本研究发现 EMMPRIN 蛋白主要表达在癌细胞的胞膜和胞质, 尤其在肿瘤浸润的边缘部位阳性细胞数有相对增加的趋势, 而在癌旁正常腺体、肠上皮化生和间质细胞中也有少量表达. 正常胃黏膜组织、慢性萎缩性胃炎伴肠上皮化生、胃癌和胃癌转移淋巴结组织中的EMMPRIN蛋白表达的阳性率分别为18.18%、40.00%、64.82%和75.00%, 呈逐渐递增的趋势, 正常胃黏膜组分别与胃癌组、胃癌转移淋巴结组相比, 差异均有显著性, 表明EMMPRIN蛋白与胃癌的发生发展以及转移密切相关, 这与文献报道基本一致[9]. 本研究发现EMMPRIN蛋白表达阳性率与胃癌患者年龄、性别、组织学类型和病理分级之间差异均无显著性, 提示EMMPRIN蛋白与胃癌患者的性别和年龄无关, 也与胃癌组织学类型和病理分级无关. 本研究还发现EMMPRIN 蛋白表达阳性率在肿瘤侵出浆膜层(T3)组为71.11%, 高于肿瘤侵及浆膜下层以内组(T1+T2)51.56%, 差异有显著性, 并与高TNM分期呈显著正相关, 这提示EMMPRIN蛋白高表达有助于胃癌的延伸和进展. 这与我们以往报道的EMMPRIN蛋白表达与70例胃癌不同临床分期和肿瘤浸润深度均无关的结果[10]不一致, 提示扩大病例数如达到200例以上, 使研究结果更具有客观可靠性. 同时, 本研究还观察到EMMPRIN 蛋白表达的阳性率在有淋巴结转移的癌组织中显著高于无淋巴结转移组, 表明EMMPRIN蛋白表达还与淋巴结的转移密切相关[7]. 还有文献报道, EMMPRIN 蛋白高表达与胃癌患者的不良预后有关[11].
大部分MMPs, 例如MMP- 1、MMP-2、MMP-3、MMP-9、MMP-11和MT-MMPs主要是由与肿瘤相关的间质成纤维细胞产生. 近来已证实, 在多种肿瘤组织中均有MT1-MMP蛋白及其mRNA的过度表达, 与肿瘤的发生、发展以及侵袭转移密切相关. Zhao等[12]报道MT1-MMP mRNA在75%(24/32)的胃癌组织中高表达. MT1-MMP在胃癌患者外周血中阳性表达与腹膜的播散, 淋巴管和血管的浸润以及淋巴结转移相关, 甚至在骨髓中表达也可预示胃癌远处转移的高危性, 因此可作为预测远处转移的标志物[13].
本研究发现MT1-MMP 蛋白主要表达在癌细胞的胞质, 而在非癌性胃黏膜腺体和间质细胞中几乎不表达. 我们结果表明, 正常胃黏膜组织、慢性萎缩性胃炎伴肠上皮化生、胃癌和胃癌转移淋巴结组织中的MT1-MMP蛋白的阳性表达率分别为9.09%、30.00%、54.27%和65.00%, 呈逐渐递增的趋势, 正常胃黏膜组分别与胃癌组、胃癌转移淋巴结组相比, 差异均有显著性, 提示MT1-MMP蛋白表达与胃癌的发生发展密切相关. 尽管本研究并未观察到MT1-MMP蛋白表达阳性率与胃癌患者年龄、性别、不同组织学类型、病理分级和肿瘤浸润深度相关, 但MT1-MMP 蛋白表达与高TNM分期和伴有淋巴结转移均呈显著正相关, 表明MT1-MMP可促进胃癌的进展和淋巴结转移. 这与文献报道基本一致[14,15].
本研究发现EMMPRIN和MT1-MMP蛋白与胃癌的发生发展以及淋巴结转移均显著相关, 二者之间是否有协同促进作用呢? 结果表明在199例人胃癌组织中, 有102例显示EMMPRIN和MT1-MMP蛋白共同阳性表达, 有54例显示EMMPRIN和MT1-MMP蛋白共同阴性表达, 二者呈显著正相关(P = 0.001, r = 0.584). EMMPRIN与MT1-MMP蛋白共同阳性的102例胃癌中, 淋巴结转移率为69.61%(71/102), 二者共同阴性的54例胃癌中, 淋巴结转移率为24.07%(13/54), 差异有显著性, 表明同时检测EMMPRIN与MT1-MMP蛋白可预测胃癌的淋巴结转移.
胃癌是消化系最常见的恶性肿瘤, 容易复发及转移, 死亡率较高, 与胃癌的浸润转移密切相关. 肿瘤细胞对ECM成分及基底膜的降解是肿瘤浸润转移的关键步骤. 而EMMPRIN作为ECM金属蛋白酶刺激物可诱导MMPs的释放, 降解基质和基底膜而促进肿瘤细胞的浸润和转移. 关于EMMPRIN和 MT1-MMP在人胃癌组织中的研究鲜见报道.
刘冰熔, 教授, 哈尔滨医科大学附属第二医院消化内科
肿瘤侵袭转移的分子机制是当前研究的热点. MMP对肿瘤的侵袭和转移发挥着关键的作用, 阻断MMP的活性及过度产生可能是肿瘤治疗的一种很有希望的策略.
近来已证实, 在多种肿瘤组织中均有MT1-MMP蛋白及其mRNA的过度表达, 与肿瘤的发生、发展以及侵袭转移均密切相关.
本研究主要基于新型荧光探针-量子点的免疫荧光组织化学技术同时检测了侵袭转移相关基因EMMPRIN和MT1-MMP在归档的非癌性胃黏膜、胃癌石蜡标本中的表达, 并分析其与临床病理特征的关系.
针对EMMPRIN和MT1-MMP 阻抑剂的进一步探索, 可能成为抑制胃癌浸润转移的一条新途径, 对于改善胃癌患者的预后也具有重要意义.
本研究选题合理, 设计科学, 结果可靠, 具有很好的参考价值.
编辑: 李军亮 电编:何基才
| 1. | Ishibashi Y, Matsumoto T, Niwa M, Suzuki Y, Omura N, Hanyu N, Nakada K, Yanaga K, Yamada K, Ohkawa K. CD147 and matrix metalloproteinase-2 protein expression as significant prognostic factors in esophageal squamous cell carcinoma. Cancer. 2004;101:1994-2000. [PubMed] [DOI] |
| 2. | Perentes JY, Kirkpatrick ND, Nagano S, Smith EY, Shaver CM, Sgroi D, Garkavtsev I, Munn LL, Jain RK, Boucher Y. Cancer cell-associated MT1-MMP promotes blood vessel invasion and distant metastasis in triple-negative mammary tumors. Cancer Res. 2011;71:4527-4538. [PubMed] [DOI] |
| 3. | Wang L, Wu G, Yu L, Yuan J, Fang F, Zhai Z, Wang F, Wang H. Inhibition of CD147 expression reduces tumor cell invasion in human prostate cancer cell line via RNA interference. Cancer Biol Ther. 2006;5:608-614. [PubMed] [DOI] |
| 4. | Liu F, Cui L, Zhang Y, Chen L, Wang Y, Fan Y, Lei T, Gu F, Lang R, Pringle GA. Expression of HAb18G is associated with tumor progression and prognosis of breast carcinoma. Breast Cancer Res Treat. 2010;124:677-688. [PubMed] [DOI] |
| 5. | Du ZM, Hu CF, Shao Q, Huang MY, Kou CW, Zhu XF, Zeng YX, Shao JY. Upregulation of caveolin-1 and CD147 expression in nasopharyngeal carcinoma enhanced tumor cell migration and correlated with poor prognosis of the patients. Int J Cancer. 2009;125:1832-1841. [PubMed] [DOI] |
| 6. | Yu W, Liu J, Xiong X, Ai Y, Wang H. Expression of MMP9 and CD147 in invasive squamous cell carcinoma of the uterine cervix and their implication. Pathol Res Pract. 2009;205:709-715. [PubMed] [DOI] |
| 7. | Zheng HC, Takahashi H, Murai Y, Cui ZG, Nomoto K, Miwa S, Tsuneyama K, Takano Y. Upregulated EMMPRIN/CD147 might contribute to growth and angiogenesis of gastric carcinoma: a good marker for local invasion and prognosis. Br J Cancer. 2006;95:1371-1378. [PubMed] [DOI] |
| 8. | Zheng H, Takahashi H, Murai Y, Cui Z, Nomoto K, Miwa S, Tsuneyama K, Takano Y. Pathobiological characteristics of intestinal and diffuse-type gastric carcinoma in Japan: an immunostaining study on the tissue microarray. J Clin Pathol. 2007;60:273-277. [PubMed] [DOI] |
| 9. | 唐 忠辉, 陈 华生, 邹 宗楷, 蔡 韶滨, 苏 海燕, 沈 洪武, 吴 文乔, 林 莉, 王 元亨. TFF3和CD147在不同胃黏膜病变中的表达及其与血管生成的关系. 世界华人消化杂志. 2008;16:3631-3636. [DOI] |
| 11. | Pinheiro C, Longatto-Filho A, Simões K, Jacob CE, Bresciani CJ, Zilberstein B, Cecconello I, Alves VA, Schmitt F, Baltazar F. The prognostic value of CD147/EMMPRIN is associated with monocarboxylate transporter 1 co-expression in gastric cancer. Eur J Cancer. 2009;45:2418-2424. [PubMed] [DOI] |
| 12. | Zhao C, Bu X, Zhang N, Wang W. Downregulation of SFRP5 expression and its inverse correlation with those of MMP-7 and MT1-MMP in gastric cancer. BMC Cancer. 2009;9:224. [PubMed] [DOI] |
| 13. | Mimori K, Fukagawa T, Kosaka Y, Ishikawa K, Iwatsuki M, Yokobori T, Hirasaki S, Takatsuno Y, Sakashita H, Ishii H. A large-scale study of MT1-MMP as a marker for isolated tumor cells in peripheral blood and bone marrow in gastric cancer cases. Ann Surg Oncol. 2008;15:2934-2942. [PubMed] [DOI] |
| 14. | Zhang M, Zhu GY, Gao HY, Zhao SP, Xue Y. Expression of tissue levels of matrix metalloproteinases and tissue inhibitors of metalloproteinases in gastric adenocarcinoma. J Surg Oncol. 2011;103:243-247. [PubMed] [DOI] |
| 15. | Yoshikawa T, Yanoma S, Tsuburaya A, Kobayashi O, Sairenji M, Motohashi H, Miyagi Y, Morinaga S, Noguchi Y, Yamamoto Y. Expression of MMP-7 and MT1-MMP in peritoneal dissemination of gastric cancer. Hepatogastroenterology. 2006;53:964-967. [PubMed] |