修回日期: 2011-12-05
接受日期: 2011-12-15
在线出版日期: 2012-01-08
目的: 观察重组腺病毒Ad5-pCEA-Hsp70介导的Hsp70基因表达对大鼠胰腺癌移植瘤生长的影响, 并分析其相关机制.
方法: 建立大鼠胰腺癌皮下移植瘤模型, 随机分为3组, 分别给予Ad5-pCEA-Hsp70、Ad5-control以及PBS进行治疗. 对比不同时间点3组肿瘤大小, 评价抑瘤效果: 通过ELISA的方法检测外周血Hsp70蛋白含量及细胞因子INF-g、TNF-a、IL-6的含量; 取动物的移植瘤常规HE染色, 观察淋巴细胞浸润情况; 分离动物脾脏单核细胞, 通过流式细胞仪检测CD83+细胞比例, 并观察脾淋巴细胞对体外培养的大鼠胰腺癌细胞的杀伤能力.
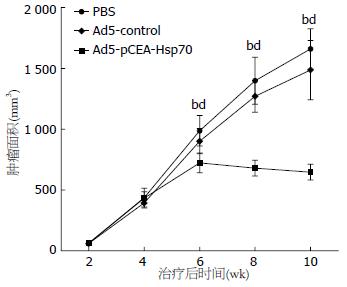
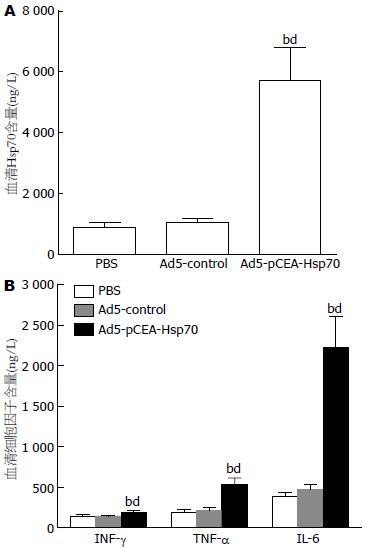
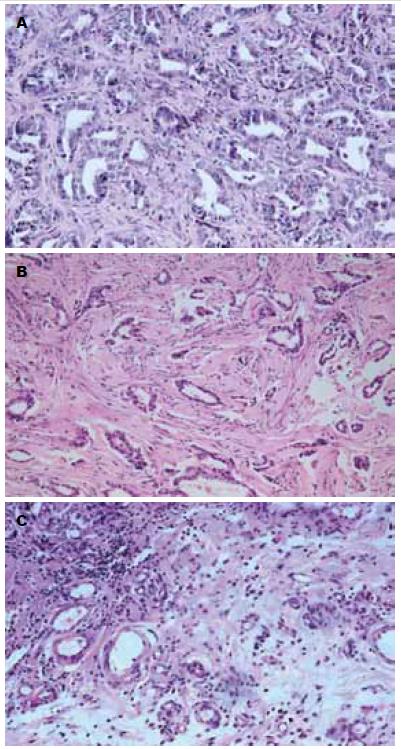
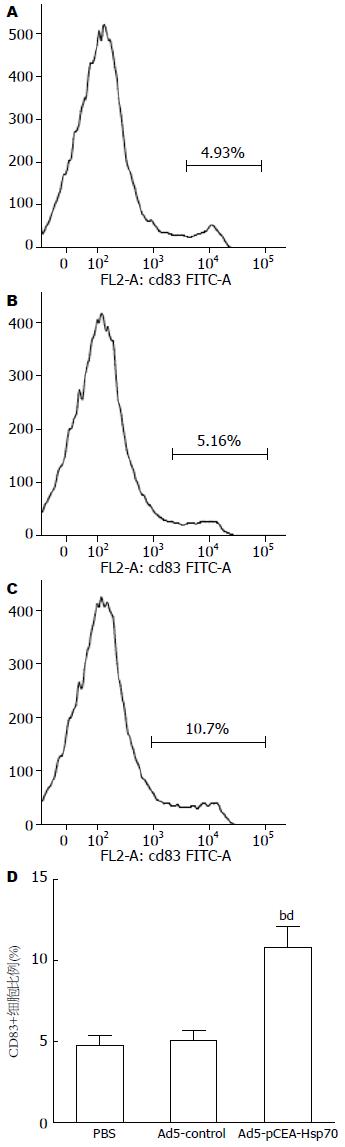
结果: 治疗后第4、6、8周, Ad5-pCEA-Hsp70组肿瘤体积分别与Ad5-control组及PBS组相比(724.4 mm3±81.6 mm3vs 901.3 mm3±103.9 mm3、987.5 mm3±126.0 mm3; 681.3 mm3±64.9 mm3vs 1270.6 mm3±131.6 mm3、1398.5 mm3±193.0 mm3; 648.0 mm3±65.9 mm3vs 1 487.0 mm3±243.0 mm3、1 660.0 mm3±167.0 mm3), 差异均具有统计学意义(均P<0.01). Ad5-pCEA-Hsp70组动物外周血Hsp70蛋白及细胞因子INF-g、TNF-a、IL-6的含量均显著高于Ad5-control组和PBS组(均P<0.01). HE染色发现, 与Ad5-control组和PBS组相比, Ad5-pCEA-Hsp70组有较多的淋巴细胞浸润. 经流式细胞仪检测, Ad5-pCEA-Hsp70组脾单核细胞中CD83+细胞比例显著高于Ad5-control组及PBS组(10.8±1.3% vs 5.1±0.6%、4.8±0.6%; 均P<0.01). 脾淋巴细胞介导的CTL实验中, 当效靶细胞比为1:1时, 3组动物之间并无统计学差异(P>0.05), 但随着效靶细胞比的增加, Ad5-pCEA-Hsp70组对胰腺癌细胞的杀伤能力较Ad5-control组和PBS组明显增加(P<0.05, P<0.01).
结论: 重组腺病毒Ad5-pCEA-Hsp70介导的Hsp70基因表达对大鼠胰腺癌动物模型的肿瘤生长具有抑制作用, 其机制与促进树突状细胞(dendritic cells, DC)的成熟、诱导细胞因子INF-g、TNF-a、IL-6的分泌、促进淋巴细胞浸润有关.
引文著录: 孙运良, 徐灿, 苏长青, 马建霞, 高军, 满晓华, 李兆申. 靶向重组腺病毒介导Hsp70基因表达对大鼠胰腺癌移植瘤的抑制作用. 世界华人消化杂志 2012; 20(1): 15-21
Revised: December 5, 2011
Accepted: December 15, 2011
Published online: January 8, 2012
AIM: To observe the effect of recombinant adenovirus Ad5-pCEA-Hsp70-mediated Hsp70 gene expression on tumor growth in a rat xenograft model of pancreatic cancer, and to analyze the underlying mechanism.
METHODS: A rat xenograft model of pancreatic cancer was established, and model animals were randomly divided into three groups, which were given Ad5-pCEA-Hsp70, Ad5-control and PBS treatment, respectively. Antitumor effect was evaluated by comparing tumor size at different time points among the three groups. ELISA was used to detect the peripheral blood levels of Hsp70 protein, INF-g, TNF-a and IL-6. HE staining was used to detect lymphocyte infiltration. Animal spleen mononuclear cells were isolated to determine the proportion of CD83+ cells by flow cytometry. Cell-killing ability of spleen lymphocytes was observed in vitro.
RESULTS: At 4, 6, and 8 weeks after treatment, tumor volume in the Ad5-CEA-Hsp70 group was significantly lower than that in the Ad5-control group and PBS group (724.4 mm3 ± 81.6 mm3vs 901.3 mm3 ± 103.9 mm3, 987.5 mm3 ± 126.0 mm3; 681.3 mm3 ± 64.9 mm3vs 1 270.6 mm3 ± 131.6 mm3, 1 398.5 mm3 ± 193.0 mm3; 648.0 mm3 ± 65.9 mm3vs 1 487.0 mm3 ± 243.0 mm3, 1 660.0 mm3 ± 167.0 mm3; all P < 0.01). The levels of Hsp70 protein and cytokines INF-g, TNF-a and IL-6 in peripheral blood in the Ad5-pCEA-Hsp70 group were significantly higher than those in the Ad5-control group and PBS group (all P < 0.01). Compared to the Ad5-control group and PBS group, Ad5-pCEA-Hsp70 group had more lymphocytic infiltration. The proportion of CD83+ cells in the Ad5-pCEA-Hsp70 group was significantly higher than that in the Ad5-control group and PBS group (10.8% ± 1.3% vs 5.1% ± 0.6%, 4.8% ± 0.6%; both P < 0.01). In the lymphocyte-mediated CTL experiment, when the cell ratio of effect: target was 1:1, there was no significant difference in the cell killing ability among the three groups (P > 0.05), but with the increase in the effect: target cell ratio, the cell killing ability in the Ad5-pCEA-Hsp70 group was significantly increased (P < 0.05, P < 0.01).
CONCLUSION: Hsp70 gene expression mediated by recombinant adenovirus Ad5-pCEA-Hsp70 could inhibit tumor growth in a rat xenograft model of pancreatic cancer via mechanisms that are related to the promotion of dentritic cell maturation, induction of cytokine secretion, and promotion of lymphocyte infiltration.
- Citation: Sun YL, Xu C, Su CQ, Ma JX, Gao J, Man XH, Li ZS. Recombinant adenovirus-mediated Hsp70 gene expression inhibits tumor growth in a rat xenograft model of pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(1): 15-21
- URL: https://www.wjgnet.com/1009-3079/full/v20/i1/15.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i1.15
近年来, 胰腺癌的发病率在世界范围内依然呈上升趋势, 胰腺癌患者的生存率和死亡率无显著降低[1]. 考虑到单独外科手术治愈率低, 迫切需要通过一些辅助治疗来提高生存率. 在众多治疗手段中, 基因治疗被认为是继手术、放疗和化疗等传统疗法之后胰腺癌治疗的新模式[2,3]. 热休克蛋白70(heat shock protein70, Hsp70) 是一类广泛存在于各种生物体内的进化上高度保守的细胞应激蛋白. 研究证实, Hsp70可结合肿瘤细胞表达的多肽类抗原, 通过内源性途径传递给MHCⅠ类分子, 引发特异性的细胞毒性T细胞反应, 诱导机体产生强大的抗肿瘤免疫效应[4-6]. 因此, 利用携带Hsp70基因的载体将其导入肿瘤细胞, 使其在细胞内稳定表达, 从而增强和诱导机体的抗肿瘤免疫反应, 已成为目前肿瘤免疫基因治疗研究的热点之一[7-9].
研究显示, CEA在正常胰腺组织中不表达, 而在胰腺癌组织中则有高频率的阳性表达率, 提示CEA基因表达与胰腺癌密切有关, 是胰腺癌基因治疗比较广谱的分子靶标[10,11]. 因此, 利用胰腺癌细胞内特异的反式作用因子的激活作用, 采用CEA基因启动子控制Hsp70基因, 可以达到靶向胰腺癌特异性表达Hsp70, 从而发挥抗肿瘤免疫反应, 并能降低对正常细胞的作用. 本研究通过建立胰腺癌动物模型, 利用前期构建的CEA启动子驱动下靶向表达Hsp70基因的重组腺病毒Ad5-pCEA-Hsp70, 观察该重组腺病毒对移植瘤生长的抑制作用并分析其相关机制, 为该肿瘤疫苗的临床转化应用提供理论基础和实验依据.
健康♂有免疫力的4周龄Lewis大鼠26只, 体质量100-150 g, SPF级, 购于上海中科院斯莱克动物中心, 中国人民解放军第二军医大学动物实验中心饲养; 适应性饲养1 wk后开始实验; 实验前24 h禁食, 自由饮水. 大鼠胰腺癌细胞株DSL-6A/C1以及人胚肾细胞系HEK293细胞为本实验室保存. DSL-6A/C1细胞在含100 mL/L FBS的Waymouth's MB 752/1培养液, 37 ℃ 50 mL/L CO2条件下培养, 培养液中含青霉素、链霉素各10 000 U/L. HEK293细胞用含100 mL/L FBS的DMEM培养基进行常规传代培养. CEA启动子驱动下靶向表达Hsp70基因的重组腺病毒Ad5-pCEA-Hsp70以及对照病毒Ad5-control为本实验室所构建并保存[12]. Hsp70 ELISA检测试剂盒购自Stressgen公司; IL-6、TNF-a和IFN-g ELISA检测试剂盒购自BD公司; FITC标记的CD83抗体为eBioscience公司产品; Cytotox96 Non-Radioactive Cytotoxicity Assay试剂盒以及淋巴细胞分离液均为Promega公司产品.
1.2.1 重组腺病毒的扩增和滴度测定: 以重组腺病毒Ad5-pCEA-Hsp70以及对照病毒Ad5-control分别感染HEK293细胞, 收获病变细胞反复冻融以释放病毒, 经半数组织培养感染剂量法(TCD50法)测定病毒滴度, 得到重组腺病毒Ad5-pCEA-Hsp70的滴度为2.5×1010 PFU/mL, 对照病毒Ad5-control的滴度为2.2×1010 PFU/mL, 置于-80 ℃冰箱中保存备用.
1.2.2 大鼠胰腺癌皮下移植瘤模型的建立: 常规培养大鼠胰腺癌细胞株DSL-6A/C1, 收集处于对数生长期的细胞, 调整细胞浓度为2.5×107/mL, 将总量为5×106(0.2 mL)的细胞接种于Lewis大鼠皮下, 待皮下移植瘤形成后, 切除移植瘤, 并将移植瘤剪成1 mm3肿块, 接种于Lewis大鼠腹部皮下. 每周2次观察荷瘤大鼠皮下瘤的生长情况, 以游标卡尺测量瘤体的长径和短径, 通过a×b2/2(a为长径, b为短径)计算移植瘤的大小[13].
1.2.3 重组腺病毒Ad5-pCEA-Hsp70对大鼠胰腺癌皮下移植瘤生长抑制作用: 待大鼠皮下形成约50-70 mm3移植瘤后, 随机将大鼠分为PBS组、Ad5-pCEA-Hsp70组以及Ad5-control组, 每组共8只动物. 其中PBS组皮下瘤内注射PBS 100 mL, 1次/2 d, 共注射3次; Ad5-pCEA-Hsp70组皮下瘤内注射溶于100 mL PBS的重组腺病毒Ad5-pCEA-Hsp70 5×108 PFU, 1次/2 d, 共注射3次. Ad5-control组皮下瘤内注射溶于100 mL PBS的重组腺病毒Ad5-control 5×108 PFU, 1次/2 d, 共注射3次. 每周2次观察荷瘤大鼠的皮下瘤的生长情况, 评价抑瘤效果. 于治疗后第8周以3%戊巴比妥钠腹腔注射麻醉各组实验动物, 通过心脏取血后处死动物, 分析腺病毒介导的Hsp70基因表达抑制大鼠胰腺癌皮下移植瘤生长的相关机制.
1.2.4 血清中Hsp70蛋白含量以及细胞因子TGF-b、INF-g、IL-6的含量的测定: 取各组实验动物的血清, 采用ELISA的方法检测外周血Hsp70蛋白以及细胞因子TGF-b、INF-g、IL-6的含量, 具体步骤按说明书进行操作.
1.2.5 脾脏CD83+细胞比例的检测: 无菌取出大鼠脾脏, 制备脾细胞单细胞悬液, 加入 FITC标记的CD83抗体孵育后, 流式细胞仪进行检测CD83+细胞比例.
1.2.6 脾淋巴细胞介导的CTL活性检测: 分离实验动物的脾脏淋巴细胞, 以脾淋巴细胞为效应细胞(E)、以大鼠胰腺癌细胞DSL-6A/C1为靶细胞(T), 应用乳酸脱氢酶(LDH)释放法检测CTL的活性, 采用Promega公司的Cytotox96 Non-Radioactive Cytotoxicity Assay试剂盒, 具体步骤按说明书进行操作. 细胞杀伤率 = (实验组A值-效应细胞自发释放组A值-靶细胞自发释放组A值)/(靶细胞最大释放组A值-靶细胞自发释放组A值)×100%.
1.2.7 重组腺病毒对实验大鼠肝肾功能的影响: 采用酶法通过HITACHI-7150型自动生化分析仪测定各组动物血清门冬氨酸氨基转移酶(AST), 丙氨酸氨基转移酶(ALT)、尿素氮(BUN)以及肌酐(Cr)含量.
统计学处理 计量资料以mean±SD表示, 采用t检验与方差分析进行统计分析, 方差不齐采用秩和检验. 所有数据均采用SPSS11.0统计软件进行分析, P<0.05表示差异有统计学意义.
治疗后第4、6、8周, Ad5-pCEA-Hsp70组肿瘤体积为分别为724.4 mm3±81.6 mm3、681.3 mm3±64.9 mm3、648.0 mm3±65.9 mm3, 分别与Ad5-control组(901.3 mm3±103.9 mm3、1270.6 mm3±131.6 mm3、1487.0 mm3±243.0 mm3)及PBS组(987.5 mm3±126.0 mm3、1 398.5 mm3±193.0 mm3、1 660.0 mm3±167.0 mm3)相比, 差异均具有统计学意义(P<0.01). 而Ad5-control组与PBS组相比, 各个不同时间点均无统计学差异(图1).
Ad5-pCEA-Hsp70组动物外周血Hsp70蛋白含量为5 718.4±1 076.3 ng/L, 与Ad5-control组(1 034.8 ng/L±154.1 ng/L)及PBS组(875.6 ng/L±174.4 ng/L)相比, 差异具有统计学意义(P<0.01). Ad5-pCEA-Hsp70组动物外周血血清细胞因子INF-g、TNF-a、IL-6的含量分别为193.9 ng/L±8.0 ng/L、534.8 ng/L±82.71 ng/L、2 195.8 ng/L±414.4 ng/L, 分别与Ad5-control组(139.0±16.4、220.8±28.1、452.8±81.8) ng/L及PBS组(144.3±24.6、192.5±39.5、382.3±54.9) ng/L相比, 差异具有统计学意义(P<0.01, 图2).
Ad5-pCEA-Hsp70组可见有较多细胞坏死和淋巴细胞浸润, 而Ad5-control和PBS组仅见少量或未见明显坏死区和淋巴细胞浸润(图3).
Ad5-pCEA-Hsp70组CD83+细胞比例为10.8%±1.3%, 与Ad5-control组(5.1%±0.6%)及PBS组(4.8%±0.6%)相比, 差异具有统计学意义(P<0.01); 而Ad5-control组与PBS组相比, 则无统计学差异(图4).
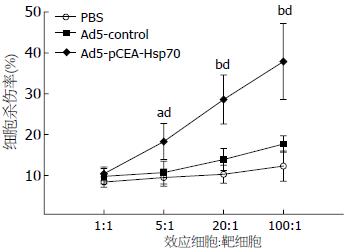
当效靶细胞比为1:1时, 3组动物之间并无统计学差异, 但随着效靶细胞比的增加, Ad5-pCEA-Hsp70组的杀伤能力较Ad5-control组和PBS组明显增加(P<0.05, P<0.01); 而Ad5-control和PBS组之间则无明显差别(图5).
肿瘤在发生发展过程中, 由于肿瘤细胞的异质性和基因多样性, 加上肿瘤抗原肽自身稳定性差、易降解和低免疫原性等特点, 常常逃避了机体免疫系统的识别, 导致免疫耐受. 如何增强肿瘤的免疫原性, 提高机体对肿瘤的免疫作用是目前的研究热点[14,15]. 研究表明, Hsp70不仅可作为抗原提呈的辅助分子参与肿瘤抗原肽的加工和处理, 增强肿瘤抗原的稳定性和免疫原性, 而且可作为抗原呈递分子直接将肿瘤抗原肽递呈给T细胞, 特别是细胞毒性T细胞, 从而激发机体的抗肿瘤特异性免疫反应[16-18]. 我们的研究也发现, 经重组的腺病毒Ad5-pCEA-Hsp70治疗后, 可对大鼠胰腺癌移植瘤的生长产生明显的抑制作用; 与PBS以及对照病毒相比, 治疗组大鼠的脾淋巴细胞具有更强的CTL活性, 移植瘤内有较多的淋巴细胞浸润, 表明Hsp70在诱导T细胞对肿瘤细胞的杀伤过程中起着重要的作用.
根据细胞因子产生的不同和生物学功能的不同, 可将Th细胞主要分为Th1和Th2两大类, Th1细胞产生IFN-g、TNF-b和IL-2, 参与细胞介导的免疫反应; 而Th2细胞产生IL-4、IL-5、IL-10和IL-13, 参与体液介导的免疫反应. 机体的抗肿瘤效应, 主要依靠Th1类细胞因子的作用. 肿瘤患者体内Th2类细胞因子多处于优势状态, 易产生免疫耐受, 成为肿瘤逃避免疫攻击的机制之一. 因此, Th1/Th2类型细胞因子之间的漂移对肿瘤免疫具有重要的影响[19-21]. Todryk等[22]研究发现, Hsp70表达可以使T细胞、巨噬细胞及树突状细胞(dendritic cells, DC)浸润肿瘤组织, 诱导Th1细胞产生细胞因IFN-g、TNF-a、和IL-12, 进而加强了T细胞介导的肿瘤免疫. 动物实验已证明, 肿瘤来源的Hsp70对荷瘤小鼠Th1型细胞因子有明确的诱升作用, 进而诱导机体产生并维持有效的抗肿瘤免疫效应[23]. 我们的研究也表明, 重组腺病毒Ad5-pCEA-Hsp70可增加荷瘤大鼠体内IFN-g、TNF-a的含量, 抑制大鼠皮下抑制瘤的生长.
DC是目前已知人体内功能最强的抗原递呈细胞(APC), 参与抗原识别、加工处理和提呈. 近年来, 越来越多的证据表明, 由DC激活的细胞免疫, 尤其是CTL介导的免疫反应, 在机体抵御恶性肿瘤中发挥着十分重要的作用[24-26]. 研究表明, CD83是成熟DC所特有膜标志分子[27]. Rouard等[28]发现, 在DC培养早期不表达CD83分子, 只有当DC分化成熟时才表达CD83分子, 此时激活T细胞功能最强. 由于肿瘤患者成熟DC的低水平表达, 从而不能进行有效的抗原提呈, 致使T细胞处于无能状态, 导致机体的免疫系统不能将肿瘤细胞清除, 是肿瘤免疫耐受原因之一[29]. 我们的研究发现, 应用重组腺病毒Ad5-pCEA-Hsp70治疗后, 荷瘤大鼠在Hsp70分泌增加的同时, 脾细胞CD83分子表达增加, 表明Hsp70在诱导DC成熟过程中发挥着重要的作用. Kuppner等[30]发现, 重组的Hsp70可刺激DC的成熟, 增加CD40、CD86、CD83等分子的表达, 增强DC激活抗原特异性T淋巴细胞的能力, 而重组的HSC70却不能诱导DCs表型的改变以及功能的增强. Chen等[31]发现, 热处理肿瘤细胞所产生的Hsp70, 通过与DC表面的TLR4受体结合后, 可促进DC的成熟与趋化至肿瘤细胞, 并可刺激IL-2、IFN-g、TNF-a等细胞因子的分泌.
通过本研究我们发现, 以腺病毒介导Hsp70基因靶向表达, 可对大鼠皮下胰腺癌移植瘤的生长产生明确的抑制作用, 其机制与促进T淋巴细胞浸润、DC的成熟以及IFN-g、TNF-a等细胞因子的分泌有关. 通过对肝肾功能检测, 我们未发现重组腺病毒有明显的毒副反应, 表明重组腺病毒Ad5-pCEA-Hsp70是一种具有良好抑瘤作用的肿瘤疫苗. 但关于Hsp70诱导机体抗肿瘤免疫的确切机制尚有待于进一步明确; 很多宿主体内存在抗腺病毒抗体, 可以中和或清除腺病毒, 降低疗效. 如何进一步解决上述问题, 提高Ad5-pCEA-Hsp70腺病毒对肿瘤的疗效和安全性, 将是我们今后研究的主要方向.
近年来, 随着肿瘤免疫学和分子生物学的发展, 针对胰腺癌分子水平的生物治疗技术取得了快速的发展, 为胰腺癌的治疗提供了更新的理论基础和实践工具. 由于Hsp70能同时激活机体特异性免疫应答和固有免疫应答, 在抗肿瘤免疫中发挥重要作用, 因此以Hsp70为基础的肿瘤疫苗受到了学者的广泛关注.
周国雄, 主任医师, 南通大学附属医院消化内科
随着DNA重组技术的应用和对Hsp70基因的深入研究, 使人类在基因水平构建以Hsp70为基础的肿瘤疫苗成为现实. 但如何控制Hsp70基因治疗的安全性、降低其对正常细胞的不良反应, 是目前人们关心的主要问题.
Ren等通过溶瘤性腺病毒将Hsp70基因导入到肿瘤细胞, 在溶瘤性腺病毒裂解肿瘤细胞的同时, 释放Hsp70, 激发肿瘤特异性的CTL反应.
本研究以腺病毒为载体, 采用CEA基因启动子控制Hsp70基因, 可以达到靶向胰腺癌特异性的表达Hsp70, 从而发挥抗肿瘤免疫反应, 抑制胰腺癌移植瘤的生长, 并减轻对其他正常细胞的影响.
本研究表明, 以腺病毒介导Hsp70基因靶向表达, 可对大鼠皮下胰腺癌移植瘤的生长产生明显的抑制作用, 且对肝肾功能无明显的影响, 为该肿瘤疫苗的临床转化应用提供了理论基础和实验依据.
本研究选题较新颖, 设计合理, 结论明确, 具有一定的科学意义, 为其他相似研究提供了参考与借鉴.
编辑: 张姗姗 电编:何基才
| 1. | Tempero MA, Berlin J, Ducreux M, Haller D, Harper P, Khayat D, Schmoll HJ, Sobrero A, Van Cutsem E. Pancreatic cancer treatment and research: an international expert panel discussion. Ann Oncol. 2011;22:1500-1506. [PubMed] [DOI] |
| 2. | Liu SH, Smyth-Templeton N, Davis AR, Davis EA, Ballian N, Li M, Liu H, Fisher W, Brunicardi FC. Multiple treatment cycles of liposome-encapsulated adenoviral RIP-TK gene therapy effectively ablate human pancreatic cancer cells in SCID mice. Surgery. 2011;149:484-495. [PubMed] [DOI] |
| 3. | Xu J, Jin C, Hao S, Luo G, Fu D. Pancreatic cancer: gene therapy approaches and gene delivery systems. Expert Opin Biol Ther. 2010;10:73-88. [PubMed] [DOI] |
| 4. | Ueda G, Tamura Y, Hirai I, Kamiguchi K, Ichimiya S, Torigoe T, Hiratsuka H, Sunakawa H, Sato N. Tumor-derived heat shock protein 70-pulsed dendritic cells elicit tumor-specific cytotoxic T lymphocytes (CTLs) and tumor immunity. Cancer Sci. 2004;95:248-253. [PubMed] [DOI] |
| 5. | Chan T, Chen Z, Hao S, Xu S, Yuan J, Saxena A, Qureshi M, Zheng C, Xiang J. Enhanced T-cell immunity induced by dendritic cells with phagocytosis of heat shock protein 70 gene-transfected tumor cells in early phase of apoptosis. Cancer Gene Ther. 2007;14:409-420. [PubMed] [DOI] |
| 6. | Bolhassani A, Rafati S. Heat-shock proteins as powerful weapons in vaccine development. Expert Rev Vaccines. 2008;7:1185-1199. [PubMed] [DOI] |
| 7. | Ren Z, Ye X, Fang C, Lu Q, Zhao Y, Liu F, Liang M, Hu F, Chen HZ. Intratumor injection of oncolytic adenovirus expressing HSP70 prolonged survival in melanoma B16 bearing mice by enhanced immune response. Cancer Biol Ther. 2008;7:191-195. [PubMed] [DOI] |
| 8. | Li JL, Liu HL, Zhang XR, Xu JP, Hu WK, Liang M, Chen SY, Hu F, Chu DT. A phase I trial of intratumoral administration of recombinant oncolytic adenovirus overexpressing HSP70 in advanced solid tumor patients. Gene Ther. 2009;16:376-382. [PubMed] [DOI] |
| 9. | Di Paolo NC, Tuve S, Ni S, Hellström KE, Hellström I, Lieber A. Effect of adenovirus-mediated heat shock protein expression and oncolysis in combination with low-dose cyclophosphamide treatment on antitumor immune responses. Cancer Res. 2006;66:960-969. [PubMed] [DOI] |
| 10. | Tassi E, Gavazzi F, Albarello L, Senyukov V, Longhi R, Dellabona P, Doglioni C, Braga M, Di Carlo V, Protti MP. Carcinoembryonic antigen-specific but not antiviral CD4+ T cell immunity is impaired in pancreatic carcinoma patients. J Immunol. 2008;181:6595-6603. [PubMed] |
| 11. | Naito Y, Okabe Y, Nagayama M, Nishinakagawa T, Taira T, Kawahara A, Hattori S, Machida K, Ishida Y, Kaji R. Accuracy of differential diagnosis for pancreatic cancer is improved in the combination of RCAS1 and CEA measurements and cytology in pancreatic juice. Med Mol Morphol. 2011;44:86-92. [PubMed] [DOI] |
| 12. | 孙 运良, 徐 灿, 苏 长青, 高 军, 金 晶, 吴 红玉, 李 兆申. CEA启动子驱动下表达Hsp70基因的重组腺病毒的构建及鉴定. 中华胰腺病杂志. 2011;11:251-254. |
| 13. | Liu Y, Ye T, Sun D, Maynard J, Deisseroth A. Tumor-specific therapeutic effect induced by an oncolytic adenoviral vector containing heat shock protein 70 and prodrug activation genes. Gene Ther. 2006;13:1235-1243. [PubMed] [DOI] |
| 14. | Jochems C, Schlom J. Tumor-infiltrating immune cells and prognosis: the potential link between conventional cancer therapy and immunity. Exp Biol Med (Maywood). 2011;236:567-579. [PubMed] [DOI] |
| 15. | Twitty CG, Jensen SM, Hu HM, Fox BA. Tumor-derived autophagosome vaccine: induction of cross-protective immune responses against short-lived proteins through a p62-dependent mechanism. Clin Cancer Res. 2011;17:6467-6481. [PubMed] [DOI] |
| 16. | Mambula SS, Calderwood SK. Heat shock protein 70 is secreted from tumor cells by a nonclassical pathway involving lysosomal endosomes. J Immunol. 2006;177:7849-7857. [PubMed] |
| 17. | Figueiredo C, Wittmann M, Wang D, Dressel R, Seltsam A, Blasczyk R, Eiz-Vesper B. Heat shock protein 70 (HSP70) induces cytotoxicity of T-helper cells. Blood. 2009;113:3008-3016. [PubMed] [DOI] |
| 18. | Harmala LA, Ingulli EG, Curtsinger JM, Lucido MM, Schmidt CS, Weigel BJ, Blazar BR, Mescher MF, Pennell CA. The adjuvant effects of Mycobacterium tuberculosis heat shock protein 70 result from the rapid and prolonged activation of antigen-specific CD8+ T cells in vivo. J Immunol. 2002;169:5622-5629. [PubMed] |
| 19. | Agaugué S, Carosella ED, Rouas-Freiss N. Role of HLA-G in tumor escape through expansion of myeloid-derived suppressor cells and cytokinic balance in favor of Th2 versus Th1/Th17. Blood. 2011;117:7021-7031. [PubMed] [DOI] |
| 20. | Godin-Ethier J, Pelletier S, Hanafi LA, Gannon PO, Forget MA, Routy JP, Boulassel MR, Krzemien U, Tanguay S, Lattouf JB. Human activated T lymphocytes modulate IDO expression in tumors through Th1/Th2 balance. J Immunol. 2009;183:7752-7760. [PubMed] [DOI] |
| 21. | Tosolini M, Kirilovsky A, Mlecnik B, Fredriksen T, Mauger S, Bindea G, Berger A, Bruneval P, Fridman WH, Pagès F. Clinical impact of different classes of infiltrating T cytotoxic and helper cells (Th1, th2, treg, th17) in patients with colorectal cancer. Cancer Res. 2011;71:1263-1271. [PubMed] [DOI] |
| 22. | Todryk S, Melcher AA, Hardwick N, Linardakis E, Bateman A, Colombo MP, Stoppacciaro A, Vile RG. Heat shock protein 70 induced during tumor cell killing induces Th1 cytokines and targets immature dendritic cell precursors to enhance antigen uptake. J Immunol. 1999;163:1398-1408. [PubMed] |
| 23. | Wan T, Zhou X, Chen G, An H, Chen T, Zhang W, Liu S, Jiang Y, Yang F, Wu Y. Novel heat shock protein Hsp70L1 activates dendritic cells and acts as a Th1 polarizing adjuvant. Blood. 2004;103:1747-1754. [PubMed] [DOI] |
| 24. | Karim R, Jordanova ES, Piersma SJ, Kenter GG, Chen L, Boer JM, Melief CJ, van der Burg SH. Tumor-expressed B7-H1 and B7-DC in relation to PD-1+ T-cell infiltration and survival of patients with cervical carcinoma. Clin Cancer Res. 2009;15:6341-6347. [PubMed] [DOI] |
| 25. | Gholamin M, Moaven O, Farshchian M, Mahmoudi M, Sankian M, Memar B, Forghani MN, Malekzadeh R, Rajabi-Mashhadi MT, Abbaszadegan MR. Induction of cytotoxic T lymphocytes primed with tumor RNA-loaded dendritic cells in esophageal squamous cell carcinoma: preliminary step for DC vaccine design. BMC Cancer. 2010;10:261. [PubMed] |
| 26. | Kim SG, Park MY, Kim CH, Sohn HJ, Kim HS, Park JS, Kim HJ, Oh ST, Kim TG. Modification of CEA with both CRT and TAT PTD induces potent anti-tumor immune responses in RNA-pulsed DC vaccination. Vaccine. 2008;26:6433-6440. [PubMed] [DOI] |
| 27. | Tsoumakidou M, Koutsopoulos AV, Tzanakis N, Dambaki K, Tzortzaki E, Zakynthinos S, Jeffery PK, Siafakas NM. Decreased small airway and alveolar CD83+ dendritic cells in COPD. Chest. 2009;136:726-733. [PubMed] [DOI] |
| 28. | Rouard H, Léon A, Klonjkowski B, Marquet J, Tennezé L, Plonquet A, Agrawal SG, Abastado JP, Eloit M, Farcet JP. Adenoviral transduction of human 'clinical grade' immature dendritic cells enhances costimulatory molecule expression and T-cell stimulatory capacity. J Immunol Methods. 2000;241:69-81. [PubMed] [DOI] |
| 29. | Yilmaz T, Gedikoglu G, Celik A, Onerci M, Turan E. Prognostic significance of Langerhans cell infiltration in cancer of the larynx. Otolaryngol Head Neck Surg. 2005;132:309-316. [PubMed] [DOI] |
| 30. | Kuppner MC, Gastpar R, Gelwer S, Nössner E, Ochmann O, Scharner A, Issels RD. The role of heat shock protein (hsp70) in dendritic cell maturation: hsp70 induces the maturation of immature dendritic cells but reduces DC differentiation from monocyte precursors. Eur J Immunol. 2001;31:1602-1609. [PubMed] [DOI] |