修回日期: 2011-02-10
接受日期: 2011-02-15
在线出版日期: 2011-03-28
目的: 通过Meta分析方法评价蛋白激酶Cθ对胃肠道间质瘤的诊断价值.
方法: 检索Pubmed数据库、万方数据库、维普数据库、CBM以及CNKI数据库, 搜集1998-2010年国内外公开发表的以病理诊断结果为金标准的关于蛋白激酶Cθ诊断胃肠道间质瘤的英文、中文文献, 按照Meta分析的要求和诊断试验公认的质量标准对所有的纳入研究进行质量评估. 采用Meta-disc1.4软件进行数据分析, 得到合并的诊断敏感度和特异度、合并的阳性和阴性似然比以及合并的比数比, 并绘制接受者工作特征(SROC)曲线.
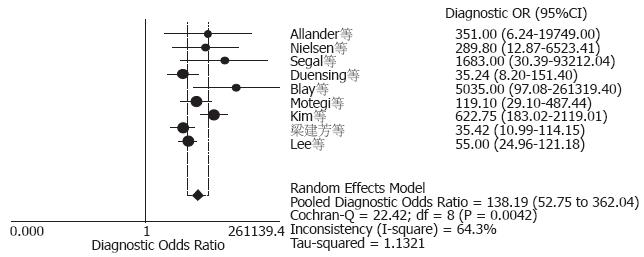
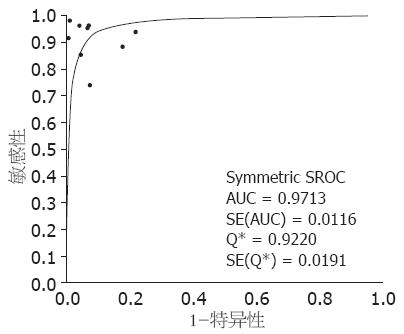
结果: 共纳入9篇(2001-2008年)国内外有关蛋白激酶Cθ诊断胃肠道间质瘤的文献, 涉及研究对象1 141例. 9篇文献研究结果存在异质性(P = 0.0042, I2 = 64.3%). 利用随机效应模型合并的诊断敏感度和特异度分别为93%(95%CI: 91%-95%)、93%(95%CI: 91%-95%), 合并阳性似然比为12.47(95%CI: 6.30-24.70), 合并阴性似然比为0.10(95%CI: 0.05-0.17), 合并比数比为138.19(95%CI: 52.75-362.04), 加权SROC面积为0.9713(SE = 0.0116).
结论: 蛋白激酶Cθ可作为敏感度以及特异度均高的标记物用于胃肠道间质瘤的诊断.
引文著录: 杨颖, 刘潇, 叶余丰, 王孟春. 蛋白激酶Cθ对胃肠道间质瘤的诊断价值. 世界华人消化杂志 2011; 19(9): 950-955
Revised: February 10, 2011
Accepted: February 15, 2011
Published online: March 28, 2011
AIM: To perform a meta-analysis to assess the value of protein kinase C theta in the diagnosis of gastrointestinal stromal tumors.
METHODS: English or Chinese papers published from 1998 to 2010, which evaluated the diagnostic value of protein kinase C theta for gastrointestinal stromal tumors using pathologic diagnosis as the gold standard, were identified by searching Pubmed, Embase, Wanfang data, VIP, CBM and CNKI. The quality of included studies was assessed using the QUADAS tool. Meta-disc 1.4 software was used to extract data and to calculate the overall sensitivity, specificity, positive likelihood ratio, negative likelihood ratio, and diagnostic odds ratio. The summary receiver operating characteristic (SROC) curve was plotted.
RESULTS: Nine studies involving 1 141 patients were included in the meta-analysis. The results for the nine studies were inconsistent (P = 0.0042, I2 = 64.3%). The overall sensitivity, specificity, positive likelihood ratio, negative likelihood ratio, and diagnostic odds ratio were 93% (95%CI: 91%-95%), 93% (95%CI: 91%-95%), 12.47 (95%CI: 6.30-24.70), 0.10 (95%CI: 0.05-0.17) and 138.19 (95%CI: 52.75-362.04), respectively. The weighted area under the ROC curve (AUC) was 0.9713 (SE = 0.0116).
CONCLUSION: Protein kinase C theta has a high value in the diagnosis of gastrointestinal stromal tumors.
- Citation: Yang Y, Liu X, Ye YF, Wang MC. Diagnostic value of protein kinase C theta for gastrointestinal stromal tumors: a meta-analysis. Shijie Huaren Xiaohua Zazhi 2011; 19(9): 950-955
- URL: https://www.wjgnet.com/1009-3079/full/v19/i9/950.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i9.950
胃肠道间质瘤(gastrointestinal stromal tumors, GISTs)是一组独立起源于胃肠道间质干细胞的肿瘤, 属于消化系间叶性肿瘤, 1983年由Mazur和Clark根据肿瘤的分化特征首次提出[1]. 目前GISTs的确诊主要依据病理表现和免疫组织化学检测, 其中免疫组织化学染色CD117多呈阳性, 对其诊断十分有意义, 但大约有5%组织形态学可疑的病例CD117呈阴性[2]. 蛋白激酶Cθ是一种新型的钙离子非依赖型丝氨酸/苏氨酸激酶, 近几年研究发现其在GISTs中存在表达, 但关于蛋白激酶Cθ对此病的诊断价值, 各文献报道不尽相同. 本研究采用Meta分析方法对有关蛋白激酶Cθ诊断GISTs的文献进行系统、客观的综合评价, 为其临床应用提供最佳的循证证据.
以美国生物学数据库(Medline)、万方科技期刊全文数据库作为已发表的国外文献的主要来源, 检索词为"gastrointestinal stromal tumor"、"Protein Kinase C theta/PKC-theta"、"diagnosis"; 以中国期刊全文数据库(CNKI)、重庆维普(VIP)中文科技期刊全文数据库、万方科技期刊全文数据库作为已发表的国内文献的主要来源, 检索词为"胃肠道间质瘤"、"蛋白激酶Cθ/PKC-theta"、"诊断", 发表年限为1998-01/2010-10. 对所有检索到的文章, 通过查阅其参考文献扩展检索的范围. 研究对象限定为人类, 并排除综述、信件、评论、病例报告等类型的文章.
1.2.1 资料提取: 制定并严格按照纳入/排除标准筛选文献, 对检索搜集到的文献, 分别由两名评价者独立进行方法学质量评价和资料提取, 并进行交叉核对, 若遇到分歧则通过讨论解决.
1.2.2 文献纳入以及排除标准: 纳入标准: (1)采用蛋白激酶Cθ诊断GISTs的文献; (2)病例数≥15; (3)有病理诊断金标准结果的对比, 诊断明确; (4)文献的结果有四格表数据或经计算可获得四格表数据, 且均可获得全文, 发表文种仅限于英文以及中文. 排除标准: (1)完全不以病理组织学证据作为金标准; (2)文献类型属综述以及个案报道; (3)样本含量<15例; (4)各数据库中互相重复的文献; (5)无法提取四格表数据的文献.
1.2.3 文献的质量评价: 用诊断性试验准确性质量评价工具QUADAS(quality assessment of diagnostic accuracy studies)[3]评价文献质量以及发生偏倚的可能性, 每个项目按"是"、"否"、"不清楚"3个标准进行评价, 由两名评价员独立进行文献评价, 分歧通过讨论解决. 若14条质量评价标准均满足则研究存在偏倚的可能性极低(A级); 如果其中任何一条或多条质量评价标准仅部分满足即不清楚, 则该研究存在偏倚的可能性为中等(B级); 如果其中任何一条或多条质量评价标准完全不满足即未采用或不正确,则该研究存在高度偏倚的可能性(C级).
统计学处理 采用STATA11.0软件用metafunnel法绘制漏斗图评估发表偏倚. 将纳入研究的诊断四表格等数据录入到Meta-disc1.4软件中, 计算纳入文献合并的诊断敏感度和特异度、阳性和阴性似然比以及合并的比数比, 并进行综合受试者工作特征(summary receiver operating characteristic, SROC)曲线拟合分析, 获得SROC曲线下面积. 为避免原始数据为0时无法计算, 每项加0.5. Spearman相关分析检查有无阈值效应引起的异质性, 对其他异质性、敏感度和特异度采用卡方检验, 对阳性似然比和阴性似然比采用cochrane-Q检验. 用I2评估异质性大小, I2<25%则异质性较小, 25%≤I2≤50%则为中等度异质性, I2>50%则研究结果间存在高度异质性. 若不存在异质性, 采用固定效应模型, 反之则采用随机效应模型对准确性指标进行汇总处理, 所有结果均用95%CI表示. 检验水准α = 0.1. 同时Meta回归探讨异质性的来源, 按P值由大到小逐步筛选出影响异质性的最重要因素, 通过RDOR评估影响因素对试验精确性的影响, 去除异质性大的研究再次分析.
最初检索到相关文献325篇, 通过筛选, 排除综述、个案报道、重复、不相关以及研究目的与本系统评价不符的文献, 最终有9篇文献[4-12]符合纳入标准. 其中英文文献8篇, 中文文献1篇, 共涉及病例1 141例, 包含胃、肠、胃食管连接处、食管、肠系膜、后腹膜、阔韧带等来源的间质瘤682例及作为对照的消化系来源的平滑肌瘤、平滑肌肉瘤、神经鞘瘤、恶性神经鞘瘤等和其他部位来源的胸腺瘤、精原细胞瘤、肾透明细胞癌、恶性黑色素瘤等459例. 发表时间为2001-2008年, 3项研究在美国完成, 2项研究在韩国完成, 中国、日本、西班牙、加拿大各有1项研究(表1).
9篇纳入研究文献均为回顾性研究, 按文献质量评价标准进行评价, 评分为A级5篇[7,9-12], B级3篇[5,6,8], C级1篇[4]. 9项研究中8项[5-12]对各种易混淆疾病进行了对比分析, 1项研究[4]对照疾病覆盖范围不全; 所有研究均设立金标准(临床表现及病理学证据), 金标准均能够准确区分恶性以及良性; 所有研究采用的病理切片与金标准检查所用的病理切片不存在病情进展; 所有研究对象接受了金标准检查; 1项研究[11]采用了盲法, 其余均未报道. 所有研究均详细描述了蛋白激酶Cθ的检测方法, 但各研究间采用试剂和仪器均不相同(表2).
| 研究设计特征 | 文献编号 | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 研究对象是否代表实际操作中接受该检查的所有患者 | N | Y | Y | Y | Y | Y | Y | Y | Y |
| 研究对象的选择标准是否明确 | N | Y | Y | Y | Y | Y | Y | Y | Y |
| 诊断金标准能否帮助疾病分级 | NR | NR | NR | Y | NR | Y | Y | Y | Y |
| 诊断试验和诊断金标准检查之间是否间隔足够短的时间 | Y | Y | Y | Y | Y | Y | Y | Y | Y |
| 所有被纳入研究的样本是否均被诊断金标准证实 | Y | Y | Y | Y | Y | Y | Y | Y | Y |
| 不管诊断试验结果如何, 患者是否都是运用同样的诊断金标准 | Y | Y | Y | Y | Y | Y | Y | Y | Y |
| 诊断金标准试验、诊断试验是否为独立的试验 | Y | Y | Y | Y | Y | Y | Y | Y | Y |
| 诊断试验的操作是否有细节描述并可以重复 | Y | Y | Y | Y | Y | Y | Y | Y | Y |
| 诊断金标准的操作是否有完整的细节描述并可以重复 | Y | Y | Y | Y | Y | Y | Y | Y | Y |
| 诊断试验结果解释是否独立于诊断金标准 | Y | Y | Y | Y | Y | Y | Y | Y | Y |
| 诊断金标准结果解释是否独立于诊断试验 | Y | Y | Y | Y | Y | Y | Y | Y | Y |
| 得到诊断试验的结果时, 与之相对应的临床资料可不可得 | Y | Y | Y | Y | Y | Y | Y | Y | Y |
| 无法解释或介于中间的试验结果是否报道 | Y | Y | Y | Y | Y | Y | Y | Y | Y |
| 中途退出研究是否有明确解释 | Y | Y | Y | Y | Y | Y | Y | Y | Y |
| 文献质量 | C | B | B | A | B | A | A | A | A |
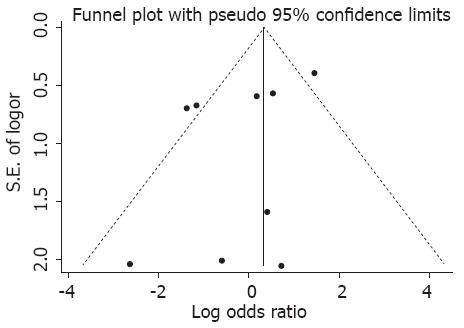
2.3.1 发表偏倚分析: 采用metafunnel法绘制漏斗图(图1)以估计发表偏倚, 可见图像对称性, 文献发表偏倚较小.
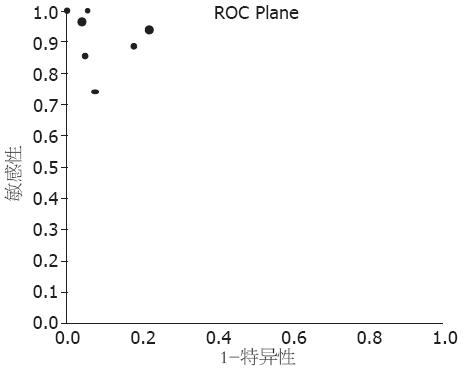
2.3.2 异质性分析: 首先检验是否存在阈值效应, 当存在阈值效应时, 敏感度与特异度呈阴性关联(与1-特异度呈阳性关联), 从而ROC平面散点分布呈典型的"肩臂形"样式, Spearman相关分析提示强阳性关联. 本研究中, Meta-disc1.4软件输出的ROC平面散点图并非典型的"肩臂形"外观(图2), 同时Spearman相关系数为-0.333(P = 0.381), 提示敏感度与1-特异度呈阴性关联, 不存在阈值效应. 对其他来源的异质性进行检验, 结果提示, 个研究之间敏感度(P = 0.0006, I2 = 71.0%)、特异度(P = 0.0000, I2 = 79.5%)、阳性似然比(cochrane-Q = 25.34, P = 0.0014, I2 = 68.4%)、阴性似然比(cochrane-Q = 24.93, P = 0.0016, I2 = 67.9%)、诊断比数比(diagnostic odds ratio, DOR)(cochrane-Q = 22.42, P = 0.0042, I2 = 64.3%)均存在高度异质性(图3). Meta回归分析发现异质性的来源与文献质量及入选文献的检测方法有关, 以文献质量分类的RDOR = 4.34(95%CI: 0.43-43.79, P = 0.1708). 按入选文献的检测方法不同分类的RDOR = 4.26(95%CI: 0.13-135.88, P = 0.3451).
2.3.3 Meta分析: 以Moses模型建立SROC直线回归模型: D = a+b×S, SROC曲线在(S, D)平面变成了一条直线, 以加权最小二乘法求得回归模型中的参数a、b. b与0差异无统计学意义(P = 0.5497), 提示SROC曲线是对称的, 拟合SROC曲线, 9项研究的加权SROC曲线下面积为0.9713, SE = 0.0116(图4). 由于异质性检验提示各研究之间存在高度异质性, 故Meta分析合并效应量时采用随机效应模型, 9个研究的合并敏感度为93%(CI: 91%-95%)、合并特异度为93%(CI: 91%-95%)、合并阳性似然比为12.47(CI: 6.30-24.70)、合并阴性似然比为0.10(CI: 0.05-0.17)、合并DOR为138.19(CI: 52.75-362.04).
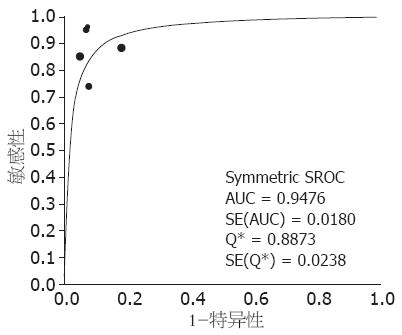
2.3.4 敏感性分析: Meta回归分析发现异质性的来源与文献质量有关, 剔除4篇精确性差的文献[6,8,10,12]后, 再次进行异质性检验, 剩余5项研究之间敏感度(P = 0.0418, I2 = 59.7%)存在较高异质性, 特异度(P = 0.2677, I2 = 23%)、阳性似然比(P = 0.3612, I2 = 8.0%)、阴性似然比(P = 0.2902, I2 = 19.6%)存在低度异质性, DOR无异质性(P = 0.4149, I2 = 0.00%). 5项研究的加权SROC曲线下面积为0.9476, SE = 0.0180(图5). 固定效应模型的合并敏感度为87%(CI: 0.81-0.92)、合并特异度为93%(CI: 0.88-0.96)、合并阳性似然比为9.37(CI: 5.52-15.89)、合并阴性似然比为0.17(CI: 0.11-0.26)、合并DOR为59.36(CI: 28.58-123.43).
单纯以文献质量为筛选标准的亚组分析并不能把异质性控制在理想水平, 说明异质性的来源有多种原因. 首先9项研究中3项研究对蛋白激酶Cθ进行了基因水平的检测, 其他研究则进行了免疫组织化学染色检测, 即存在检测方法不统一的情况; 其次, GISTs的诊断存在金标准判读的偏倚, 由此可能夸大诊断实验的特异度; 第三, 部分研究纳入的病例数较大, 所占权重也较大, 因此对异质性分析结果影响较大. 最后, 所有的研究都是回顾性的, 存在收集GISTs病例后再设置对照的情况, 可能未实现同步盲法而存在判读偏移. 本文纳入的9项研究中均有明确的诊断金标准, 研究对象包含了所有因胃肠道肿块而进行免疫组织化学或基因水平检测的病例, 仅1项研究[4]未包含各类易混淆的疾病. 8项研究[4-10,12]未明确报道是否采用了盲法, 可能同样存在诊断实验的判读偏倚.
目前多数学者认为GISTs起源于胃肠道间质干细胞-Cajal细胞(interstitial cells of Cajal, ICC), 大部分存在c-kit基因的突变, c-kit基因突变导致KIT酪氨酸激酶持续活化, KIT(CD117)过度表达[13], 是目前诊断GISTs的主要依据. 然而少数c-kit基因突变的病例KIT表达很弱甚至不表达, 还有一部分KIT阴性的GISTs因血小板起源生长因子受体基因突变所致[14,15]. 因此, 对于形态组织学可疑但KIT表达阴性的病例诊断较困难, 十分有必要寻找一种新的诊断标志物. 蛋白激酶Cθ是蛋白激酶C家族成员之一, 其活性受甘油二酯和磷脂调控, 是一个细胞周期蛋白, 最初仅发现在T淋巴细胞、骨骼肌细胞及血小板中表达. 近年, DNA微阵列技术证实蛋白激酶Cθ与KIT同时表达于豚鼠消化系的ICC[16], 并且在GISTs中高水平表达. Western blot也清晰地显示了在GISTs中存在与KIT表达无关的单个条带, 该条带位于蛋白激酶Cθ分子量所在位置[14,17]. 因此, 蛋白激酶Cθ可能作为一种新的标志物用于GISTs的诊断, 尤其适用于KIT表达为阴性的病例. 本研究共搜索到9篇符合纳入标准的相关文献, 质量水平中等, 采用诊断实验专用软件Meta-disc1.4软件计算合并的敏感度和特异度等, 并绘制蛋白激酶Cθ诊断GISTs的SROC曲线, 对蛋白激酶Cθ诊断GISTs有一个较客观而准确的评价. 结果显示蛋白激酶Cθ在诊断GISTs方面具有较好的敏感度93%(95%CI: 91%-95%)及特异度93%(95%CI: 91%-95%), SROC曲线下面积为0.9713. Meta回归分析发现异质性的来源与文献质量有关, 在去除精确性差的4项研究后, 得到的合并敏感度及特异度分别为87%(95%CI: 81%-92%)、93%(95%CI: 88%-96%), 与9项研究的合并效应无统计学差异. 因此, 蛋白激酶Cθ可作为敏感度以及特异度均高的标志物用于GISTs的诊断.
胃肠道间质瘤是消化系常见的间叶源性肿瘤, c-kit原癌基因和血小板起源生长因子受体(PDGFRA)基因突变是其发生的关键因素. 目前确诊主要依据病理表现和免疫组织化学检测, 其中免疫组织化学染色CD117多呈阳性, 但对于形态组织学可疑CD117表达阴性的病例诊断却较困难, 需要寻找一种新的诊断标志物. 近几年研究发现蛋白激酶Cθ在胃肠道间质瘤中高水平表达, 可能作为一种新的标志物用于胃肠道间质瘤的诊断, 尤其适用于CD117表达为阴性的病例.
崔莲花, 副教授, 青岛大学医学院公共卫生系
Blay等证实蛋白激酶Cθ在胃肠道间质瘤中高表达, 但在其他间叶组织肿瘤中则不表达, 包括KIT阳性的肿瘤.
本文通过Meta分析, 系统、客观、科学地评价了蛋白激酶Cθ对胃肠道间质瘤的诊断价值, 为其临床应用提供最佳的循证证据.
本文内容丰富, 为胃肠道间质瘤的诊断提供依据.
编辑: 李薇 电编:何基才
| 1. | Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol. 1983;7:507-519. [PubMed] [DOI] |
| 3. | Whiting P, Rutjes AW, Reitsma JB, Bossuyt PM, Kleijnen J. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC Med Res Methodol. 2003;3:25. [PubMed] [DOI] |
| 4. | Allander SV, Nupponen NN, Ringnér M, Hostetter G, Maher GW, Goldberger N, Chen Y, Carpten J, Elkahloun AG, Meltzer PS. Gastrointestinal stromal tumors with KIT mutations exhibit a remarkably homogeneous gene expression profile. Cancer Res. 2001;61:8624-8628. [PubMed] |
| 5. | Nielsen TO, West RB, Linn SC, Alter O, Knowling MA, O'Connell JX, Zhu S, Fero M, Sherlock G, Pollack JR. Molecular characterisation of soft tissue tumours: a gene expression study. Lancet. 2002;359:1301-1307. [PubMed] [DOI] |
| 6. | Segal NH, Pavlidis P, Noble WS, Antonescu CR, Viale A, Wesley UV, Busam K, Gallardo H, DeSantis D, Brennan MF. Classification of clear-cell sarcoma as a subtype of melanoma by genomic profiling. J Clin Oncol. 2003;21:1775-1781. [PubMed] [DOI] |
| 7. | Duensing A, Joseph NE, Medeiros F, Smith F, Hornick JL, Heinrich MC, Corless CL, Demetri GD, Fletcher CD, Fletcher JA. Protein Kinase C theta (PKCtheta) expression and constitutive activation in gastrointestinal stromal tumors (GISTs). Cancer Res. 2004;64:5127-5131. [PubMed] [DOI] |
| 8. | Blay P, Astudillo A, Buesa JM, Campo E, Abad M, García-García J, Miquel R, Marco V, Sierra M, Losa R. Protein kinase C theta is highly expressed in gastrointestinal stromal tumors but not in other mesenchymal neoplasias. Clin Cancer Res. 2004;10:4089-4095. [PubMed] [DOI] |
| 9. | Motegi A, Sakurai S, Nakayama H, Sano T, Oyama T, Nakajima T. PKC theta, a novel immunohistochemical marker for gastrointestinal stromal tumors (GIST), especially useful for identifying KIT-negative tumors. Pathol Int. 2005;55:106-112. [PubMed] [DOI] |
| 10. | Kim KM, Kang DW, Moon WS, Park JB, Park CK, Sohn JH, Jeong JS, Cho MY, Jin SY, Choi JS. PKCtheta expression in gastrointestinal stromal tumor. Mod Pathol. 2006;19:1480-1486. [PubMed] |
| 12. | Lee HE, Kim MA, Lee HS, Lee BL, Kim WH. Characteristics of KIT-negative gastrointestinal stromal tumours and diagnostic utility of protein kinase C theta immunostaining. J Clin Pathol. 2008;61:722-729. [PubMed] [DOI] |
| 13. | Rubin BP, Singer S, Tsao C, Duensing A, Lux ML, Ruiz R, Hibbard MK, Chen CJ, Xiao S, Tuveson DA. KIT activation is a ubiquitous feature of gastrointestinal stromal tumors. Cancer Res. 2001;61:8118-8121. [PubMed] |
| 14. | Heinrich MC, Corless CL, Duensing A, McGreevey L, Chen CJ, Joseph N, Singer S, Griffith DJ, Haley A, Town A. PDGFRA activating mutations in gastrointestinal stromal tumors. Science. 2003;299:708-710. [PubMed] [DOI] |
| 15. | Hirota S, Ohashi A, Nishida T, Isozaki K, Kinoshita K, Shinomura Y, Kitamura Y. Gain-of-function mutations of platelet-derived growth factor receptor alpha gene in gastrointestinal stromal tumors. Gastroenterology. 2003;125:660-667. [PubMed] [DOI] |
| 16. | Poole DP, Van Nguyen T, Kawai M, Furness JB. Protein kinases expressed by interstitial cells of Cajal. Histochem Cell Biol. 2004;121:21-30. [PubMed] [DOI] |