修回日期: 2011-01-26
接受日期: 2011-02-15
在线出版日期: 2011-03-28
来自骨髓的造血干细胞具有干细胞的多向分化的潜能. 近年来有研究表明, 在特定微环境下, 造血干细胞能诱导分化成肝细胞, 也有研究对此表示争议. 本文对造血干细胞是否能有效诱导分化成肝细胞作简要综述.
引文著录: 盛瑜, 韩国庆. 造血干细胞分化成肝细胞的可能性. 世界华人消化杂志 2011; 19(9): 925-929
Revised: January 26, 2011
Accepted: February 15, 2011
Published online: March 28, 2011
Bone marrow-derived hematopoietic stem cells have the potential to undergo multilineage differentiation. Recent studies have shown that, in a given microenvironment, hematopoietic stem cells can differentiate into liver cells. However, some researchers hold a dissenting view. This review discusses the possibility of differentiation of hematopoietic stem cells into liver cells.
- Citation: Sheng Y, Han GQ. Possibility of differentiation of hematopoietic stem cells into liver cells. Shijie Huaren Xiaohua Zazhi 2011; 19(9): 925-929
- URL: https://www.wjgnet.com/1009-3079/full/v19/i9/925.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i9.925
造血干细胞早在200多年前就已被提出, 来自骨髓的造血干细胞在整个生命过程中不断产生血细胞, 并且具有干细胞的自我更新和多向分化的潜能, 近年研究表明, 造血干细胞在特定环境下, 能向肝细胞分化, 形成造血干细胞源性肝细胞(hematopoietic stem cells-derived hepatocytes, HSCDH). 对于这一研究的可能性, 我们提出了几个质疑的问题: (1)造血干细胞能分化成肝细胞吗? (2)如果能, 那么在生理状态下或是肝细胞损伤的病理情况下HSCDH是否能替代受试者的肝细胞? (3)造血干细胞中哪类细胞能诱导分化成肝细胞? (4)产生的机制是什么? (5)造血干细胞在肝内除了直接分化成肝细胞, 对肝细胞的恢复还有其他作用机制吗?
在哺乳动物早期的胚胎发育过程中肝组织和造血组织保持着密切的联系. 造血干细胞先从卵黄囊或/和胚胎的主动脉-性腺-中肾区域迁移出后, 主要在胚胎肝中形成血细胞[1]. 随后, 前肠内胚层出现内胚层前体细胞, 在胎肝中分化成肝细胞和胆管细胞[2]. 在胎肝中, 胚胎肝上皮细胞和肝内造血干细胞通过特异的细胞因子和生长因子的作用, 相互促进彼此的细胞分化[3]. 虽然胎肝上皮细胞和造血祖细胞共同表达一些相同的基因, 但是两者共同起源的干细胞在胎肝中并没有确定[4,5].
目前对于造血干细胞能否分化成肝细胞, 研究最多的实验模型是用异体骨髓(含造血干细胞)植入受到致命性辐射的小鼠体内的实验, 检测在失去造血细胞系统的小鼠体内异体造血干细胞如何重建造血系统, 是否存在分化成肝细胞的可能. 分析了Lagasse等用标准的实验模型所做的28个实验[6-32], 有80%以上的实验检测到的HSCDH产量小于受试者肝细胞总量的0.05%, 而只有6%的实验产量超过1.5%. 当采用抑制受试者自身内源性肝细胞增殖的实验方法后, 50%的实验中HSCDH的产量多于受者肝细胞总量的1.5%, 而只有35%的产量>0.05%. 分析造成HSCDH产量高的实验结果的可能有: 移植后肝细胞扩增程度的差别, 在体外培养的造血干细胞基因重塑以及对HSCDH的测定不严密等原因. 总的实验结果分析表明, 移植的造血干细胞产生肝样细胞的可能性很低(≤10-4).
很少有人研究造血干细胞的移植水平与移植后HSCDH的增殖水平对肝细胞产的影响. Wang等[25]和Camargo等[26]用小鼠建立骨髓移植后再生肝细胞力学模型, 将小鼠经过NTBC处理, 阻止有肝毒性的延胡索二酰乙酰的形成, 在延胡索二酰乙酰阴性的小鼠肝脏中, 检测到移植后产生的HSCDH的量只占宿主肝细胞的10-4到10-6, 说明移植(1-2)×106个骨髓细胞, 会产生50到500个HSCDH. 因此, 只有0.0025%-0.025%的移植细胞发生分化, 仅为受试者肝细胞总量的0.01%到0.0001%. 相似的移植水平在其他研究中也出现过[27-29].
在上述实验中, 对Fah-/-小鼠去除保护肝细胞的NTBC因素的处理后, 内源性肝细胞被杀死, 而移植的造血干细胞增殖分化获得HSCDH, 并且HSCDH很少受到处理因素的影响, 50-500个HSCDH快速增殖, 产生一系列的HSCDH, 占整个肝脏细胞的30%. 在Jang等[30]和Yannaki等[31]的两个实验中, 用CCl4造成肝脏的损伤的模型, 发现移植骨髓造血干细胞后也出现增殖的情况. 但是, 在大多数的研究中骨髓移植的细胞增殖很少见. 在正常生理条件下的成体肝脏中, 移植骨髓出现肝细胞增殖的情况更是少见. 甚至在70%的肝损伤(等价于像CCl4引起的肝细胞损失), 只能诱导剩余的肝细胞不到2个分裂周期的循环. 这些研究说明移植造血干细胞的不同增殖水平, 是HSCDH产量的一个主要变化因素.
Jang等[30]、Terai等[32]、Yamamoto等[33]的3个实验中, 在未接受辐射的小鼠体内, 发现移植造血干细胞产生肝细胞的产量多于受者肝细胞总量的1.5%. 在移植异体的Fra25Lin-"home recovered"(将分离的骨髓造血干细胞通过表面抗原的表达、沉淀、标记在动物体内移植恢复其功能)骨髓入未受辐射的小鼠体内, 2 d后HSCDH的产量为肝细胞总量的2%-7%, 但是独立使用这一方法并没有获得此种结果. 在另一些实验研究中, 将异体的骨髓或是Liv8-的骨髓细胞直接输送到CCl4造成的肝损害小鼠的静脉血管内, 检测到>12%的肝细胞来自于移植的造血干细胞, 但是Narindrasorasak等[34]使用同样的设计, 却没有得到此种结果. 所以这个问题需要进一步的研究.
Gupta等[35]在胆汁淤积的小鼠模型中, 将来自骨髓的β2M-Thy1+造血干细胞与肝细胞共同培养(被一层半透膜隔开), 检测到骨髓造血干细胞能分化出几种细胞, 有多功能的成体祖细胞、巨噬细胞集落刺激因子的作用下产生的巨噬细胞, 来自胎儿骨髓的Flk+CD31-CD34+细胞[36], 以及自由的体细胞等. 然而肝细胞未能检测到. 但是, 有实验表明, 如果延长骨髓造血干细胞在体外的培养时间会发生细胞核基因重塑, 从而导致产生的细胞系更具可塑性(可塑性指细胞从一种组织完全转变成另一种, 失去原来组织的特异性表面标记和功能, 获得新的组织的相关标记和功能), 也许能获得较多量的肝细胞, 这一问题有待进一步研究.
最近研究结果表明, 在成年动物生理以及大部分病理的情况下, 造血干细胞对肝细胞的替换的作用是微乎其微的[37,38]. 成年鼠肝细胞的生理更新周期大约是400 d[21], 每天的更新的数量大约是肝细胞总量的0.25%. 然而众多研究表明HSCDH产量仅是肝细胞总量的10-4-10-5, 产量太低而不能代替受试者肝细胞的损失量, 不能满足受试者肝脏的生理更新.
当受试者自身内源性肝细胞因创伤或疾病导致大量损失时, 如Fah-/-的小鼠接受Fah+/+骨髓移植细胞后, 发现HSCDH快速选择性扩增替代肝细胞. 有学者认为这种快速选择性的扩增是可能发生的, 但是这种选择优势是由致命的内源性肝细胞损伤才能实现的. 在大部分情况下, 移植细胞的后代相对于内源性肝细胞是没有选择优势的. 如在CCl4暴露的小鼠实验中[31], 对内源性肝细胞与移植细胞增殖情况做了比较, 小部分的HSCDH增殖量增长6倍, 而内源性肝细胞增殖更多, 扩增了约10倍, 大部分新增的肝细胞还是来源于剩余的受者内源性肝细胞. 在肝细胞因创伤或疾病大量损失后, 剩余的内源性肝细胞快速从静止状态激活, 迅速增殖补充肝细胞的损失[21]. 而且, 即使当剩余细胞也受到损伤, 阻止其增殖, 来自卵原细胞池的内胚层肝脏上皮干细胞会代替他们分化出肝细胞, 来补充损失的肝细胞.
有研究显示淋巴细胞系能产生肝细胞. 但是这一结论被Willenbring等[39]和Camargo两个实验否定. 因为在Rag1-和Rag2-的转基因小鼠中, 其骨髓缺乏淋巴细胞系细胞, 但将其骨髓移植入另一组受辐射的小鼠体内, 仍能产生HSCDH. 也有学者认为单核巨噬细胞也能产生肝细胞, 在实验中将体外培育的由骨髓产生的巨噬细胞输送入受试者体内发现可以产生肝细胞, 但是Simonsson等[40]为巨噬细胞在体外培育过程中可能已经出现细胞核重塑, 导致可塑性增加, 而产生肝细胞. 对于异体骨髓植入受辐射的小鼠体内哪种特定的造血干细胞系能产生肝细胞, 仍不能确定, 并且即使产生少量肝细胞是不是因为在移植过程中发生了细胞核重塑, 都需要进一步研究.
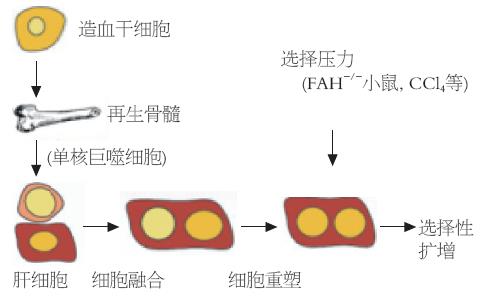
目前认为造血干细胞分化成肝细胞的机制可能有两种: 一是骨髓造血干细胞的分化转移; 二是宿主肝细胞和造血干细胞的融合. 分化转移指在基因的转录过程中, 造血干细胞基因表型直接转换成肝细胞表型. 与此相反, 融合是指一个肝细胞和一个造血干细胞产生异核杂交细胞, 含有两种细胞的基因和细胞器. 这种杂交细胞要想表达肝细胞表型, 需要将造血干细胞核从异核细胞中挤出去, 或者造血干细胞特异基因重塑, 从而产生肝细胞特异蛋白(图1).
造血干细胞直接分化转移成肝细胞这一机制并没有被证实. 分化转移需要证明在同一时间多功能造血干细胞基因转变成肝脏特异基因, 并且在移植中会促使造血干细胞产生肝细胞. 在Fra25Lin-"homed-recovered"细胞中检测到造血干细胞的一小部分基因表达转换成肝细胞基因, 但是在这项实验中, 除了检测到这一小部分基因外, 并没有说明转换的基因改变后被克隆, 以及这些表达肝细胞性能的造血干细胞能否产生肝细胞. 目前仍缺乏造血干细胞的转换机制. 中胚层的造血干细胞分化转移成内胚层的肝细胞, 通常认为是在原肠胚形成时期, 是发育出现受阻的情况, 而在成年动物中不会发生. 在成年动物病理状态下, 类似的分化转移的过程如间充质细胞与上皮细胞的转化也是可能的. 但是造血干细胞能分化成肝细胞最可能的原因, 是造血干细胞的细胞核在延长的细胞培养中, 可能已经重塑, 因此增加了他们的可塑性而分化成肝细胞[40]. 这一问题还需进一步研究.
在一些实验中发现造血干细胞与宿主肝细胞融合能产生肝样细胞. 最近有研究认为正常及病态肝脏接受造血干细胞移植后, 可以产生肝样细胞, 产量为肝细胞总量的10-4-10-6. 如Vassilopoulos等[41]、Kashofer等[42]和Fujino等[43]分别用3种不同的肝损伤模型, 使用不同的检测方法检测到杂交细胞, 说明存在细胞融合. 在这些杂交细胞中, 造血干细胞的基因发生重组, 抑制造血干细胞基因的表达, 上调肝细胞基因的表达. 然而造血干细胞和肝细胞的融合发生率是很低的, 如Zhou等[44]将ALDHhiLin-细胞植入肝损害模型中, 发现这些细胞与肝细胞融合的发生率很小. 在健康小鼠肝脏内用Cre-lox重组的方法[11], 发现融合率很低. Harris等[45]用同样的方法却没有检测到骨髓细胞和肝细胞融合, 而在一只暴露在肝毒素化学制品的动物中, 检测到融合现象. 总之, 这些结果说明受损肝脏的肝细胞可能比正常的肝细胞更容易发生细胞融合.
在胚胎形成时期造血干细胞迁移进肝内能分泌某些细胞因子和生长因子, 支持肝细胞的增殖分化. 在成年动物体内, 主要是来源于骨髓的肝脏非实质细胞分泌产生细胞因子和生长因子, 来调节肝细胞的增殖和修复等功能[46,47]. 目前有研究表明, 输注的造血干细胞可以通过其分泌的细胞因子或生长因子对肝细胞的增殖、恢复起作用, 例如Yannaki等[31]用小鼠CCl4肝损伤的模型, 在输注造血干细胞前, 只输注粒细胞集落刺激因子(造血干细胞分泌产生的)就能阻止小鼠死于CCl4的毒性. 说明造血干细胞除了直接转化成肝细胞以外, 还可以通过其他机制调节肝细胞的增殖生长. 在Esch等[48]的实验中, 研究右叶肝脏因肿瘤切除的患者, 将CD133+的异体骨髓造血干细胞移植入左叶肝中, 发现左叶肝中剩余的肝细胞有增殖现象. 说明移植的造血干细胞有可能产生某些因子促进剩余的细胞增殖. 但是对移植造血干细胞后, 是主要通过分化成肝细胞起作用, 还是由移植细胞或是非实质肝细胞分泌的细胞因子和生长因子调节肝脏功能的, 或是同时起作用, 其机制需要进一步研究.
虽然目前研究说明中胚层造血干细胞能产生极少数的肝细胞, 但是在大多数情况下, 这不是一个有效的方法. 造血干细胞虽然通过旁分泌提供细胞因子和生长因子促进肝细胞的作用, 但是, 无论在生理还是病理条件下, 造血干细胞对肝细胞形成的作用都是微乎其微的. 移植的造血干细胞的细胞核重塑能产生新的细胞系, 说明造血干细胞不能直接有效的分化成肝细胞, 这些问题都需要进一步研究. 对于造血干细胞能否产生肝细胞, 需要有足够的实验研究证明, 不能轻易下结论.
实验研究大部分基于肝损伤的动物模型, 模拟临床中肝损害或是晚期肝病的模型, 其研究价值很大, 但是实验研究中也出现争议, 对分化的可能性提出质疑.
单云峰, 副主任医师, 温州医学院附属第一医院肝胆外科
骨髓造血干细胞的多向分化的潜能, 对于其在特定条件下定向分化成肝细胞的研究已成为热点.
Snorri等认为造血干细胞并不是肝细胞的直接前体细胞, 造血干细胞分化成肝细胞的可能性很低, 分化产生的干细胞只占整个肝细胞的≤10-4. 对于造血干细胞分化成肝细胞的可能性需进一步研究.
目前大量文章综述了造血干细胞能分化出肝细胞, 而对于其分化可能性的大小, 移植细胞的分化情况, 增殖情况及移植分化后产生的肝细胞对受损肝脏的修复作用的大小, 以及可能的分化机制几个方面分别综述鲜有报道.
本文较全面地总结论述了造血干细胞向肝细胞分化的研究水平, 从实验研究上对其分化的可能性及临床应用的价值作出评价, 对以后实验研究具有一定的参考价值.
本文选题新颖, 论据充分, 结论科学, 具有较好的可读性.
编辑: 李薇 电编:何基才
| 1. | Durand C, Dzierzak E. Embryonic beginnings of adult hematopoietic stem cells. Haematologica. 2005;90:100-108. [PubMed] |
| 2. | Lemaigre F, Zaret KS. Liver development update: new embryo models, cell lineage control, and morphogenesis. Curr Opin Genet Dev. 2004;14:582-590. [PubMed] [DOI] |
| 3. | Kinoshita T, Miyajima A. Cytokine regulation of liver development. Biochim Biophys Acta. 2002;1592:303-312. [PubMed] [DOI] |
| 4. | Suskind DL, Muench MO. Searching for common stem cells of the hepatic and hematopoietic systems in the human fetal liver: CD34+ cytokeratin 7/8+ cells express markers for stellate cells. J Hepatol. 2004;40:261-268. [PubMed] [DOI] |
| 5. | Zheng YW, Taniguchi H. Diversity of hepatic stem cells in the fetal and adult liver. Semin Liver Dis. 2003;23:337-348. [PubMed] [DOI] |
| 6. | Lagasse E, Connors H, Al-Dhalimy M, Reitsma M, Dohse M, Osborne L, Wang X, Finegold M, Weissman IL, Grompe M. Purified hematopoietic stem cells can differentiate into hepatocytes in vivo. Nat Med. 2000;6:1229-1234. [PubMed] [DOI] |
| 7. | Krause DS, Theise ND, Collector MI, Henegariu O, Hwang S, Gardner R, Neutzel S, Sharkis SJ. Multi-organ, multi-lineage engraftment by a single bone marrow-derived stem cell. Cell. 2001;105:369-377. [PubMed] [DOI] |
| 8. | Fujii H, Hirose T, Oe S, Yasuchika K, Azuma H, Fujikawa T, Nagao M, Yamaoka Y. Contribution of bone marrow cells to liver regeneration after partial hepatectomy in mice. J Hepatol. 2002;36:653-659. [PubMed] [DOI] |
| 9. | Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, Reyes M, Lenvik T, Lund T, Blackstad M. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature. 2002;418:41-49. [PubMed] [DOI] |
| 10. | Kanazawa Y, Verma IM. Little evidence of bone marrow-derived hepatocytes in the replacement of injured liver. Proc Natl Acad Sci USA. 2003;100 Suppl 1:11850-11853. [PubMed] [DOI] |
| 11. | Wulf GG, Luo KL, Jackson KA, Brenner MK, Goodell MA. Cells of the hepatic side population contribute to liver regeneration and can be replenished with bone marrow stem cells. Haematologica. 2003;88:368-378. [PubMed] |
| 12. | Abe S, Lauby G, Boyer C, Rennard SI, Sharp JG. Transplanted BM and BM side population cells contribute progeny to the lung and liver in irradiated mice. Cytotherapy. 2003;5:523-533. [PubMed] [DOI] |
| 13. | Wang X, Willenbring H, Akkari Y, Torimaru Y, Foster M, Al-Dhalimy M, Lagasse E, Finegold M, Olson S, Grompe M. Cell fusion is the principal source of bone-marrow-derived hepatocytes. Nature. 2003;422:897-901. [PubMed] [DOI] |
| 14. | Ishikawa H, Nakao K, Matsumoto K, Nishimura D, Ichikawa T, Hamasaki K, Eguchi K. Bone marrow engraftment in a rodent model of chemical carcinogenesis but no role in the histogenesis of hepatocellular carcinoma. Gut. 2004;53:884-889. [PubMed] [DOI] |
| 15. | Abedi M, Greer DA, Colvin GA, Demers DA, Dooner MS, Harpel JA, Pimentel J, Menon MK, Quesenberry PJ. Tissue injury in marrow transdifferentiation. Blood Cells Mol Dis. 2004;32:42-46. [PubMed] [DOI] |
| 16. | Sharma AD, Cantz T, Richter R, Eckert K, Henschler R, Wilkens L, Jochheim-Richter A, Arseniev L, Ott M. Human cord blood stem cells generate human cytokeratin 18-negative hepatocyte-like cells in injured mouse liver. Am J Pathol. 2005;167:555-564. [PubMed] [DOI] |
| 17. | Zhu W, Qiu DK, Lai ZS, Wang YD, Zhang YL. [A study of liver cell transformation from bone marrow hematopoietic stem cells]. Zhonghua Ganzangbing Zazhi. 2007;15:221-222. [PubMed] |
| 18. | Khurana S, Jaiswal AK, Mukhopadhyay A. Hepatocyte nuclear factor-4alpha induces transdifferentiation of hematopoietic cells into hepatocytes. J Biol Chem. 2010;285:4725-4731. [PubMed] [DOI] |
| 19. | Rideout WM 3rd, Eggan K, Jaenisch R. Nuclear cloning and epigenetic reprogramming of the genome. Science. 2001;293:1093-1098. [PubMed] [DOI] |
| 20. | Javazon EH, Beggs KJ, Flake AW. Mesenchymal stem cells: paradoxes of passaging. Exp Hematol. 2004;32:414-425. [PubMed] [DOI] |
| 21. | Grisham JW. A morphologic study of deoxyribonucleic acid synthesis and cell proliferation in regenerating rat liver; autoradiography with thymidine-H3. Cancer Res. 1962;22:842-849. [PubMed] |
| 23. | Taub R. Liver regeneration: from myth to mechanism. Nat Rev Mol Cell Biol. 2004;5:836-847. [PubMed] [DOI] |
| 24. | Prindull G, Zipori D. Environmental guidance of normal and tumor cell plasticity: epithelial mesenchymal transitions as a paradigm. Blood. 2004;103:2892-2899. [PubMed] [DOI] |
| 25. | Wang X, Montini E, Al-Dhalimy M, Lagasse E, Finegold M, Grompe M. Kinetics of liver repopulation after bone marrow transplantation. Am J Pathol. 2002;161:565-574. [PubMed] [DOI] |
| 26. | Camargo FD, Finegold M, Goodell MA. Hematopoietic myelomonocytic cells are the major source of hepatocyte fusion partners. J Clin Invest. 2004;113:1266-1270. [PubMed] |
| 27. | Mallet VO, Mitchell C, Mezey E, Fabre M, Guidotti JE, Renia L, Coulombel L, Kahn A, Gilgenkrantz H. Bone marrow transplantation in mice leads to a minor population of hepatocytes that can be selectively amplified in vivo. Hepatology. 2002;35:799-804. [PubMed] [DOI] |
| 28. | Wagers AJ, Sherwood RI, Christensen JL, Weissman IL. Little evidence for developmental plasticity of adult hematopoietic stem cells. Science. 2002;297:2256-2259. [PubMed] [DOI] |
| 29. | Alvarez-Dolado M, Pardal R, Garcia-Verdugo JM, Fike JR, Lee HO, Pfeffer K, Lois C, Morrison SJ, Alvarez-Buylla A. Fusion of bone-marrow-derived cells with Purkinje neurons, cardiomyocytes and hepatocytes. Nature. 2003;425:968-973. [PubMed] [DOI] |
| 30. | Jang YY, Collector MI, Baylin SB, Diehl AM, Sharkis SJ. Hematopoietic stem cells convert into liver cells within days without fusion. Nat Cell Biol. 2004;6:532-539. [PubMed] [DOI] |
| 31. | Yannaki E, Athanasiou E, Xagorari A, Constantinou V, Batsis I, Kaloyannidis P, Proya E, Anagnostopoulos A, Fassas A. G-CSF-primed hematopoietic stem cells or G-CSF per se accelerate recovery and improve survival after liver injury, predominantly by promoting endogenous repair programs. Exp Hematol. 2005;33:108-119. [PubMed] [DOI] |
| 32. | Terai S, Sakaida I, Yamamoto N, Omori K, Watanabe T, Ohata S, Katada T, Miyamoto K, Shinoda K, Nishina H. An in vivo model for monitoring trans-differentiation of bone marrow cells into functional hepatocytes. J Biochem. 2003;134:551-558. [PubMed] [DOI] |
| 33. | Yamamoto N, Terai S, Ohata S, Watanabe T, Omori K, Shinoda K, Miyamoto K, Katada T, Sakaida I, Nishina H. A subpopulation of bone marrow cells depleted by a novel antibody, anti-Liv8, is useful for cell therapy to repair damaged liver. Biochem Biophys Res Commun. 2004;313:1110-1118. [PubMed] [DOI] |
| 34. | Narindrasorasak S, Yao P, Sarkar B. Protein disulfide isomerase, a multifunctional protein chaperone, shows copper-binding activity. Biochem Biophys Res Commun. 2003;311:405-414. [PubMed] [DOI] |
| 35. | Gupta RC, Shukla OP. Microbial metabolism of 2-hydroxypyridine. Indian. J Biochem Biophys. 1975;12:296-298. [PubMed] |
| 36. | Fang B, Shi M, Liao L, Yang S, Liu Y, Zhao RC. Multiorgan engraftment and multilineage differentiation by human fetal bone marrow Flk1+/CD31-/CD34- Progenitors. J Hematother Stem Cell Res. 2003;12:603-613. [PubMed] [DOI] |
| 37. | Fausto N. Liver regeneration and repair: hepatocytes, progenitor cells, and stem cells. Hepatology. 2004;39:1477-1487. [PubMed] [DOI] |
| 38. | Grompe M. Bone marrow-derived hepatocytes. Novartis Found Symp. 2005;265:20-27; discussion 28-34, 92-97. [PubMed] |
| 39. | Willenbring H, Bailey AS, Foster M, Akkari Y, Dorrell C, Olson S, Finegold M, Fleming WH, Grompe M. Myelomonocytic cells are sufficient for therapeutic cell fusion in liver. Nat Med. 2004;10:744-748. [PubMed] [DOI] |
| 40. | Simonsson S, Gurdon JB. Changing cell fate by nuclear reprogramming. Cell Cycle. 2005;4:513-515. [PubMed] [DOI] |
| 41. | Vassilopoulos G, Wang PR, Russell DW. Transplanted bone marrow regenerates liver by cell fusion. Nature. 2003;422:901-904. [PubMed] [DOI] |
| 42. | Kashofer K, Siapati EK, Bonnet D. In vivo formation of unstable heterokaryons after liver damage and hematopoietic stem cell/progenitor transplantation. Stem Cells. 2006;24:1104-1112. [PubMed] [DOI] |
| 43. | Fujino H, Hiramatsu H, Tsuchiya A, Niwa A, Noma H, Shiota M, Umeda K, Yoshimoto M, Ito M, Heike T. Human cord blood CD34+ cells develop into hepatocytes in the livers of NOD/SCID/gamma(c)null mice through cell fusion. FASEB J. 2007;21:3499-3510. [PubMed] [DOI] |
| 44. | Zhou P, Hohm S, Olusanya Y, Hess DA, Nolta J. Human progenitor cells with high aldehyde dehydrogenase activity efficiently engraft into damaged liver in a novel model. Hepatology. 2009;49:1992-2000. [PubMed] [DOI] |
| 45. | Harris RG, Herzog EL, Bruscia EM, Grove JE, Van Arnam JS, Krause DS. Lack of a fusion requirement for development of bone marrow-derived epithelia. Science. 2004;305:90-93. [PubMed] [DOI] |
| 46. | Stadtfeld M, Graf T. Assessing the role of hematopoietic plasticity for endothelial and hepatocyte development by non-invasive lineage tracing. Development. 2005;132:203-213. [PubMed] [DOI] |
| 47. | Cantz T, Sharma AD, Jochheim-Richter A, Arseniev L, Klein C, Manns MP, Ott M. Reevaluation of bone marrow-derived cells as a source for hepatocyte regeneration. Cell Transplant. 2004;13:659-666. [PubMed] [DOI] |
| 48. | am Esch JS 2nd, Knoefel WT, Klein M, Ghodsizad A, Fuerst G, Poll LW, Piechaczek C, Burchardt ER, Feifel N, Stoldt V, Stockschläder M, Stoecklein N, Tustas RY, Eisenberger CF, Peiper M, Häussinger D, Hosch SB. Portal application of autologous CD133+ bone marrow cells to the liver: a novel concept to support hepatic regeneration. Stem Cells. 2005;23:463-470. [PubMed] [DOI] |