修回日期: 2011-02-09
接受日期: 2011-02-15
在线出版日期: 2011-03-28
目的: 探讨DOG1、CD117和血小板衍生生长因子受体α(PDGFRA)在胃肠道间质瘤(GISTs)诊断中的意义, 并分析与其GISTs临床病理因素和危险度的关系.
方法: 应用免疫组织化学Envision二步法检测63例GISTs及43例非GISTs间叶源性肿瘤患者中DOG1、CD117及PDGFRA的表达, 并分析上述免疫组织化学指标与临床病理因素(性别、年龄、部位、肿瘤大小、核分裂象、组织学类型)和危险度的相关性.
结果: GISTs中DOG1、CD117和PDGFRA阳性表达率分别为84.13%(53/63)、90.48%(57/63)、52.38%(33/63), DOG1、CD117与PDGFRA相比, 差异显著(均P<0.01), 而其中CD117阴性的6例GISTs均表达DOG1阳性, 5例表达PDGFRA阳性; 非GISTs间叶源性肿瘤中DOG1、CD117及PDGFRA阳性表达率分别为11.63%、16.28%、6.98%. DOG1及PDGFRA的表达在不同性别、年龄、部位、肿瘤大小、核分裂象、组织学类型之间没有显著性差异, 与危险度亦无相关性. 但CD117的表达与部位及组织学类型有关(P = 0.008, 0.045), 其他部位(肠系膜、腹腔、网膜)CD117表达率低于胃、小肠、结肠及直肠(50.00% vs 94.74%, P = 0.008). 且梭型及上皮型中CD117高表达.
结论: DOG1和CD117可以作为GISTs诊断的特异性标志物; 对于KIT阴性的GISTs, DOG1检测的加入, 将在病理学和临床上进一步完善诊断依据; DOG1、CD117和PDGFRA不能作为判断危险度的指标.
引文著录: 隋杏玲, 郝旺, 孙秀威. DOG1、CD117和PDGFRA在胃肠道间质瘤中的表达及相关性. 世界华人消化杂志 2011; 19(9): 912-918
Revised: February 9, 2011
Accepted: February 15, 2011
Published online: March 28, 2011
AIM: To investigate the significance of expression of discovered on GIST-1 (DOG1), CD117 and platelet-derived growth factor receptor alpha (PDGFRA) in gastrointestinal stromal tumors (GISTs) by analyzing their correlation with clinicopathologic features and risk degree of GISTs.
METHODS: The expression of DOG1, CD117 and PDGFRA was detected by immunohistochemistry in 63 cases of GISTs and 43 cases of non-GISTs. The correlation of expression of DOG1, CD117 and PDGFRA with clinicopathologic factors and risk degree of GISTs was then analyzed.
RESULTS: The positive expression rates of DOG1, CD117 and PDGFRA in GISTs were 84.13% (53/63), 90.48% (57/63) and 3.17% (33/63), respectively. The positive expression rates of DOG1 and CD117 in GISTs were significantly higher than that of PDGFRA (both P < 0.01). Of six CD117-negative cases, all were positive for DOG1 and five positive for PDGFRA. The positive expression rates of DOG1, CD117 and PDGFRA in patients with non-GISTs were 11.63%, 16.28% and 6.98%, respectively. The expression of DOG1 and PDGFRA had no significant association with gender, age, tumor location, tumor size, mitotic phase, histotype, or risk degree, while the expression of CD117 was related with tumor location and histotyoe (P = 0.008, 0.045). Tumors derived from the mesentery, abdominal cavity and epiploon had higher positive rates of CD117 than those derived from the stomach, small intestine, colon and rectum (50.00% vs 94.74%, P = 0.008). CD117 was highly expressed in spindle-cell and epithelial-cell types.
CONCLUSION: Both DOG1 and CD117 are highly expressed in GISTs and can serve as specific diagnostic markers for GISTs. DOG1 has a good sensitivity and specificity in the diagnosis of GISTs, especially KIT-negative GISTs. Detection of DOG1, CD117 and PDGFRA expression can not be used for assessing the risk degree of GISTs.
- Citation: Sui XL, Hao W, Sun XW. Expression of DOG1, CD117 and PDGFRA in gastrointestinal stromal tumors. Shijie Huaren Xiaohua Zazhi 2011; 19(9): 912-918
- URL: https://www.wjgnet.com/1009-3079/full/v19/i9/912.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i9.912
胃肠道间质瘤(gastrointestinal stromal tumors, GISTs)是一类特殊的起源于胃肠道间叶组织的肿瘤, 占胃肠道间叶肿瘤的大部分, 通常CD117免疫表型阳性, 遗传学上频发c-kit或血小板衍生生长因子受体α(platelet-derived growth factor receptor alpha, PDGFRA)基因激活突变. 近年来, 随着GISTs有效的靶向治疗的新近发展, GISTs患者的预后已显著提高, 因此对于GISTs的准确诊断变得尤为重要, 尤其对于KIT表达缺失的GISTs. DOG1(discovered on GIST-1)是一种新近发现的GISTs的特异性标志物, 与KIT的总体敏感性几乎相同[1]. 本研究通过对63例GISTs及43例非GISTs间叶源性肿瘤组织标本进行免疫组织化学检测, 以进一步探讨GISTs免疫组织化学结果在诊断中的意义及其与临床病理相关因素和危险度分级的关系.
收集哈尔滨医科大学附属第三医院自2004-01/2008-12经手术切除的资料完整、诊断明确的GISTs患者组织标本63例, 其均为原发性肿瘤. 本组63例患者中, 男31例, 女32例, 男女比例1∶1; 年龄24-83(中位年龄56)岁; 肿瘤大小1.5-29(中位值9.0)cm; 病灶位于胃34例(54%), 小肠13例(21%), 直肠7例(11%), 结肠3例(5%), 其他部位(肠系膜、腹腔、网膜)6例(10%); 组织学类型中, 梭型52例(83%), 上皮型6例(10%), 混合型5例(8%); 根据美国国立卫生研究院(NIH)确定的GIST危险度分级(2008年)进行分级(表1)[2], 其中极低危险度4例(6%), 低危险度13例(1%), 中危险度19例(30%), 高危险度27例(43%). 另收集非GISTs间叶源性肿瘤组织标本43例, 均经复诊明确诊断, 其中神经鞘瘤25例, 平滑肌瘤12例, 平滑肌肉瘤6例. DOG1、CD117、PDGFRA单克隆抗体及免疫组织化学试剂盒均购自北京中杉金桥有限公司, 即用型.
| 肿瘤原发部位 | 肿瘤大小(cm) | 核分裂数(每50个高倍视野) | 危险度分级 |
| 任何部位 | <2.0 | ≤5 | 极低度 |
| 任何部位 | 2.1-5.0 | ≤5 | 低度 |
| 胃 | 2.1-5.0 | >5 | 中等度 |
| 任何部位 | <5.0 | 6-10 | 中等度 |
| 胃 | 5.1-10.0 | ≤5 | 中等度 |
| 肿瘤破裂 | 任何大小 | 无论多少 | 高度 |
| 任何部位 | >10 | 无论多少 | 高度 |
| 任何部位 | 任何大小 | >10 | 高度 |
| 任何部位 | >5.0 | >5 | 高度 |
| 非胃来源 | 2.1-5.0 | >5 | 高度 |
| 非胃来源 | 5.1-10.0 | ≤5 | 高度 |
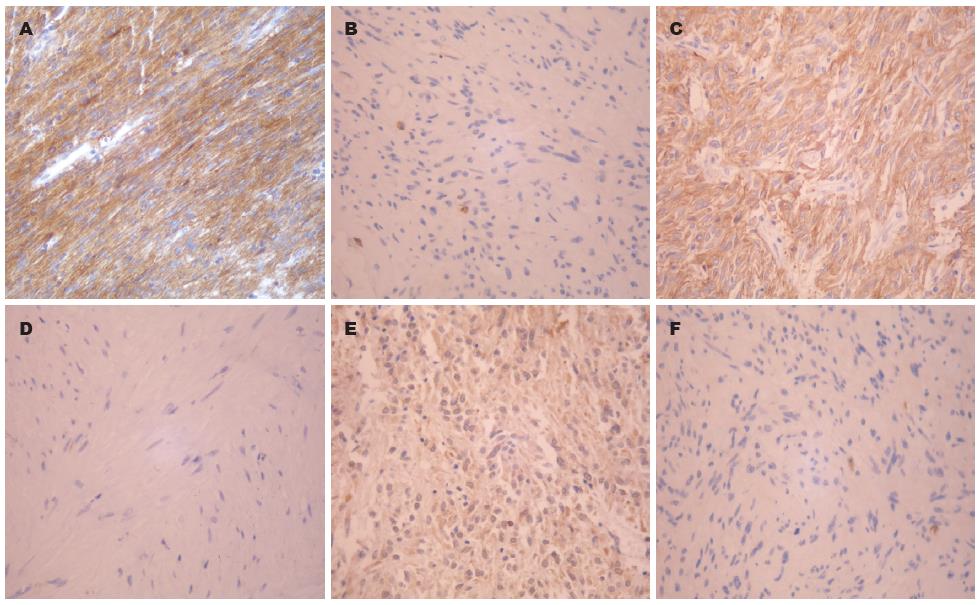
所有标本均经10%甲醛固定, 常规石蜡包埋, 3 μm切片, 染色步骤和抗体稀释度均按产品说明书进行. PBS代替一抗做阴性对照, 显微镜下观察结果. 结果评定DOG1染色主要位于细胞质, 少量位于细胞膜, CD117染色以细胞质为主, 少量亦定位于细胞膜, PDGFRA主要为细胞质染色. 根据显微镜下有无阳性细胞及其个数进行分类: 阴性(-), 阳性细胞数<5%; 弱阳性(+), 棕色颗粒, 阳性细胞数5%-25%; 阳性(++), 褐色颗粒, 阳性细胞数25%-50%; 强阳性(+++), 深褐色颗粒, 阳性细胞数>50%.
统计学处理 采用SPSS13.0软件对数据进行统计学处理, 计数资料组间比较采用χ2检验, 以P≤0.05为有统计学差异.
DOG1染色主要位于细胞质, 少量位于细胞膜, CD117染色以细胞质为主, 少量亦定位于细胞膜, PDGFRA主要为细胞质染色, 均呈弥漫性分布(图1). DOG1阳性表达率为84.13%, 其中弱阳性(+)18例(28.57%), 阳性(++)12例(19.05%), 强阳性(+++)23例(36.51%); CD117阳性率为90.48%, 高于DOG1阳性表达; PDGFRA为52.38%. 其中DOG1、CD117与PDGFRA相比, 差异有统计学意义(均P<0.01). 另外CD117阴性的6例病例中, 均表达DOG1阳性, 5例表达PDGFRA阳性(表2).
DOG1的表达率低于CD117, 分别为11.63%和16.28%, 其中神经鞘瘤3例, 平滑肌瘤1例, 平滑肌肉瘤1例表达DOG1阳性; PDGFRA为6.98%(表3).
| 类别 | n | DOG1 | CD117 | PDGFRA | |||
| - | + | - | + | - | + | ||
| 神3/4鞘瘤 | 25 | 22(88.00) | 3(12.00) | 21(84.00) | 4(16.00) | 23(92.00) | 2(8.00) |
| 平滑肌瘤 | 12 | 11(91.67) | 1(8.33) | 10(83.33) | 2(16.67) | 11(91.67) | 1(8.33) |
| 平滑肌肉瘤 | 6 | 5(83.33) | 1(16.67) | 5(83.33) | 1(1.67) | 6(100.00) | 0(0.00) |
| 合计 | 43 | 8(88.37) | 5(11.63) | 36(83.71) | 7(16.28) | 40(93.02) | 3(6.98) |
DOG1、PDGFRA与患者性别、年龄、部位、肿瘤大小、核分裂象及组织学类型无统计学差异, 与危险度亦无相关性, 而CD117的表达却与部位及组织学类型有关, 其他部位(肠系膜、腹腔、网膜)CD117表达率低于胃、小肠及结直肠, 且CD117高表达于梭型及上皮型中, 具有统计学意义(表4).
| 临床病理特征 | n | DOG1 | CD117 | PDGFRA | ||||||
| n(%) | χ2值 | P值 | n(%) | χ2值 | P值 | n(%) | χ2值 | P值 | ||
| 性别 | ||||||||||
| 男 | 31 | 26(83.87) | 0.003 | 0.956 | 28(90.32) | 0.002 | 0.967 | 16(51.61) | 0.104 | 0.904 |
| 女 | 32 | 27(84.38) | 29(90.63) | 17(53.13) | ||||||
| 年龄(岁) | ||||||||||
| ≤50 | 20 | 16(80.00) | 0.374 | 0.541 | 19(95.00) | 0.696 | 0.404 | 12(60.00) | 0.682 | 0.409 |
| >50 | 43 | 37(86.05) | 38(88.37) | 21(48.84) | ||||||
| 部位 | ||||||||||
| 胃 | 34 | 27(79.41) | 4.433 | 0.351 | 32(94.12) | 13.800 | 0.008 | 19(55.88) | 0.883 | 0.927 |
| 小肠 | 13 | 13(100) | 13(100.00) | 6(46.15) | ||||||
| 直肠 | 7 | 5(71.43) | 6(85.71) | 3(42.86) | ||||||
| 结肠 | 3 | 3(100.00) | 3(100.00) | 2(66.67) | ||||||
| 其他 | 6 | 5(83.33) | 3(50.00) | 3(50.00) | ||||||
| 肿瘤大小(cm) | ||||||||||
| ≤2 | 4 | 4(100.00) | 6.182 | 0.103 | 3(75.00) | 3.382 | 0.336 | 3(75.00) | 1.837 | 0.607 |
| 2.1-5 | 18 | 12(66.67) | 18(100.00) | 10(55.56) | ||||||
| 5.1-10 | 26 | 23(88.46) | 23(88.46) | 14(53.85) | ||||||
| >10 | 15 | 14(93.33) | 13(86.67) | 6(40.00) | ||||||
| 核分裂象(个/50HPF) | ||||||||||
| ≤5 | 43 | 35(81.40) | 1.021 | 0.600 | 40(93.02) | 2.397 | 0.302 | 24(55.81) | 1.304 | 0.521 |
| 6-10 | 17 | 15(88.24) | 15(88.24) | 7(41.18) | ||||||
| >10 | 3 | 3(100.00) | 2(85.00) | 2(45.00) | ||||||
| 组织学类型 | ||||||||||
| 梭型 | 52 | 43(82.69) | 1.026 | 0.599 | 48(92.31) | 6.223 | 0.045 | 25(48.08) | 2.406 | 0.300 |
| 上皮型 | 6 | 5(83.33) | 6(100.00) | 4(66.67) | ||||||
| 混合型 | 5 | 5(100.00) | 3(60.00) | 4(80.00) | ||||||
| 危险度 | ||||||||||
| 极低度 | 4 | 4(100.00) | 7.764 | 0.051 | 3(75.00) | 3.758 | 0.289 | 3(75.00) | 1.151 | 0.765 |
| 低度 | 13 | 10(76.92) | 13(100.00) | 7(53.85) | ||||||
| 中度 | 19 | 13(68.42) | 18(94.74) | 9(47.37) | ||||||
| 高度 | 27 | 26(96.30) | 23(85.19) | 13(48.15) | ||||||
GISTs是一类特殊的起源于胃肠道间叶组织的肿瘤, 占胃肠道间叶肿瘤的大部分, 组织学上由梭形、上皮样、偶或多形性细胞排列成束状或弥漫状图像, 免疫表型上表达c-kit基因蛋白产物KIT(CD117), 由突变的c-kit或PDGFRA基因驱动的特殊肿瘤[3]. 国外研究报道, GISTs发病率约为1-2/10万[4], 仅占全部胃肠道肿瘤的3%以下, 但却是最常见的胃肠道间叶源性肿瘤, 发生于消化系的任何部位, 最常发生于胃(60%-70%), 其次是小肠(20%-30%), 结肠、直肠(5%), 发生于食管<5%, 偶见在网膜和肠系膜[5-8], 发病高峰位于55-65岁, 男稍多于女, 或男女相等, 无明显差异[9-12]. 我们的资料显示, 病灶亦主要位于胃, 占54%(34例), 小肠21%(13例), 直肠11%(7例), 结肠5%(3例), 其他部位肠系膜、腹腔、网膜10%(6例); 男31例, 女32例, 男女比例1∶1; 年龄24-83(中位年龄56)岁, 与文献报道相似.
CD117作为GISTs相对特异的标志物, 具有良好的敏感性, 在绝大多数GISTs中弥漫强表达, 阳性率85%-94%, 也就是说几乎所有的GISTs均有c-Kit表达, 因此CD117已成为GISTs特征性标志[13]. 我们的研究中CD117阳性率为90.48%, 与文献报道相一致. CD117亦可作为治疗的靶点, 其通过TKIs抑制KIT和PDGFRA激酶已经使GISTs的治疗发生了革命性的变化, 因此特异性诊断对合适的患者提供了潜在拯救生命的治疗. 但是CD117并不是GISTs绝对特异、敏感的指标, 仍有5%的GISTs缺少CD117的表达, 另外有文献报道, 精原细胞瘤、肥大细胞瘤、恶性黑色素瘤均表达CD117[14], 这增加了GISTs诊断的难度.
2003年Heinrich等[15]报道了GISTs中存在PDGFRA基因激活突变, 并进一步通过Western blot证实了PDGFRA蛋白的表达, 使得PDGFRA成为一种诊断GISTs的新的标志物. 我们的结果显示PDGFRA为52.38%, 敏感性较低, 且与CD117相比, 有统计学差异(P<0.01), 但CD117阴性的6例病例中, 5例表达阳性, 显示PDGFRA 在CD117阴性GISTs中高表达, 与文献[16,17]报道一致, 提示与CD117联合应用有诊断意义. 但PDGFRA并不是GISTs的特异性标志物, 由于石蜡包埋的组织中PDGFRA缺乏可靠的抗体, 其免疫组织化学染色情况国内外文献报道仍较少, 且结果也不一致[16-21], 加上许多易与GISTs混淆的肉瘤(如平滑肌肉瘤、滑膜肉瘤等)也可检测出PDGFRA抗体表达, 潜在否定了其应用及诊断价值, 临床上应用较少.
由于第一代和第二代酪氨酸激酶抑制剂药物的有效性, GISTs的精确诊断已变得极为重要, 但迄今为止, GISTs诊断除了结合肿瘤的解剖学位置、组织形态等特征外, 主要依赖于免疫组织化学CD117和/或CD34蛋白表达的证实. 对于大约5%组织形态学可疑的GISTs, 由于其免疫组织化学染色CD117呈阴性, 使其精确性诊断变得复杂化, 虽然KIT和PDGFRA突变筛选在这种情况下是有益的, 但是其增加了诊断的时间和成本, 况且目前国内大多数单位尚不具备检测c-Kit突变的条件, 这就促使很多病理学者试图寻找其他对GISTs诊断和预后有用的新的标志物.
DOG1是新近发现的GISTs的一种特异性标志物, 由West等[22]利用基因表达分析筛选出的选择性高表达于GISTs的基因, 定位于人类染色体11q13, 含有26个外显子, 编码960个氨基酸组成的分子量为114 000 Da的蛋白[23,24]. 此蛋白有8个穿膜的功能区, 被认为是一种钙调控的氯离子通道蛋白[25]. 目前对DOG1基因进行检测分析, 发现并未存在突变型DOG1基因[26]. 但遗憾的是, 对其功能尚不明确.
近年来, DOG1的研究已成为GISTs领域的一个热点. 国外大多数研究报道[27,28], GISTs中DOG1和KIT的总体敏感性几乎相同, 均达95%以上, 并且GISTs中的结果普遍一致, 而与CD117联合用于GISTs的诊断具有较好的互补性. 目前国内亦有此方面研究[29-32], DOG1阳性表达率96.1%以上, 与国外文献报道一致, 但也存在一定的分歧. 我们的研究发现, DOG1在GISTs的总阳性率为84%, 这与Espinosa等[33]及尹慕军等[30]的结果一致, 虽阳性表达率低于CD117(91%), 但对于CD117阴性的6例标本, DOG1几乎均为阳性, 这一点证实了DOG1至少可以作为GISTs明确诊断的必要补充, 对于易漏诊的部分病例提供了潜在的诊断依据. DOG1染色强度中, 强阳性敏感性较高, 显著高于弱阳性和阳性(36.5% vs 28.6%, 19.0%). 在GISTs中, DOG1与PDGFRA表达率相比, 有统计学意义, 其敏感性高于PDGFRA. DOG1在非GISTs中的阳性率普遍偏低(神经鞘瘤12%, 平滑肌瘤8%, 平滑肌肉瘤17%), 对于GISTs的鉴别诊断提供了良好的特异性标志物.
对于DOG1、CD117及PDGFRA与临床病理因素与危险度的相关性, 文献报道较少, 且结果存在较大的差异. 张著学等[34]发现PDGFRA及CD117的表达在组织学分型之间比较差异均有显著性, PDGFRA在混合细胞型表达率高(81%), 而CD117在梭形细胞型表达率高(98%); Kang等[35]的研究显示, DOG1、CD117的表达与组织类型有关, 梭型细胞中高表达, CD117高表达亦见于女性患者, 而PDGFRA表达与部位有关, 非小肠部位表达率明显增高; 甄丽影等[29]、Espinosa等[33]分析发现DOG1表达与基因突变类型、突变位置、肿瘤大小、肿瘤级别和患者年龄均没有相关性; 但尹慕军等[30]发现, DOG1蛋白表达情况与肿瘤发生部位、细胞丰富程度、细胞核异形性及Fletcher危险程度分级有关. 我们的研究发现, DOG1的表达与在不同性别、年龄、部位、肿瘤大小、核分裂象、组织学类型间无显著性差异, 与甄丽影等[29]、Espinosa等[33]的结果一致, 与危险度亦无相关性, 但P = 0.051, 值得我们大样本试验进一步证实; CD117的表达在部位及组织学类型之间比较有显著性差异, 其他部位(肠系膜、腹腔、网膜)CD117表达率低于胃、小肠及结直肠, 且梭型及上皮型中CD117高表达, 而PDGFRA的表达与临床病理因素及危险度分级无相关性, 我们的结果与以上各研究小组间有一定的差异, 这仍需要更进一步深入的研究.
目前GISTs的临床病理和治疗研究已取得巨大进展, 但还有许多问题有待回答, 尤其在肿瘤发生机制、生物学行为预测和更有效治疗等方面. CD117及PDGFRA在GISTs中的研究已经相当成熟, 但与临床病理因素及危险度的关系仍不甚清楚, 矛盾较大, DOG1具体生物学功能及在GISTs中高表达的机制尚不清楚, 需要更进一步深入的研究. 但毋庸置疑是, DOG1可以作为GISTs患者明确诊断的一种特异性标志物, 尤其对于CD117阴性的患者, DOG1的检测具有诊断价值. 相信随着对GISTs研究的不断深入, DOG1、CD117及PDGFRA在GISTs的发生机制、诊断、治疗及预后中的作用将会逐渐表现出来. 对于明确诊断GISTs患者, 研究更好的靶向治疗药物, 延长患者生存期及改善患者预后意义重大.
胃肠道间质瘤(GISTs)是最常见的胃肠道间叶源性肿瘤, 遗传学上具有c-kit或PDGFRA基因激活突变, 通常CD117免疫表型阳性. 近年来, 随着GISTs有效靶向治疗的新近发展, GISTs患者的预后已显著提高, 因此对于GISTs的准确诊断变得尤为重要, 但迄今为止, GISTs诊断除了结合肿瘤的解剖学位置、组织形态等特征外, 主要依赖于免疫组织化学CD117和CD34蛋白表达的证实, 但仍有5%的GISTs缺乏CD1l7表达.
宋军, 副教授, 武汉协和医院消化科
近年来, DOG1的研究已成为GISTs领域的一个热点.
Miettinen等的研究发现GISTs中DOG1和KIT的总体敏感性几乎相同: 94.4%和94.7%, 并且GISTs中的结果普遍一致; Kang等的研究显示DOG1、CD117的表达与组织类型有关, 梭型细胞中高表达, CD117高表达, 亦见于女性患者, 而PDGFRA表达与部位有关, 非小肠部位表达率明显增高; 张著学等发现PDGFRA及CD117的表达在组织学分型之间比较, 差异均有显著性.
本研究发现DOG1及PDGFRA的表达在不同性别、年龄、部位、肿瘤大小、核分裂象、组织学类型之间没有显著性差异, 与危险度亦无相关性, 但CD117的表达与部位及组织学类型有关, 其他部位(肠系膜、腹腔、网膜)CD117表达率低于胃、小肠、结肠及直肠, 且梭型及上皮型中CD117高表达.
DOG1是一种新型的更加敏感而特异的标志物, 选择性高表达于GISTs, 且其表达并不依赖于c-kit或PDGFRA基因突变状态, 而与CD117的总体敏感性几乎相同, 其与CD117、PDGFRA的联合使用将在病理学和临床上进一步完善诊断依据, 在GISTs的辅助诊断中意义重大.
本文设计合理, 分析深入, 对胃肠道间质瘤的诊断意义的研究具有一定先进性和临床意义.
编辑: 李薇 电编:李薇
| 1. | Miettinen M, Wang ZF, Lasota J. DOG1 antibody in the differential diagnosis of gastrointestinal stromal tumors: a study of 1840 cases. Am J Surg Pathol. 2009;33:1401-1408. [PubMed] [DOI] |
| 2. | Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Hum Pathol. 2008;39:1411-1419. [PubMed] [DOI] |
| 4. | Rossi CR, Mocellin S, Mencarelli R, Foletto M, Pilati P, Nitti D, Lise M. Gastrointestinal stromal tumors: from a surgical to a molecular approach. Int J Cancer. 2003;107:171-176. [PubMed] [DOI] |
| 5. | Miettinen M, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol. 2005;29:52-68. [PubMed] [DOI] |
| 6. | Dow N, Giblen G, Sobin LH, Miettinen M. Gastrointestinal stromal tumors: differential diagnosis. Semin Diagn Pathol. 2006;23:111-119. [PubMed] [DOI] |
| 7. | Stamatakos M, Douzinas E, Stefanaki C, Safioleas P, Polyzou E, Levidou G, Safioleas M. Gastrointestinal stromal tumor. World J Surg Oncol. 2009;7:61. [PubMed] [DOI] |
| 9. | Bórquez Ma P, Neveu C R. [Gastrointestinal stromal tumors. An update]. Rev Med Chil. 2008;136:921-929. [PubMed] |
| 11. | Corless CL, Heinrich MC. Molecular pathobiology of gastrointestinal stromal sarcomas. Annu Rev Pathol. 2008;3:557-586. [PubMed] [DOI] |
| 13. | 夏 泽锋, 陈 少飞, 陶 凯雄, 蔡 开琳, 帅 晓明, 韩 高雄, 王 继亮, 杜 寒松, 郑 威强, 王 国斌. 胃肠道间质瘤67例. 世界华人消化杂志. 2010;18:2266-2270. [DOI] |
| 14. | Hornick JL, Fletcher CD. Immunohistochemical staining for KIT (CD117) in soft tissue sarcomas is very limited in distribution. Am J Clin Pathol. 2002;117:188-193. [PubMed] [DOI] |
| 15. | Heinrich MC, Corless CL, Duensing A, McGreevey L, Chen CJ, Joseph N, Singer S, Griffith DJ, Haley A, Town A. PDGFRA activating mutations in gastrointestinal stromal tumors. Science. 2003;299:708-710. [PubMed] [DOI] |
| 16. | Peterson MR, Piao Z, Weidner N, Yi ES. Strong PDGFRA positivity is seen in GISTs but not in other intra-abdominal mesenchymal tumors: Immunohistochemical and mutational analyses. Appl Immunohistochem Mol Morphol. 2006;14:390-396. [PubMed] [DOI] |
| 17. | 郑 松, 陈 丽荣, 王 海军, 罗 月球, 朱 永良, 程 水珍, 周 燕. PDGFR-α在胃肠道间质瘤中的表及其临床意义. 浙江大学学报(医学版). 2007;36:280-284. |
| 18. | Miettinen M, Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med. 2006;130:1466-1478. [PubMed] |
| 19. | Medeiros F, Corless CL, Duensing A, Hornick JL, Oliveira AM, Heinrich MC, Fletcher JA, Fletcher CD. KIT-negative gastrointestinal stromal tumors: proof of concept and therapeutic implications. Am J Surg Pathol. 2004;28:889-894. [PubMed] [DOI] |
| 20. | Pauls K, Merkelbach-Bruse S, Thal D, Büttner R, Wardelmann E. PDGFRalpha- and c-kit-mutated gastrointestinal stromal tumours (GISTs) are characterized by distinctive histological and immunohistochemical features. Histopathology. 2005;46:166-175. [PubMed] [DOI] |
| 21. | Rossi G, Valli R, Bertolini F, Marchioni A, Cavazza A, Mucciarini C, Migaldi M, Federico M, Trentini GP, Sgambato A. PDGFR expression in differential diagnosis between KIT-negative gastrointestinal stromal tumours and other primary soft-tissue tumours of the gastrointestinal tract. Histopathology. 2005;46:522-531. [PubMed] [DOI] |
| 22. | West RB, Corless CL, Chen X, Rubin BP, Subramanian S, Montgomery K, Zhu S, Ball CA, Nielsen TO, Patel R. The novel marker, DOG1, is expressed ubiquitously in gastrointestinal stromal tumors irrespective of KIT or PDGFRA mutation status. Am J Pathol. 2004;165:107-113. [PubMed] [DOI] |
| 23. | Caputo A, Caci E, Ferrera L, Pedemonte N, Barsanti C, Sondo E, Pfeffer U, Ravazzolo R, Zegarra-Moran O, Galietta LJ. TMEM16A, a membrane protein associated with calcium-dependent chloride channel activity. Science. 2008;322:590-594. [PubMed] [DOI] |
| 24. | Yang YD, Cho H, Koo JY, Tak MH, Cho Y, Shim WS, Park SP, Lee J, Lee B, Kim BM. TMEM16A confers receptor-activated calcium-dependent chloride conductance. Nature. 2008;455:1210-1215. [PubMed] [DOI] |
| 25. | Carles A, Millon R, Cromer A, Ganguli G, Lemaire F, Young J, Wasylyk C, Muller D, Schultz I, Rabouel Y. Head and neck squamous cell carcinoma transcriptome analysis by comprehensive validated differential display. Oncogene. 2006;25:1821-1831. [PubMed] [DOI] |
| 26. | Miwa S, Nakajima T, Murai Y, Takano Y, Sugiyama T. Mutation assay of the novel gene DOG1 in gastrointestinal stromal tumors (GISTs). J Gastroenterol. 2008;43:531-537. [PubMed] [DOI] |
| 27. | Novelli M, Rossi S, Rodriguez-Justo M, Taniere P, Seddon B, Toffolatti L, Sartor C, Hogendoorn PC, Sciot R, Van Glabbeke M. DOG1 and CD117 are the antibodies of choice in the diagnosis of gastrointestinal stromal tumours. Histopathology. 2010;57:259-270. [PubMed] [DOI] |
| 28. | Lopes LF, West RB, Bacchi LM, van de Rijn M, Bacchi CE. DOG1 for the diagnosis of gastrointestinal stromal tumor (GIST): Comparison between 2 different antibodies. Appl Immunohistochem Mol Morphol. 2010;18:333-337. [PubMed] [DOI] |
| 33. | Espinosa I, Lee CH, Kim MK, Rouse BT, Subramanian S, Montgomery K, Varma S, Corless CL, Heinrich MC, Smith KS. A novel monoclonal antibody against DOG1 is a sensitive and specific marker for gastrointestinal stromal tumors. Am J Surg Pathol. 2008;32:210-218. [PubMed] [DOI] |
| 35. | Kang YN, Jung HR, Hwang I. Clinicopathological and immunohistochemical features of gastointestinal stromal tumors. Cancer Res Treat. 2010;42:135-143. [PubMed] [DOI] |