修回日期: 2011-01-17
接受日期: 2011-01-27
在线出版日期: 2011-03-18
骨桥蛋白(osteopontin, OPN)是一种多功能的糖蛋白, 在体内参与多种生理和病理活动. 众多的研究已经表明OPN表达在多种肝脏疾病和肝病动物模型中发生异常变化, 这种变化具有重要的病理意义. 深入研究OPN在不同肝脏疾病中的作用机制和其调控的通路, 对寻找治疗肝脏疾病的新靶点和开发新药物都有非常重要意义.
引文著录: 袁运生, 谢旻旗, 钱正昊, 张夕原, 严德珺, 俞雁. 骨桥蛋白: 肝脏疾病中的一个重要分子. 世界华人消化杂志 2011; 19(8): 814-819
Revised: January 17, 2011
Accepted: January 27, 2011
Published online: March 18, 2011
Osteopontin (OPN) is a multi-functional glycoprotein that has been implicated in a number of physiological and pathological events in vivo. Recent studies have shown that abnormal changes in OPN expression occur in many liver diseases and animal models of liver diseases and may play an important role in the pathogenesis of these diseases. Elucidation of mechanisms underlying the role of OPN in the pathogenesis of different liver diseases will help identify new therapeutic targets and develop new drugs for these diseases.
- Citation: Yuan YS, Xie MQ, Qian ZH, Zhang XY, Yan DJ, Yu Y. Osteopontin: an important molecule in liver diseases. Shijie Huaren Xiaohua Zazhi 2011; 19(8): 814-819
- URL: https://www.wjgnet.com/1009-3079/full/v19/i8/814.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i8.814
电骨桥蛋白(osteopontin, OPN), 又称为分泌磷酸蛋白(secreted phosphoprotein 1, SPP1), 最早被发现作为转化特异性的酸性蛋白, 后来又发现在骨骼中表达, 具有潜在的联系骨细胞和羟基磷灰石的桥梁作用, 因此在人体内被称为骨桥蛋白[1]. OPN是一种多功能的磷酸化糖蛋白, 在体内的多个组织和器官皆发现其表达, 包括肾脏、牙、血管内皮细胞、乳腺、胆管、胰腺、肝脏等[1,2]. OPN除了在骨骼中调控矿物质的代谢外, OPN广泛参与机体多种生理和病理过程, 其中主要包括以下4个方面: (1)保护细胞和抑制细胞凋亡[3]; (2)调控内皮细胞迁移[4]和炎症细胞的趋化, 如巨噬细胞的募集[5]; (3)改善损伤组织的重构与修复[6]; (4)OPN的高水平表达促进癌细胞的转移, 如乳腺癌[7]和肝癌的恶化[8]. 由于OPN的高水平表达和各类疾病的预后具有显著的相关性, 尤其是在肿瘤恶化方面, OPN已成为一个潜在的生物标记[9-11]. 在肝脏疾病方面, 包括胆管癌[12]、肝癌切除后移植[13]和乙型肝炎患者[14]等都表现了OPN的表达水平升高, 并显示出与疾病的发展及预后具有显著相关性. 同样, 高通量DNA微阵列芯片在肝脏疾病动物模型上的应用也帮助我们在肝脏疾病动物模型上也观察到了类似的结果[15,16]. 随着对肝脏疾病分子机制研究的不断深入, 越来越多的研究结果证明OPN在肝病的发生与治疗过程中具有重要的地位, OPN与肝脏疾病的关系及作用机制已成为研究热点之一. 我国是肝病患者数量较多, 尤其是病毒性肝炎的发病率高(107.3/10万人, 卫生部2010年卫生统计年鉴数据), 肝脏疾病已经成为我国一项重要的公共健康问题, 对于肝病相关调控因子的研究具有重要的科学意义和重大的社会价值. 本文将近年来OPN在肝脏疾病方面的国内外研究做一简要的综述.
人的OPN基因表达的蛋白有3个异构体分别是OPNa、OPNb和OPNc(http://www.ncbi.nlm.nih.gov), 其中OPNa成熟的mRNA达全部7个外显子(http://genome.ucsc.edu/cgi-bin/hgBlat), OPNa全长为314氨基酸残基, 成熟的OPN切去前面的16个氨基酸, b转录本缺少第5外显子, c转录本缺少第4外显子(图1). 小鼠OPN基因表达295个氨基酸残基的蛋白, 前15个氨基酸为信号肽, 小鼠OPN(mouse OPN, mOPN)和人OPN(human OPN, hOPN)具有59%的同源性[1].
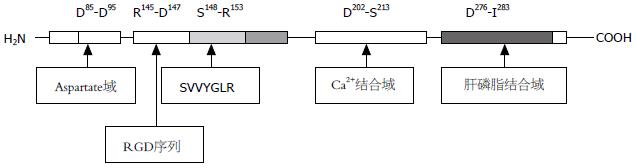
在不同物种的OPN蛋白中具有几个保守的序列, 这些序列对维持OPN蛋白的功能具有重要作用. 其中一个重要的特征序列为精氨酸-甘氨酸-天门冬氨酸(arginine-glycine-aspartic acid, RGD)细胞吸附序列, 可以直接和细胞外基质中的多种整合素结合(图2)[17]. 凝血酶消化位点也是一个重要的保守序列, 这一序列出现在各个物种中, 而OPN的磷酸化依赖于凝血酶的剪切[1,17]. 另外OPN还含有一个钙离子结合位点和两个肝磷脂结合结构域[3]. OPN蛋白富含精氨酸、谷氨酸和丝氨酸, 蛋白上含有1个N-糖基化和5-6个O-糖基化侧链, 含有多个丝氨酸磷酸化位点和苏氨酸磷酸化位点[1,18].
OPN在体内被凝血酶切割后, 分为两段, 其中C端的一段可以直接与CD44v6受体结合, 而N端一段则可以与整合素受体结合[1,19]. 整合素受体是由两个不同的亚基(α亚基和β亚基)组成的糖蛋白受体, OPN通过RGD序列和αvβ1、αvβ3、αvβ5、α9β1、α8β1受体结合, 调控细胞的迁移、趋化、吸附以及多种细胞内的信号通路. OPN可以与不同的整合素受体在不同的细胞中激活相同或者不同的信号通路[1]. 在功能上, OPN与αvβ3结合可以介导B淋巴细胞、血小板、破骨细胞和平滑肌细胞的吸附, 经过检测发现, αvβ3的表达还与乳腺癌的骨转移相关[19]. CD44受体是一种糖蛋白受体, 在体内广泛表达在各种细胞的表面, 调控细胞外基质和细胞与细胞间的相互作用与联系. CD44受体的配体众多, OPN与CD44v6型异构体相结合. 体外HepG2细胞株研究发现OPN不仅与CD44v6结合, 而且还调控CD44v6受体的表达, 并调控细胞的迁移[20].
OPN在正常的肝细胞中基本不表达, 但是在肝癌细胞中表达水平显著升高, 并且高水平的OPN表达是肝癌恶化的重要诊断生物标记之一. 在肝癌组织中, OPN的转录水平和蛋白水平的显著升高都起到了促进患者病情恶化的效果[21]. 对比肝细胞癌(hepatocellular carcinoma, HCC)患者、慢性肝病和正常人群的血清OPN水平发现, OPN在HCC患者中的血清水平要显著高于慢性肝病患者和正常人, 统计分析表明, 这种血清水平的变化和HCC患者的疾病发展程度具有很高的相关性, 他对于肝癌诊断的敏感性与特异性分别达到了87%和82%[22]. 近年, 在对OPN在乙型肝炎导致HCC患者中表达水平的变化时发现, 由乙肝病毒导致的HCC患者, 患者体内的OPN水平升高与患者的生存期直接相关. OPN水平异常升高患者的无病生存期与总生存时间要显著短于OPN水平较低的患者[23].
在调控机制方面, OPN接受肝生长因子(hepatocyte growth factor, HGF)调控, 并参与HGF对细胞迁移调控的自分泌调节因子和HGF进行相互作用, 调控癌细胞的迁移和侵入[24]. 体内和体外的研究已经证实OPN是调控HCC细胞迁移与侵入的重要因子. 如果对高侵入型HCC细胞株SK-Hep-1的OPN基因进行敲除, 可有效降低其侵入能力, 并且其侵入能力可以通过添加外源性的OPN得以恢复[25]. 除了OPN与HGF之间的相互调控之外, OPN促进基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)的表达来对细胞外基质进行重构和促进细胞迁移[26]. 同时, OPN可被MMP-9水解后产生的一个5 000 Da小片段(从167-210)对HCC细胞的迁移起到重要的调控作用[27]. OPN很有可能成为下一个在HCC临床诊断中的重要诊断指标, 也是一个潜在的治疗靶点.
肝炎是我国最常见的肝病之一, 患者数量众多. OPN在各种肝炎中均表现为表达水平升高, 并对疾病的发展具有重要的调控作用, 其中包括病毒性肝炎[14], 酒精性肝炎(alcoholic hepatitis, AH)[28]和重症肝炎(fulminant hepatitis, FH)等[29]. 在丙型肝炎患者中, 血清OPN水平的高低与患者发展成肝纤维化与炎症活动呈正相关, 而在乙型肝炎患者体内血清OPN的水平高低与患者发展成为肝硬化也具有正相关. 因此, 在一定程度上, OPN可以作为病毒性肝炎活动的诊断指标之一[14,30]. 在动物模型研究中发现, AH模型的体内OPN水平表现了与临床上的升高相一致, OPN的水平也在一定程度反应了肝脏的病理变化[2,31,32]. OPN对疾病进程相关性上, FH患者表现尤为明显. 临床上FH患者的血清OPN水平急剧升高, 并与具有相似症状的自限性肝炎具有显著的差异, 后者OPN的水平远低于重症肝炎. 另外, 在FH患者之间, OPN水平的差异与疾病的预后有重要相关性[2]. 高水平的OPN对FH的预后非常不利, 这个在对FH动物模型研究中也得到了证实. 无论是通过RNA干扰还是注射OPN抗体都能有效的降低血清转氨酶水平, 减少肝脏组织的坏死, 有效保护肝细胞[29]. OPN调控肝脏炎症过程中, 主要是OPN可以趋化单核细胞, 增加单核细胞的滤过性, 造成肝细胞的免疫性损伤与肝小叶坏死[33], 另一方面OPN还可以介导中性粒细胞的浸润, 加重肝脏炎症程度[34].
肝脏纤维化是一种常见的慢性肝脏疾病, 其持续的发展最后会导致肝硬化. OPN同样也参与肝纤维化的进程调控, 但与肝癌与肝炎不同, 在不同的病因诱导的肝纤维化进程中OPN发挥不同的调控作用. 目前研究显示, 在大部分病因诱导的肝纤维化过程中, OPN都发挥了加速和促进纤维化的作用, 如病毒感染[30]、胆道病变[35]和非酒精性肝炎[36]等. 众所周知, 肝脏纤维化的机制是由于肝脏受到慢性损伤后肝星状细胞活化, 基质胶原蛋白分泌增加, 从导致肝脏的纤维化, TGF-β1调控的信号通路是目前研究最清楚的肝纤维化调控因子之一, 作为TGF-β1的下游基因, OPN的表达水平还有可能通过激活NF-κB通路来直接参与了肝星状细胞的激活[37-39]. 同时, 在肝脏受到损上后, 肝星状细胞自身也开始高水平表达OPN[40]. 除此之外, OPN还接受刺猬蛋白信号通路(hedgehog pathway)的激活和纤维原细胞特异蛋白1(fibroblast-specific protein 1, FSP1)的调控, 加速肝纤维化和肝硬化进程[41].
但也有例外, 在CCl4诱导肝纤维化小鼠模型中却观察到了OPN可以有效地减轻肝纤维化的程度. 同时, 利用OPN基因敲除小鼠和野生型小鼠建立肝纤维化模型发现, OPN基因敲除小鼠肝脏的纤维化程度高于野生型小鼠[42]. 肝纤维化形成是由多因子复杂网络调控的漫长过程, OPN在其中可能并不是决定性因素, OPN在不同的病理环境下发挥不同的调控功能.
尽管在大多数肝病中, OPN都起到加重病情的作用, 但这并不妨碍他对肝损伤后修复起到潜在正调控作用. 在注射了CCl4的肝损伤模型小鼠肝脏中分离出的库普弗细胞、巨噬细胞和星状细胞中, OPN的表达水平显著增加[40], 可能与和其他趋化因子协同作用, 促进库普弗细胞和巨噬细胞的渗透性[43]. 库普弗细胞的活化在肝再生修复过程中起到重要作用[44]. 通过对FH病理研究还发现了OPN不仅在炎性细胞中表达, 他在再生的肝细胞和胆管中也有表达, 人们推测OPN可能和肝脏的干细胞活化有关[2]. 同时, OPN基因是肝再生起始的重要调控因子HGF的下游靶基因之一[24]. OPN在体内通过调控前MMP-9的活性来调控尿激酶型纤溶酶激活因子(urokinase plasminogen activator, uPA)的分泌, uPA是肝再生过程中, 调控水解细胞基质蛋白和清除坏死区细胞残余的重要因子, 这对肝损伤后再生修复具有十分重要的意义[45,46]. 除此之外, OPN对肝脏的保护功能还在整体动物水平上得到体现, 对OPN基因缺陷型小鼠的研究显示, 无论是单次还是长期多次用CCl4处理小鼠, 基因缺陷型小鼠的肝脏早期的坏死区域都要显著大于野生型小鼠, 而在后期的肝纤维化程度上, 缺陷型比野生型更加严重, 这在一定程度上表明了OPN增加了肝细胞在受到化学毒害时的生存机会, 有利于肝脏的再生和修复[42].
OPN和肝脏疾病有着密切的联系, 但在不同的肝脏疾病中, 其作用却并不相同, 主要表现在以下3个方面: (1)OPN是促进肝癌恶化的关键细胞因子之一, 对肝癌的诊断和预后有重要的参考价值, 是肝癌诊断的潜在指标, 并有可能发展成为肝癌治疗的一个重要治疗靶点; (2)OPN的高水平表达能够加剧肝脏的炎症和由慢性肝炎与胆道病变诱导的肝纤维化与硬化, 能够部分反应肝脏炎症的活动水平; (3)OPN在化学性的肝损伤方面是重要的肝损伤保护因子, 对肝脏的修复起到正调控作用. 进一步深入研究OPN在不同肝病中表现出调控作用特异性, 将有助于揭示OPN在肝脏病理过程中的作用分子机制和发现OPN在疾病状态下所参与的调控通路, 这对于发现肝脏疾病诊断的新标记、治疗的新靶点具有特殊的意义.
骨桥蛋白(OPN)是一种多功能的磷酸化糖蛋白, 在体内的多个组织和器官皆发现其表达, 包括肾脏、牙、血管内皮细胞、乳腺、胆管、胰腺、肝脏等. 由于OPN的高水平表达和各类疾病的预后具有显著的相关性, 尤其是在肿瘤恶化方面, OPN已成为一个潜在的生物标记.
梅林, 教授, 北京大学医学部生理学与病理生理学系神经调节和消化内分泌研究室
随着对肝脏疾病分子机制研究的不断深入, 越来越多的研究结果证明OPN在肝病的发生与治疗过程中具有重要的地位, OPN与肝脏疾病的关系及作用机制已成为研究热点之一.
在动物模型研究中发现, AH模型的体内OPN水平表现了与临床上的升高相一致, OPN的水平也在一定程度反应了肝脏的病理变化.
本文可读性较好, 具有一定的临床参考意义.
编辑: 李薇 电编:何基才
| 1. | Sodek J, Ganss B, McKee MD. Osteopontin. Crit Rev Oral Biol Med. 2000;11:279-303. [PubMed] [DOI] |
| 2. | Arai M, Yokosuka O, Kanda T, Fukai K, Imazeki F, Muramatsu M, Seki N, Miyazaki M, Ochiai T, Hirasawa H. Serum osteopontin levels in patients with acute liver dysfunction. Scand J Gastroenterol. 2006;41:102-110. [PubMed] [DOI] |
| 3. | Mazzali M, Kipari T, Ophascharoensuk V, Wesson JA, Johnson R, Hughes J. Osteopontin--a molecule for all seasons. QJM. 2002;95:3-13. [PubMed] [DOI] |
| 4. | Poggio P, Grau JB, Field BC, Sainger R, Seefried WF, Rizzolio F, Ferrari G. Osteopontin controls endothelial cell migration in vitro and in excised human valvular tissue from patients with Calcific Aortic Stenosis and controls. J Cell Physiol. 2010; Dec6. [Epub ahead of print]. [PubMed] |
| 5. | Marcondes MC, Poling M, Watry DD, Hall D, Fox HS. In vivo osteopontin-induced macrophage accumulation is dependent on CD44 expression. Cell Immunol. 2008;254:56-62. [PubMed] [DOI] |
| 6. | Liaw L, Birk DE, Ballas CB, Whitsitt JS, Davidson JM, Hogan BL. Altered wound healing in mice lacking a functional osteopontin gene (spp1). J Clin Invest. 1998;101:1468-1478. [PubMed] |
| 7. | Yu KN, Minai-Tehrani A, Chang SH, Hwang SK, Hong SH, Kim JE, Shin JY, Park SJ, Kim JH, Kwon JT. Aerosol delivery of small hairpin osteopontin blocks pulmonary metastasis of breast cancer in mice. PLoS One. 2010;5:e15623. [PubMed] |
| 8. | Chen RX, Xia YH, Xue TC, Ye SL. Transcription factor c-Myb promotes the invasion of hepatocellular carcinoma cells via increasing osteopontin expression. J Exp Clin Cancer Res. 2010;29:172. [PubMed] |
| 9. | Zhao B, Sun T, Meng F, Qu A, Li C, Shen H, Jin Y, Li W. Osteopontin as a potential biomarker of proliferation and invasiveness for lung cancer. J Cancer Res Clin Oncol. 2011; Jan 5. [Epub ahead of print]. [PubMed] |
| 10. | Konno S, Hizawa N, Nishimura M, Huang SK. Osteopontin: a potential biomarker for successful bee venom immunotherapy and a potential molecule for inhibiting IgE-mediated allergic responses. Allergol Int. 2006;55:355-359. [PubMed] [DOI] |
| 11. | Kim JH, Skates SJ, Uede T, Wong KK, Schorge JO, Feltmate CM, Berkowitz RS, Cramer DW, Mok SC. Osteopontin as a potential diagnostic biomarker for ovarian cancer. JAMA. 2002;287:1671-1679. [PubMed] [DOI] |
| 12. | Hass HG, Nehls O, Jobst J, Frilling A, Vogel U, Kaiser S. Identification of osteopontin as the most consistently over-expressed gene in intrahepatic cholangiocarcinoma: detection by oligonucleotide microarray and real-time PCR analysis. World J Gastroenterol. 2008;14:2501-2510. [PubMed] [DOI] |
| 13. | Sieghart W, Wang X, Schmid K, Pinter M, König F, Bodingbauer M, Wrba F, Rasoul-Rockenschaub S, Peck-Radosavljevic M. Osteopontin expression predicts overall survival after liver transplantation for hepatocellular carcinoma in patients beyond the Milan criteria. J Hepatol. 2011;54:89-97. [PubMed] [DOI] |
| 14. | Zhao L, Li T, Wang Y, Pan Y, Ning H, Hui X, Xie H, Wang J, Han Y, Liu Z. Elevated plasma osteopontin level is predictive of cirrhosis in patients with hepatitis B infection. Int J Clin Pract. 2008;62:1056-1062. [PubMed] |
| 15. | Yuan Y, Wu X, Ou Q, Gao J, Tennant BC, Han W, Yu Y. Differential expression of the genes involved in amino acids and nitrogen metabolisms during liver regeneration of mice. Hepatol Res. 2009;39:301-312. [PubMed] [DOI] |
| 16. | Xu CS, Zhang AS, Han HP, Yuan JY, Chang CF, Li WQ, Yang KJ, Zhao LF, Li YC, Zhang HY. Gene expression differences of regenerating rat liver in a short interval successive partial hepatectomy. World J Gastroenterol. 2004;10:2680-2689. [PubMed] |
| 17. | Denhardt DT, Noda M, O'Regan AW, Pavlin D, Berman JS. Osteopontin as a means to cope with environmental insults: regulation of inflammation, tissue remodeling, and cell survival. J Clin Invest. 2001;107:1055-1061. [PubMed] [DOI] |
| 18. | Rangaswami H, Bulbule A, Kundu GC. Osteopontin: role in cell signaling and cancer progression. Trends Cell Biol. 2006;16:79-87. [PubMed] [DOI] |
| 19. | Wai PY, Kuo PC. The role of Osteopontin in tumor metastasis. J Surg Res. 2004;121:228-241. [PubMed] [DOI] |
| 20. | Gao C, Guo H, Downey L, Marroquin C, Wei J, Kuo PC. Osteopontin-dependent CD44v6 expression and cell adhesion in HepG2 cells. Carcinogenesis. 2003;24:1871-1878. [PubMed] [DOI] |
| 21. | Pan HW, Ou YH, Peng SY, Liu SH, Lai PL, Lee PH, Sheu JC, Chen CL, Hsu HC. Overexpression of osteopontin is associated with intrahepatic metastasis, early recurrence, and poorer prognosis of surgically resected hepatocellular carcinoma. Cancer. 2003;98:119-127. [PubMed] [DOI] |
| 22. | Kim J, Ki SS, Lee SD, Han CJ, Kim YC, Park SH, Cho SY, Hong YJ, Park HY, Lee M. Elevated plasma osteopontin levels in patients with hepatocellular carcinoma. Am J Gastroenterol. 2006;101:2051-2059. [PubMed] [DOI] |
| 23. | Xie H, Song J, Du R, Liu K, Wang J, Tang H, Bai F, Liang J, Lin T, Liu J. Prognostic significance of osteopontin in hepatitis B virus-related hepatocellular carcinoma. Dig Liver Dis. 2007;39:167-172. [PubMed] [DOI] |
| 24. | Medico E, Gentile A, Lo Celso C, Williams TA, Gambarotta G, Trusolino L, Comoglio PM. Osteopontin is an autocrine mediator of hepatocyte growth factor-induced invasive growth. Cancer Res. 2001;61:5861-5868. [PubMed] |
| 25. | Cheng J, Huo DH, Kuang DM, Yang J, Zheng L, Zhuang SM. Human macrophages promote the motility and invasiveness of osteopontin-knockdown tumor cells. Cancer Res. 2007;67:5141-5147. [PubMed] [DOI] |
| 26. | Chen RX, Xia YH, Xue TC, Ye SL. Osteopontin promotes hepatocellular carcinoma invasion by up-regulating MMP-2 and uPA expression. Mol Biol Rep. 2010; Nov 23. [Epub ahead of print]. [PubMed] |
| 27. | Takafuji V, Forgues M, Unsworth E, Goldsmith P, Wang XW. An osteopontin fragment is essential for tumor cell invasion in hepatocellular carcinoma. Oncogene. 2007;26:6361-6371. [PubMed] [DOI] |
| 28. | Seth D, Gorrell MD, Cordoba S, McCaughan GW, Haber PS. Intrahepatic gene expression in human alcoholic hepatitis. J Hepatol. 2006;45:306-320. [PubMed] [DOI] |
| 29. | Saito Y, Kon S, Fujiwara Y, Nakayama Y, Kurotaki D, Fukuda N, Kimura C, Kanayama M, Ito K, Diao H. Osteopontin small interfering RNA protects mice from fulminant hepatitis. Hum Gene Ther. 2007;18:1205-1214. [PubMed] [DOI] |
| 30. | Huang W, Zhu G, Huang M, Lou G, Liu Y, Wang S. Plasma osteopontin concentration correlates with the severity of hepatic fibrosis and inflammation in HCV-infected subjects. Clin Chim Acta. 2010;411:675-678. [PubMed] [DOI] |
| 31. | Apte UM, Banerjee A, McRee R, Wellberg E, Ramaiah SK. Role of osteopontin in hepatic neutrophil infiltration during alcoholic steatohepatitis. Toxicol Appl Pharmacol. 2005;207:25-38. [PubMed] [DOI] |
| 32. | Banerjee A, Apte UM, Smith R, Ramaiah SK. Higher neutrophil infiltration mediated by osteopontin is a likely contributing factor to the increased susceptibility of females to alcoholic liver disease. J Pathol. 2006;208:473-485. [PubMed] [DOI] |
| 33. | Mochida S, Yoshimoto T, Mimura S, Inao M, Matsui A, Ohno A, Koh H, Saitoh E, Nagoshi S, Fujiwara K. Transgenic mice expressing osteopontin in hepatocytes as a model of autoimmune hepatitis. Biochem Biophys Res Commun. 2004;317:114-120. [PubMed] [DOI] |
| 34. | Diao H, Kon S, Iwabuchi K, Kimura C, Morimoto J, Ito D, Segawa T, Maeda M, Hamuro J, Nakayama T. Osteopontin as a mediator of NKT cell function in T cell-mediated liver diseases. Immunity. 2004;21:539-550. [PubMed] [DOI] |
| 35. | Fickert P, Thueringer A, Moustafa T, Silbert D, Gumhold J, Tsybrovskyy O, Lebofsky M, Jaeschke H, Denk H, Trauner M. The role of osteopontin and tumor necrosis factor alpha receptor-1 in xenobiotic-induced cholangitis and biliary fibrosis in mice. Lab Invest. 2010;90:844-852. [PubMed] [DOI] |
| 36. | Syn WK, Choi SS, Liaskou E, Karaca GF, Agboola KM, Oo YH, Mi Z, Pereira TA, Zdanowicz M, Malladi P. Osteopontin is induced by hedgehog pathway activation and promotes fibrosis progression in nonalcoholic steatohepatitis. Hepatology. 2011;53:106-115. [PubMed] |
| 37. | Liu X, Hu H, Yin JQ. Therapeutic strategies against TGF-beta signaling pathway in hepatic fibrosis. Liver Int. 2006;26:8-22. [PubMed] [DOI] |
| 38. | Tokairin T, Nishikawa Y, Watanabe H, Doi Y, Omori Y, Yoshioka T, Yamamoto Y, Yoshida M, Nishimura T, Li Q. Osteopontin expression in the liver with severe perisinusoidal fibrosis: autopsy case of Down syndrome with transient myeloproliferative disorder. Pathol Int. 2008;58:64-68. [PubMed] |
| 39. | Huang L, Wei MF, Feng JX. Abnormal activation of OPN inflammation pathway in livers of children with biliary atresia and relationship to hepatic fibrosis. Eur J Pediatr Surg. 2008;18:224-229. [PubMed] [DOI] |
| 40. | Kawashima R, Mochida S, Matsui A, YouLuTuZ Y, Ishikawa K, Toshima K, Yamanobe F, Inao M, Ikeda H, Ohno A. Expression of osteopontin in Kupffer cells and hepatic macrophages and Stellate cells in rat liver after carbon tetrachloride intoxication: a possible factor for macrophage migration into hepatic necrotic areas. Biochem Biophys Res Commun. 1999;256:527-531. [PubMed] [DOI] |
| 41. | Österreicher CH, Penz-Österreicher M, Grivennikov SI, Guma M, Koltsova EK, Datz C, Sasik R, Hardiman G, Karin M, Brenner DA. Fibroblast-specific protein 1 identifies an inflammatory subpopulation of macrophages in the liver. Proc Natl Acad Sci U S A. 2011;108:308-313. [PubMed] [DOI] |
| 42. | Lorena D, Darby IA, Gadeau AP, Leen LL, Rittling S, Porto LC, Rosenbaum J, Desmoulière A. Osteopontin expression in normal and fibrotic liver. altered liver healing in osteopontin-deficient mice. J Hepatol. 2006;44:383-390. [PubMed] [DOI] |
| 43. | Wang Y, Mochida S, Kawashima R, Inao M, Matsui A, YouLuTuZ Y, Nagoshi S, Uede T, Fujiwara K. Increased expression of osteopontin in activated Kupffer cells and hepatic macrophages during macrophage migration in Propionibacterium acnes-treated rat liver. J Gastroenterol. 2000;35:696-701. [PubMed] [DOI] |
| 44. | Takeishi T, Hirano K, Kobayashi T, Hasegawa G, Hatakeyama K, Naito M. The role of Kupffer cells in liver regeneration. Arch Histol Cytol. 1999;62:413-422. [PubMed] [DOI] |
| 45. | Bezerra JA, Currier AR, Melin-Aldana H, Sabla G, Bugge TH, Kombrinck KW, Degen JL. Plasminogen activators direct reorganization of the liver lobule after acute injury. Am J Pathol. 2001;158:921-929. [PubMed] [DOI] |
| 46. | Rangaswami H, Bulbule A, Kundu GC. Nuclear factor-inducing kinase plays a crucial role in osteopontin-induced MAPK/IkappaBalpha kinase-dependent nuclear factor kappaB-mediated promatrix metalloproteinase-9 activation. J Biol Chem. 2004;279:38921-38935. [PubMed] [DOI] |