修回日期: 2010-12-14
接受日期: 2010-12-21
在线出版日期: 2011-03-18
目的: 评估益生菌植物乳杆菌(LP)对三硝基苯磺酸(TNBS)诱导小鼠肠道炎症损伤的治疗作用, 并探讨其可能的作用机制.
方法: 将成年♀Balb/c小鼠随机分成3组: 正常对照组(Control组), TNBS灌肠诱导小鼠结肠炎组(TNBS组)和LP干预组(TNBS+LP组), TNBS诱导肠炎模型建立后, 给予TNBS+LP组小鼠灌胃LP 3 wk, 其余两组灌胃空白对照PBS液. 实验结束后对大鼠一般情况、结肠大体损伤及组织学损伤进行评估, 并对各组小鼠结肠组织髓过氧化物酶(MPO)活性、LTB4含量及促炎细胞因子TNF-α和IFN-γ的表达进行测定.
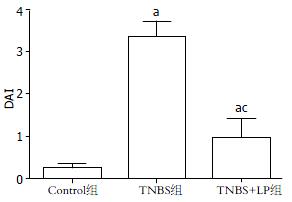
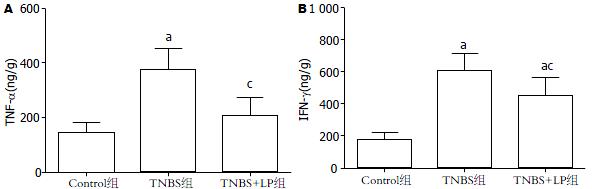
结果: 与TNBS诱导的TNBS组相比, LP明显减轻了TNBS诱导的小鼠结肠炎症, 表现为疾病活动指数下降(3.37 ± 0.36 vs 0.97±0.47, P<0.05), 结肠大体和组织学评分显著降低(1.11±0.61 vs 4.62±0.40; 1.48±0.40 vs 5.39±1.12, 均P<0.05), 且LP显著降低了TNBS诱导的小鼠结肠黏膜内中性粒细胞浸润, 这与MPO活性降低相一致(25.14 U/g±5.22 U/g vs 90.3 U/g±7.70 U/g, P<0.05). 此外, LP明显降低了TNBS诱导的小鼠结肠内具有化学趋化活性的LTB4含量(3.13 ng/g±0.10 ng/g vs 8.43 ng/g±0.49 ng/g, P<0.05)和增加了促炎细胞因子TNF-α和IFN-γ的表达(205 ng/g±68 ng/g vs 375 ng/g±79 ng/g; 446 ng/g±116 ng/g vs 603 ng/g±109 ng/g, 均P<0.05).
结论: 口服植物乳杆菌能有效缓解TNBS诱导的小鼠结肠炎症状, 其作用机制可能与其降低白细胞聚集及促炎细胞因子的表达有关.
引文著录: 叶胜青, 赵志鸿, 夏阳, 陈红旗. 植物乳杆菌对2,4,6-三硝基苯磺酸诱导的小鼠结肠炎的治疗作用. 世界华人消化杂志 2011; 19(8): 794-799
Revised: December 14, 2010
Accepted: December 21, 2010
Published online: March 18, 2011
AIM: To determine the effect of administration of Lactobacillus plantarum (LP) on established colitis in mice and to explore possible mechanisms involved.
METHODS: A model of colitis was induced by intracolonic injection of 2,4,6-trinitrobenzene sulfonic acid sodium salt (TNBS) in adult Balb/c mice. The mice were then treated with LP (109 CFU) or vehicle for three weeks. After treatment, all mice were killed and colonic damage was evaluated both histologically and biochemically, including determination of the activity of myeloperoxidase (MPO) activity, and the levels of leukotriene B4 (LTB4), tumor necrosis factor α (TNF-α) and interferon-γ (IFN-γ) in colon tissue.
RESULTS: LP therapy resulted in amelioration of colitis induced with TNBS in mice when compared with control mice without undergoing LP treatment. This anti-inflammatory effect of LP was evidenced by a significant reduction of macroscopic and microscopic colonic damage scores (1.11 ± 0. 61 vs 4.62 ± 0. 40, P < 0.05; 1.48 ± 0.40 vs 5.39 ± 1.12, P < 0.05). Moreover, a reduction of neutrophil infiltrate in LP-treated mice was confirmed biochemically by a significant reduction of the activity of colonic MPO (25.14 U/g ± 5.22 U/g vs 90.3 U/g ± 7.70 U/g, P < 0.05), a marker of neutrophil infiltration, in comparison with non-treated colitic mice. In addition, treatment with LP resulted in a lower colonic content of LTB4 and in a significant reduction of proinflammatory factors, such as TNF-α and IFN-γ, when compared with control mice (3.13 ng/g ± 0.10 ng/g vs 8.43 ng/g ± 0. 49 ng/g, P < 0.05; 205 ng/g ± 68 ng/g vs 375 ng/g ± 79 ng/g, P < 0.05; 446 ng/g ± 116 ng/g vs 603 ng/g ± 109 ng/g, P < 0.05).
CONCLUSION: Administration of LP is effective in accelerating the recovery of experimental colitis in mice possibly by reducing leukocyte accumulation and proinflammatory cytokine expression.
- Citation: Ye SQ, Zhao ZH, Xia Y, Chen HQ. Administration of Lactobacillus plantarum reduces TNBS-induced colitis in mice. Shijie Huaren Xiaohua Zazhi 2011; 19(8): 794-799
- URL: https://www.wjgnet.com/1009-3079/full/v19/i8/794.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i8.794
炎症性肠病(inflammatory bowel disease, IBD)是一种慢性肠道炎症状态, 包括溃疡性结肠炎和克罗恩病. IBD是遗传、免疫和环境等综合因素作用的结果, 具体病因不明. 目前研究表明, 肠道菌群在IBD的发生发展中起到了至关重要的作用[1,2]. 益生菌被定义为一种活的微生物, 当摄入足够数量后能发挥其对宿主的健康有益作用. 尽管益生菌的具体作用机制不明, 但其具有调节肠道菌群(促进有益菌的生长、对抗致病菌的作用)、减缓炎症进程和增强肠道屏障功能的作用[3,4]. 临床及动物实验研究均证实, 益生菌能有效诱导和维持缓解溃疡性结肠炎的炎症状态, 减轻症状[5-7], 而有关益生菌对肠道炎症建立后的治疗作用研究报道则较少. 本实验旨在评估益生菌对2,4,6三硝基苯磺酸(trinitro-benzene-sulfonic acid, TNBS)诱导小鼠肠道炎症损伤的治疗作用, 并探讨其可能作用机制.
♀健康清洁级SD大鼠, 购自上海市实验动物中心; TNBS购于美国Sigma公司; 植物乳杆菌(Lactobacillus plantarum, LP, CGMCC 1258)由上海交大昂立医药研究院提供, 以低压冻干菌粉的形式保存于-20 ℃.
1.2.1 LP菌液配制: LP菌粉用Ringer缓冲液稀释后2 h内经改良MC培养基37 ℃厌氧培养48 h, 活菌数达5×1010 CFU/g. 将该菌粉置于MRS液体培养基中37 ℃厌氧培养12 h, 5 000 r/min离心5 min, 出去上清液, 菌体悬于无菌PBS缓冲液中, 利用分光光度法配制成1.0×109 CFU/mL浓度的LP悬液备用.
1.2.2 实验性结肠炎小鼠模型制作: 按先前建立的方法利用TNBS诱导小鼠结肠炎模型[8]: 小鼠禁食24 h后, 用氯胺酮腹腔注射麻醉, 将硅胶导管(15G)置入肛门内约6 cm, 模型组小鼠经硅胶导管灌注100 μL TNBS/乙醇溶液(0.5 mg TNBS+等体积无水乙醇), 正常对照组(Control组)灌注等量的0.9%盐溶液, 小鼠头低脚高位保持约30 s, 建立TNBS结肠炎模型.
1.2.3 实验设计: 采用随机数字表法将24只8周龄Balb/c小鼠随机分成3组: Control组(n = 8), TNBS组(TNBS, n = 8), 干预组(TNBS+LP, n = 8). TNBS诱导肠炎后, TNBS组小鼠每日清晨灌胃PBS 0.5 mL, TNBS+LP组小鼠每日灌胃LP 0.5 mL, 持续3 wk. 实验开始后每日监测小鼠食物摄入量、体质量和结肠炎临床征象. 对小鼠一般状况及疾病活动指数(disease activity index, DAI)进行评估. DAI依据(体质量下降分数+粪便性状分数+便血分数)/3进行计算[9]. 实验结束后将小鼠处死, 收集结肠组织行组织病理学检查、髓过氧化物酶(myeloperoxidase, MPO)、白细胞三烯B4(leukotriene B4, LTB4)和促炎细胞因子TNF-α和IFN-γ分析.
1.2.4 结肠炎症大体和组织学损伤评估: 将小鼠处死后取其结肠组织, 参照Peran等[9]的方法, 进行大体评分(0-10分). 并将新鲜切取结肠组织置于40 g/L甲醛中, 经常规石蜡包埋、脱水处理后4 μm切片, HE染色后镜检, 采用双盲法按如下标准进行组织病理学评分[10]: 黏膜溃疡(0-2分), 上皮细胞增生(0-2分), 单核细胞浸润(0-2分), 中性粒细胞浸润(0-2分), 隐窝萎缩(0-2分)和坏死(0-2分).
1.2.5 MPO活性检测: 切除结肠组织约0.2 g置于冷的六溴十二烷基三甲基铵缓冲中匀浆, 经3个冻融循环后, 60 ℃孵育, 10 000 g离心10 min, 再将上清液置于96培养板, 并与3,3',5,5'-四甲基联苯胺和过氧化氢混合. 测定各样本吸光度(A)值. 利用蛋白定量试剂盒(Quick Start Bradford Protein Assay, Bio-Rad, Hercules, CA)对上清液蛋白进行定量, MPO活性表示为U/g.
1.2.6 LTB4含量检测: 按试剂盒(Cayman Chemical, Ann Arbor, MI)方法, 取病变段结肠组织0.2 g, 按质量体积比为1:19加入匀浆介质制成5%组织匀浆, 根据测得的标准品A值和对应浓度绘制标准曲线, 根据标准曲线和测得的各样本A值计算对应LTB4含量.
1.2.7 TNF-α和IFN-γ表达检测: 利用ELISA试剂盒(BD Pharmingen, Oxford, UK)对结肠组织TNF-α和IFN-γ的表达进行检查, 方法如下: 将切除结肠组织与冷的匀浆液(含有2%胎牛血清和0.5%十六烷基三甲基溴)混合后匀浆, 将匀浆液在4 ℃ 15 000 g离心15 min. 利用BCA蛋白定量试剂盒(Pierce, Rockford, IL, USA)对上清液蛋白进行定量. 结肠上清液中TNF-α和IFN-γ的含量依据说明进行测量, 表示为μg/g.
统计学处理 本研究应用SPSS16.0统计包进行统计分析, 实验数据以mean±SD表示, 采用单因素方差分析(One-way ANOVA)进行各组比较, 组间比较采用SNK法. 以P<0.05为差异有统计学意义.
小鼠经TNBS灌肠诱导肠炎后, 出现食量下降、腹泻、便血等消化道症状, 及毛色灰暗、精神萎靡和体质量下降等改变. LP干预后小鼠食量和体重均出现明显增加, 毛色逐渐光泽, 精神状态明显好转, 腹泻和血便消失, DAI评分明显下降(3.37±0.36 vs 0.97±0.47, P<0.05, 图1).
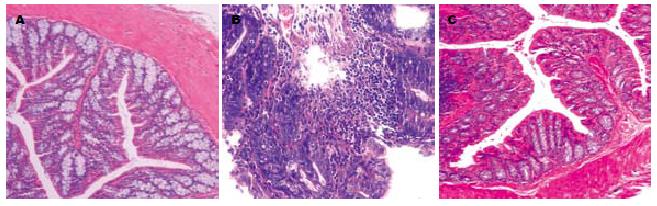
TNBS诱导后的小鼠结肠大体损伤的部位主要位于直肠远端, 表现为黏膜充血、水肿、糜烂、溃疡, 可见肠壁局部增厚、肠腔狭窄. 组织学分析显示, 损伤部位主要位于黏膜及黏膜下层, 以中性粒细胞浸润为主, 亦可见单核细胞、巨噬细胞浸润, 可见透壁性溃疡形成及隐窝脓肿(图2). LP干预后, 小鼠结肠大体和组织学病变均出现明显好转, 大体标本仅可见轻度黏膜充血、水肿, 偶有可见糜烂和溃疡形成, 大体损伤评分TNBS组明显高于Control组, TNBS+LP组则显著低于TNBS组(表1). 组织学表现仅有散在炎症细胞浸润, 且以单核细胞和巨噬细胞为主, 轻度上皮细胞增生. 组织学损伤评分TNBS组高于Control组, 而TNBS+LP组较TNBS组则出现显著降低(表1).
MPO作为中性粒细胞浸润的标志物, 在TNBS诱导的小鼠结肠炎组织出现明显增高, 而LP干预3 wk后, TNBS+LP组小鼠结肠MPO活性较TNBS组明显降低, 与Control组已无统计学差异(表1). 类似于MPO活性分析, LTB4含量在TNBS诱导的小鼠结肠炎模型中出现明显的增加, 而LP作用后则出现明显的下降, 尽管LP未能使LTB4含量恢复至正常水平, 但TNBS+LP组与TNBS组相比具有明显的统计学差异(表1).
在TNBS诱导的结肠炎模型小鼠结肠组织中, 促炎细胞因子TNF-α和IFN-γ的表达出现明显增强, 而LP干预3 wk后, 两者均出现了显著降低, 具有统计学差异(图3).
已有研究表明, TNBS灌肠诱导小鼠结肠炎的发生与以下机制有关: TNBS作用后直接引起活性氧族, 如超氧负离子、过氧化氢等的大量产生, 引起肠壁的非特异性损伤[11-13]; 随后, 特征性Th1型迟发型超敏反应的发生则进一步导致结肠壁出现慢性透壁性损伤, 类似于人类克罗恩病[11,14].
既往研究表明益生菌能有效阻止各种半抗原物质介导的实验性结肠炎的发生[12,15-17], 这可能与其具有促进有益菌如双歧杆菌、乳酸杆菌的生长, 增强短链脂肪酸的合成, 增加谷胱甘肽的合成与分泌, 及调节细胞因子分泌的作用有关[18-20]. 我们前期的实验研究亦表明, 预防性应用益生菌能下调黏附分子在实验性结肠炎模型小鼠中的高表达, 缓解肠道炎症[21]. 而有关益生菌对已建立结肠炎模型的治疗作用研究则较少, 为此, 本实验在TNBS灌肠诱导小鼠结肠炎建立的基础上, 开展了益生菌对已建立结肠炎的治疗作用评估. 本研究发现, LP能有效减轻TNBS诱导的结肠炎症状, 表现为TNBS小鼠一般状况的改善、DAI评分的下降、结肠大体和组织损伤的减轻.
目前有关益生菌发挥其有益作用的精确机制尚不十分清楚, 且不同菌株具有不同作用途径. 益生菌作用机制主要包括: 对潜在致病菌的竞争性抑制; 调节机体局部和系统免疫反应; 增强肠道屏障功能等[22]. 本实验研究发现, TNBS能显著增强小鼠结肠MPO的活性, 增加LTB4的含量, 促进促炎细胞因子TNF-α和IFN-γ的表达, 而LP干预后, 则显著降低了MPO的活性和LTB4含量, 下调了TNF-α和IFN-γ的表达. MPO作为中性粒细胞浸润的标志物, 已有实验研究证实其在实验性结肠炎模型中存在高表达[23]. MPO已被广泛应用于肠道炎症进展的示踪物质, MPO活性的降低可以理解为某种既定物质具有抗炎活性的表现[24]. 本实验中LP干预后MPO活性的降低与组织学表现相一致, 表现为结肠黏膜内白细胞浸润水平在LP干预后出现显著降低. 以往研究已证实, 在IBD模型中, 循环粒细胞向肠黏膜内的浸润对肠壁损伤起到了主要作用[25], 由此, LP这种对炎症细胞向结肠黏膜内浸润的抑制作用可能与其对抗结肠组织损伤的作用有关. 以上研究结果与益生菌能抑制结肠炎大鼠循环白细胞与内皮细胞的黏附作用的结果相一致. 而益生菌对炎症细胞浸润抑制作用的发挥有赖于对多种具有化学趋化作用介质的抑制. 本实验研究发现, LP能显著降低具有化学趋化活性的LTB4结肠内含量和促炎细胞因子NF-α、IFN-γ的表达. LTB4通过促进中性粒细胞向肠黏膜内浸润参与了IBD的发生发展[26]. 促炎细胞因子TNF-α和IFN-γ作为潜在的化学趋化物, 能促进粒细胞向炎症肠黏膜内的浸润, 启动炎症级联反应, 最终导致肠道炎症的持续发生[27]. Llopis等[28]研究发现, 益生菌干酪乳杆菌与克罗恩患者炎症肠黏膜共培养能显著对抗大肠杆菌诱导的促炎作用, 这与抑制关键促炎介质包括TNF-α、IFN-γ的高表达有关. 此外, 临床和实验研究均证实益生菌鼠李糖乳杆菌能通过下调TNF-α/IL-10比率发挥其抗炎作用, 这可能与其促进Th1型介导的免疫反应向Th2/Th3型转换有关[29,30]. 国内有学者研究表明, 嗜酸乳杆菌对DSS诱导的实验性结肠炎小鼠有治疗作用, 可抑制转录因子的表达, 其部分作用机制可能为通过抑制STAT1、T-bet信号分子的激活来抑制Th1型免疫反应, 减少对GATA3的抑制而发挥治疗作用[31].
总之, 本实验研究表明, 口服LP能有效缓解TNBS诱导的小鼠结肠炎症状, 其作用机制可能与降低白细胞浸润和促炎细胞因子的表达有关. 同时也提示, 利用益生菌实现对IBD及相关疾病的治疗作用具有较好的应用前景[32], 但益生菌真正应用于临床实践中还面临着诸多问题亟待解决, 如益生菌菌株的选择及其剂量、起止时间的选择和安全性等, 尚需长期的大规模临床试验加以验证.
炎症性肠病(IBD), 包括克罗恩病和溃疡性结肠炎, 是病因未明的肠道非特异性炎症状态, 是遗传、免疫和环境综合作用的结果, 目前仍是一种不可治愈性疾病.
白爱平, 副教授, 南昌大学第一附属医院消化内科
因传统的治疗药物具有较大的不良反应和治疗有限性, 具有肠道菌群调节能力的益生菌成为IBD治疗的研究热点, 但其作用机制尚不清楚.
Morris等研究发现, TNBS作用于肠壁后引起肠壁的非特异性损伤和特征性Th1型迟发型超敏反应的发生, 导致结肠壁出现慢性透壁性损伤, 形成类似于人类克罗恩病的疾病动物模型, 该模型制作简便、经济, 是研究IBD发病机制和药物治疗较理想的工具.
既往大多数研究是益生菌对实验性肠炎的预防性治疗研究, 而有关益生菌对肠道炎症建立后治疗作用的研究则较少, 本实验在评估益生菌疗效的基础上, 对作用机制进行了深入分析.
口服植物乳杆菌能有效缓解TNBS诱导的小鼠结肠炎症状, 其作用机制可能与降低白细胞浸润和促炎细胞因子的表达有关. 同时也提示, 利用益生菌实现对IBD的治疗作用具有较好的应用前景.
益生菌: 一种活的微生物, 当摄入足够数量后能发挥其对宿主健康的有益作用
本文选题准确, 实验设计合理, 具有一定的新颖性.
编辑: 李薇 电编:李薇
| 1. | Guarner F, Malagelada JR. Gut flora in health and disease. Lancet. 2003;361:512-519. [PubMed] [DOI] |
| 2. | Sartor RB. Microbial influences in inflammatory bowel diseases. Gastroenterology. 2008;134:577-594. [PubMed] [DOI] |
| 3. | Shanahan F. Inflammatory bowel disease: immunodiagnostics, immunotherapeutics, and ecotherapeutics. Gastroenterology. 2001;120:622-635. [PubMed] [DOI] |
| 4. | Hedin C, Whelan K, Lindsay JO. Evidence for the use of probiotics and prebiotics in inflammatory bowel disease: a review of clinical trials. Proc Nutr Soc. 2007;66:307-315. [PubMed] [DOI] |
| 5. | Hedin CR, Mullard M, Sharratt E, Jansen C, Sanderson JD, Shirlaw P, Howe LC, Djemal S, Stagg AJ, Lindsay JO. Probiotic and prebiotic use in patients with inflammatory bowel disease: a case-control study. Inflamm Bowel Dis. 2010;16:2099-2108. [PubMed] [DOI] |
| 6. | Mach T. Clinical usefulness of probiotics in inflammatory bowel diseases. J Physiol Pharmacol. 2006;57 Suppl 9:23-33. [PubMed] |
| 7. | Nanda Kumar NS, Balamurugan R, Jayakanthan K, Pulimood A, Pugazhendhi S, Ramakrishna BS. Probiotic administration alters the gut flora and attenuates colitis in mice administered dextran sodium sulfate. J Gastroenterol Hepatol. 2008;23:1834-1839. [PubMed] [DOI] |
| 8. | Mañé J, Lorén V, Pedrosa E, Ojanguren I, Xaus J, Cabré E, Domènech E, Gassull MA. Lactobacillus fermentum CECT 5716 prevents and reverts intestinal damage on TNBS-induced colitis in mice. Inflamm Bowel Dis. 2009;15:1155-1163. [PubMed] [DOI] |
| 9. | Peran L, Camuesco D, Comalada M, Nieto A, Concha A, Diaz-Ropero MP, Olivares M, Xaus J, Zarzuelo A, Galvez J. Preventative effects of a probiotic, Lactobacillus salivarius ssp. salivarius, in the TNBS model of rat colitis. World J Gastroenterol. 2005;11:5185-5192. [PubMed] |
| 10. | Madsen KL, Doyle JS, Jewell LD, Tavernini MM, Fedorak RN. Lactobacillus species prevents colitis in interleukin 10 gene- deficient mice. Gastroenterology. 1999;116:1107-1114. [PubMed] [DOI] |
| 11. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 12. | Zoumpopoulou G, Foligne B, Christodoulou K, Grangette C, Pot B, Tsakalidou E. Lactobacillus fermentum ACA-DC 179 displays probiotic potential in vitro and protects against trinitrobenzene sulfonic acid (TNBS)-induced colitis and Salmonella infection in murine models. Int J Food Microbiol. 2008;121:18-26. [PubMed] [DOI] |
| 13. | Daniel C, Poiret S, Goudercourt D, Dennin V, Leyer G, Pot B. Selecting lactic acid bacteria for their safety and functionality by use of a mouse colitis model. Appl Environ Microbiol. 2006;72:5799-5805. [PubMed] [DOI] |
| 14. | Di Giacinto C, Marinaro M, Sanchez M, Strober W, Boirivant M. Probiotics ameliorate recurrent Th1-mediated murine colitis by inducing IL-10 and IL-10-dependent TGF-beta-bearing regulatory cells. J Immunol. 2005;174:3237-3246. [PubMed] |
| 15. | Peran L, Sierra S, Comalada M, Lara-Villoslada F, Bailón E, Nieto A, Concha A, Olivares M, Zarzuelo A, Xaus J. A comparative study of the preventative effects exerted by two probiotics, Lactobacillus reuteri and Lactobacillus fermentum, in the trinitrobenzenesulfonic acid model of rat colitis. Br J Nutr. 2007;97:96-103. [PubMed] [DOI] |
| 16. | Peran L, Camuesco D, Comalada M, Nieto A, Concha A, Adrio JL, Olivares M, Xaus J, Zarzuelo A, Galvez J. Lactobacillus fermentum, a probiotic capable to release glutathione, prevents colonic inflammation in the TNBS model of rat colitis. Int J Colorectal Dis. 2006;21:737-746. [PubMed] [DOI] |
| 17. | Geier MS, Butler RN, Giffard PM, Howarth GS. Lactobacillus fermentum BR11, a potential new probiotic, alleviates symptoms of colitis induced by dextran sulfate sodium (DSS) in rats. Int J Food Microbiol. 2007;114:267-274. [PubMed] [DOI] |
| 18. | Kanauchi O, Mitsuyama K, Andoh A. The therapeutic impact of manipulating microbiota in inflammatory bowel disease. Curr Pharm Des. 2009;15:2074-2086. [PubMed] [DOI] |
| 19. | Hegazy SK, El-Bedewy MM. Effect of probiotics on pro-inflammatory cytokines and NF-kappaB activation in ulcerative colitis. World J Gastroenterol. 2010;16:4145-4151. [PubMed] [DOI] |
| 20. | Peran L, Camuesco D, Comalada M, Bailon E, Henriksson A, Xaus J, Zarzuelo A, Galvez J. A comparative study of the preventative effects exerted by three probiotics, Bifidobacterium lactis, Lactobacillus casei and Lactobacillus acidophilus, in the TNBS model of rat colitis. J Appl Microbiol. 2007;103:836-844. [PubMed] [DOI] |
| 22. | Vanderpool C, Yan F, Polk DB. Mechanisms of probiotic action: Implications for therapeutic applications in inflammatory bowel diseases. Inflamm Bowel Dis. 2008;14:1585-1596. [PubMed] [DOI] |
| 23. | Krawisz JE, Sharon P, Stenson WF. Quantitative assay for acute intestinal inflammation based on myeloperoxidase activity. Assessment of inflammation in rat and hamster models. Gastroenterology. 1984;87:1344-1350. [PubMed] |
| 24. | Veljaca M, Lesch CA, Pllana R, Sanchez B, Chan K, Guglietta A. BPC-15 reduces trinitrobenzene sulfonic acid-induced colonic damage in rats. J Pharmacol Exp Ther. 1995;272:417-422. [PubMed] |
| 25. | Ajuebor MN, Zagorski J, Kunkel SL, Strieter RM, Hogaboam CM. Contrasting roles for CXCR2 during experimental colitis. Exp Mol Pathol. 2004;76:1-8. [PubMed] [DOI] |
| 26. | Grice CA, Tays KL, Savall BM, Wei J, Butler CR, Axe FU, Bembenek SD, Fourie AM, Dunford PJ, Lundeen K. Identification of a potent, selective, and orally active leukotriene a4 hydrolase inhibitor with anti-inflammatory activity. J Med Chem. 2008;51:4150-4169. [PubMed] [DOI] |
| 27. | Stallmach A, Giese T, Schmidt C, Ludwig B, Mueller-Molaian I, Meuer SC. Cytokine/chemokine transcript profiles reflect mucosal inflammation in Crohn's disease. Int J Colorectal Dis. 2004;19:308-315. [PubMed] [DOI] |
| 28. | Llopis M, Antolin M, Carol M, Borruel N, Casellas F, Martinez C, Espín-Basany E, Guarner F, Malagelada JR. Lactobacillus casei downregulates commensals' inflammatory signals in Crohn's disease mucosa. Inflamm Bowel Dis. 2009;15:275-283. [PubMed] [DOI] |
| 29. | Peña JA, Versalovic J. Lactobacillus rhamnosus GG decreases TNF-alpha production in lipopolysaccharide-activated murine macrophages by a contact-independent mechanism. Cell Microbiol. 2003;5:277-285. [PubMed] [DOI] |
| 30. | Schultz M, Linde HJ, Lehn N, Zimmermann K, Grossmann J, Falk W, Schölmerich J. Immunomodulatory consequences of oral administration of Lactobacillus rhamnosus strain GG in healthy volunteers. J Dairy Res. 2003;70:165-173. [PubMed] [DOI] |