修回日期: 2011-02-09
接受日期: 2011-02-15
在线出版日期: 2011-03-08
目的: 研究肿瘤耐药相关基因P-gp和ABCG2在食管鳞状细胞癌组织中的表达及其临床病理特征和预后的关系.
方法: 应用免疫组织化学SP法检测食管鳞状细胞癌患者76例及正常食管黏膜30例, 观察肿瘤耐药相关基因P-gp和ABCG2的表达, 同时回顾性研究了这些表达与食管鳞状细胞癌发生、浸润及转移等临床病理学参数的关系.
结果: (1)食管鳞状细胞癌组织中, P-gp和ABCG2的表达阳性率分别为88.16%和80.26%. 30例食管正常黏膜中两者的表达率分别为60%和50%. 差异均有统计学意义(P<0.05); (2)食管鳞状细胞癌组织中, P-gp在不同临床分期、不同浸润深度组之间阳性表达率的差异有统计学意义(P = 0.002, 0.035); (3)食管鳞状细胞癌组织中, ABCG2在不同临床分期、有或无淋巴结转移组之间阳性表达率的差异有统计学意义(P = 0.006, 0.034); (4)P-gp与ABCG2的表达呈正相关(r = 0.228, P<0.05); (5)本组病例的5年总生存率为34.21%, 单因素生存分析表明, P-gp阳性表达组的生存率显著低于阴性表达组, 两组间生存率的差异有统计学意义(P<0.05).
结论: P-gp和ABCG2在食管鳞癌的发生发展中可能起一定的作用. P-gp与食管鳞癌的预后密切相关.
引文著录: 龚晓瑾, 古力巴哈尔•阿不力米提, 蒲红伟, 陈晓. P-gp和ABCG2在食管鳞状细胞癌中的表达及临床病理意义. 世界华人消化杂志 2011; 19(7): 728-733
Revised: February 9, 2011
Accepted: February 15, 2011
Published online: March 8, 2011
AIM: To investigate the expression of P-glycoprotein (P-gp) and ATP-binding cassette superfamily G member 2 (ABCG2) in esophageal squamous cell carcinoma (ESCC) and to analyze their clinicopathologic significance.
METHODS: Immunohistochemistry was used to detect the expression of P-gp and ABCG2 in 76 cases of ESCC and in 30 cases of normal esophageal tissue. The relationship of P-gp and ABCG2 expression with clinicopathologic parameters of ESCC was then analyzed.
RESULTS: The positive rates of P-gp and ABCG2 expression were 88.16% and 80.26% in ESCC and 60% and 50% in normal esophageal tissue, respectively, with statistically significant differences among the two groups (both P < 0.05). The expression of P-gp protein was significantly associated with tumor clinical stage and depth of invasion in ESCC, while that of ABCG2 was significantly associated with tumor clinical stage and lymph node metastasis. The expression of P-gp was positively correlated with that of ABCG2 (r = 0.228, P < 0.05). The 5-year overall survival rate for all patients was 34.21%. Univariate survival analysis showed that the five-year survival rate for P-gp-positive patients was significantly lower than that for P-gp-negative ones (P < 0.05).
CONCLUSION: P-gp and ABCG2 play an important role in the pathogenesis of ESCC. The expression of P-gp is closely related to prognosis of ESCC.
- Citation: Gong XJ, Gulibahaer•Abulimiti, Pu HW, Chen X. Clinicopathologic significance of expression of P-gp and ABCG2 in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(7): 728-733
- URL: https://www.wjgnet.com/1009-3079/full/v19/i7/728.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i7.728
我国是食管癌(esophageal carcinoma, EC)高发国家, 占世界总发病率的50%, 近年来食管癌的发病和死亡率仍逐年上升, 而疗效和预后却很差[1,2]. 肿瘤细胞的多药耐药性(multidrug resistance, MDR)是肿瘤化疗失败的主要原因之一[3]. P-糖蛋白(P-glycoprotein, P-gp)和三磷酸腺苷结合转运蛋白G超家族成员2(ATP-binding cassette superfamily G member 2, ABCG2)是重要的肿瘤耐药相关基因. 近年来对食管癌多药耐药的研究不断深入, 为临床评价和预测化疗效果, 及预后、合理用药提供指导.
选用新疆医科大学第一及第二附属医院2001-01/2004-12期间手术切除并经病理证实的食管鳞状细胞癌标本76例, 其中, 汉族30例, 哈萨克族46例, 男56例, 女20例, 年龄38.0-76.0(平均57)岁. 按照WHO分类标准进行病理分级: 高分化鳞癌23例, 中低分化鳞癌53例; 根据1997年国际抗癌联盟(UICC)对食管癌的分期标准进行分期: Ⅰ-Ⅱ期45例, Ⅲ-Ⅳ期31例; 肿瘤浸润局限于食管肌层31例; 肿瘤浸润食管外膜层45例; 有淋巴结转移的35例, 无淋巴结转移的41例. 另取同期手术切除的距离食管鳞癌原发灶5 cm的正常癌旁组织30例. 所有患者术前未经放、化疗治疗, 临床资料完整.
1.2.1 P-gp和ABCG2检测: 采用SP免疫组织化学三步法进行P-gp和ABCG2检测. 步骤严格按照试剂盒说明操作.
1.2.2 染色结果判断: P-gp和ABCG2的表达定位于细胞质和/或细胞膜, 以相应部位出现棕黄色颗粒为阳性表达.
1.2.3 预后随访: 本组研究中搜集了患者的详细资料, 采用电话随访的方式对76例食管鳞状细胞癌患者的生存情况进行随访. 随访时间截止到2009-12.
统计学处理 采用SPSS17.0统计软件对数据进行分析处理: 数据结果分别采用χ2检验, 非参数秩和检验, Spearman相关性分析和Kaplan-Meier生存分析. 检验水准α = 0.05, P<0.05为差异有统计学意义.
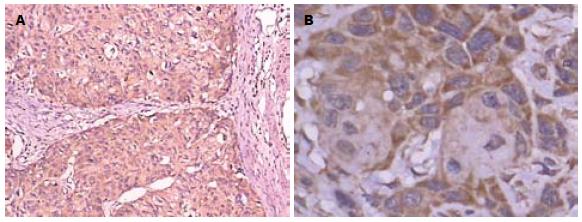
在76例食管癌组织中, P-gp蛋白的阳性表达率为88.16%(67/76), 食管正常组织中P-gp蛋白的阳性表达率为60%(18/30), 食管鳞癌组织中的阳性表达率高于正常组织的阳性表达率, 两组间比较, 差异有统计学意义(P<0.05, 表1, 图1).
| 分组 | n | 阴性 | 阳性 | 阳性率(%) | χ2值 | P值 |
| 食管鳞癌组织 | 76 | 9 | 67 | 88.16 | 10.73 | <0.005 |
| 正常食管黏膜 | 30 | 12 | 18 | 60.00 |
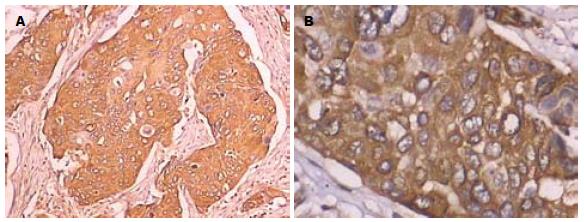
在76例食管癌组织中, ABCG2蛋白的阳性表达率为80.26%(61/76), 食管正常组织中ABCG2的阳性表达率为50.00%(15/30), 食管鳞癌组织中的阳性表达率高于正常组织的阳性表达率, 两组间比较, 差异有统计学意义(P<0.05, 表2, 图2, 3).
| 分组 | n | 阴性 | 阳性 | 阳性率(%) | χ2值 | P值 |
| 食管鳞癌组织 | 76 | 15 | 61 | 80.26 | 9.71 | <0.005 |
| 正常食管黏膜 | 30 | 15 | 15 | 50.00 |
食管鳞状细胞癌组织中, P-gp的阳性表达率在临床分期Ⅲ和Ⅳ组较Ⅰ和Ⅱ组增高, 差异有统计学意义(W = 1449.500, P<0.01). 不同分化程度P-gp蛋白的表达分为高分化和中低分化两组进行比较, 结果两组之间的差异无统计学意义(W = 1997.000, P>0.05). 随着浸润深度的增加P-gp阳性表达也逐渐增高, 把浸润深度分为≤肌层和≥外膜层两组进行比较, 结果两组之间的差异有统计学意义(W = 1002.500, P<0.05). 有、无淋巴结转移时, P-gp蛋白的表达两组间差异无统计学意义(W = 1454.000, P>0.05). 汉族和哈萨克族之间以及男女之间比较P-gp的阳性表达检出率的差异均无统计学意义(P>0.05). P-gp的表达在年龄<60岁和年龄≥60岁两组之间进行比较, 差异亦无统计学意义(W = 1231.500, P>0.05, 表3).
| 病理特征 | n | - | + | ++ | +++ | W值 | P值 |
| 临床分期 | |||||||
| Ⅰ和Ⅱ | 45 | 7 | 16 | 13 | 9 | 1449.500 | 0.002 |
| Ⅲ和Ⅳ | 31 | 2 | 4 | 9 | 16 | ||
| 分化程度 | |||||||
| 高分化 | 23 | 3 | 4 | 8 | 8 | 1997.000 | 0.608 |
| 中低分化 | 53 | 6 | 16 | 14 | 17 | ||
| 浸润深度 | |||||||
| ≤肌层 | 31 | 4 | 12 | 9 | 6 | 1002.500 | 0.035 |
| ≥外膜层 | 45 | 5 | 8 | 13 | 19 | ||
| 淋巴结转移 | |||||||
| 有 | 35 | 3 | 8 | 10 | 14 | 1454.000 | 0.176 |
| 无 | 41 | 6 | 12 | 12 | 11 | ||
| 民族 | |||||||
| 汉 | 30 | 4 | 8 | 9 | 9 | 1116.500 | 0.670 |
| 哈 | 46 | 5 | 12 | 14 | 15 | ||
| 性别 | |||||||
| 男 | 56 | 7 | 14 | 17 | 18 | 2148.500 | 0.927 |
| 女 | 20 | 2 | 6 | 5 | 7 | ||
| 年龄(岁) | |||||||
| <60 | 44 | 7 | 8 | 15 | 14 | 1231.500 | 0.996 |
| ≥60 | 32 | 2 | 12 | 7 | 11 |
食管鳞状细胞癌组织中, ABCG2的阳性表达率在临床分期Ⅲ和Ⅳ组较Ⅰ和Ⅱ组增高(W = 1483.500, P<0.05), 差异有统计学意义. 不同分化程度ABCG2蛋白的表达分为高分化和中低分化两组进行比较, 结果两组之间的差异无统计学意义(W = 1994.000, P>0.05). 把浸润深度分为≤肌层和≥外膜层两组进行比较, ABCG2的表达两组之间的差异无统计学意义(W = 1031.500, P>0.05). 有、无淋巴结转移时, ABCG2蛋白的表达两组间差异有统计学意义(W = 1383.000, P<0.05). 汉族和哈萨克族之间以及男女之间比较ABCG2的阳性表达检出率的差异均无统计学意义(P>0.05). ABCG2的表达在年龄<60岁和年龄≥60岁两组之间进行比较, 差异亦无统计学意义(W = 1153.000, P>0.05, 表4).
| 病理特征 | n | - | + | ++ | +++ | W值 | P值 |
| 临床分期 | |||||||
| Ⅰ和Ⅱ | 45 | 12 | 9 | 14 | 10 | 1 483.5 | 0.006 |
| Ⅲ和Ⅳ | 31 | 2 | 5 | 9 | 15 | ||
| 分化程度 | |||||||
| 高分化 | 23 | 4 | 4 | 6 | 9 | 1 994.0 | 0.584 |
| 中低分化 | 53 | 10 | 10 | 17 | 16 | ||
| 浸润深度 | |||||||
| ≤肌层 | 31 | 8 | 5 | 12 | 6 | 1 031.5 | 0.075 |
| ≥外膜层 | 45 | 6 | 9 | 11 | 19 | ||
| 淋巴结转移 | |||||||
| 有 | 35 | 4 | 6 | 9 | 16 | 1 383.0 | 0.034 |
| 无 | 41 | 10 | 8 | 14 | 9 | ||
| 民族 | |||||||
| 汉 | 30 | 6 | 8 | 9 | 7 | 1 025.0 | 0.151 |
| 哈 | 46 | 8 | 6 | 14 | 18 | ||
| 性别 | |||||||
| 男 | 56 | 11 | 8 | 13 | 24 | 615.5 | 0.058 |
| 女 | 20 | 3 | 6 | 10 | 1 | ||
| 年龄(岁) | |||||||
| <60 | 44 | 8 | 6 | 14 | 16 | 1 153.0 | 0.387 |
| ≥60 | 32 | 6 | 8 | 9 | 9 |
如表5所示, 76例食管鳞癌组织中P-gp蛋白的表达和ABCG2的表达呈正相关(r = 0.228, P<0.05).
| ABCG2 | P-gp | 合计 | |
| - | + | ||
| - | 4 | 11 | 15 |
| + | 5 | 56 | 61 |
| 合计 | 9 | 67 | 76 |
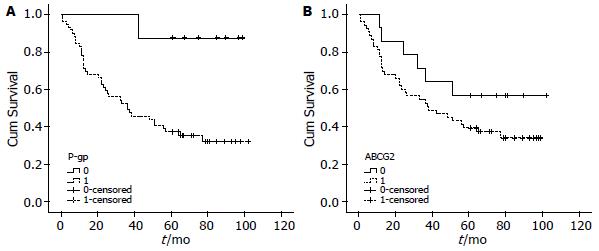
本组研究对76例食管鳞状细胞癌患者的5年生存率进行了随访, 其中9例失访, 41例死亡, 26例存活, 中位生存期为51.0(38.8-63.2) mo, 5年总生存率为34.21%(26/76).
肿瘤细胞的MDR是指肿瘤细胞可耐受结构、功能和杀伤机制不同的多种药物的致死剂量. 他可使抗癌药物泵出细胞致细胞内药物浓度降低; 还可直接与药物结合, 使药物无法进入细胞发挥杀伤作用, 使肿瘤细胞产生耐药性.
P-gp是具有能量依赖性"药泵"功能的跨膜糖蛋白, 能将细胞内带阳性电荷的亲脂类化疗药物逆浓度泵至细胞外, 降低细胞内药物浓度, 从而阻碍化疗药物作用的发挥, 产生耐药. Tsuruo等[4]研究认为, P-gp通常在结肠癌、肾细胞癌及肾上腺癌中化疗前即高水平表达, 而在其他肿瘤中常在产生获得性耐药时有高水平表达. 本研究显示, 食管鳞癌组织中P-gp的阳性表达率高于正常食管黏膜组织的阳性表达率, 提示P-gp是引起食管肿瘤耐药性的原因之一, 表明食管鳞状细胞癌存在原发耐药; 而在正常食管黏膜组织中, P-gp可作为一种防御机制, 促使进入食管黏膜细胞内的毒物外排, 减少毒性作用, 可能与分泌代谢产物、保护正常组织细胞免受外来侵害、防御外源性毒物、转运激素及参与炎症反应等有关.
孙瑞清等[5]采用免疫组织化学技术检测P-gp、nm23在食管鳞状细胞癌中的表达水平, 认为P-gp的表达与肿瘤浸润深度有关, 这与本组研究的结果相一致. 推测其在食管癌晚期即癌细胞外侵、转移阶段也可能起着一定作用. P-gp高表达, 临床分期越晚, 化疗疗效越差, 预后不良, 其对植物碱类、阿霉素、紫杉醇和泰素帝等抗癌药物耐药性越强, 反之P-gp表达率越低, 临床分期越早, 其耐药性越弱. 这与恶性肿瘤临床分期早, 其化疗一般较敏感, 预后较好相一致. 有文献[6,7]报道, P-gp阳性表达与消化系癌患者的性别、年龄、癌分化程度及淋巴结转移均无关, 这与本研究基本一致. 王延明等[8]研究发现51例食管癌组织中P-gp阴性患者的1、2、3年生存率高于P-gp阳性者, 而且死亡的主要原因为癌复发和转移, 阳性与否的1、2、3年生存率比较无统计学意义, 可能与病例数较少有关. 本研究的病例数有所增加且随访时间增长为5年, P-gp阳性和阴性表达组之间的生存率存在差异, 提示P-gp的表达与患者的生存时间有一定联系, 阴性表达较阳性表达生存率高. 而对于阳性表达者可以选择非MDR类型药物联合方案如长春瑞宾、吉西他宾、顺铂等药物联合化疗, 以达到提高治疗有效率, 延长生存期的目的.
ABCG2是ABC转运体家族的成员, 参与肿瘤细胞的MDR. 近年来大量研究表明ABCG2在许多正常组织中有表达. Jonker等[9]也发现ABCG2基因敲除小鼠的肠道吸收谱受到明显限制, 并且影响到肝胆清除率和胎盘转运. 因此认为ABCG2在正常组织的表达定位与其本身作为转运蛋白影响肠黏膜的吸收率或药物的生物利用率, 以及肝肾和血浆的清除率有关, 他可以泵出细胞内毒物, 保护组织免受损伤. 亦有研究表明ABCG2在各种组织源性的肿瘤中广泛表达, 并无组织特异性[10]. 刘亮等[11]采用RT-PCR方法检测了不同食管病变中ABCG2 mRNA的表达情况, 发现食管癌组织中ABCG2表达显著高于正常黏膜, 与本研究一致, 提示了ABCG2可能参与了食管癌原发性耐药及MDR的形成, 其可以作为一种新的引起耐药的分子, 指导临床上对食管癌的化疗. 但ABCG2的阳性表达在食管鳞癌组织中高于正常黏膜组织这是否和获得性耐药有关, 还需进一步研究.
ABCG2在食管鳞癌组织中的表达, 不仅与患者的临床分期有关, 还与有无淋巴结转移密切相关, 这与高坤祥等[12]的研究结果一致. 说明ABCG2可能就是食管鳞癌患者化疗不敏感的主要因素, 尤其是对中晚期患者. Allikmets等[13]的研究认为ABCG2在胎盘的高表达是受到性激素的调节, 提示ABCG2在两性机体的表达上很可能存在差异. 之后Merino等[14]的研究也表明ABCG2在小鼠各器官的表达及其药物代谢动力学存在两性差异, 并且指出该差异与性激素受体表达有关. 本组研究中ABCG2在男性中的阳性表达率明显低于女性中的阳性表达率, 虽差异无统计学意义, 但可以看出ABCG2和性激素水平有一定关系.
本研究还发现在新疆的汉族和哈萨克族食管鳞癌的发生发展中P-gp、ABCG2的表达具有共同性, 无民族背景间的基因差异. P-gp与ABCG2他们在食管鳞癌组织中的表达存在相关性, 这是否因为两者可能有共同的调控机制, 在MDR中起着协同作用, 还需进一步深入研究.
我国是食管癌(EC)高发国家, 占世界总发病率的50%, 近年来食管癌的发病和死亡率仍逐年上升, 而疗效和预后却很差. 肿瘤细胞的多药耐药性(MDR)是肿瘤化疗失败的主要原因之一.
向德兵, 副教授, 中国人民解放军第三军医大学大坪医院肿瘤中心
孙瑞清等采用免疫组织化学技术检测P-gp、nm23在食管鳞状细胞癌中的表达水平, 认为P-gp的表达与肿瘤浸润深度有关.
P-gp和ABCG2在食管鳞癌的发生发展中可能起一定的作用. P-gp与食管鳞癌的预后密切相关.
本文具有一定的科学性和临床意义, 但新颖性一般.
编辑: 李薇 电编:何基才
| 4. | Tsuruo T, Naito M, Tomida A, Fujita N, Mashima T, Sakamoto H, Haga N. Molecular targeting therapy of cancer: drug resistance, apoptosis and survival signal. Cancer Sci. 2003;94:15-21. [PubMed] [DOI] |
| 5. | 孙 瑞清, 吴 建农, 陈 淼. 食管鳞癌组织中P-gp和nm23表达的意义及其对预后的影响. 江苏大学学报(医学版). 2006;16:406-408. |
| 6. | Camassei FD, Arancia G, Cianfriglia M, Bosman C, Francalanci P, Ravà L, Jenkner A, Donfrancesco A, Boldrini R. Nephroblastoma: multidrug-resistance P-glycoprotein expression in tumor cells and intratumoral capillary endothelial cells. Am J Clin Pathol. 2002;117:484-490. [PubMed] [DOI] |
| 7. | Lacueva FJ, Calpena R, Medrano J, Teruel A, Mayol MJ, Graells ML, Camarasa MV, Perez-Vazquez MT, Ferragut JA. Changes in P-glycoprotein expression in gastric carcinoma with respect to distant gastric mucosa may be influenced by p53. Cancer. 2000;89:21-28. [PubMed] [DOI] |
| 9. | Jonker JW, Buitelaar M, Wagenaar E, Van Der Valk MA, Scheffer GL, Scheper RJ, Plosch T, Kuipers F, Elferink RP, Rosing H. The breast cancer resistance protein protects against a major chlorophyll-derived dietary phototoxin and protoporphyria. Proc Natl Acad Sci U S A. 2002;99:15649-15654. [PubMed] [DOI] |
| 10. | Zhang W, Shannon WD, Duncan J, Scheffer GL, Scheper RJ, McLeod HL. Expression of drug pathway proteins is independent of tumour type. J Pathol. 2006;209:213-219. [PubMed] [DOI] |
| 13. | Allikmets R, Schriml LM, Hutchinson A, Romano-Spica V, Dean M. A human placenta-specific ATP-binding cassette gene (ABCP) on chromosome 4q22 that is involved in multidrug resistance. Cancer Res. 1998;58:5337-5339. [PubMed] |
| 14. | Merino G, van Herwaarden AE, Wagenaar E, Jonker JW, Schinkel AH. Sex-dependent expression and activity of the ATP-binding cassette transporter breast cancer resistance protein (BCRP/ABCG2) in liver. Mol Pharmacol. 2005;67:1765-1771. [PubMed] [DOI] |