修回日期: 2011-01-27
接受日期: 2011-02-15
在线出版日期: 2011-03-08
目的: 观察姜黄素对葡聚糖硫酸钠(DSS)诱导的小鼠溃疡性结肠炎的疗效, 并探讨其作用机制.
方法: 选♀BALB/c小鼠60只, 随机分为4组, 每组15只. A组: 正常对照组; B组: DSS结肠炎组, 小鼠每日自由摄取5% DSS溶液; C组: 姜黄素治疗组, 小鼠自由摄取5% DSS溶液, 每日腹腔注射姜黄素悬液30 mg/kg; D组: 地塞米松治疗组, 饮用5%DSS溶液, 每日腹腔注射一次地塞米松针剂0.4 mg/kg. 各组小鼠每日记录疾病活动指数(DAI)评分, HE染色观察小鼠结肠黏膜组织学改变. ELISA法测定结肠组织中肿瘤坏死因子(TNF)-α、白介素(IL)-6含量. 免疫组织化学染色观察核因子-κB(NF-κB)在结肠组织炎性细胞内的表达情况. Western blot检测结肠组织胞质NF-κB抑制蛋白IκB的表达情况.
结果: DAI与组织学损伤评分显示C、D组分别与B组比较差异有统计学意义(DAI: 1.64±0.92, 2.80±0.92 vs 7.67±1.56; 组织学损伤评分: 1.36±0.50, 2.00±0.67 vs 2.83±0.83, 均P<0.01), C、D组比较差异有统计学意义(P<0.01). TNF-α(μg/L)、IL-6(μg/L)的浓度在B组明显升高, 且高于C、D组(TNF-α: 102.75±3.52 vs 75.91±1.59, 78.25±2.15; IL-6: 80.94±3.26 vs 59.65±1.39, 65.57±4.04, 均P<0.01); NF-κB在C、D组中的表达较B组显著下降(2.73±0.79, 4.22±1.09 vs 7.92±1.24, 均P<0.01), C、D组之间仍有统计学意义(P<0.05). IκBα在C、D、B组中的表达水平逐渐降低, C、D组和B组比较差异有统计学意义(P<0.05).
结论: 姜黄素可以有效治疗DSS诱导的小鼠溃疡性结肠炎, 其疗效优于地塞米松. 其机制可能是通过抑制NF-κB信号通路及调节细胞因子TNF-α、IL-6等的释放而发挥作用.
引文著录: 陈欧, 李昌平, 罗彬, 冯琦, 马春华, 冯凯祥. 姜黄素对DSS诱导的小鼠溃疡性结肠炎的疗效. 世界华人消化杂志 2011; 19(7): 680-686
Revised: January 27, 2011
Accepted: February 15, 2011
Published online: March 8, 2011
AIM: To investigate the efficacy of curcumin in the treatment of dextran sulphate sodium (DSS)-induced ulcerative colitis in mice.
METHODS: Sixty female BALB/c mice were randomly divided into four groups: normal group, experimental colitis group (administered with 5% DSS solution), curcumin treatment group (administered with 5% DSS solution and intraperitoneally injected with curcumin, 30 mg/kg body weight), dexamethasone treatment group (administered with 5% DSS solution and intraperitoneally injected with dexamethasone, 0.4 mg/kg body weight). The severity of colitis was evaluated using the disease activity index (DAI) score, and colonic mucosal histological changes were observed by HE staining. Tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) levels in colonic tissue were determined by ELISA. The expression of nuclear factor-κB (NF-κB) in intestinal inflammatory cells was determined by immunohistochemistry. The expression of inhibitor of NF-κB (IκB) in intestinal inflammatory cells was determined by Western blot.
RESULTS: Compared with the normal group and experimental colitis group, treatment with curcumin significantly improved symptoms, reduced colonic DAI and histological scores (DAI: 1.64 ± 0.92, 2.80 ± 0.92 vs 7.67 ± 1.56; histological scores: 1.36 ± 0.50, 2.00 ± 0.67 vs 2.83 ± 0.83, all P < 0.01), and decreased the levels of colonic TNF-α and IL-6 (TNF-α: 102.75 ± 3.52 vs 75.91 ± 1.59, 78.25 ± 2.15; IL-6: 80.94 ± 3.26 vs 59.65 ± 1.39, 65.57 ± 4.04, all P < 0.01). Curcumin decreased the expression of NF-κB (2.73 ± 0.79, 4.22 ± 1.09 vs 7.92 ± 1.24, both P < 0.01) and degradation of IκBα more significantly than dexamethasone.
CONCLUSION: Curcumin has a positive effect in treating DSS-induced colitis in mice. The therapeutic effect of curcumin is superior to dexamethasone. Curcumin reduces colonic inflammation by decreasing the expression of NF-κB and modulating the release of cytokines.
- Citation: Chen O, Li CP, Luo B, Feng Q, Ma CH, Feng KX. Efficacy of curcumin in the management of dextan sulphate sodium-induced ulcerative colitis in mice. Shijie Huaren Xiaohua Zazhi 2011; 19(7): 680-686
- URL: https://www.wjgnet.com/1009-3079/full/v19/i7/680.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i7.680
溃疡性结肠炎(ulcerative colitis, UC)是一种肠道非特异性炎症性疾病, 属于炎症性肠病(inflammatory bowel disease, IBD)的一种, 其病因及发病机制尚未清楚. 有研究证实促炎和抗炎细胞因子失衡在IBD发生和发展中起着重要作用, 细胞因子可以激活NF-κB, 而多种促炎细胞因子的启动子部位都有NF-κB位点, 他是细胞因子释放的关键调控因素. 阻断NF-κB信号通路, 减少细胞因子、炎症介质的产生, 减轻炎症反应, 是治疗IBD的新思路. 本实验将姜黄素用于治疗葡聚糖硫酸钠(dextran sulphate sodium, DSS)诱导的小鼠模型的UC, 检测NF-κB激活及其抑制蛋白IκB的表达和细胞因子TNF-α、IL-6的表达, 从而观察姜黄素治疗结肠炎模型的疗效, 探讨其对UC可能的抗炎机制.
健康♀BALB/c小鼠60只, 鼠龄6-7 wk, 体质量18-22 g, 购于重庆腾鑫公司. 葡聚糖硫酸钠(dextran sulphate sodium, DSS)购自Sigma公司, 姜黄素购自中国质量检验所, NF-κB p65抗体购自美国Bioworld公司, TNF-α、IL-6的ELISA试剂盒购自美国RD公司, IκBα抗体购自美国CST公司, 联苯胺检测试剂盒购自北京中山试剂公司.
1.2.1 分组及造模: 60只♀BALB/c小鼠随机分为A、B、C、D 4组, 每组15只. A组: 正常对照组, 每日进饮用水及饲料, 不做处理, 共7 d; B组: DSS结肠炎组, 每日自由饮用5% DSS溶液, 每日腹腔注射与C组等体积的25 mL/L乙醇溶液, 共7 d; C组: 姜黄素治疗组, 饮用5% DSS溶液, 每日腹腔注射姜黄素悬液1次(按30 mg/kg的剂量溶于25 mL/L乙醇1 000 μL), 共7 d; D组: 地塞米松治疗组, 饮用5% DSS溶液, 每日腹腔注射1次地塞米松针剂(剂量为0.4 mg/kg溶于生理盐水1 000 μL), 共7 d. 7 d后处死全部小鼠, 留取结肠组织送病理、另留2份保存于液氮中用于Western blot和ELISA检测.
1.2.2 结肠炎症的评价: 包括疾病活动指数(disease activity index, DAI)的评分和组织学损伤评分[1,2]. DAI = (体质量下降分数+大便性状分数+便血分数)/3; 正常大便为干而小粒状, 半稀便为糊状但不粘肛门, 稀便为液状而且黏肛门, 大便隐血用联苯胺法检测. 体质量下降分数分为5级, 0分: 无下降, 1分: 下降1%-5%, 2分下降: 6%-10%, 3分: 下降11%-15%, 4分: 下降>15%; 大便性状正常记为0分, 半稀便记为2分, 稀便记为4分; 便血阴性为0分, 隐血阳性为2分, 肉眼血便为4分. 组织学评分分为5级, 0分: 正常结肠黏膜, 1分: 隐窝腺体丢失1/3, 2分: 隐窝腺体丢失2/3, 3分: 隐窝腺体全部丢失, 黏膜上皮完整, 伴有轻度炎细胞浸润, 4分: 黏膜上皮糜烂、破坏, 伴有明显炎细胞浸润.
1.2.3 结肠黏膜TNF-α、IL-6浓度的测定: 取1 cm结肠组织, 在冰浴条件下制成组织匀浆, 离心后取上清液, 用ELISA法测定TNF-α、IL-6浓度, 具体步骤按试剂盒(美国RD公司)说明书操作.
1.2.4 原位检测结肠黏膜NF-κB P65的表达: 用免疫组织化学法, 常规组织切片脱蜡, 进行抗原修复, 水洗; 滴加3% H2O2室温孵育5-10 min, 消除内源性过氧化物酶活性, PBS冲洗; 血清在室温下封闭15 min, 清除多余血清; 滴加羊抗小鼠NF-κB p65多克隆抗体37 ℃孵育2 h, PBS液冲洗3次; 滴加生物素化的兔抗羊抗体室温孵育20 min, PBS液冲洗3次. 滴加辣根过氧化物酶标记的链霉亲和素室温孵育20 min, PBS冲洗3次; 使用DAB显色, 然后冲洗复染、封片. 染色评分标准: 染色强度分4级, 阴性染色0分; 弱阳性染色1分, 中度阳性染色2分, 强阳性染色3分. 每张切片按所见阳性细胞范围分5级, 阴性为0分, 阳性细胞占1%-10%的1分; 阳性细胞占11%-50%的2分; 阳性细胞占51%-80%的3分; 阳性细胞占81%-100%的4分; 每张切片的评分为两者之积.
1.2.5 Western blot检测结肠组织IκBα的含量: 提取组织中的总蛋白, 先称取组织, 加入裂解液, 充分裂解后, 4 ℃ 12 000 r/min, 5 min, 取上清. SDS-PAGE电泳分离蛋白质后, 采用湿式电转移将蛋白分子转移到NC膜, 电转移结束后NC膜用洗膜缓冲液TBST洗涤3次(5 min/次), 封阻缓冲液(5% BSA)在室温下密闭轻摇封阻1 h. 洗膜缓冲液洗涤3次(5 min/次)后, NC膜与Ⅰ抗4 ℃孵育过夜, 洗膜缓冲液洗涤3次(5 min/次). NC膜与Ⅱ抗于室温下轻摇动孵育1 h, 洗膜缓冲液洗涤3次(5 min/次). 加入ECL化学发光试剂A、B液各0.5 mL, 混匀, 润透NC膜后室温作用1 min. 暗室中将NC膜迅速封入保鲜膜中, Kodak X-ray film压片, 放射自显影5 min. X-ray film置于显影液中15-30 s, 定影液中1.5 min, 清水冲洗晾干. Western blot数据分析: 目的蛋白的灰度值除以内参GAPDH的灰度值以校正误差, 所得结果代表某样品的目的蛋白相对含量.
统计学处理 SPSS13.0软件进行统计学分析, 所有数据均以mean±SD表示. 对符合正态分布的数据比较采用方差分析, 组间两两比较采用SNK(q检验), 不符合正态分布的数据采用Wilcoxom秩和检验. P<0.05为差异有统计学意义.
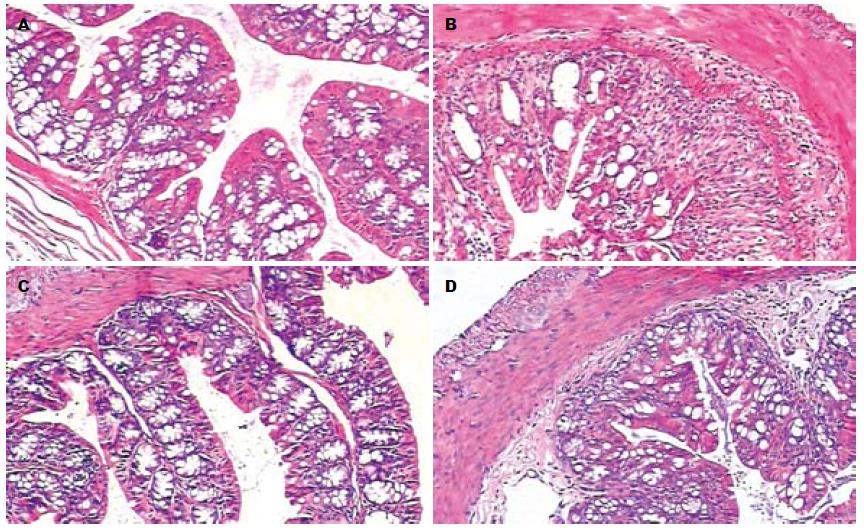
正常对照组小鼠反应灵敏, 饮食活动正常, 毛发有光泽, 无便血. 小鼠于饮用5% DSS溶液后第3天出现懒动、拱背、厌食、体质量下降、粪便隐血阳性, 进食和饮水量减少. 随时间延长, B组小鼠症状逐渐加重, DAI值逐渐升高, 第5-7天出现不同程度的肉眼血便. C组、D组症状较B组小鼠明显减轻, DAI评分也明显低于B组, 评分示B组与C组、D组比较差异有统计学意义(P<0.01). C组与D组比较也有统计学意义(P<0.01, 表1).
B组小鼠结肠炎症主要累及黏膜和黏膜下层, 少数可达浆膜层, 结肠黏膜不完整, 可见多灶性浅溃疡, 大部分腺体被破坏, 腺体正常结构丧失, 排列紊乱, 腺腔消失; 可见密集炎性细胞浸润. C组、D组小鼠结肠腺体破坏较轻, 结构基本恢复正常, 炎性细胞浸润深度较B组浅, 炎性细胞数量也显著减少, 炎症程度明显减轻(图1). B组的评分明显高于C组的评分, 差异有统计学意义(P<0.01), 也明显高于D组的评分, (P<0.01). C组的评分低于D组, 差异有统计学意义(P<0.01, 表1).
B组明显高于A组, C组、D组经干预后显著下降, B组与C组、D组比较差异有统计学意义(P<0.01). C组与D组比较, TNF-α的浓度两者之间差异无统计学意义, 而IL-6的浓度有统计学意义(P<0.01, 表1).
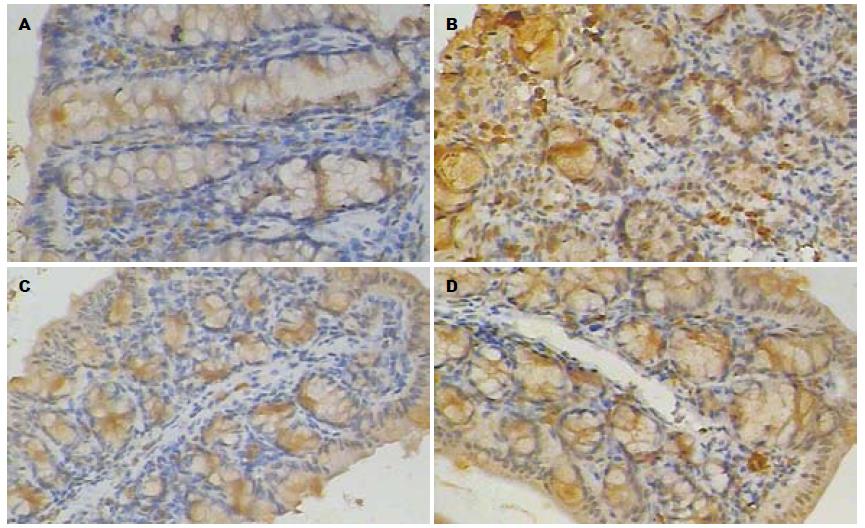
NF-κB的表达主要位于表面上皮、隐窝上皮细胞和巨噬细胞. 正常结肠组织中NF-κB主要在胞质表达, 胞核中有少量表达. A组在胞质中偶有表达, B组胞质和胞核均呈现强表达, C组在胞质表达, 胞核中也有少许表达, D组胞质和胞核中均有表达, 但弱于B组(图2). 评分B组与C、D组比较差异有统计学意义(P<0.01), C组与D组比较差异有统计学意义(P<0.05, 表1).
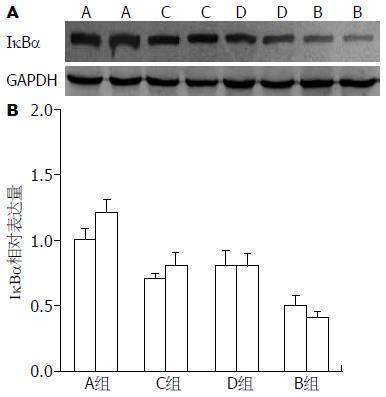
Western blot显示B组结肠组织中IκBα蛋白水平与A组相比明显下降, C组、D组蛋白水平与B组相比明显升高, 差异有统计学意义(P<0.05, 图3). IκBα的表达水平与NF-κB的激活成负相关, 这一结果与NF-κB免疫组织化学的表达结果吻合.
本实验成功使用DSS诱导了小鼠结肠炎模型, DSS是一种由蔗糖合成的硫酸多糖体, 具有和肝素同样的抗止血及抗凝血作用, 其诱导的结肠炎动物模型, 临床表现和病理改变与人类UC极为类似[3], 具体的机制尚不十分清楚, 大多数研究认为可能与肠道菌群失调、巨噬细胞功能障碍以及DSS抑制上皮细胞增生、调节细胞因子的表达及与嗜酸性粒细胞脱颗粒有关[4].
UC的病因与发病机制目前尚不清楚, 大多数研究认为与免疫反应有关[5,6], 遗传、环境因素、肠道黏膜屏障的破坏、持续的肠道感染等多种因素共同参与了UC的发生[7]. 正常机体内促炎和抗炎细胞因子处于平衡状态, UC时肠黏膜促炎细胞因子表达升高, 而抑炎细胞因子分泌相对不足, 使肠黏膜产生强烈的炎性反应, 引起肠道损伤[8,9]. 细胞因子TNF-α、IL-1、IL-6等具有广泛的生物活性, 他们与其相应的受体结合后能增强炎性细胞的功能, 促进多种促炎因子及炎症介质的表达, 重要的是他们可以激活NF-κB[10,11], 他们与相应的受体及受体作用蛋白结合后使TAK1(属于有丝分裂原激活蛋白激酶)磷酸化而被激活, 随之将IκB激酶激活, 催化IκB的磷酸化, IκB随之降解, 最终导致NF-κB途径的活化[12,13]. NF-κB是固有和适应性免疫应答中重要的转录调控因子, 广泛存在于各种组织中, 具有调控炎症反应、免疫、细胞分化等功能[14], 是肠道免疫反应中重要的调节基因, 他的激活显著地诱导了IBD的发生, 并且能够促进多种促炎因子的表达, 极大地影响了黏膜炎症的发生过程[15,16]. NF-κB在DSS诱导的小鼠UC模型中被激活后可以促进多种炎症因子的表达[17], 主要有: (1)细胞因子如TNF-α、TNF-β、IL-2、IL-6、IL-8等; (2)黏附分子如血管细胞黏附分子-1(vascular cell adhesion molecule-1, VCAM-1)、细胞内黏附分子-1(intracellular adhesion molecule-1, ICAM-1)、内皮细胞白细胞黏附分子-1(endothelial cell leukocyte adhesion molecule-1, ELAM-1)、P选择素等, 各黏附分子均有-κB结合位点; (3)诱生型酶如COX-2、iNOS等; (4)趋化蛋白如趋化蛋白-1; (5)免疫性受体如MHC-Ⅰ、MHC-Ⅱ、TCRα、TCRβ等. 许多细胞因子、炎症介质的基因启动子或增强子部位均有-κB位点, NF-κB与-κB位点结合后促进细胞因子的表达, 而后者的释放又进一步激活NF-κB[10,11], 形成正反馈效应, 使炎症反应放大和持续.
近年来, UC的治疗的焦点主要集中在抑制机体的免疫反应上, 生物免疫治疗也取得了一定的进展, 近来使用抗TNF-α抗体[18]和抗IL-2R[19]单抗治疗UC取得一定效果亦证实了细胞因子在UC发病中的作用, 人源单抗和重组细胞因子对人体整个免疫系统有不利因素, 加之价格昂贵, 均不利于广泛应用于临床. 研究证明许多治疗IBD的药物如糖皮质激素[20]、柳氮磺胺吡啶[21]的药理作用均与抑制NF-κB活性有关. 这些药疗效尚可, 但不良反应较大, 不利于长期使用.
姜黄素来源于姜科植物姜黄的干燥根茎, 来源广泛, 具有抗炎、抗氧化、免疫调节、抗肿瘤等功能[22,23]. 本次实验证实姜黄素确实有抗炎作用, 经姜黄素治疗的小鼠的活动、进食、饮水等一般情况明显改善, 小鼠DAI评分、组织学评分都明显降低, 疗效优于地塞米松, 且结肠黏膜的TNF-α、IL-6的表达降低, NF-κB的激活也明显降低, 同时NF-κB抑制剂IκBα的降解也减少, 这与Arafa等[24]、Deguchi等[25]的研究结果一致. 姜黄素的抗炎机制可能有以下几个方面[26]: (1)调节细胞因子的释放, 通过抑制促炎细胞因子及增加抑炎细胞因子表达而发挥抗炎作用; 有研究将来自于儿童和成人UC的活检的肠道黏膜与姜黄素一起进行半体内培养, 发现IL-10表达增加, 而IL-1β表达下降, 进一步表明姜黄素可以通过调节细胞因子释放而发挥抗炎作用[27]; (2)从多阶段抑制NF-κB及其上游的信号通路而发挥抗炎作用; 首先, 抑制NF-κB的部分激活信号, 如细胞因子(TNF-α、IL-1、IL-8等)、脂多糖、氧自由基及凝血酶等. 其次, 抑制NF-κB活化途径中的一些关键酶如Jun蛋白N端激酶、蛋白激酶C等[28], 抑制活化途径中的接头蛋白如髓样分化蛋白MyD88[29]等. 最后可抑制NIK、MEKK-1阻止IκB激酶的磷酸化; (3)可以通过上调氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor γ, PPARγ)的活性而负性调节NF-κB的表达, 进而调节细胞因子的释放[30]; (4)可以通过下调COX-2、iNOS等的活性而发挥抗炎作用[31].
本实验结果显示经姜黄素治疗的小鼠结肠组织炎症损伤明显减轻, 且疗效优于地塞米松, 同时他减弱了结肠组织中NF-κB和TNF-α、IL-6的表达.
总之, 姜黄素对DSS诱导的小鼠UC具有治疗作用, 其作用机制可能是抑制NF-κB及细胞因子TNF-α、IL-6等的表达而达到抗炎疗效. 应进一步探讨姜黄素对UC的保护作用及机制, 为姜黄素作为治疗UC的治疗药物提供依据, 姜黄素价格低廉、安全性高, 会有极大的应用潜力.
溃疡性结肠炎(UC)是一种肠道非特异性炎症性疾病, 其病因及发病机制尚未清楚, 治疗上也缺乏特异有效的药物, 研究其发病机制, 以及寻找治疗新策略和新药物是当今UC研究领域的一大热点.
刘萱, 副主任医师, 首都医科大学附属北京友谊医院消化科
UC治疗的焦点主要集中在抑制机体的免疫反应上, 细胞因子、NF-κB在炎症反应中的调控作用使其成为研究炎症性肠病的治疗途径的中心靶点. 近年的研究表明姜黄素具有强大的抗炎作用, 姜黄素在UC中的疗效及抗炎机制是目前研究的热点之一.
DSS结肠炎动物模型临床表现和病理改变更接近人类UC, 姜黄素在DSS结肠炎中的研究, 国内尚无报道, 本实验对姜黄素治疗小鼠DSS结肠炎的机制进行探讨并观察其疗效.
本文从分子水平阐述了姜黄素对UC的抗炎机制及疗效, 为姜黄素治疗UC提供了有力的证据, 而姜黄素价格低廉、来源广泛, 有很好的应用前景, 有望开发成为治疗UC的新药.
本文方法合理, 结果可信, 对姜黄素未来在临床中用于治疗溃疡性结肠炎提供了实验依据.
编辑: 李军亮 电编:何基才
| 1. | Hamamoto N, Maemura K, Hirata I, Murano M, Sasaki S, Katsu K. Inhibition of dextran sulphate sodium (DSS)-induced colitis in mice by intracolonically administered antibodies against adhesion molecules (endothelial leucocyte adhesion molecule-1 (ELAM-1) or intercellular adhesion molecule-1 (ICAM-1)). Clin Exp Immunol. 1999;117:462-468. [PubMed] [DOI] |
| 2. | Murano M, Maemura K, Hirata I, Toshina K, Nishikawa T, Hamamoto N, Sasaki S, Saitoh O, Katsu K. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis. Clin Exp Immunol. 2000;120:51-58. [PubMed] [DOI] |
| 3. | Yan Y, Kolachala V, Dalmasso G, Nguyen H, Laroui H, Sitaraman SV, Merlin D. Temporal and spatial analysis of clinical and molecular parameters in dextran sodium sulfate induced colitis. PLoS One. 2009;4:e6073. [PubMed] [DOI] |
| 4. | Maltby S, Wohlfarth C, Gold M, Zbytnuik L, Hughes MR, McNagny KM. CD34 is required for infiltration of eosinophils into the colon and pathology associated with DSS-induced ulcerative colitis. Am J Pathol. 2010;177:1244-1254. [PubMed] [DOI] |
| 5. | Endo K, Shiga H, Kinouchi Y, Shimosegawa T. [Inflammatory bowel disease: IBD]. Rinsho Byori. 2009;57:527-532. [PubMed] |
| 6. | Matricon J. [Immunopathogenesis of inflammatory bowel disease]. Med Sci (Paris). 2010;26:405-410. [PubMed] [DOI] |
| 7. | Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 2007;448:427-434. [PubMed] [DOI] |
| 8. | Sanchez-Munoz F, Dominguez-Lopez A, Yamamoto-Furusho JK. Role of cytokines in inflammatory bowel disease. World J Gastroenterol. 2008;14:4280-4288. [PubMed] [DOI] |
| 9. | Polińska B, Matowicka-Karna J, Kemona H. [The cytokines in inflammatory bowel disease]. Postepy Hig Med Dosw (Online). 2009;63:389-394. [PubMed] |
| 10. | Li H, Lin X. Positive and negative signaling components involved in TNFalpha-induced NF-kappaB activation. Cytokine. 2008;41:1-8. [PubMed] [DOI] |
| 11. | Yamazaki K, Gohda J, Kanayama A, Miyamoto Y, Sakurai H, Yamamoto M, Akira S, Hayashi H, Su B, Inoue J. Two mechanistically and temporally distinct NF-kappaB activation pathways in IL-1 signaling. Sci Signal. 2009;2:ra66. [PubMed] [DOI] |
| 12. | Wertz IE, Dixit VM. Signaling to NF-kappaB: regulation by ubiquitination. Cold Spring Harb Perspect Biol. 2010;2:a003350. [PubMed] [DOI] |
| 13. | Häcker H, Karin M. Regulation and function of IKK and IKK-related kinases. Sci STKE. 2006;2006:re13. |
| 14. | Oeckinghaus A, Ghosh S. The NF-kappaB family of transcription factors and its regulation. Cold Spring Harb Perspect Biol. 2009;1:a000034. [PubMed] [DOI] |
| 15. | Atreya I, Atreya R, Neurath MF. NF-kappaB in inflammatory bowel disease. J Intern Med. 2008;263:591-596. [PubMed] [DOI] |
| 16. | Nenci A, Becker C, Wullaert A, Gareus R, van Loo G, Danese S, Huth M, Nikolaev A, Neufert C, Madison B. Epithelial NEMO links innate immunity to chronic intestinal inflammation. Nature. 2007;446:557-561. [PubMed] [DOI] |
| 18. | Wilhelm SM, McKenney KA, Rivait KN, Kale-Pradhan PB. A review of infliximab use in ulcerative colitis. Clin Ther. 2008;30:223-230. [PubMed] [DOI] |
| 19. | Creed TJ, Probert CS, Norman MN, Moorghen M, Shepherd NA, Hearing SD, Dayan CM. Basiliximab for the treatment of steroid-resistant ulcerative colitis: further experience in moderate and severe disease. Aliment Pharmacol Ther. 2006;23:1435-1442. [PubMed] [DOI] |
| 20. | King EM, Holden NS, Gong W, Rider CF, Newton R. Inhibition of NF-kappaB-dependent transcription by MKP-1: transcriptional repression by glucocorticoids occurring via p38 MAPK. J Biol Chem. 2009;284:26803-26815. [PubMed] [DOI] |
| 21. | Zhao W, Song L, Hongzhu D. Amelioration of dextran sulfate sodium-induced chronic colitis by sulfasalazine salicylazosulfapyridine via reducing NF-kappaB transcription factor p65 recruitment to ICAM-1 gene promoters. Yakugaku Zasshi. 2010;130:1239-1249. [PubMed] [DOI] |
| 22. | Shishodia S, Singh T, Chaturvedi MM. Modulation of transcription factors by curcumin. Adv Exp Med Biol. 2007;595:127-148. [PubMed] [DOI] |
| 23. | Goel A, Kunnumakkara AB, Aggarwal BB. Curcumin as "Curecumin": from kitchen to clinic. Biochem Pharmacol. 2008;75:787-809. [PubMed] [DOI] |
| 24. | Arafa HM, Hemeida RA, El-Bahrawy AI, Hamada FM. Prophylactic role of curcumin in dextran sulfate sodium (DSS)-induced ulcerative colitis murine model. Food Chem Toxicol. 2009;47:1311-1317. [PubMed] [DOI] |
| 25. | Deguchi Y, Andoh A, Inatomi O, Yagi Y, Bamba S, Araki Y, Hata K, Tsujikawa T, Fujiyama Y. Curcumin prevents the development of dextran sulfate Sodium (DSS)-induced experimental colitis. Dig Dis Sci. 2007;52:2993-2998. [PubMed] [DOI] |
| 27. | Epstein J, Docena G, MacDonald TT, Sanderson IR. Curcumin suppresses p38 mitogen-activated protein kinase activation, reduces IL-1beta and matrix metalloproteinase-3 and enhances IL-10 in the mucosa of children and adults with inflammatory bowel disease. Br J Nutr. 2010;103:824-832. [PubMed] [DOI] |
| 28. | Foryst-Ludwig A, Neumann M, Schneider-Brachert W, Naumann M. Curcumin blocks NF-kappaB and the motogenic response in Helicobacter pylori-infected epithelial cells. Biochem Biophys Res Commun. 2004;316:1065-1072. [PubMed] [DOI] |
| 29. | Lubbad A, Oriowo MA, Khan I. Curcumin attenuates inflammation through inhibition of TLR-4 receptor in experimental colitis. Mol Cell Biochem. 2009;322:127-135. [PubMed] [DOI] |
| 30. | Jacob A, Wu R, Zhou M, Wang P. Mechanism of the Anti-inflammatory Effect of Curcumin: PPAR-gamma Activation. PPAR Res. 2007;2007:89369. [PubMed] |
| 31. | Camacho-Barquero L, Villegas I, Sánchez-Calvo JM, Talero E, Sánchez-Fidalgo S, Motilva V, Alarcón de la Lastra C. Curcumin, a Curcuma longa constituent, acts on MAPK p38 pathway modulating COX-2 and iNOS expression in chronic experimental colitis. Int Immunopharmacol. 2007;7:333-342. [PubMed] [DOI] |