修回日期: 2011-01-18
接受日期: 2011-01-23
在线出版日期: 2011-02-28
目的: 探讨上腹部中、大手术后肠道细菌易位(BT)与术后全身炎性反应综合征(SIRS)的关系.
方法: 选择60例大、中型上腹部手术患者, 于术前和术后1、3、5 d采集外周血, 进行血浆D-乳酸, 全血细菌DNA检测. 全血DNA提取后进行PCR扩增, 采用靶基因为大肠杆菌特异性β半乳糖苷酶基因和16SrRNA基因. 观察患者术后10 d以监测SIRS情况.
结果: 术前PCR检测全血细菌DNA均为阴性,术后共有14例阳性. PCR阳性组SIRS发生率为85.7%(12/14), 阴性组为21.7%(10/46), 差异显著(P<0.01); 术后出现SIRS的患者PCR阳性率为54.5%(12/22), 无SIRS组为5.3%(2/38), 差异显著(P<0.01); 大手术组PCR阳性率为38.5%(10/26),中手术组PCR阳性率为11.8%(4/34), 差异显著(P<0.05). PCR阳性的患者外周血血浆D-乳酸浓度较PCR阴性者明显升高(5 d: 11.53 mg/L±0.68 mg/L vs 5.70 mg/L±2.46 mg/L, P<0.01), 有SIRS的患者外周血血浆D-乳酸浓度较无SIRS患者明显升高(5 d: 10.61 mg/L±1.77 mg/L vs 5.02 mg/L±1.8 mg/L, P<0.01).
结论: 上腹部大、中型手术后肠黏膜屏障损伤与BT关系密切, 术后SIRS和与BT密切相关. PCR技术对术后SIRS有较好的早期预警价值.
引文著录: 邵长春, 丁连安, 牛冬光. 上腹部中、大手术后肠道细菌易位60例. 世界华人消化杂志 2011; 19(6): 640-643
Revised: January 18, 2011
Accepted: January 23, 2011
Published online: February 28, 2011
AIM: To investigate the relationship between bacterial translocation and acute systemic inflammatory syndrome (SIRS) in patients who underwent moderate or major upper abdominal operations.
METHODS: Sixty patients who underwent moderate or major upper abdominal operations were observed. Blood samples were collected before surgery and 1, 3, 5 d after surgery to detect plasma D-lactate and isolate genomic DNA. PCR analysis was performed to amplify the β-galactosidase gene of Escherichia coli and 16S rRNA gene. SIRS was monitored in all patients for 10 days.
RESULTS: PCR results were negative in all the patients before operation, while positive PCR results were obtained in 14 patients after surgery. Twelve patients who showed positive PCR results had SIRS (12/14, 85.7%), while only 21.7% of patients (10/46) with negative PCR results had SIRS (P < 0.01). The positive rate of PCR test was significantly higher in patients with SIRS than in those without SIRS [54.5% (12/22) vs 5.3% (2/38), P < 0.01], and in patients undergoing major operations than in those undergoing moderate operations [38.5% (10/26) vs 11.8% (4/34), P < 0.05]. Plasma level of D-lactate was significantly higher in patient with positive PCR results than in those with negative PCR results (5 d: 11.53 mg/L ± 0.68 mg/L vs 5.70 mg/L ± 2.46 mg/L, P < 0.01) and in patients with SIRS than in those without SIRS (5 d: 10.61 mg/L ± 1.77 mg/L vs 5.02 mg/L ± 1.8 mg/L, P < 0.01).
CONCLUSION: Increased intestinal permeability is closely related to bacterial translocation, and bacterial translocation is closely related to SIRS.
- Citation: Shao CC, Ding LA, Niu DG. Bacterial translocation after moderate or major upper abdominal surgery: an analysis of 60 cases. Shijie Huaren Xiaohua Zazhi 2011; 19(6): 640-643
- URL: https://www.wjgnet.com/1009-3079/full/v19/i6/640.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i6.640
越来越多的学者及临床工作者关注肠屏障功能的研究, 肠道作为多脏器功能障碍的始动器官[1], 已被许多学者接受. 肠道缺血/再灌注损伤引起肠道黏膜屏障功能障碍, 使肠腔中的细菌、内毒素易位, 各种炎症介质的共同作用可触发全身炎症反应综合征(systemic inflammatory response syndrome, SIRS), 而SIRS可能是导致多器官功能障碍(multiple organ dysfunction syndrome, MODS)的重要原因[2]. 当机体遭受创伤、出血、应激、手术、感染以及休克等损害时, 可首先造成肠黏膜的缺血、缺氧, 肠通透性增加, 寄生于肠道内的微生物和/或内毒素, 通过某种途径越过肠黏膜屏障, 大量侵入正常情况下为无菌的肠道以外的组织, 如肠系膜淋巴结、门静脉、肝、脾以及全身血液循环, 其结果可能引发肠源性感染, 并且触发SIRS, 导致脓毒症、休克、MODS, 甚至死亡[3,4]. 这一现象可在动物实验中获得直接的证据, 临床上用以判断肠黏膜屏障损伤及肠道细菌易位(bacterial translocation, BT)的指标与方法或可行性差, 人体内难以得到直接证明. 本研究通过检测外周血D-乳酸浓度判断肠黏膜通透性, 用提取全血细菌DNA, 进行PCR扩增判断肠道BT, 探讨上腹部中大型手术后肠黏膜屏障损伤、BT与SIRS之间的联系.
选择青岛大学医学院附属医院普外科2009-12/2010-07大中型上腹部手术患者60例, 其中根治性远端胃切除术18例, 根治性近端胃切除术9例, 根治性全胃切除术8例, 胰十二指肠切除术12例, 胆肠吻合术13例. 男32例, 女28例, 平均年龄55.8(36-70)岁. 所有研究的患者均知情同意, 该研究课题已通过大学伦理委员会会的批准. 术前有严重全身性疾病、脏器功能障碍及严重并发症的患者不列入本研究. 术前准备按常规进行. 所有研究的患者均常规预防性使用抗生素.
1.2.1 分组: 按手术时间及术中失血量粗略地分为大手术组[手术时间>3 h和(或)术中失血>500 mL]和中等手术组; 按PCR扩增结果分为PCR阳性组与PCR阴性组. 按术后是否出现SIRS分为SIRS组及无SIRS组.
1.2.2 血D-乳酸水平的测定: 分别于术前1 d及术后1、3、5 d各取静脉血3 mL, 经肝素抗凝, 离心, 血浆置EP管中-80 ℃冻存后成批检测. 血浆D-乳酸采用酶学分光光度法检测. 原理: D-乳酸与氧化型辅酶在碱性环境中和D-乳酸脱氢酶存在条件下, 可生成丙酮酸和还原型辅酶, 在反应体系中加入肼类化合物, 除去丙酮酸, 使反应向右进行, 测定还原型辅酶的吸光度即可定量D-乳酸. 简要步骤如下[5]: 取血浆0.4 mL+5.8 mol/L高氯酸0.04 mL, 振荡20 s混匀后冰浴10 min, 4 000 r/min 4 ℃离心10 min; 取上清0.2 mL+11.6 mol/L氢氧化钾0.02 mL, 混匀后冰浴10 min, 3 200 r/min 4 ℃离心10 min; 取上清0.125 mL+辅酶I-甘氨酸缓冲液0.375 mL+D-乳酸脱氢酶0.025 mL, 混匀后置25 ℃水浴90 min; 采用Beckman DU-7紫外分光光度计(波长340 nm)测定A值, 并以不同浓度的D-乳酸作标准曲线.
1.2.3 血细菌DNA检测: 分别于术前1 d及术后1、3、5 d各取静脉血3 mL, 经Na2EDTA抗凝处理, 4 ℃保存后成批检测. 经高速离心后, 采用血细菌DNA提取盒(Biospin细菌DNA提取盒)提取细菌DNA, 以标准菌株为阳性对照, 进行PCR扩增. 引物设计: 大肠杆菌特异性β半乳糖苷酶基因的BG-1、BG-4; 所有细菌共有16SrRNA基因的高度保守区引物16SrRNA+、16SrRNA. 引物, 引物序列, 靶基因及扩增产物长度见表1.
| 引物 | 引物序列 | 靶基因 | 扩增产物长度(bp) |
| BG-1(+strand) | 5'-CTT TGC CTG GTT TCC GGC ACC AGA A-3' (201-225) | 大肠杆菌特异性β- 半乳糖苷酶基因 | 762 |
| BG-4(-strand) | 5'-AAC CAC CGC ACG ATA GAG ATT CGG G-3' (963-939) | ||
| 16SrRNA+(+strand) | 5'-AGT TTG ATC CTG GCT CAG -3'(8-27) | 16S rRNA基因 | 768 |
| 16SrRNA-(-strand) | 5'-GGA CTA CCA GGG TAT CTA AT-3'(806-787) |
1.2.4 观察术后SIRS情况: 观察术后10 d有无SIRS发生, 具备以下两项或两项以上体征可诊断为SIRS: 体温>38 ℃或<36 ℃; 心率>90次/min; 呼吸频率>20次/min或PaCO2<4.27 kPa(32 mmHg); 外周血白细胞计数>12.0×109/L或<4.0×109/L, 或未成熟粒细胞>10%.
统计学处理 数各分组所得计量数据采用mean±SD表示, 用SPSS17.0软件处理数据, 计数资料采用χ2检验, 计量资料采用t检验及ANOVA分析.
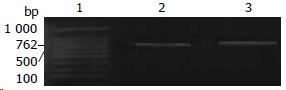
术前PCR检测全血细菌DNA均为阴性, 术后共出现14例PCR阳性, 其中具有代表性的图谱见图1, 2. 22例患者术后发生SIRS, 其中有12例患者PCR阳性, 有6例手术时间超过4 h, 失血超过1 000 mL. PCR阳性组SIRS发生率为85.7%(12/14), 阴性组为21.7%(10/46), 差异有显著统计学意义(P<0.01, 表2). 术后出现SIRS的患者PCR阳性率为54.5%(12/22), 无SIRS组为5.3%(2/38), 差异有显著统计学意义(P<0.01, 表2). 大手术组PCR阳性率为38.5%(10/26), 中手术组PCR阳性率为11.8%(4/34), 差异有统计学意义(P<0.05, 表2).
| 分组 | n | PCR(+) | BG | 16SrRNA | ||||||
| 0 d | 1 d | 3 d | 5 d | 0 d | 1 d | 3 d | 5 d | |||
| SIRS组 | 22 | 12 | 0 | 5 | 12 | 10 | 0 | 7 | 12 | 11 |
| Non-SIRS组 | 38 | 2 | 0 | 2 | 1 | 0 | 0 | 2 | 1 | 0 |
| 大手术组 | 26 | 10 | 0 | 4 | 10 | 9 | 0 | 6 | 10 | 10 |
| 中手术组 | 34 | 4 | 0 | 3 | 2 | 1 | 0 | 4 | 3 | 1 |
BT及其并发症已在大量的动物模型中明确地证实存在, 尤其在发生严重创伤或失血性休克后, 但在人类临床研究中, 对其存在和意义仍存在较大争议[6-8].
D-乳酸是肠道多种细菌发酵的代谢产物, 当肠道发生急性缺血时, 局部细菌大量繁殖, 破坏肠黏膜生物屏障, 由于肠缺血导致肠黏膜绒毛顶端上皮脱落, 细胞旁路径增加而导致肠黏膜通透性增加[9]. 此时肠道中细菌产生的大量D-乳酸透过受损的肠黏膜经循环进入血液, D-乳酸在肝内不被分解, 因此外周血浆D-乳酸水平与门静脉血浆D-乳酸水平相比无明显变化, 通过测定外周血血液中D-乳酸水平可及时反映肠黏膜损害程度和通透性变化[10,11]. 因此, 外周血中血浆D-乳酸的测定可作为判断肠黏膜屏障功能的敏感指标. 本研究采用PCR方法可检测全血细菌DNA, 较传统的血培养敏感[12].
本研究表明上腹部中大型手术可发生BT, 术后发生SIRS与BT有着密切的关系. 术后发生BT的原因可能主要是手术中麻醉与手术创伤刺激引起内脏血管痉挛, 加之术中失血,肠道处于缺血缺氧状态, 缺血再灌注损伤, 释放炎症介质,导致肠屏障功能破坏, 从而易于发生BT[13,14]. 大手术组PCR阳性率较中手术组高(P<0.05). 在60例手术中, 有6例手术时间>4 h, 失血超过1 000 mL, 这6例患者术后PCR结果均为阳性. 这表明术后BT与手术创伤有关, 手术创伤越大, 时间越长, 术中失血越多, 肠道缺血缺氧越严重, 越容易发生BT.
本研究结果提示, 上腹部中大型手术创伤较大可引起机体缺血再灌注损伤、炎症介质释放, 肠道黏膜损伤, 使肠黏膜通透性增高, 造成肠道BT, 机体对其的反应表现为SIRS; 而SIRS启动后进一步激发大量炎性介质的全身性释放, 作用于肠道造成肠道血流的低灌注, 肠黏膜缺血缺氧, 进一步加重肠黏膜屏障的功能损害, 易于导致肠道BT发生. 上腹部中大型手术术后发生SIRS与BT有着密切的关系, BT与SIRS的关系是相互的[15]. PCR技术可早期诊断BT, 对术后SIRS有较好的早期预警价值. 此外, 适度的麻醉, 缩短手术时间、减少手术创伤及术中失血有助于预防术后BT的发生. PCR有自身的局限性, PCR仅能检出细菌DNA的碎片, 并不能确定细菌是否具有活力, 另外PCR不能进行药物敏感试验来指导临床抗生素治疗而血培养可以做到这些, 故将血培养与PCR检测配合起来更有意义.
1979年Berg等提出细菌易位是指肠道内活的细菌穿过肠道黏膜层进入固有层. 继而到达肠系膜淋巴结以及更远处的器官. 在严重的创伤、出血、应激、手术、感染以及休克等应激状态下, 会导致肠屏障功能障碍、细菌易位, 并由此诱发全省炎症反应综合征、脓毒症、多器官功能障碍, 甚至死亡. 可见, 细菌易位极可能是SIRS及MODS发生发展中的关键环节. 细菌易位理论研究已在动物模型中明确地证实, 但在人类临床研究中, 对其存在和意义仍存在较大争议.
陈敬贤, 教授, 安徽医科大学微生物教研室; 李晓波, 教授, 上海交通大学药学院
Ono等研究了52例外科患者, 包括肝叶切除、食管切除及结肠癌化疗患者, PCR检测阳性, 大部分为肠源性细菌及少量白念珠菌, 而对照组健康人群全部阴性. 说明肠屏障的破坏确可引起细菌易位的发生, 但缺乏与术后脓毒症发生的关联.
目前, 尚无非常可靠的方法来明确人类细菌易位的诊断, 肠系膜淋巴结培养受到多方面的限制, 而血培养阳性率较低. 本研究采用PCR技术测定细菌易位, PCR方法可检测全血细菌DNA, 可提供细菌易位的直接证据, 较传统的血培养敏感. 本研究将PCR技术应用于临床研究, 研究表明细菌易位与术后SIRS的发生有着密切的关系.
本研究提示上腹部中大型手术后肠通透性升高, 可能发生肠黏膜屏障损伤导致细菌易位, 诱发全身炎症反应综合征, PCR技术可早期诊断细菌易位, 对术后SIRS有较好的早期预警价值, 具有一定的理论价值和临床意义.
本文实验设计较合理, 思路清楚, 具有一定的理论价值和临床意义.
编辑: 李薇 电编:李薇
| 3. | Deitch EA, Xu D, Kaise VL. Role of the gut in the development of injury- and shock induced SIRS and MODS: the gut-lymph hypothesis, a review. Front Biosci. 2006;11:520-528. [PubMed] [DOI] |
| 4. | Gatt M, Reddy BS, MacFie J. Review article: bacterial translocation in the critically ill--evidence and methods of prevention. Aliment Pharmacol Ther. 2007;25:741-757. [PubMed] [DOI] |
| 5. | 于 勇, 盛 志勇, 柴 家科, 黎 君友, 杨 晓东, 袁 仕安, 晋 桦, 董 宁, 孙 丹. 烧伤患者血浆D-乳酸水平和肠道内IgA含量的变化. 刨伤外科杂志. 2003;5:122-124. |
| 7. | Ammori BJ, Fitzgerald P, Hawkey P, McMahon MJ. The early increase in intestinal permeability and systemic endotoxin exposure in patients with severe acute pancreatitis is not associated with systemic bacterial translocation: molecular investigation of microbial DNA in the blood. Pancreas. 2003;26:18-22. [PubMed] [DOI] |
| 8. | Balzan S, de Almeida Quadros C, de Cleva R, Zilberstein B, Cecconello I. Bacterial translocation: overview of mechanisms and clinical impact. J Gastroenterol Hepatol. 2007;22:464-471. [PubMed] [DOI] |
| 9. | Günel E, Cağlayan O, Cağlayan F. Serum D-lactate levels as a predictor of intestinal ischemia-reperfusion injury. Pediatr Surg Int. 1998;14:59-61. [PubMed] [DOI] |
| 10. | Assadian A, Assadian O, Senekowitsch C, Rotter R, Bahrami S, Fürst W, Jaksch W, Hagmüller GW, Hübl W. Plasma D-lactate as a potential early marker for colon ischaemia after open aortic reconstruction. Eur J Vasc Endovasc Surg. 2006;31:470-474. [PubMed] [DOI] |
| 11. | Song WB, Lv YH, Zhang ZS, Li YN, Xiao LP, Yu XP, Wang YY, Ji HL, Ma L. Soluble intercellular adhesion molecule-1, D-lactate and diamine oxidase in patients with inflammatory bowel disease. World J Gastroenterol. 2009;15:3916-3919. [PubMed] |
| 12. | Ono S, Tsujimoto H, Yamauchi A, Hiraki S, Takayama E, Mochizuki H. Detection of microbial DNA in the blood of surgical patients for diagnosing bacterial translocation. World J Surg. 2005;29:535-539. [PubMed] [DOI] |
| 13. | Sakaguchi S, Furusawa S. Oxidative stress and septic shock: metabolic aspects of oxygen-derived free radicals generated in the liver during endotoxemia. FEMS Immunol Med Microbiol. 2006;47:167-177. [PubMed] [DOI] |
| 14. | Kaneko H, Tamura A, Ishii T, Maeda T, Katagiri T, Ishii J, Kubota Y, Suzuki T, Tsuchiya M, Otsuka Y. Bacterial translocation in small intestinal ischemia-reperfusion injury and efficacy of Anti-CINC antibody treatment. Eur Surg Res. 2007;39:153-159. [PubMed] [DOI] |
| 15. | Guarner C, Soriano G. Bacterial translocation and its consequences in patients with cirrhosis. Eur J Gastroenterol Hepatol. 2005;17:27-31. [PubMed] [DOI] |