修回日期: 2011-01-15
接受日期: 2011-01-21
在线出版日期: 2011-02-28
目的: 探讨结直肠癌β-连环素(β-catenin)与血管内皮生长因子-C和-D(VEGF-C, VEGF-D)的表达相关性及其意义.
方法: 应用免疫组织化学SP法检测96例结直肠癌及正常结直肠组织中β-catenin与VEGF-C和-D的表达, 并分析其相关性和意义.
结果: 正常结直肠黏膜β-catenin细胞膜阳性表达, 结直肠癌β-catenin主要呈细胞核和/或细胞质异位表达, 异位表达率为67.70%; 结直肠癌组织VEGF-C和-D阳性率明显高于正常结直肠组织(43.75% vs 19.79%; 38.54% vs 13.54%, 均P<0.01); 而且β-catenin与VEGF-C和-D的表达呈显著正相关(均P<0.01).
结论: 结直肠癌β-catenin异位表达可能是VEGF-C和-D高表达的重要原因, 其在结直肠癌淋巴管生成中可能起重要作用.
引文著录: 牟江洪, 向德兵, 肖华亮, 林俐. β-catenin与VEGF-C和-D在结直肠癌中的表达及其相关性. 世界华人消化杂志 2011; 19(6): 636-639
Revised: January 15, 2011
Accepted: January 21, 2011
Published online: February 28, 2011
AIM: To investigate the expression of β-catenin and vascular endothelial growth factor-C/-D (VEGF-C/-D) in colorectal cancer (CRC) and to analyze their significance.
METHODS: The expression of β-catenin and VEGF-C/-D in 96 CRC specimens were detected by immunohistochemistry.
RESULTS: In normal colonic mucosa, β-catenin was detected on the plasma membrane of epithelial cells. Reduced membrane expression of β-catenin was noted in CRC, and 67.71% of cases of CRC showed cytoplasmic and nuclear expression of β-catenin. The positive rates of VEGF-C/-D expression were significantly higher in tumor tissue than in normal mucosa (43.75% vs 19.79%; 38.54% vs 13.54%, both P < 0.01). The expression of β-catenin had a significantly positive correlation with that of VEGF-C/-D (both P < 0.01).
CONCLUSION: Cytoplasmic and nuclear β-catenin expression may induce VEGF-C/-D overexpression in CRC, which may play an important role in lymphangiogenesis in CRC.
- Citation: Mou JH, Xiang DB, Xiao HL, Lin L. Expression of β-catenin and VEGF-C/-D in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(6): 636-639
- URL: https://www.wjgnet.com/1009-3079/full/v19/i6/636.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i6.636
血管内皮生长因子(vascular endothelial growth, VEGF)-C和-D是主要的淋巴管生成因子, 其可能与肿瘤发生、发展有关, 尤其是VEGF-C和-D通过其受体VEGFR-3信号传导途径诱导肿瘤淋巴管生成, 促进肿瘤淋巴结转移的潜在作用已越来越引起人们的重视[1,2]. β-catenin信号通路异常激活可以启动多种下游靶基因转录(如c-Myc、cyclin D1、NF-κB、COX-2、MMP等), 在肿瘤的发生、发展、侵袭、转移中起重要作用; β-catenin胞质和/或胞核异位表达是其发挥作用的物质基础[3,4]. 新近有研究表明VEGF-C和-D基因启动子含有β-catenin/Tcf-4复合体的结合位点, 其可能是β-catenin信号通路的下游靶基因[5,6]. 为此, 我们拟检测结直肠癌β-catenin异位表达和VEGF-C/D表达的相关性, 探讨β-catenin信号通路在结直肠癌淋巴管生成中可能的潜在作用.
选取中国人民解放军第三军医大学附属大坪医院1996-1998年间结直肠癌根治术石蜡标本96例, 其中男50例, 女46例, 男女比例为1:1; 年龄22-83(平均53)岁, 中位年龄57岁; 术前均未进行抗肿瘤治疗.
所有标本经40 g/L中性甲醛液固定, 常规石蜡包埋, 4 µm切片, 水化后行免疫组织化学SP法染色, 切片均采用胰酶消化和微波抗原修复, 其余步骤参照试剂盒说明进行. 每例标本均对癌组织和相应正常结直肠黏膜染色. 鼠抗人β-catenin(1:200)、VEGF-C(1:50)、VEGF-D(1:200)单克隆抗体均为Novus Bio公司产品; SP试剂盒购自北京中杉生物技术公司. β-catenin染色结果判断标准参照Maruyama等[7]的方法, 胞质和/或胞核着色细胞比例>10%为阳性, 称为β-catenin异位表达. VEGF-C和-D表达采用半定量计分法判定[8], 细胞着色强弱分为四级: 不着色 = 0, 弱着色 = 1, 中等着色 = 2, 强着色 = 3; 着色细胞比例也分为四级: 无细胞着色 = 0、着色细胞比例<25% = 1, 着色细胞比例25-50% =2, 着色细胞比例>50% = 3. 细胞着色强弱和着色细胞比例两者乘积≤2为阴性表达, >2为阳性表达.
统计学处理 应用SPSS10.0统计软件对数据进行显著性和相关性检验, 组间差异显著性采用χ2或Fisher精确检验, β-catenin和VEGF-C/-D表达的相关性采用Spearman秩相关分析, P<0.05表示有显著统计学意义.
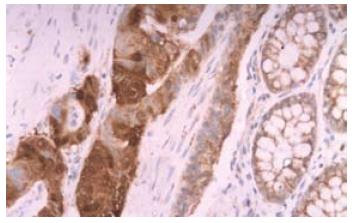
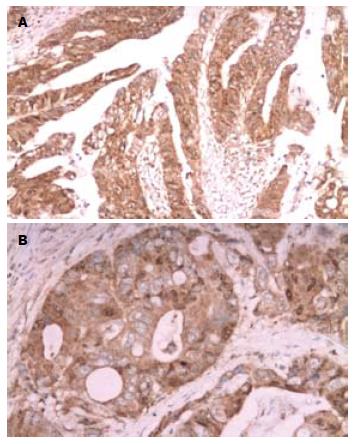
图1显示β-catenin阳性物质呈棕黄色细颗粒状, 正常结直肠黏膜β-catenin定位于黏膜上皮细胞胞膜, 结直肠癌β-catenin胞膜表达不同程度缺失, 主要呈胞质和/或胞核表达, 异位表达率为67.70%. 图2显示VEGF-C和-D阳性物质也呈棕黄色细颗粒状, 主要定位于结直肠癌癌细胞胞质. 结直肠癌组织VEGF-C和-D阳性率分别为43.75%和38.54%, 经χ2或Fisher精确检验, 均显著高于正常结直肠组织的表达率19.79%和13.54%(P<0.01; P<0.01).
VEGF-C和-D是目前发现的少数几个强有力的淋巴管内皮生长因子, 属于VEGF家族成员. 但是与VEGF等其他家族成员不同的是, VEGF-C/-D具有双重作用: 在胚胎时期与血管内皮细胞VEGFR-2结合诱导血管生成, 而在成年主要与淋巴管内皮细胞VEGFR-3结合诱导淋巴管生成[9]. 体内体外实验已经证实, VEGF-C/-D在多种实体肿瘤中高表达, 并诱导肿瘤内和/或肿瘤周围淋巴管生成, 促进肿瘤转移[10,11]. 我们以前的研究也显示, 结直肠癌VEGF-C/-D表达较正常结直肠组织显著增加, 并与癌周淋巴管密度、淋巴结转移及远处器官转移密切相关, 提示结直肠癌VEGF-C/-D可能主要诱导癌周淋巴管生成, 进而促进结直肠癌转移[12].
但是到目前为止, 人们对VEGF-C/-D的调控机制还缺乏足够的认识, 一个重要原因是淋巴管生成机制与血管生成不尽相同, 缺氧等诸多影响血管生成的因素并不调控VEGF-C/-D的表达. 现有的研究仅发现细胞接触、类固醇激素以及几种细胞因子(如Heregulin-β1)和致炎因子(如IL-1α、TNF)等少数VEGF-C/-D调控因素[13,14], 而且对其具体调控机制也还不甚清楚.
β-catenin信号通路是近年来发育生物学及肿瘤生物学研究的热点, 在胚胎发育过程以及多种肿瘤的发生发展中起重要作用[4]. β-catenin信号通路致癌的关键是: β-catenin胞质累积(包括β-catenin突变、表达激活、降解减少、E-cadherin-β-catenin复合体裂解等诱因), 然后转位进入细胞核内, 结合并激活Tcf-4转录因子, 启动下游靶基因转录(如c-Myc、cyclin D1、NF-κB、COX-2、MMP等), 在肿瘤的发生、发展、侵袭、转移中起重要作用[15]. 大约90%的结直肠癌存在β-catenin信号通路异常, 被公认为结直肠癌发生发展过程中的关键信号通路之一.
更令我们感兴趣的是, 已有研究显示β-catenin信号通路通过调控VEGF等对血管生成具有重要的作用[5,16], 但是在淋巴管生成中是否也有类似的功能尚不清楚. 新近有研究表明VEGF-C和-D基因启动子含有β-catenin/Tcf-4复合体的结合位点, 其可能是β-catenin信号通路的下游靶基因[5,6]. 我们以前的研究发现β-catenin异位表达与结直肠癌癌周淋巴管密度密切相关, 可能与结直肠癌淋巴管生成有关, 但其具体机制不清楚. 本次实验结果显示β-catenin异位表达和VEGF-C/-D有显著的正相关性, 提示结直肠癌VEGF-C/-D可能是β-catenin/Tcf-4信号通路的下游靶基因, β-catenin可能通过该通路直接调控VEGF-C/-D表达, 进而在结直肠癌淋巴管生成中发挥作用. 其具体调控机制和作用位点的进一步研究, 将有助于阐明结直肠癌淋巴管生成和转移机制; 同时拓展β-catenin功能, 为潜在的靶向β-catenin信号通路的分子、基因治疗提供新的理论依据.
淋巴管生成是肿瘤淋巴结转移的一个重要因素. 研究表明, 多种肿瘤VEGF-C/-D表达显著增加, 结合并激活受体VEGFR-3, 诱导肿瘤周围和/或肿瘤内部淋巴管生成, 促进肿瘤淋巴结转移.
黄培林, 教授, 东南大学
Katoh等通过生物信息学和人类情报库发现VEGF-C/-D基因启动子区域含有β-catenin/Tcf-4复合体的结合位点, 首次找到了β-catenin信号通路可能参与淋巴管生成的直接证据.
β-catenin信号通路对VEGF-C/-D调控机制的研究, 有助于进一步阐明结直肠癌淋巴管生成和转移机制, 同时拓展β-catenin功能, 为潜在的靶向β-catenin信号通路的分子、基因治疗提供新的理论依据, 具有重要的临床意义.
本文逻辑性较好, 图片清晰, 讨论充分, 具有一定的科学性和实用性.
编辑: 曹丽鸥 电编:何基才
| 1. | Al-Rawi MA, Jiang WG. Lymphangiogenesis and cancer metastasis. Front Biosci. 2011;16:723-739. [PubMed] [DOI] |
| 2. | Kluger MS, Colegio OR. Lymphangiogenesis linked to VEGF-C from tumor-associated macrophages: accomplices to metastasis by cutaneous squamous cell carcinoma? J Invest Dermatol. 2011;131:17-19. [PubMed] [DOI] |
| 3. | Katoh M. Networking of WNT, FGF, Notch, BMP, and Hedgehog signaling pathways during carcinogenesis. Stem Cell Rev. 2007;3:30-38. [PubMed] [DOI] |
| 4. | Liu F, Millar SE. Wnt/beta-catenin signaling in oral tissue development and disease. J Dent Res. 2010;89:318-330. [PubMed] [DOI] |
| 5. | Katoh Y, Katoh M. Comparative integromics on VEGF family members. Int J Oncol. 2006;28:1585-1589. [PubMed] |
| 6. | Easwaran V, Lee SH, Inge L, Guo L, Goldbeck C, Garrett E, Wiesmann M, Garcia PD, Fuller JH, Chan V. beta-Catenin regulates vascular endothelial growth factor expression in colon cancer. Cancer Res. 2003;63:3145-3153. [PubMed] |
| 7. | Maruyama K, Ochiai A, Akimoto S, Nakamura S, Baba S, Moriya Y, Hirohashi S. Cytoplasmic beta-catenin accumulation as a predictor of hematogenous metastasis in human colorectal cancer. Oncology. 2000;59:302-309. [PubMed] [DOI] |
| 8. | Mattern J, Koomägi R, Volm M. Biological characterization of subgroups of squamous cell lung carcinomas. Clin Cancer Res. 1999;5:1459-1463. [PubMed] |
| 9. | Joukov V, Sorsa T, Kumar V, Jeltsch M, Claesson-Welsh L, Cao Y, Saksela O, Kalkkinen N, Alitalo K. Proteolytic processing regulates receptor specificity and activity of VEGF-C. EMBO J. 1997;16:3898-3911. [PubMed] [DOI] |
| 10. | Royston D, Jackson DG. Mechanisms of lymphatic metastasis in human colorectal adenocarcinoma. J Pathol. 2009;217:608-619. [PubMed] [DOI] |
| 11. | Achen MG, Stacker SA. Molecular control of lymphatic metastasis. Ann N Y Acad Sci. 2008;1131:225-234. [PubMed] [DOI] |
| 12. | Mou JH, Yan XC, Li ZP, Wang D, Duan GJ, Xiang DB, Xiao HL, Zhang QH. [Characteristic and clinicopathologic significance of lymphangiogenesis in colorectal cancer]. Zhonghua Binglixue Zazhi. 2005;34:348-352. [PubMed] |
| 13. | Varney ML, Singh S, Backora M, Chen Z, Singh RK. Lymphangiogenesis and anti-tumor immune responses. Curr Mol Med. 2009;9:694-701. [PubMed] [DOI] |
| 14. | Cao Y, Zhong W. Tumor-derived lymphangiogenic factors and lymphatic metastasis. Biomed Pharmacother. 2007;61:534-539. [PubMed] [DOI] |
| 15. | Pishvaian MJ, Byers SW. Biomarkers of WNT signaling. Cancer Biomark. 2007;3:263-274. [PubMed] |
| 16. | Doyle JL, Haas TL. Differential role of beta-catenin in VEGF and histamine-induced MMP-2 production in microvascular endothelial cells. J Cell Biochem. 2009;107:272-283. [PubMed] [DOI] |