修回日期: 2011-01-06
接受日期: 2011-01-11
在线出版日期: 2011-02-28
目的: 探讨KLF6和WWOX蛋白在结直肠癌组织中的表达及其临床病理意义.
方法: 采用免疫组织化学法分别检测40例结直肠癌及40例正常结直肠黏膜组织中KLF6和WWOX蛋白的表达, 并分析两者的表达水平与其临床病理因素的关系.
结果: 结直肠癌组织中的KLF6和WWOX蛋白的阳性表达率明显低于正常结直肠黏膜组织(45.0% vs 82.5%; 37.5% vs 90.0%, 均P<0.05), KLF6和WWOX蛋白在结直肠癌组织中的表达呈正相关(r = 0.320, P<0.05), 并与肿瘤组织的分化程度、淋巴结转移及浸润深度均密切相关(均P<0.05).
结论: KLF6和WWOX的低表达可能与结直肠癌的发生、发展及预后有关, 联合检测两者对结直肠癌的诊断及预后判断具有重要意义.
引文著录: 万晓娟, 宋锐锋, 陈玉龙, 徐珂, 徐峰. KLF6和WWOX蛋白在结直肠癌组织中的表达及意义. 世界华人消化杂志 2011; 19(6): 602-607
Revised: January 6, 2011
Accepted: January 11, 2011
Published online: February 28, 2011
AIM: To investigate the expression of Kruppel-like factor 6 (KLF6) and WW domain-containing oxidoreductase (WWOX) proteins in colorectal carcinoma and to analyze their clinicopathological significance.
METHODS: The expression of KLF6 and WWOX proteins was detected by immunohistochemistry in 40 colorectal carcinoma specimens and 40 normal colorectal mucosa specimens.
RESULTS: The positive rates of KLF6 and WWOX protein expression differed significantly between colorectal carcinoma and normal colorectal mucosa (KLF6: 45.0% vs 82.5%, WWOX: 37.5% vs 90.0%, both P < 0.05). The expression of KLF6 and WWOX proteins was found to be associated with tumor differentiation, lymph node metastasis, and tumor invasion in colorectal carcinoma (all P < 0.05). A positive correlation was noted between the expression of KLF6 and that of WWOX in colorectal carcinoma (r = 0. 320, P < 0.05).
CONCLUSION: Reduced expression of KLF6 and WWOX proteins may be related with the development, progression, and prognosis of colorectal carcinoma. Combined detection of KLF6 and WWOX protein expression is helpful for diagnosis and evaluation of the prognosis of colorectal carcinoma.
- Citation: Wan XJ, Song RF, Chen YL, Xu K, Xu F. Significance of KLF6 and WWOX protein expression in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(6): 602-607
- URL: https://www.wjgnet.com/1009-3079/full/v19/i6/602.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i6.602
结直肠癌是消化系统常见的恶性肿瘤之一, 在欧美国家居恶性肿瘤死因的第2位[1]. 近年来, 随着我国生活水平的不断提高及饮食习惯的改变, 结直肠癌的发病率及死亡率呈上升趋势[2], 严重危害人们的健康. 因此, 探讨结直肠癌的发病机制, 寻找有效预防及治疗的途径, 是目前迫切需要解决的问题. Kruppel样因子6(Kruppel-like factor 6, KLF6), 又称锌指转录因子9(zinc finger factor9, ZP9), 是一种具有抑制细胞生长、促进凋亡、参与细胞衰老调控的抑癌基因[3,4], 虽然在肝癌[5,6]、前列腺癌[7-10]等方面的研究较多, 但在结直肠癌方面的报道相对少见. 包含氧化还原酶的WW域(WW domain-containing oxidoreductase, WWOX)是Bednarek等[11]在2000年应用鸟枪基因测序技术鉴定出的一种候选抑癌基因. 有文献报道, 在人类卵巢癌、肺癌、胃癌等多种肿瘤中WWOX呈现低表达, 并与肿瘤浸润深度、淋巴结转移及临床病理分期有关, 还发现过表达的WWOX可以诱导肿瘤细胞调亡并抑制其生长[12-15]. KLF6和WWOX蛋白分别在多种恶性肿瘤中存在异常表达, 但联合检测两者在结直肠癌的表达及相关性研究, 迄今国内外均未见报道. 本实验采用免疫组织化学法检测KLF6和WWOX蛋白在40例结直肠癌及40例正常结直肠黏膜组织中的表达, 并探讨两者与结直肠癌发生、发展的关系及其临床意义.
收集郑州大学第一附属医院2008-2009年期间手术切除的结直肠癌标本40例及40例相应的癌旁正常组织(距肿瘤边缘≥5 cm). 患者术前均未行放化疗及免疫治疗. 其中男19例, 女21例, 年龄30-81岁, 均经病理学确诊并有完整的临床资料. 所有组织均用40 g/L中性甲醛固定, 常规石蜡包埋, 4 μm厚的连续切片. 其中有淋巴结转移17例, 无淋巴结转移23例; 按组织学分级, 高+中分化21例, 低分化+黏液腺癌19例; 有浆膜浸润22例, 无浆膜浸润18例; 浓缩型兔抗KLF6多克隆抗体、浓缩型兔抗WWOX多克隆抗体、SP免疫组化染色试剂盒均购自北京博奥森生物技术有限公司, DAB显色试剂盒购自北京中杉金桥生物技术有限公司.
1.2.1 免疫组织化学: 采用链霉菌抗生物素蛋白-过氧化物酶连结法(streptavidin- peroxidase, SP). KLF6和WWOX抗体稀释浓度均为1:100, DAB显色, 苏木素复染, 操作步骤严格按照说明书进行. 实验中以已知的阳性组织(KLF6: 肺癌组织; WWOX: 胃癌组织)作阳性对照, PBS液代替一抗作阴性对照.
1.2.2 评分方法: 参考许红霞等[16]的计分方法, 并做适当修改: KLF6以腺体胞质和(或)胞核出现黄色颗粒为阳性, WWOX以腺体胞质中出现黄色颗粒为阳性, 随机选取5个高倍视野计数, 以阳性细胞数和着色强度综合判断. 着色强度计分: 无色0分, 淡黄色1分, 棕黄色2分, 黄褐色3分; 阳性细胞数计分: 0%-5%为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分, 以上两项之积, 0-4分为蛋白表达降低或缺失(阴性), 5-12分为中(+)、高(++)度阳性表达(阳性).
统计学处理 采用SPSS16.0统计软件进行数据分析, 统计方法采用χ2检验及Spearman关联性分析, 检验水准α = 0.05.
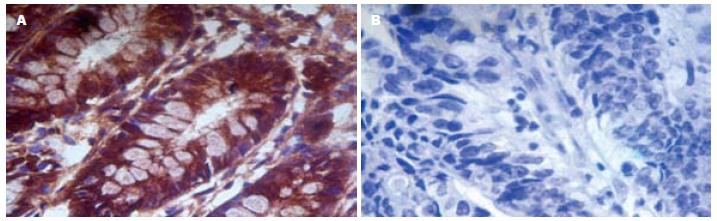
KLF6蛋白主要定位于胞质中, 部分胞质、胞核可同时呈阳性表达, 在正常组织中有较强表达, 呈棕黄色或黄褐色颗粒, 在癌组织中着色较弱, 表达缺失常见(图1). KLF6蛋白在结直肠癌及正常组织的阳性表达率分别为45.0%、82.5%, 组间差异有统计学意义(P<0.05, 表1). KLF6蛋白在结直肠癌组织的表达与患者的性别、年龄无关(P>0.05), 而与肿瘤的分化程度、浸润深度及淋巴结转移有关(P<0.05, 表2).
| 组织类别 | KLF6 | χ2值 | P值 | WWOX | χ2值 | P值 | ||||||
| - | + | ++ | 阳性率(%) | - | + | ++ | 阳性率(%) | |||||
| 结直肠癌 | 22 | 11 | 7 | 45.0 | 25 | 9 | 6 | 37.5 | ||||
| 正常组织 | 7 | 15 | 18 | 82.5 | 12.170 | 0.000 | 4 | 20 | 16 | 90.0 | 23.854 | 0.000 |
| 因素 | n | KLF6 | χ2值 | P值 | WWOX | χ2值 | P值 | ||||||
| - | + | ++ | 阳性(%) | - | + | ++ | 阳性(%) | ||||||
| 性别 | |||||||||||||
| 男 | 19 | 9 | 3 | 7 | 52.6 | 11 | 4 | 4 | 42.1 | ||||
| 女 | 21 | 13 | 4 | 4 | 38.1 | 0.852 | 0.356 | 14 | 3 | 4 | 33.3 | 0.327 | 0.567 |
| 年龄(岁) | |||||||||||||
| <60 | 20 | 8 | 7 | 5 | 60.0 | 10 | 4 | 6 | 50.0 | ||||
| ≥60 | 20 | 14 | 4 | 2 | 30.0 | 3.636 | 0.057 | 15 | 2 | 3 | 25.0 | 2.667 | 0.102 |
| 淋巴结转移 | |||||||||||||
| 有 | 17 | 13 | 2 | 2 | 23.5 | 14 | 1 | 2 | 17.6 | ||||
| 无 | 23 | 9 | 6 | 8 | 60.9 | 5.507 | 0.019 | 11 | 6 | 6 | 52.2 | 4.972 | 0.026 |
| 分化程度 | |||||||||||||
| 高+中 | 21 | 7 | 5 | 9 | 66.7 | 9 | 5 | 7 | 57.1 | ||||
| 低+黏液腺癌 | 19 | 15 | 3 | 1 | 21.1 | 8.386 | 0.004 | 16 | 3 | 0 | 15.8 | 7.278 | 0.007 |
| 浆膜浸润 | |||||||||||||
| 有 | 22 | 16 | 4 | 2 | 27.3 | 17 | 3 | 2 | 22.7 | ||||
| 无 | 18 | 6 | 8 | 4 | 66.7 | 6.208 | 0.013 | 8 | 3 | 7 | 55.6 | 4.552 | 0.033 |
一般认为肿瘤的发生、发展及转移是个复杂而有序的多阶段生物学过程, 受多个基因的调控, 结直肠癌的发生亦是如此, 近年来对抑癌基因KLF6和WWOX的研究成为国内外的热门课题.
KLF6是转录因子Kruppel家族成员之一, 位于人类10p15区域, 因其羧基末端具有锌指结构, 故称锌指转录因子, 可特异性的与多种基因启动子中GC盒结合, 与其他家族成员不同的是, 其氨基末端富含酸性氨基酸残基, 与转录活性有关, 参与细胞的增殖、分化、凋亡、生长等过程. 近年研究发现其在肿瘤的发生发展中起到一定的作用, 并在多种肿瘤组织中呈现低表达或表达缺失. KLF6的抑癌作用是Narla等[7]在对前列腺癌的研究中发现的, 野生型KLF6能以P53非依赖方式上调P21的表达, 从而显著降低细胞增殖, 而突变型则没有上述作用, 同时, 在前列腺癌组织中还发现存在KLF6基因的杂合性丢失(loss of heterozygosity, LOH), KLF6基因的LOH在前列腺癌组织中发生率高达77%, 对发生LOH的癌组织进行基因测序, 结果显示KLF6等位基因中有71%发生了突变, 突变导致了KLF6蛋白非保守氨基酸的序列变化, LOH和点突变等导致的KLF6基因的失活、在肿瘤的发生、发展及转移过程中起了重要作用, 并认为KLF6是前列腺癌潜在的抑癌基因, 在人类其他肿瘤的发生、发展及演进过程中可能也起着重要作用. 在对胃癌[17]的研究中也发现KLF6基因存在LOH. 本实验发现KLF6蛋白在结直肠癌组织的阳性表达率显著低于正常结直肠组织; 随着肿瘤浸润程度加深及淋巴结转移, KLF6蛋白的阳性表达率也随之下降; 随着分化程度的降低, KLF6蛋白的表达率亦下降, 有的甚至表达缺失, 提示KLF6蛋白的表达水平与肿瘤的分化程度、浸润深度及淋巴结转移均有关, 与王夫景等[18]的研究结果一致. 但Cho等[19]的研究发现仅有36.6%的结直肠癌组织呈现KLF6表达降低或表达缺失, 且与肿瘤的大小密切相关, 而与肿瘤分期, 部位及淋巴结转移无关, 与本实验及王夫景等的研究结果存在差异. 关于KLF6蛋白在结直肠癌组织的表达水平及其与临床病理因素关系的报道少见, 有待于更多的研究来证实. 在神经胶母细胞瘤CRL2020和A235细胞株中进行KLF6重建, 细胞增殖减少将近50%, 而KLF6敲出后, 细胞增殖增加2.5-4.5倍[20]. 抑癌基因KLF6的转染可以明显抑制前列腺癌PC-3细胞的生长增殖并诱导其凋亡, 其作用机制可能与下调Bcl-2和cyclin D1的表达有关[21]. KLF6可直接激活转录因子3(activating transcription factor 3, ATF3), 结合并激活其启动子, 进而诱导肿瘤细胞的凋亡. Huang等[8]用siRNA敲出ATF3后能阻断KLF6诱导的细胞凋亡, 而肿瘤来源的突变型KLF6却不能激活ATF3, 无法诱导凋亡. KLF6可通过多种途径抑制细胞的增殖并诱导其凋亡, 发挥抑癌基因的作用, 而KLF6的表达缺失将使肿瘤细胞逃逸凋亡, 从而促进肿瘤的发生发展. 野生型KLF6能以P53非依赖方式上调P21的表达[7], 还能与cyclin D1作用, 并破坏cyclin D1和CDK4的复合体, 从而引起细胞周期停滞, KLF6可能是细胞周期的一个检查点[22], 由于KLF6不依赖P53, 设想KLF6和P53可能在细胞周期的调控上发挥着类似的作用. 以上关于KLF6抑制细胞增殖及促进细胞凋亡的途径有待于在结直肠癌的进一步研究中证实.
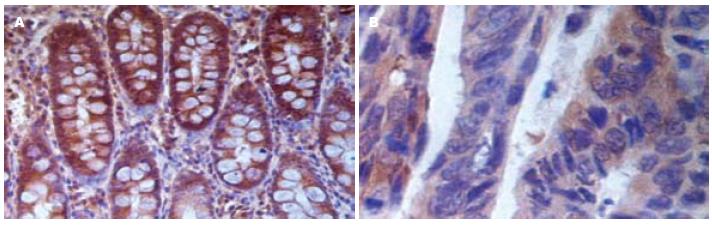
WWOX基因跨越了基因组内STS markers D16s518和D16s516的一个>106 bp的区域, 这个区域位于染色体的16q23.3-q24.1(普通型脆性位点, FRA16D), 与对应于常见染色体脆性位点FRA3B的FHIT基因非常相像, 他的结构异常也与多种肿瘤密切相关, 故被认为是继FHIT基因之后的又一个新的抑癌基因[11,23]. WWOX易受外界因素的影响, 当环境致癌因素作用于FRA16D时, 引起WWOX基因发生断裂, 变异和失活, 从而导致肿瘤的产生. 本实验发现WWOX蛋白主要在胞质中表达, 在结直肠癌组织中的阳性表达率显著低于正常结直肠组织, 与李秋芳等[24]在肺癌方面的报道基本一致. 并且随着分化程度的降低, WWOX蛋白的阳性表达率下降, 有的甚至呈阴性表达; 随着肿瘤浸润程度加深及淋巴结转移, WWOX蛋白的阳性表达率也随之下降, 提示WWOX蛋白的表达水平与肿瘤的分化程度、浸润深度及淋巴结转移均相关, 与许红霞等[16]、陈志英等[25]的研究结果基本相符, 其正常表达可能在结直肠组织中发挥着抑癌基因的作用, 低表达或表达缺失可能参与了结直肠癌的发生、发展及转移的过程. 在对肝外胆管癌的研究中发现WWOX mRNA的表达显著低于正常胆管组织, 47%表达缺失, WWOX蛋白表达的缺失频率为57%, 且与组织学分级显著相关[26]. WWOX蛋白含有414个氨基酸, 在他的氨基酸末端有2个WW结构域, 主要与蛋白之间相互作用有关, 而蛋白之间的相互作用是抑癌基因通过信号转导途径抑制肿瘤生长所必需的. Chang等[27]研究指出WWOX蛋白主要位于线粒体, 在凋亡应激因素TNF/十字胞碱、苍术苷等作用下, WWOX蛋白合成增加, 第1个WW结构域中的Try33磷酸化, 线粒体通透性改变, WWOX蛋白从线粒体转位至细胞核, 上调促凋亡因子P53, 下调抑制凋亡因子Bcl-2、Bcl-xL, 从而增强TNF介导的细胞毒性; 同时增强TRADD介导的细胞凋亡. 而郭文娟等[28]的研究发现Bcl-xL在结肠腺癌中的阳性率明显高于正常组织. 在对胃癌、肺癌的研究中发现WWOX调节位点的超甲基化现象[14,15], Qin等[29]认为在前列腺癌中WWOX基因的表达下调归因于WWOX基因调节带的DNA超甲基化, 而用脱氧杂氮胞苷(5-aza-2-deoxycytidine, AZA), 一种DNA甲基转移酶抑制剂进行治疗, 增加了癌细胞中WWOX mRNA和蛋白的表达, 并且肿瘤的生长也被抑制. 杨巍等[30]所构建的pcDNA4/myc-WWOX真核表达载体转染肿瘤细胞能抑制肿瘤生长并诱导其凋亡, 使得人为促进肿瘤细胞高表达WWOX蛋白有希望作为一种新的基因治疗手段. 但关于WWOX在结直肠癌的具体作用机制尚未完全明确, 有待于更深入的研究.
本实验还发现KLF6与WWOX蛋白在结直肠癌组织中的表达呈正相关(r = 0.320, P<0.05), 且随着肿瘤分化程度的降低以及临床分期和淋巴结转移的增加, 两者的表达均在降低, 提示两者的低表达共同促进结直肠癌的发生及侵袭转移. 在前面的叙述中已提到KLF6可引起细胞周期停滞, KLF6可能是细胞周期的一个检查点[22], 野生型KLF6能以P53非依赖方式上调P21的表达, 降低细胞的增殖[7], KLF6和P53可能在细胞周期的调控上发挥着类似的作用[6], 而WWOX可上调促凋亡因子P53[27], 那么, 我们可设想WWOX可通过某种机制来上调KLF6的表达, 从而共同发挥抑癌基因的作用, 两者的低表达又共同促进结直肠癌的发生及侵袭转移. 但到目前为止, 两者之间相互作用的具体机制尚未见报道, 故上述的假设有待于广大学者的进一步研究来证实.
总之, KLF6和WWOX蛋白在结直肠癌中的表达均明显低于正常组织, 其低表达可能与结直肠癌的发生、发展及转移有关. 联合检测两者对结直肠癌的诊断, 恶性程度及预后的判断具有重要意义.
结直肠癌是消化系统常见的恶性肿瘤之一. 近年来, 随着我国生活水平的不断提高及饮食习惯的改变, 结直肠癌的发病率及死亡率呈上升趋势, 严重危害人们的健康. 因此, 探讨结直肠癌的发病机制, 寻找有效预防及治疗的途径, 是目前迫切需要解决的问题.
顾国利, 副主任医师, 中国人民解放军空军总医院普通外科
一般认为肿瘤的发生、发展及转移是个复杂而有序的多阶段生物学过程, 受多个基因的调控, 结直肠癌的发生亦是如此, 近年来对抑癌基因KLF6和WWOX的研究成为国内外的热门课题.
王少平等应用RT-PCR及Western blot技术对肝癌研究发现, 癌组织中KLF6 mRNA及蛋白表达水平明显低于正常组织.
本实验应用免疫组织化学法联合检测KLF6和WWOX蛋白在结直肠癌及癌旁正常黏膜组织中的表达情况, 从而在蛋白水平上探讨二者与结直肠癌各项临床病理参数之间的关系, 为KLF6和WWOX成为判断结直肠癌生物学行为的重要参考指标提供理论依据.
本实验证实了KLF6和WWOX蛋白在结直肠癌表达的情况及二者的相关性. 联合检测两种蛋白的表达, 对结直肠癌的诊断及预后判断具有重要意义, 为结直肠癌的治疗提供新的思路及理论依据.
本文新颖性较好, 具有较好的可读性和科学价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Ferlay J, Autier P, Boniol M, Heanue M, Colombet M, Boyle P. Estimates of the cancer incidence and mortality in Europe in 2006. Ann Oncol. 2007;18:581-592. [PubMed] [DOI] |
| 3. | Koivisto PA, Hyytinen ER, Matikainen M, Tammela TL, Ikonen T, Schleutker J. Kruppel-like factor 6 germ-line mutations are infrequent in Finnish hereditary prostate cancer. J Urol. 2004;172:506-507. [PubMed] [DOI] |
| 4. | Lièvre A, Landi B, Côté JF, Veyrie N, Zucman-Rossi J, Berger A, Laurent-Puig P. Absence of mutation in the putative tumor-suppressor gene KLF6 in colorectal cancers. Oncogene. 2005;24:7253-7256. [PubMed] [DOI] |
| 5. | 王 少平, 亢 黎莉, 陈 孝平, 周 鹤俊, 周 卫江, 徐 江. KLF6基因在原发性肝癌中的表达. 华中科技大学学报(医学版). 2008;37:343-346. |
| 6. | 潘 修成, 陈 智, 陈 峰, 陈 晓红, 周 承, 羊 正纲. 原发性肝癌组织中Kruppel样因子6(KLF6)的表达及其对肝癌细胞增殖的抑制作用. 实用肿瘤杂志. 2007;22:125-129. |
| 7. | Narla G, Heath KE, Reeves HL, Li D, Giono LE, Kimmelman AC, Glucksman MJ, Narla J, Eng FJ, Chan AM. KLF6, a candidate tumor suppressor gene mutated in prostate cancer. Science. 2001;294:2563-2566. [PubMed] [DOI] |
| 8. | Huang X, Li X, Guo B. KLF6 induces apoptosis in prostate cancer cells through up-regulation of ATF3. J Biol Chem. 2008;283:29795-29801. [PubMed] [DOI] |
| 10. | Leow CC, Wang BE, Ross J, Chan SM, Zha J, Carano RA, Frantz G, Shen MM, de Sauvage FJ, Gao WQ. Prostate-specific Klf6 inactivation impairs anterior prostate branching morphogenesis through increased activation of the Shh pathway. J Biol Chem. 2009;284:21057-21065. [PubMed] [DOI] |
| 11. | Bednarek AK, Laflin KJ, Daniel RL, Liao Q, Hawkins KA, Aldaz CM. WWOX, a novel WW domain-containing protein mapping to human chromosome 16q23.3-24.1, a region frequently affected in breast cancer. Cancer Res. 2000;60:2140-2145. [PubMed] |
| 12. | Paige AJ, Taylor KJ, Taylor C, Hillier SG, Farrington S, Scott D, Porteous DJ, Smyth JF, Gabra H, Watson JE. WWOX: a candidate tumor suppressor gene involved in multiple tumor types. Proc Natl Acad Sci U S A. 2001;98:11417-11422. [PubMed] [DOI] |
| 13. | Xiong Z, Hu S, Wang Z. Cloning of WWOX gene and its growth-inhibiting effects on ovarian cancer cells. J Huazhong Univ Sci Technolog Med Sci. 2010;30:365-369. [PubMed] [DOI] |
| 14. | Baykara O, Demirkaya A, Kaynak K, Tanju S, Toker A, Buyru N. WWOX gene may contribute to progression of non-small-cell lung cancer (NSCLC). Tumour Biol. 2010;31:315-320. [PubMed] [DOI] |
| 15. | Maeda N, Semba S, Nakayama S, Yanagihara K, Yokozaki H. Loss of WW domain-containing oxidoreductase expression in the progression and development of gastric carcinoma: clinical and histopathologic correlations. Virchows Arch. 2010;457:423-432. [PubMed] [DOI] |
| 16. | 许 红霞, 周 建农, 莫 伏根, 侯 宁, 胡 赛男, 束 永前. 抑癌基因WWOX和FHIT在结直肠癌中的表达及临床意义. 南京医科大学学报(自然科学版). 2007;27:812-815. |
| 17. | Sangodkar J, Shi J, DiFeo A, Schwartz R, Bromberg R, Choudhri A, McClinch K, Hatami R, Scheer E, Kremer-Tal S. Functional role of the KLF6 tumour suppressor gene in gastric cancer. Eur J Cancer. 2009;45:666-676. [PubMed] [DOI] |
| 19. | Cho YG, Choi BJ, Song JW, Kim SY, Nam SW, Lee SH, Yoo NJ, Lee JY, Park WS. Aberrant expression of krUppel-like factor 6 protein in colorectal cancers. World J Gastroenterol. 2006;12:2250-2253. [PubMed] |
| 20. | Camacho-Vanegas O, Narla G, Teixeira MS, DiFeo A, Misra A, Singh G, Chan AM, Friedman SL, Feuerstein BG, Martignetti JA. Functional inactivation of the KLF6 tumor suppressor gene by loss of heterozygosity and increased alternative splicing in glioblastoma. Int J Cancer. 2007;121:1390-1395. [PubMed] [DOI] |
| 21. | 孙 明, 杨 恭如, 黄 健, 李 虹, 卢 一平, 魏 强, 范 天勇, 李 响. 转染抑癌基因KLF6对前列腺癌PC-3细胞的作用研究. 中华男科学杂志. 2006;12:502-509. |
| 22. | Camacho-Vanegas O, Narla G, Teixeira MS, DiFeo A, Misra A, Singh G, Chan AM, Friedman SL, Feuerstein BG, Martignetti JA. Functional inactivation of the KLF6 tumor suppressor gene by loss of heterozygosity and increased alternative splicing in glioblastoma. Int J Cancer. 2007;121:1390-1395. [PubMed] [DOI] |
| 23. | Bednarek AK, Keck-Waggoner CL, Daniel RL, Laflin KJ, Bergsagel PL, Kiguchi K, Brenner AJ, Aldaz CM. WWOX, the FRA16D gene, behaves as a suppressor of tumor growth. Cancer Res. 2001;61:8068-8073. [PubMed] |
| 27. | Chang NS, Pratt N, Heath J, Schultz L, Sleve D, Carey GB, Zevotek N. Hyaluronidase induction of a WW domain-containing oxidoreductase that enhances tumor necrosis factor cytotoxicity. J Biol Chem. 2001;276:3361-3370. [PubMed] [DOI] |
| 29. | Qin HR, Iliopoulos D, Semba S, Fabbri M, Druck T, Volinia S, Croce CM, Morrison CD, Klein RD, Huebner K. A role for the WWOX gene in prostate cancer. Cancer Res. 2006;66:6477-6481. [PubMed] [DOI] |