修回日期: 2011-01-14
接受日期: 2011-01-21
在线出版日期: 2011-02-28
目的: 探讨染色放大内镜下大肠病变的腺管开口分型与病变组织hMLH1和hMSH2蛋白表达的关系.
方法: 根据Kudo分型方法, 染色放大内镜下大肠病变腺管开口分为Ⅰ-Ⅴ型; 所有病灶性质由病理组织学分别确诊为非肿瘤性病变、腺瘤性病变及癌性病变; 免疫组织化学方法检测活检组织hMLH1和hMSH2蛋白的表达.
结果: 应用染色放大内镜对146例患者的大肠黏膜进行细微结构形态学观察, 共检出息肉样病变256枚. 随着腺管开口分型序数的递增, 活检组织中hMLH1与hMSH2蛋白的丢失率逐渐增高, Ⅰ-Ⅴ型hMLH1丢失率分别为0.00%(0/11)、1.61%(1/62)、19.68%(25/127)、33.33%(1/3)、32.26%(10/31)、36.36%(8/22); hMSH2蛋白丢失率分别为0.00%(0/11)、3.22%(2/62)、16.53%(21/127)、33.33%(1/3)、35.48%(11/31)、40.90%(9/22), 组间两两比较差异有统计学意义(均P<0.01); 74例大肠黏膜非肿瘤性病变中2例hMLH1表达阴性, 占2.70%(2/74), 3例hMSH2表达阴性, 占4.05%(3/74); 130例腺瘤组织中30例hMLH1表达阴性, 占23.07%(30/130), 22例hMSH2表达阴性, 占16.92%(22/130); 52例癌变组织中13例hMLH1表达阴性, 占25%(13/52), 16例hMSH2表达阴性, 占30.76%(16/52), 癌性病变组hMLH1与hMSH2蛋白的丢失率明显高于腺瘤性病变组及非肿瘤性病变组(均P<0.01); hMSH2与hMLH1蛋白的丢失率在不同病变组织中(非肿瘤性病变、腺瘤性病变及癌性病变)无相关性(均P>0.05).
结论: 随着大肠腺管分型序数的递增, hMLH1和hMSH2蛋白的丢失率逐渐增加, 与大肠病变病理诊断中的丢失率具有一致性, 提示DNA错配修复基因突变或功能缺失可能是大肠发生癌变进程中的早期事件, 染色放大内镜下随访大肠腺管组织中hMLH1和hMSH2蛋白的丢失率有助于发现癌前病变、大肠癌.
引文著录: 唐采白, 程慧敏, 杨伟利, 赵俊华, 王恒. 大肠腺管开口分型与hMLH1和hMSH2蛋白表达在染色放大内镜下的相关性. 世界华人消化杂志 2011; 19(6): 596-601
Revised: January 14, 2011
Accepted: January 21, 2011
Published online: February 28, 2011
AIM: To explore the relationship between pit patterns of colorectal polypoid lesions classified by magnifying chromoendoscopy and expression of human MutL homolog 1/2 (hMLH1/2) proteins in colorectal mucosa.
METHODS: Colorectal lesions in 146 patients were classified as type I to V pit patterns by magnifying chromoendoscopy using the Kudo criteria. All lesions were pathologically confirmed as nonneoplastic, adenomatous or cancerous lesions. Colorectal mucosal biopsy specimens were used to detect the expression of hMLH1 and hMSH2 proteins by immunohistochemistry.
RESULTS: A total of 256 polypoid lesions were found in 146 patients by magnifying chromoendoscopy. The rates of loss of hMLH1 and hMSH2 protein expression increased gradually from type I to type V pit patterns in 256 polypoid lesions [hMLH1: 0.0% (0/11), 1.61% (1/62), 19.68% (25/127), 33.33% (1/3), 32.26% (10/31), 36.36%(8/22); hMSH2: 0.00% (0/11), 3.22% (2/62), 16.53% (21/127), 33.33% (1/3), 35.48% (11/31), 40.90% (9/22); all P < 0.01]. The rates of loss of hMLH1 and hMSH2 expression were 2.70% and 4.05% in nonneoplastic lesions, 23.07% and 16.92% in adenoma lesions, and 25% and 30.76% in cancerous lesions. The rates of loss of hMLH1 and hMSH2 protein expression were significantly higher in cancerous lesions than in adenomatous and nonneoplastic lesions (both P < 0.01). There was no significant difference between the rate of loss of hMLH1 and that of hMSH2 protein expression in all lesions (all P > 0.05).
CONCLUSION: The rates of loss of hMLH1 and hMSH2 protein expression gradually increased from type I to type V pit patterns, suggesting that mutation or functional deficiency of DNA mismatch repair genes is an early event in colorectal carcinogenesis. Lesion classification by magnifying chromoendoscopy or detection of the loss of hMLH1 and hMSH2 protein expression can help identify precancerous and colorectal lesions from colorectal lesions.
- Citation: Tang CB, Cheng HM, Yang WL, Zhao JH, Wang H. Relationship between pit patterns of colorectal polypoid lesions classified by magnifying chromoendoscopy and expression of hMLH1 and hMSH2 proteins in colorectal mucosa. Shijie Huaren Xiaohua Zazhi 2011; 19(6): 596-601
- URL: https://www.wjgnet.com/1009-3079/full/v19/i6/596.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i6.596
DNA错配修复基因作为一组高度保守的看家基因, 主要功能是纠正复制和重组中的碱基配对错误及因基因损伤所致的碱基配对错误、碱基插入、缺失等损伤, 对DNA基因组的稳定性起着重要的作用. 研究表明[1-8], 错配修复基因的突变是结直肠癌发生发展的重要途径之一, 其中hMLH1和hMSH2是最重要的两个错配修复基因. 日本学者Kudo等[9]研究发现, 结直肠腺管开口即凹窝形态在不同性质的病变中有不同特征, 并提出Kudo分型. 为此, 本研究采用染色放大内镜观察大肠腺管开口分型, 同时应用免疫组织化学的方法检测大肠病变组织中错配修复基因hMSH2、hMLH1蛋白的表达丢失情况, 探讨hMSH2和hMLH1蛋白的丢失率与染色放大内镜下大肠腺管开口分型之间的相关性.
选择2008-01/2010-06在徐州医学院第三附院消化科行结肠镜检的结直肠疾病患者146例, 其中男97例、女49例, 年龄27-83(平均58.3)岁. 放大电子结肠镜为日本Olympus公司产 CF TYPE H260AZI型, 染色剂采用0.2%靛胭脂液, 所有检查均由同一内镜医师操作及做出内镜下诊断. 146例患者经0.2%靛胭脂染色放大后发现息肉样病变256枚. 患者检查前均签署知情同意书, 并经医院伦理委员会批准.
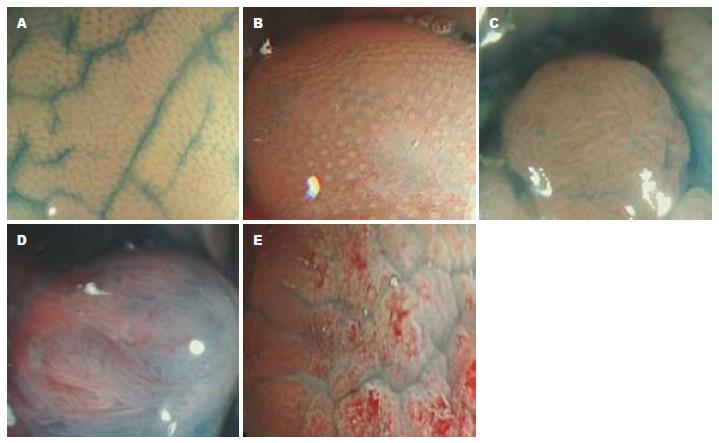
1.2.1 腺管开口类型: 采用工藤进英Kudo的分型方法, 其分类如下:Ⅰ型为规则圆形小窝; Ⅱ型为规则星状或乳头样小窝; ⅢL型为大管状或大圆形小窝; Ⅲs型为圆管状小窝; Ⅳ型为脑沟或脑回状; Ⅴ型不规则或无结构. Ⅰ型为正常或黏膜下肿物, Ⅱ型为炎性息肉, Ⅲ型为凹陷性肿瘤或隆起性肿瘤, Ⅳ型为绒毛状腺瘤, Ⅴ型为大肠癌. 最终非肿瘤性病变、腺瘤性病变及癌性病变判定以病理组织学诊断为标准.
1.2.2 SP法观察hMLH1和hMSH2蛋白的表达: hMSH2和hMLH1单克隆抗体购自美国Santa Cruz生物制剂公司, SP(鼠)免疫组织化学试剂盒购自福州迈新生物技术开发公司. 采用免疫组织化学方法进行染色, 一抗浓度均稀释为1:200. 标本经甲醛固定, 石蜡包埋, 切成4 μm厚的组织切片, 附于玻片上. 实验采用免疫组织化学SP法, 步骤按试剂盒说明书进行操作. 用正常大肠细胞核棕黄色染色为阳性对照, 用PBS液代替一抗作为阴性对照, 切片内细胞hMLH1或hMSH2蛋白检测缺乏核染色者记录为失表达, 每次实验均设阴性及阳性对照. hMLH1和hMSH2蛋白表达主要表现为细胞核出现棕色或棕褐色颗粒. 结果判定: hMLH1和hMSH2蛋白表达情况, 以每张切片的阳性细胞数<5%为蛋白表达缺失, ≥5%为蛋白表达阳性.
统计学处理 用SPSS13.0统计软件对实验数据进行统计学分析, hMSH2、hMLH1蛋白在大肠病变活检组织中的表达变化结果及其与腺管开口分型之间的比较采用χ2检验, 以P<0.05为差异有统计学意义.
146例患者经0.2%的靛胭脂染色放大后发现息肉样病变256枚, 息肉样病变腺管开口分型按照工藤进英提出的pit分型标准, 本组256枚息肉样病变pit分型为Ⅰ型11枚, Ⅱ型62枚, Ⅲs型3枚, ⅢL型127枚, Ⅳ型31枚, Ⅴ型22枚(图1). 根据病理组织学诊断结果, 256枚Ⅰ型至Ⅴ型息肉样病变经病理诊断为非肿瘤性病变、腺瘤性病变、癌性病变例数详见表1.
| Pit分型 | n | 病理诊断 | ||
| 非肿瘤性病变 | 腺瘤性病变 | 癌性病变 | ||
| Ⅰ型 | 11 | 11 | 0 | 0 |
| Ⅱ型 | 62 | 55 | 7 | 0 |
| ⅢL型 | 127 | 8 | 107 | 12 |
| Ⅲs型 | 3 | 0 | 3 | 0 |
| Ⅳ型 | 31 | 0 | 8 | 23 |
| Ⅴ型 | 22 | 0 | 5 | 17 |
| 合计 | 256 | 74 | 130 | 52 |
Ⅰ-Ⅴ型腺管开口形态中均有hMLH1与hMSH2蛋白表达, 随着腺管开口分型序数的递增, hMLH1与hMSH2蛋白的丢失率逐渐增高, Ⅰ-Ⅴ型hMLH1丢失率分别为0.0%(0/11)、1.61%(1/62)、19.68%(25/127)、33.33%(1/3)、32.26%(10/31)、36.36%(8/22); hMSH2蛋白丢失率分别为0.00%(0/11)、3.22%(2/62)、16.53%(21/127)、33.33%(1/3)、35.48%(11/31)40.90%(9/22), 组间两两比较差异有统计学意义(P<0.01, 表2).
| Pit分型 | n | hMLH1 | hMSH2 | ||
| 阳性 | 阴性 | 阳性 | 阴性 | ||
| Ⅰ型 | 11 | 11 | 0 | 11 | 0 |
| Ⅱ型 | 62 | 61 | 1 | 60 | 2 |
| ⅢL型 | 127 | 102 | 25 | 106 | 21 |
| Ⅲs型 | 3 | 2 | 1 | 2 | 1 |
| Ⅳ型 | 31 | 21 | 10 | 20 | 11 |
| Ⅴ型 | 22 | 14 | 8 | 13 | 9 |
| P值 | 0.0002 | 0.0001 | |||
| χ2值 | 24.13 | 27.35 | |||
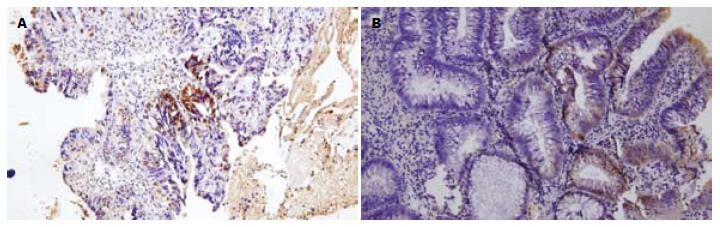
非肿瘤性病变、腺瘤及癌变组织中hMLH1和hMSH2有不同程度的表达. 74例大肠黏膜非肿瘤性病变包括炎性息肉、增生性息肉、幼年性息肉、黑斑息肉及肥大赘生物等, 其中2例hMLH1表达阴性, 3例hMSH2表达阴性; 130例腺瘤组织中hMLH1和hMSH2多呈弥漫性表达, 部分区域呈局灶性表达增强, 其中30例hMLH1表达阴性, 22例hMSH2表达阴性; 52例癌变组织中hMLH1和hMSH2为灶性表达(图2), 其中13例hMLH1表达阴性, 16例hMSH2表达阴性; 腺瘤组及癌变组hMLH1、hMSH2蛋白丢失率与非肿瘤性病变组比较差异显著(P<0.001, 表3). 另外, 在不同病变组织中(非肿瘤性病变、腺瘤性病变及癌性病变), hMSH2与hMLH1蛋白的丢失率经Spearman关联性分析, 无相关性(P = 0.3333).
| 分组 | n | hMLH1 | hMSH2 |
| 非肿瘤性病变 | 74 | 2 | 3 |
| 腺瘤性病变 | 130 | 30 | 22 |
| 癌性病变 | 52 | 13 | 16 |
| P值 | 0.0003 | 0.0003 | |
| χ2值 | 15.99 | 16.37 |
肿瘤的发生是一个多基因参与多阶段的过程, 人体细胞有一系列的机制保证遗传物质的稳定性, DNA错配修复系统是其中之一. 错配修复基因是一组高度保守的管家基因, hMLH1和hMSH2基因是人类错配修复系统的重要成员, 其中任何一种错配修复基因突变最终将导致机体DNA错配修复系统功能的异常, 可引起广泛的体细胞突变和DNA复制错误, 错配修复功能缺失也可导致一些抑癌基因突变率的增加和突变的积累而促进肿瘤的发生.
hMLH1和hMSH2与多种肿瘤的发生、发展关系密切, 他们的异常表达无论在遗传性肿瘤还是散发性肿瘤中均有发现[10-14]. 资料表明, hMLH1在碱基错配修复过程中发挥着解旋及切开错配碱基的关键作用, hMSH2基因是最早被发现的人类错配修复基因, 是细菌MutS和酵母菌MSH2的人类同源体, 其编码蛋白参与组成hMuts二聚体, 此二聚体能识别DNA复制中的错配碱基及插入缺失环, 是完成DNA修复的必需组件. hMLH1和hMSH2蛋白表达水平的降低能引起DNA错配修复功能低下, 使癌相关基因突变不能及时得以纠正, 从而导致肿瘤的易感性增加[15-18].
近年来, 随着内镜放大倍数和分辨率的提高, 染色放大内镜在大肠疾病诊断中的应用逐渐增多[19-24]. 日本学者Kudo等[9]提出的黏膜腺管开口分型为染色放大内镜检查提供了诊断标准, 对染色黏膜观察后再采用放大肠镜对大肠腺管开口分型进行仔细观察, 可以大致判断是否为肿瘤性病变以及病变的浸润程度[25-29]. Emura等[30]研究表明染色放大内镜按Kudo分类法鉴别良恶性腺瘤, 其敏感性和特异性均在90%以上. 染色放大内镜有助于早期大肠癌发现, 但目前染色放大内镜下大肠黏膜微细结构改变与致癌基因突变的关系尚相见关报道.
本研究采用染色放大内镜观察到256枚大肠黏膜息肉样病变, 在大肠黏膜腺管开口Ⅰ-Ⅴ型中hMLH1蛋白的丢失率分别为0.0%(0/11)、1.61%(1/62)、19.68%(25/127)、33.33%(1/3)、32.26%(10/31)、36.36%(8/22), hMSH2蛋白的丢失率分别为0.00%(0/11)、3.22%(2/62)、16.53%(21/127)、33.33%(1/3)、35.48%(11/31)40.90%(9/22), 随大肠黏膜腺管开口分型序数的递增, 其丢失率逐渐升高. 病理诊断中非肿瘤性病变-腺瘤性病变-癌性病变hMLH1和hMSH2基因蛋白的丢失率亦逐渐升高, 与大肠黏膜腺管开口Ⅰ-Ⅴ型中hMLH1蛋白的丢失率具有一致性. 本研究比较了大肠黏膜非肿瘤性病变、腺瘤性病变及癌性病变中hMLH1和hMSH2蛋白表达丢失率, 经统计学分析hMLH1和hMSH2蛋白表达丢失率无相关性, 所以两者在大肠癌变的过程中各自发挥不同作用.
本研究显示, 随着大肠腺管开口序数的升高, hMLH1和hMSH2蛋白的丢失率逐渐增加, 与大肠病变病理诊断中的丢失率具有一致性. hMLH1和hMSH2基因蛋白的丢失率从非肿瘤性病变、腺瘤性病变到癌性病变逐渐升高, 提示在肿瘤发生的早期阶段已经有MMR的基因的突变或功能异常, 尤其是hMLH1和hMSH2的突变可能是大肠癌发生的早期事件之一. 因此, 染色放大内镜下随访大肠腺管组织中hMLH1和hMSH2蛋白的丢失率有助于发现癌前病变、大肠癌.
大肠肿瘤是常见肿瘤, 在我国绝大部分大肠癌在发现时已近中晚期, 5年生存率在30%-60%, 所以早期诊断大肠癌和研究其发病机制以期寻找更加有效的治疗方法显得尤为重要. 近年来, 我国部分医院开展了染色放大内镜工作, 并发表了一些研究报道, 但通过染色放大内镜观察肠的微细结构及其与DNA错配修复酶hMLH1、hMSH2表达的相关性国内报道很少.
姜春萌, 教授, 大连医科大学附属第二医院消化科
Fu等应用染色放大内镜在122例患者中发现206个大肠息肉样病变, 最后经病理学证实染色放大内镜对瘤性的和非瘤性病变的诊断准确性达95.6%, 而普通电子结肠镜仅84%.
本研究通过染色放大内镜的方法, 观察大肠表面微细结构改变, 按大肠腺管开口形态进行分型, 对大肠病变hMLH1和hMSH2蛋白表达进行同步检测, 分析其在不同大肠病变组织中的表达差异, 对大肠癌的发病机制提出新的观点, 评价大肠腺管开口类型结合肿瘤相关基因的检测对于判断大肠非肿瘤性和肿瘤性病变的诊断价值.
随着大肠腺管分型序数的递增, hMLH1和hMSH2蛋白的丢失率逐渐增加, 与大肠病变病理诊断中的丢失率具有一致性, 提示DNA错配修复基因突变或功能缺失可能是大肠发生癌变进程中的早期事件, 染色放大内镜下检测大肠腺管组织中hMLH1和hMSH2蛋白的丢失率有助于发现癌前病变、大肠癌.
本文科学性较好, 具有较好的临床实用性.
编辑: 李薇 电编:何基才
| 3. | 顾 国利, 魏 学明, 王 石林, 任 力, 胡 益云, 李 德昌. 遗传性非息肉病性大肠癌中hMSH2、hMLH1、TβRⅡ、MMP-7及TIMP-2的表达和其特殊生物学行为间的关系. 世界华人消化杂志. 2007;15:1738-1744. [DOI] |
| 5. | Berndt SI, Platz EA, Fallin MD, Thuita LW, Hoffman SC, Helzlsouer KJ. Mismatch repair polymorphisms and the risk of colorectal cancer. Int J Cancer. 2007;120:1548-1554. [PubMed] [DOI] |
| 6. | 宋 伟庆, 韩 彩丽, 周 保军, 张 轶华, 陈 怡, 刘 玉, 韦 金英. COX-2与hMLH1、hMSH2在大肠癌中表达的相关性研究. 世界华人消化杂志. 2005;13:105-109. [DOI] |
| 7. | 杨 磊, 丁 彦青, 李 国新, 余 江, 王 瑜, 周 军, 杨 红军, 张 进华. 青年大肠癌微卫星不稳定和hMLH1/hMSH2表达缺失在遗传性非息肉病性大肠癌初筛中的应用. 南方医科大学学报. 2007;27:779-782. |
| 8. | 付 蕾, 盛 剑秋, 孙 自勤, 韩 敏, 黄 继胜, 牧 宏, 韩 文良, 牛 宏, 李 爱琴, 武 子涛. 76个中国人遗传性非息肉病性大肠癌家系hMLH1和hMSH2基因突变规律研究. 胃肠病学和肝病学杂志. 2007;16:459-461. |
| 9. | Kudo S, Tamura S, Nakajima T, Yamano H, Kusaka H, Watanabe H. Diagnosis of colorectal tumorous lesions by magnifying endoscopy. Gastrointest Endosc. 1996;44:8-14. [PubMed] [DOI] |
| 10. | Park JW, Chang HJ, Park S, Kim BC, Kim DY, Baek JY, Kim SY, Oh JH, Choi HS, Park SC. Absence of hMLH1 or hMSH2 expression as a stage-dependent prognostic factor in sporadic colorectal cancers. Ann Surg Oncol. 2010;17:2839-2846. [PubMed] [DOI] |
| 11. | Altavilla G, Fassan M, Busatto G, Orsolan M, Giacomelli L. Microsatellite instability and hMLH1 and hMSH2 expression in renal tumors. Oncol Rep. 2010;24:927-932. [PubMed] [DOI] |
| 12. | Vageli D, Daniil Z, Dahabreh J, Karagianni E, Vamvakopoulou DN, Ioannou MG, Scarpinato K, Vamvakopoulos NC, Gourgoulianis KI, Koukoulis GK. Phenotypic mismatch repair hMSH2 and hMLH1 gene expression profiles in primary non-small cell lung carcinomas. Lung Cancer. 2009;64:282-288. [PubMed] [DOI] |
| 13. | Li M, Liu L, Wang Z, Wang L, Liu Z, Xu G, Lu S. Overexpression of hMSH2 and hMLH1 protein in certain gastric cancers and their surrounding mucosae. Oncol Rep. 2008;19:401-406. [PubMed] |
| 14. | Zheng JY, Ren TS, Liu B, Wang MN, Liao HH. [Expression and significance of mismatch repair genes hMLH1 and hMSH2 in sporadic colorectal carcinoma]. Zhonghua Zhongliu Zazhi. 2010;32:590-594. [PubMed] |
| 16. | Stasikowska-Kanicka O, Stawerski P, Wagrowska-Danilewicz M, Danilewicz M. Immunohistochemical analysis of hMLH1 and hMSH2 proteins in serous ovarian tumours. Pol J Pathol. 2009;60:174-178. [PubMed] |
| 17. | Czerninski R, Krichevsky S, Ashhab Y, Gazit D, Patel V, Ben-Yehuda D. Promoter hypermethylation of mismatch repair genes, hMLH1 and hMSH2 in oral squamous cell carcinoma. Oral Dis. 2009;15:206-213. [PubMed] [DOI] |
| 18. | Naqvi RA, Hussain A, Deo SS, Kukreti H, Chauhan M, Sarin R, Saxena A, Asim M, Shukla NK, Husain SA. Hypermethylation analysis of mismatch repair genes (hmlh1 and hmsh2) in locally advanced breast cancers in Indian women. Hum Pathol. 2008;39:672-680. [PubMed] [DOI] |
| 22. | Kiesslich R, Neurath MF. Chromo- and magnifying endoscopy for colorectal lesions. Eur J Gastroenterol Hepatol. 2005;17:793-801. [PubMed] [DOI] |
| 23. | Fu KI, Kato S, Sano Y, Fujii T. Magnification with chromoendoscopy is the most reliable method to determine whether colorectal lesions are neoplastic or not. Endoscopy. 2007;39:476; author reply 477. [PubMed] [DOI] |
| 24. | Thorlacius H, Toth E. Role of chromoendoscopy in colon cancer surveillance in inflammatory bowel disease. Inflamm Bowel Dis. 2007;13:911-917. [PubMed] [DOI] |
| 25. | Kanao H, Tanaka S, Oka S, Kaneko I, Yoshida S, Arihiro K, Yoshihara M, Chayama K. Clinical significance of type V(I) pit pattern subclassification in determining the depth of invasion of colorectal neoplasms. World J Gastroenterol. 2008;14:211-217. [PubMed] [DOI] |
| 26. | Hurlstone DP, Sanders DS. Recent advances in chromoscopic colonoscopy and endomicroscopy. Curr Gastroenterol Rep. 2006;8:409-415. [PubMed] [DOI] |
| 28. | Li X, Chen H, Gao Y, Chen X, Ge Z. Prediction of histology and invasive depth of colorectal neoplasia based on morphology of surface depression using magnifying chromocolonoscopy. Int J Colorectal Dis. 2010;25:79-85. [PubMed] [DOI] |
| 30. | Emura F, Saito Y, Taniguchi M, Fujii T, Tagawa K, Yamakado M. Further validation of magnifying chromocolonoscopy for differentiating colorectal neoplastic polyps in a health screening center. J Gastroenterol Hepatol. 2007;22:1722-1727. [PubMed] [DOI] |