修回日期: 2010-12-23
接受日期: 2010-12-29
在线出版日期: 2011-02-28
目的: 观察Ghrelin、NF-κB在大鼠急性坏死性胰腺炎并肝损伤及褪黑素干预时在肝脏中的表达, 探讨两者在其中的作用及褪黑素对Ghrelin的影响和可能机制.
方法: 72只♂SD大鼠随机分为对照组(C组, n = 24)、急性坏死性胰腺炎组(A组, n = 24)、褪黑素干预组(M组, n = 24). A组分3次腹腔注射6%左旋精氨酸(L-Arg)1.5 g/kg, 诱发急性坏死性胰腺炎, C组同法注射等量生理盐水, M组在首次注射L-Arg前0.5 h腹腔注射1%褪黑素50 μg/kg. 各组大鼠在末次腹腔注射后6、12、24 h分批处死. 光镜下观察胰腺及肝脏病理改变并进行评分, 测定血清淀粉酶水平, RT-PCR检测肝脏Ghrelin及NF-κB mRNA水平, Western blot检测肝NF-κB蛋白表达.
结果: A组各时点胰腺及肝脏病理评分、血清淀粉酶、肝NF-κB mRNA(6 h: 0.74±0.04 vs 0.40±0.05; 12 h: 0.77±0.03 vs 0.40±0.02; 24 h: 0.82±0.04 vs 0.40±0.03, 均P = 0.000)及蛋白表达(24 h: 0.48±0.07 vs 0.16±0.04, P = 0.000)均较C组显著升高(均P<0.01). Ghrelin mRNA较C组明显降低(6 h: 0.39±0.04 vs 0.66±0.03; 12 h: 0.14±0.37 vs 0.30±0.05; 24 h: 0.22±0.02 vs 0.59±0.05, 均P = 0.000). M组各时点胰腺及肝脏病理评分、血清淀粉酶、肝NF-κB mRNA(6 h: 0.50±0.05 vs 0.74±0.04; 12 h: 0.54±0.04 vs 0.77±0.03; 24 h: 0.57±0.03 vs 0.82±0.04, 均P<0.05)及蛋白表达(24 h: 0.32±0.04 vs 0.48±0.07, P<0.05), 均较A组显著降低(均P<0.05). Ghrelin mRNA较A组升高(6 h: 0.54±0.03 vs 0.39±0.04; 12 h: 0.40±0.09 vs 0.30±0.05; 24 h: 0.39±0.04 vs 0.22±0.02, 均P<0.05).
结论: Ghrelin在急性胰腺炎并肝损伤时的表达可能与病变严重程度有关; NF-κB在该病变发展过程中起了重要作用, 外源性褪黑素可以减轻急性胰腺炎的胰腺和肝脏病变, 该保护作用可能与提高Ghrelin的表达、下调NF-κB的活性有关.
引文著录: 苏娟, 唐国都, 杨慧莹, 覃蒙斌, 梁志海. Ghrelin及NF-κB在急性坏死性胰腺炎并肝损伤中的作用. 世界华人消化杂志 2011; 19(6): 568-574
Revised: December 23, 2010
Accepted: December 29, 2010
Published online: February 28, 2011
AIM: To investigate the expression of ghrelin in the liver of rats with acute necrotizing pancreatitis (ANP) with liver injury and to explore the role of ghrelin and NF-κB in the pathogenesis of ANP-associated liver injury and the mechanism underlying the therapeutic effects of melatonin against ANP.
METHODS: Seventy-two male Sprague-Dawley rats were randomly and equally divided into control group, ANP group, and melatonin intervention group. Rats of the ANP group and melatonin intervention group were injected with 6% L-Arg (1.5 g/kg) intraperitoneally three times to induce ANP. Rats of the control group were injected with same volume of normal saline. The melatonin intervention group was given 1% melatonin (50 μg/kg) intraperitoneally 0.5 h before the first injection of L-Arg. Rats were sacrificed at 6, 12, and 24 h after the injection of melatonin. Pathological changes in the pancreatic and hepatic tissue were observed and graded under a microscope. The expression of ghrelin and NF-κB mRNAs was evaluated by RT-PCR, while the protein expression of NF-κB was detected by Western blot.
RESULTS: Pancreatic and hepatic pathological scores, serum amylase, and expression of NF-κB mRNA (6 h: 0.74 ± 0.04 vs 0.40 ± 0.05; 12 h: 0.77 ± 0.03 vs 0.40 ± 0.02; 24 h: 0.82 ± 0.04 vs 0.40 ± 0.03, all P = 0.001) and protein in the liver at all time points were significantly higher (24 h: 0.48 ± 0.07 vs 0.6 ± 0.04, P < 0.05), and ghrelin mRNA expression was significantly lower in the ANP group than in the control group (6 h: 0.39 ± 0.04 vs 0.66 ± 0.03; 12 h: 0.14 ± 0.37 vs 0.30 ± 0.05; 24 h: 0.22 ± 0.02 vs 0.59 ± 0.05, all P < 0.05). Pancreatic pathological scores, hepatic pathological scores, serum amylase, and expression of NF-κB mRNA(6 h: 0.50 ± 0.05 vs 0.74 ± 0.04, 12 h: 0.54 ± 0.04 vs 0.77 ± 0.03, 24 h: 0.57 ± 0.03 vs 0.82 ± 0.04, all P < 0.05) and protein were decreased (24 h: 0.32 ± 0.04 vs 0.48 ± 0.07, P < 0.05), and ghrelin mRNA expression was elevated (6 h: 0.54 ± 0.03 vs 0.39 ± 0.04, 12 h: 0.40 ± 0.09 vs 0.30 ± 0.05, 24 h: 0.39 ± 0.04 vs 0.22 ± 0.02, all P < 0.05) in the melatonin intervention group compared with in the ANP group.
CONCLUSION: The expression of ghrelin may be related to the severity of ANP with liver injury. NF-κB may also be involved in the pathogenesis of ANP with liver injury. Exogenous melatonin can reduce ANP possibly by up-regulating ghrelin expression and down-regulating NF-κB expression.
- Citation: Su J, Tang GD, Yang HY, Qin MB, Liang ZH. Role of ghrelin and NF-κB in the pathogenesis of acute necrotizing pancreatitis-associated liver injury. Shijie Huaren Xiaohua Zazhi 2011; 19(6): 568-574
- URL: https://www.wjgnet.com/1009-3079/full/v19/i6/568.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i6.568
急性胰腺炎(acute pancreatitis, AP), 临床上分为轻症与重症两型, 是常见的急腹症之一. 重症急性胰腺炎(severe acute pancreatitis, SAP)以胰腺出血、坏死为主要病理基础, 易并发胃肠、肝、肺、肾等器官的急性损伤, 造成多器官功能障碍(multiple organ dysfunction syndrome, MODS)甚至多器官功能衰竭(multiple organ failure, MOF), 病死率高. 各种病因, 包括胆石症、大量饮酒及暴饮暴食、胰腺本身病变导致胰管阻塞等, 引起腺泡细胞损伤, 胰酶激活、释放, 同时活化炎症细胞引起多种炎症介质及细胞因子产生并释放入血, 氧化应激损伤形成, 导致胰腺微循环障碍、胰管通透性增高, 各有害因素进入血循环, 损伤机体其他脏器. Ghrelin是1999年发现的生长激素促分泌受体的天然配体, 主要在胃合成分泌, 在肠道、肝、肾、肺、心脏及中枢神经系统都有表达, 具有刺激生长激素释放、调节摄食、刺激胃酸及胃蛋白酶分泌、提高心输出量及升高血压等多种生物学功能[1,2]; 研究发现Ghrelin和急性胰腺炎的严重程度有关; 其具有抗炎、抗氧化损伤等作用[3,4]. 而核转录因子κB(nuclear factor-κB, NF-κB)是目前较公认的参与胰腺炎合并胰外器官损伤的关键因子[5]. 本实验通过多次大剂量腹腔注射L-精氨酸(L-Arg)诱导建立急性胰腺炎并肝损伤的模型, 观察Ghrelin与NF-κB在肝脏的表达与相关器官的病理损伤的关系, 探讨Ghrelin、NF-κB在肝脏损伤中的作用及褪黑素(melatonin, Mel)对其的影响和可能机制.
清洁级♂SD大鼠72只, 体质量180-250 g, 由广西医科大学动物实验中心提供. L-Arg(美国Sigma公司); 1%Mel(德国Ruibio公司); NF-κB单克隆抗体、β-actin单克隆抗体、HRP标记的羊抗鼠二抗(均为Santa Cruz公司); TRIzol(Invitrogen公司); RT-PCR逆转录试剂盒(MBI公司); RT-PCR Taq酶(美国Promega公司); 胞质胞核蛋白抽提、Braford蛋白定量试剂盒(碧云天公司); ECL(北京普利来公司).
1.2.1 分组及造模: 72只大鼠随机分为3组, 对照组(C组, 24只), 急性坏死性胰腺炎模型组(A组, 24只), Mel干预组(M组, 24只). 各组大鼠实验前禁食12 h, 自由饮水. A组: 分3次腹腔注射6% L-Arg 1.5 g/kg, 每次间隔1 h, 诱发急性坏死性胰腺炎[6]; C组同法注射等量生理盐水; M组在首次注射L- Arg前0.5 h腹腔注射1% Mel 50 μg/kg, 之后同A组方法. 各组大鼠在末次腹腔注射后6、12、24 h按时点每批8只分批处死. 留取动脉血、胰腺、肝脏组织标本.
1.2.2 胰腺及肝脏组织切片、HE染色: 留取的标本40 g/L甲醛固定, 石蜡包埋、切片后进行HE染色, 在光镜下每张切片随机观察5个视野并评分, 均由同一病理医师完成.每张切片评分为5个视野均值, 胰腺、肝脏病理评分分别参考Kusske[7]、Schmidt[8]评分标准.
1.2.3 血清淀粉酶测定: 各时点分批处死大鼠后取动脉血, 全自动生化分析仪测定血清淀粉酶含量.
1.2.4 肝脏NF-κB、Ghrelin mRNA水平检测: RT-PCR测定. TRIzol提取细胞总RNA. 引物依据GenBank中大鼠NF-κB及Ghrelin mRNA序列设计. NF-κB上游引物: 5'-AGCTCAAGATCTGCCGAGTA-3'; 下游引物5'-GATCTGCCCAGGTGGTAACAC-3'; 扩增片段为557 bP. Ghrelin上游引物序列: 5'-GTGTCTTCAGCGACTATCT-3'; 下游引物序列: 5'-CCTGTCAGTGGTTACTTGTT-3'; 扩增片段为362 bP. β-actin上游引物序列5'-CCCATCTATGAGGGTTACGC-3'; 下游引物序列: 5'-TTTAATGTCACGCACGATTTC-3'; 扩增片段为150 bP. RT-PCR的具体操作按试剂盒说明进行. 逆转录合成cDNA反应条件: 65 ℃, 5 min; 42 ℃, 60 min; 70 ℃, 5 min. 合成的cDNA加相应引物进行扩增. PCR反应体系为50 μL, 5×buffer 10 μL, 1.5 mmol/L MgCl2, dNTP 1 μL(10 mmol/L), 上下游引物各2.5 μL(10 μmol/L), Taq酶0.25 μL(5 U/μL), cDNA模板1 μL, ddH2O 33 μL. NF-κB扩增条件为: 预变性94 ℃ 5 min, 94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸45 s, 共35个循环, 总延伸72 ℃ 10 min. Ghrelin扩增条件为: 预变性95 ℃ 5 min, 94 ℃变性30 s, 56 ℃退火40 s, 72 ℃延伸40 s, 共35个循环, 总延伸72 ℃ 10 min. PCR产物用1.5%琼脂糖凝胶电泳后进行凝胶成像系统分析.
1.2.5 肝脏NF-κB的Western blot检测: 称取一定量的组织, 按照说明书抽提胞核蛋白后, 按照试剂盒操作, 制作蛋白标准曲线、测定蛋白浓度. 取等量蛋白在SDS-PAGE上电泳(12%分离胶, 5%浓缩胶)后转移至PVDF膜, 5%脱脂奶粉封闭, NF-κB单抗按1:800、β-actin单抗过夜冰敷, TBST洗膜3次后二抗1:4 000常温孵育, 同前法洗膜3次, 应用增强的化学发光法(Enhanced chemiluminescence, ECL)显影、定影后, 图片经扫描用Quantity One软件分析.
统计学处理 应用SPSS13.0软件包分析, 实验数据均用mean±SD表示, 采用单因素方差分析对数据进行检验, P<0.05为差异有统计学意义.
C组大鼠胰腺肉眼观无变化, 镜下见胰腺腺泡结构完整, 腺小叶清晰, 偶见少量水肿和炎性细胞浸润, 无坏死、出血. A组胰腺外观呈灰白色或暗紫色, 水肿明显. 腹腔见淡黄色或血性腹水, 部分脏器粘连、脂肪皂化. 镜下见胰腺腺泡水肿, 结构不清, 炎性细胞浸润、甚至片状组织坏死及出血, 腺小叶结构破坏. 病变在各时点随时间延续而加重. M组的病变较A组减轻, 胰腺外观稍肿, 腹水减少, 腹腔脏器无粘连、脂肪皂化. 镜下见腺泡水肿轻于A组, 腺泡细胞坏死, 少量炎性细胞浸润, 但无片状出血坏死. 各组胰腺评分见表1.
| 分组 | 胰腺病理评分 | 肝脏病理评分 | 淀粉酶 (U/L) |
| C组 | |||
| 6 h | 0.14±0.37 | 0.25±0.46 | 1736.25±435.99 |
| 12 h | 0.14±0.37 | 0.50±0.53 | 1901.12±777.11 |
| 24 h | 0.33±0.51 | 1.00±0.76 | 2033.00±862.66 |
| A组 | |||
| 6 h | 4.50±1.19a | 4.00±0.76a | 2129.42±760.16a |
| 12 h | 5.75±1.49a | 4.88±0.83a | 3012.22±1424.89a |
| 24 h | 8.43±1.39a | 6.13±0.83a | 4598.42±2273.79a |
| M组 | |||
| 6 h | 1.72±0.75c | 3.00±0.76c | 1824.12±333.55c |
| 12 h | 2.37±1.18c | 2.88±0.83c | 1834.87±499.07c |
| 24 h | 6.57±0.65c | 3.38±0.74c | 3990.75±1145.61c |
C组肝脏表面鲜红色, 光滑无出血、渗出. 光镜下见肝窦、汇管区无明显变化, 肝细胞结构清晰. A组肝脏外观呈暗红色, 水肿. 镜下肝细胞浊肿, 肝窦扩张充血明显, 汇管区见炎性细胞浸润, 少量肝细胞坏死.各时点病变随时间而加重. M组细胞肿胀程度较A组减轻, 肝窦扩张, 汇管区炎性细胞浸润少量, 无肝细胞坏死. 各组肝脏评分见表1.
A组各时点的淀粉酶比C组显著升高, 6、12、24 h相应各时点M组比A组降低. 各组淀粉酶的数值见表1.
A组各时点NF-κB mRNA较C组显著升高, 且其表达水平随时间提高; 同时点M组表达较A组降低, 差异有统计学意义, 在各个时点的表达随时间增加; Ghrelin mRNA在C组表达最高, A组的表达显著低于C组, 且随着时间的增加, Ghrelin mRNA降低. M组较A组同时点表达有所回升(P<0.05, 图1, 表2).
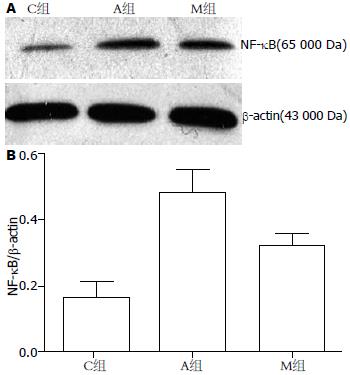
以β-actin为内参, 在24 h NF-κB蛋白的表达, M组较C组显著提高, 而M组较之于A组有所降低(24 h: 0.48±0.07 vs 0.32±0.04, 0.16±0.04, 均P<0.05, 图2).
肝脏是机体有毒物质代谢、降解、排泄的主要场所, 尤其是胃肠道吸收的物质, 绝大部分经门静脉入肝. ANP发生后, 释放入血的胰酶、大量炎性介质和细胞因子、各种氧自由基、肠道细菌移位及内毒素等, 经门静脉首先进入肝脏, 损伤肝实质. 肝功能受损后, 对有害物质清除能力下降, 从而加剧了疾病的发展, 形成恶性循环, 最终导致肝功能衰竭. 其中, 炎症反应和氧化损伤是最关键的机制. 肝Kupffer细胞是体内最大的巨噬细胞群. 从胰腺、胃肠道产生而到达肝脏的炎症因子, 包括TNF-α、IL-1、IL-6、IL-8及磷脂酶A2(phospholipases, PLA2)等, 不仅直接损伤肝细胞, 还激活肝血窦内的Kupffer细胞, 后者经不同的信号转导途径, 活化NF-κB、上调TNF-α、Fas的表达, 从而分泌TNF-α、Fas-L、TGF-β1、IL-1、IL-6、IL-8等细胞因子, 介导细胞凋亡或者坏死[9]. 而各种氧自由基可直接将胞膜脂质过氧化, 损伤细胞; 其本身也可激活Kupffer细胞、网状内皮细胞、中性粒细胞等. 炎性细胞被激活、分泌大量的炎症因子, 参与触发"瀑布式"级联反应, 使炎症从局部蔓延至全身, 即所谓的"全身严重反应综合征"( systemic inflammatory response syndrome, SIRS), 最终引起MODS.
Ghrelin最先由Kojima等[10]于1999年从大鼠胃组织中提纯出来. Ghrelin由28个氨基酸组成, 在体内包括中枢神经系统、肺、肾、心血管、消化及免疫系统都有广泛分布. 在消化系统中, 整个胃肠道及胰腺、肝脏中均有分布, 胃肠道X/A样细胞是主要的分泌细胞[11]. Ghrelin与其活性受体GHS-R1a结合后, 可促使生长激素释放、参与调控机体的摄食行为, 抑制脂肪降解, 调节机体的能量平衡[12]. 而在病理状态, Ghrelin能抑制炎症因子的产生和释放, 减轻机体的炎症反应. 研究发现, 脂多糖诱导的巨噬细胞活化后, 炎症因子IL-1β、TNF-α大量生成, 而抗炎因子IL-10产生减少; 予外源性Ghrelin则可剂量、时间依赖性地降低IL-1β、TNF-α, 同时提高IL-10的表达[13]. Ghrelin可提高缺血/再灌注损伤的胃黏膜血流灌注, 加上抗炎作用, 促进损伤部位的修复, 从而在胃肠黏膜损伤时发挥保护作用[14,15]. Mel是主要在胃肠道和松果体分泌的一种抗氧化剂, 具有脂溶性, 因而能够直接进入细胞, 对抗氧自由基、增强过氧化酶活性而保护DNA、蛋白质及生物膜不受氧化损害, 其抗氧化能力比维生素E、谷胱甘肽强[16]. 研究显示, 在消化系统中, Ghrelin对肝脏、胃、肠道及胰腺病变均具有保护作用[17-20].
NF-κB是一种能与免疫球蛋白κ轻链基因的增强序列κB序列特意结合的蛋白因子. 静息状态下, NF-κB与其抑制蛋白I-κB(inhibitor protein-κB)结合存在于胞质中, 受各种胞外刺激后, I-κB磷酸化被水解, 两者分离, NF-κB被释放进入胞核, 与多种目的基因的特定DNA序列结合, 启动这些基因的转录, 其中包括如ICAM-1、IL-1、IL-8、IL-10、TNF-α、Fas-L等炎症介质及细胞因子, 从而介导一系列的炎症反应. 在胰腺炎的全身炎症反应中, NF-κB可能是触发"瀑布式"级联反应的重要开关, 尤其是在肝脏损伤时, Kupffer细胞的NF-κB被活化后, TNF-α、Fas的表达也上调, 产生大量的细胞因子, 是胰腺炎肝损伤的关键步骤[9,21]. 研究发现, Ghrelin与Mel发挥抗炎、抗氧化作用时, 都与NF-κB活性的降低有关, 两者可能都通过NF-κB途径下调细胞因子及炎症介质、氧自由基的表达, 从而对机体发挥保护作用[22,23].
在本实验中, NF-κB mRNA和蛋白表达水平在A组显著高于C组, 且随时间而增高, 与病理切片观察到的两个器官损伤程度改变一致; 与此相反, 肝Ghrelin mRNA在C组表达最高, 而A组显著降低, 且随着胰腺、肝脏损伤的加重而降低. 予Mel预处理, 对应各时点的NF-κB mRNA和蛋白表达水平较A组均下降, 而肝Ghrelin mRNA的表达有所恢复, 同时可见胰腺及肝脏的病理改变减轻; 而肝脏的超氧化物歧化酶(super oxide dismutase, SOD)含量亦有恢复, 作为脂质过氧化程度指标的丙二醛(malonaldehyde, MDA)含量亦减少. 分析原因可能有如下几个方面. 首先, 炎性介质、细胞因子及氧自由基进入肝脏, 通过活化细胞内NF-κB并致一系列炎症反应损伤肝细胞的同时, 还对在肝脏有少量分布的Ghrelin细胞有损害作用, 直接使后者Ghrelin mRNA的转录、翻译受到阻碍; 其次, 急性坏死性胰腺炎进展时, 胃肠黏膜亦可因细菌毒素及应激相关性损伤导致胃肠上皮受损, 可能使Ghrelin生成减少, 在肝脏的分布减少, 其对肝组织的保护作用显著减弱, 间接使分泌Ghrelin细胞的功能降低, mRNA合成减低; 再者, 炎症因子还可直接对Ghrelin细胞进行干扰. 有实验证实外源性IL-1β可使大鼠胃Ghrelin mRNA表达显著下降[24]. 据此推测A组的肝脏Ghrelin mRNA表达下调也和在此聚集的大量细胞因子有关. Mel干预后, 通过下调NF-κB活性, 发挥其抗炎抗氧化作用, 使得肝细胞及Ghrelin细胞损伤减轻, Ghrelin mRNA表达及SOD含量得以升高, MDA的形成得到控制.这一系列过程, 都与NF-κB途径有关. 研究表明外源性Ghrelin在急性胰腺炎过程中可以改善该脏器的血流灌注、抑制炎症因子产生、促进胰腺细胞增殖[25-27]. 因此, 本实验虽未给予外源性Ghrelin, 而是通过检测内源性Ghrelin在胰腺炎及Mel干预组的表达, 间接证明了Ghrelin的保护作用. 由此我们想到, Ghrelin有降低细胞因子及炎性介质水平、氧自由基损伤的作用, 那么在胰腺炎初期, Ghrelin的减少很可能使促炎与抗炎、氧化与抗氧化两个平衡缺少一个调控因素, 从而打破平衡, 致使病变进一步加重.
本研究证明: 急性胰腺炎并肝损伤时, 肝脏Ghrelin的表达下降; 外源性Mel可以减轻急性胰腺炎的胰腺和肝脏病变, 上调Ghrelin的表达水平. Ghrelin和Mel有可能通过共同的通路, 即下调NF-κB的活性在胰腺炎肝损伤中发挥保护作用. Ghrelin、Mel和以NF-κB为靶点的药物, 可成为今后胰腺炎治疗研究的一个方向.
Ghrelin可减少炎症因子的产生, 减轻组织炎症反应, 对抗过氧化物形成; 而褪黑素亦具有强大的抗氧化作用. 目前Ghrelin在急性坏死性胰腺炎中的作用研究大多集中于检测在血清的水平及其受体的含量, 但对于胰腺组织及其他胰外器官的研究较少; 褪黑素、Ghrelin与胰腺炎三者关系的研究鲜有报道.
秦成勇, 教授, 山东省立医院消化内科
目前对Ghrelin的研究重在炎症损伤中的抗炎症、抗氧化作用, 尤其是其在炎症相关性疾病中的潜在治疗作用成为热点. 而褪黑素因抗氧化应激等作用对氧化相关疾病的保护作用亦是研究热点之一.
Waseem等的研究提示Ghrelin呈剂量、时间依赖性地抑制炎症因子的产生; 而预先给予外源性Ghrelin则减低了NF-κB的激活程度; 增强了p38MAPK的活性, 从而提高了抑炎因子的释放. Ni等证实褪黑素通过抑制NF-κB的活性、减少TNF-α的表达, 降低胰腺炎肝损伤时的细胞凋亡、坏死.
本文通过对急性坏死性胰腺炎及褪黑素干预下Ghrelin和NF-κB表达的研究, 在国内外首次探讨褪黑素、Ghrelin与胰腺炎三者之间的关系, 为临床AP的诊疗提供新的思路.
本研究再次证实褪黑素对胰腺炎有抑制作用, Ghrelin及NF-κB在该疾病过程中起着重要的作用, 提高Ghrelin的表达和抑制NF-κB活性, 为胰腺炎治疗提供了新思路.
本文设计合理, 结果可靠, 为探讨Ghrelin及NF-κB在急性坏死性胰腺炎并肝损伤中的作用奠定了实验基础.
编辑: 李薇 电编:李薇
| 1. | Kojima M, Kangawa K. Ghrelin: structure and function. Physiol Rev. 2005;85:495-522. [PubMed] [DOI] |
| 3. | Lee SH, Kim YD, Kong YH, Han KH, Jeong WJ, Lee SJ, Cheon GJ. The relevance of serum ghrelin concentration to severity of acute pancreatitis. Gut Liver. 2010;4:234-240. [PubMed] [DOI] |
| 4. | Katergari SA, Milousis A, Pagonopoulou O, Asimakopoulos B, Nikolettos NK. Ghrelin in pathological conditions. Endocr J. 2008;55:439-453. [PubMed] [DOI] |
| 5. | Rakonczay Z Jr, Hegyi P, Takács T, McCarroll J, Saluja AK. The role of NF-kappaB activation in the pathogenesis of acute pancreatitis. Gut. 2008;57:259-267. [PubMed] [DOI] |
| 7. | Kusske AM, Rongione AJ, Ashley SW, McFadden DW, Reber HA. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice. Surgery. 1996;120:284-288; discussion 289. [PubMed] [DOI] |
| 8. | Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT, Warshaw AL. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992;215:44-56. [PubMed] [DOI] |
| 9. | Murr MM, Yang J, Fier A, Gallagher SF, Carter G, Gower WR Jr, Norman JG. Regulation of Kupffer cell TNF gene expression during experimental acute pancreatitis: the role of p38-MAPK, ERK1/2, SAPK/JNK, and NF-kappaB. J Gastrointest Surg. 2003;7:20-25. [PubMed] [DOI] |
| 10. | Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 1999;402:656-660. [PubMed] [DOI] |
| 11. | Date Y, Kojima M, Hosoda H, Sawaguchi A, Mondal MS, Suganuma T, Matsukura S, Kangawa K, Nakazato M. Ghrelin, a novel growth hormone-releasing acylated peptide, is synthesized in a distinct endocrine cell type in the gastrointestinal tracts of rats and humans. Endocrinology. 2000;141:4255-4261. [PubMed] [DOI] |
| 12. | Broglio F, Prodam F, Riganti F, Gottero C, Destefanis S, Granata R, Muccioli G, Abribat T, van der Lely AJ, Ghigo E. The continuous infusion of acylated ghrelin enhances growth hormone secretion and worsens glucose metabolism in humans. J Endocrinol Invest. 2008;31:788-794. [PubMed] |
| 13. | Waseem T, Duxbury M, Ito H, Ashley SW, Robinson MK. Exogenous ghrelin modulates release of pro-inflammatory and anti-inflammatory cytokines in LPS-stimulated macrophages through distinct signaling pathways. Surgery. 2008;143:334-342. [PubMed] [DOI] |
| 14. | Brzozowski T, Konturek PC, Sliwowski Z, Pajdo R, Drozdowicz D, Kwiecien S, Burnat G, Konturek SJ, Pawlik WW. Prostaglandin/cyclooxygenase pathway in ghrelin-induced gastroprotection against ischemia-reperfusion injury. J Pharmacol Exp Ther. 2006;319:477-487. [PubMed] [DOI] |
| 15. | Konturek PC, Brzozowski T, Walter B, Burnat G, Hess T, Hahn EG, Konturek SJ. Ghrelin-induced gastroprotection against ischemia-reperfusion injury involves an activation of sensory afferent nerves and hyperemia mediated by nitric oxide. Eur J Pharmacol. 2006;536:171-181. [PubMed] [DOI] |
| 16. | Rozov SV, Filatova EV, Orlov AA, Volkova AV, Zhloba AR, Blashko EL, Pozdeyev NV. N1-acetyl-N2-formyl-5-methoxykynuramine is a product of melatonin oxidation in rats. J Pineal Res. 2003;35:245-250. [PubMed] [DOI] |
| 17. | Hong RT, Xu JM, Mei Q. Melatonin ameliorates experimental hepatic fibrosis induced by carbon tetrachloride in rats. World J Gastroenterol. 2009;15:1452-1458. [PubMed] [DOI] |
| 21. | Zhang XP, Jiang J, Yu YP, Cheng QH, Chen B. Effect of Danshen on apoptosis and NF-κB protein expression of the intestinal mucosa of rats with severe acute pancreatitis or obstructive jaundice. Hepatobiliary Pancreat Dis Int. 2010;9:537-546. [PubMed] |
| 22. | Li WG, Gavrila D, Liu X, Wang L, Gunnlaugsson S, Stoll LL, McCormick ML, Sigmund CD, Tang C, Weintraub NL. Ghrelin inhibits proinflammatory responses and nuclear factor-kappaB activation in human endothelial cells. Circulation. 2004;109:2221-2226. [PubMed] [DOI] |
| 23. | Ni Y, Wu JS, Fang PP, Wu XL, Sun XC, Jia GB, Zhang RZ. [Mechanism of liver injury in severe acute pancreatitis rats and role of melatonin]. Zhonghua Yixue Zazhi. 2008;88:2867-2871. [PubMed] |
| 24. | Asakawa A, Inui A, Kaga T, Yuzuriha H, Nagata T, Ueno N, Makino S, Fujimiya M, Niijima A, Fujino MA. Ghrelin is an appetite-stimulatory signal from stomach with structural resemblance to motilin. Gastroenterology. 2001;120:337-345. [PubMed] [DOI] |
| 25. | Warzecha Z, Ceranowicz P, Dembinski A, Cieszkowski J, Kusnierz-Cabala B, Tomaszewska R, Kuwahara A, Kato I. Therapeutic effect of ghrelin in the course of cerulein-induced acute pancreatitis in rats. J Physiol Pharmacol. 2010;61:419-427. [PubMed] |
| 26. | Sehirli O, Sener E, Sener G, Cetinel S, Erzik C, Yeğen BC. Ghrelin improves burn-induced multiple organ injury by depressing neutrophil infiltration and the release of pro-inflammatory cytokines. Peptides. 2008;29:1231-1240. [PubMed] [DOI] |
| 27. | Daniel P, Leśniowski B, Jasińska A, Pietruczuk M, Małecka-Panas E. Usefulness of assessing circulating levels of resistin, ghrelin, and IL-18 in alcoholic acute pancreatitis. Dig Dis Sci. 2010;55:2982-2987. [PubMed] [DOI] |