修回日期: 2010-12-02
接受日期: 2010-12-07
在线出版日期: 2011-02-18
目的: 探讨Ras三磷酸鸟苷酶激活样蛋白(RASAL1)及基因在人结肠癌中的表达及其与临床病理参数间的关系.
方法: 收集2009-04/2010-05经手术切除的结肠腺癌标本50例作为研究组, 相应正常组织为对照组, 做成蜡块标本; 其中20例另取其癌组织、癌旁组织及正常组织的新鲜标本; 用免疫组织化学染色观察50例蜡块标本RASAL1蛋白的表达; 用RT-PCR检测20例新鲜标本RASAL1 mRNA的表达, 并分析其与临床病理参数的关系.
结果: RASAL1蛋白主要在细胞质中表达; RASAL1蛋白在结肠癌中的阳性表达率明显低于癌旁组织及正常组织[46%(23/50) vs 85%(17/20), 96%(48/50), 均P<0.05]; RASAL1 mRNA在结肠癌中的阳性表达率较癌旁组织及正常组织明显减低[50%(10/20) vs 90%(18/20), 95%(19/20), 均P<0.05], RASAL1蛋白与mRNA的表达呈明显正相关(r = 0.686, P<0.01), 与肿瘤的分化程度(P<0.05)、侵袭深度(P<0.01)、淋巴结转移(P<0.05)、TNM分期(P<0.05)呈负相关.
结论: RASAL1在结肠腺癌组织中低表达, 且与分化程度及进展阶段负相关; RASAL1有可能成为结肠癌治疗的一个新靶点.
引文著录: 程桂丹, 陈洪, 陆枫林. 肿瘤相关基因RASAL1在结肠癌中的表达及临床意义. 世界华人消化杂志 2011; 19(5): 488-493
Revised: December 2, 2010
Accepted: December 7, 2010
Published online: February 18, 2011
AIM: To investigate the expression of RASAL1 (Ras GTPase-activating-like protein 1) mRNA and protein in human colorectal carcinoma (CRC) and to analyze its correlation with tumor clinicopathological features.
METHODS: Fifty paraffin-embedded surgical CRC specimens, matched tumor-adjacent tissue specimens, and normal colorectal tissue specimens were used to detect the distribution of RASAL1 by immunohistochemistry (IHC). Twenty fresh CRC specimens, matched tumor-adjacent tissue specimens, and normal colorectal tissue specimens were used to determine the levels of RASAL1 mRNA expression by RT-PCR. The correlation between RASAL1 expression and tumor clinicopathological parameters was analyzed.
RESULTS: RASAL1 was mainly localized in the cytoplasm of glands cells. The positive rate of RASAL1 protein expression in CRC was significantly lower than those in tumor-adjacent tissue and normal colorectal tissue [46% (23/50) vs 85% (17/20), 96% (48/50), both P < 0.05]. The positive rate of RASAL1 mRNA expression was also significantly lower in CRC than in tumor-adjacent tissue and normal colorectal tissue [50% (10/20) vs 90% (18/20), 95% (19/20), both P < 0.05]. The expression of RASAL1 protein was positively related with that of RASAL1 mRNA (r = 0.686, P < 0.01), but negatively with tumor differentiation degree (P < 0.05), invasive depth (P < 0.01), lymph node metastasis (P < 0.05), and TNM stage (P < 0.05).
CONCLUSION: The expression of RASAL1 mRNA and protein is reduced in CRC. RASAL1 expression is negatively related to tumor progression. RASAL1 may be a novel therapeutic target for CRC.
- Citation: Cheng GD, Chen H, Lu FL. Clinical significance of RASAL1 expression in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(5): 488-493
- URL: https://www.wjgnet.com/1009-3079/full/v19/i5/488.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i5.488
结肠癌形成、进展和转移与癌基因、抑癌基因不可逆的积累突变和失调有关. 其中, Ras基因与肿瘤发生发展的关系引起人们较高的关注. Ras基因是第一个被鉴定的人类癌基因, 对于Ras基因、蛋白及其参与的信号转导通路的研究一直是分子肿瘤学的研究热点之一. RASAL1基因是近年新发现的一种钙离子依赖性Ras活性调节基因, 研究发现RASAL1基因可能参与了部分恶性肿瘤的发生[1], 目前国外已有研究表明在结肠癌中存在RASAL1的表达缺失, 并发现RASAL1的表达可能与结肠癌的进展有关[2,3], 而国内尚无报道. 本实验拟采用免疫组织化学染色及RT-PCR的方法检测结肠腺癌组织、癌旁组织及正常组织中RASAL1的表达情况, 探讨其与结肠癌临床病理参数间的关系, 旨在为结肠癌的临床诊断及治疗提供科学依据.
收集2009-04/2010-05东南大学附属中大医院普外科经手术切除的结肠腺癌标本50例作为研究组, 相应正常组织为对照组(术前未接受放、化疗或其他针对肿瘤的治疗, 肿瘤组织均取自肿瘤中心非坏死部位)其中男29例, 女21例; 年龄为32-78(平均56.1±13.7)岁. 50例标本均经术后病理切片证实, 并结合临床资料进行TNM分期, 石蜡包埋. 其中20例另取肿瘤组织、癌旁组织及正常组织的新鲜手术标本, 均在离体后0.5 h内迅速取材, 并分别放入经DEPC水处理过的冻存管中置于-70 ℃冰箱中备用. 剩余癌旁组织经甲醛固定, 石蜡包埋, 常规连续4 μm切片, 用于常规病理诊断及免疫组织化学染色. 羊抗人RASAL1多克隆抗体为英国Abcam公司产品(工作浓度1:100, 用PBS稀释), SP试剂盒购自北京中杉生物技术有限公司, TRIzol、PCR试剂盒购自宝生物(TaKaRa)工程大连有限公司, RASAL1引物由生工生物工程(上海)有限公司合成.
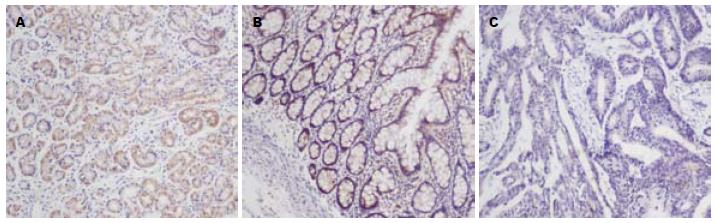
1.2.1 RASAL1蛋白检测: 采用链霉素抗生素蛋白-过氧化物酶免疫组织化学染色方法(SP法). 50例石蜡包埋标本切片脱蜡后入蒸馏水10 min, 3%双氧水室温孵育5-10 min; 蒸馏水冲洗, PBS浸泡5 min; 抗原修复, 自然冷却, PBS冲洗5 min×3次; 加入正常山羊血清工作液封闭, 室温孵育10 min; 弃去血清, 加一抗工作液, 4 ℃孵育过夜; PBS冲洗5 min×3次; 加二抗工作液, 37 ℃孵育15 min, PBS冲洗5 min×3次; 加入辣根过氧化物酶标记的链霉卵白素工作液, 37 ℃孵育15 min, PBS冲洗5 min×3次; DAB显色10 min; 脱水、透明、封片、镜下观察. 实验结果判定用已知阳性组织作为阳性对照, 以正常山羊血清取代一抗作为阴性对照, 以磷酸缓冲液代替一抗作为空白对照. RASAL1的表达参照Fromowitz方法[4]在高倍镜下对着色反应作如下评分, 分别记为: 阳性细胞数<5%为阴性记0分, 5%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分. 阳性强度以无着色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 两者相加, <2为阴性(-), 2-3为弱阳性(+), 4-5为中度阳性(++), 6-7为强阳性(+++).
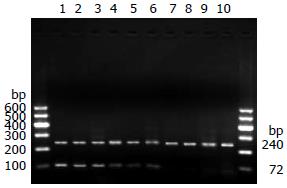
1.2.2 RT-PCR测定RASAL1 mRNA的表达: 20例新鲜标本处理后, 总RNA抽取(TRIzol试剂盒), 用紫外分光光度仪测量总RNA浓度和纯度, -70 ℃保存. 按照试剂盒操作说明取1 μg RNA进行cDNA合成. RASAL1 cDNA引物序列: 上游: 5'-TGGATTTCTCTTCTTGCGATTCT-3', 下游: 5'-TGTTGGTCCCGAAGGTCAA-3', 扩增片段长度72 bp; 内参β-actin引物序列: 上游: 5'-TAAAGACCTCTATGCCAACACAGT-3', 下游: 5'-CACGATGGAGGGGCCGGACTCATC-3', 扩增片段长度240 bp. PCR反应体系为10×缓冲液5 μL, dNTP(10 mmol/L)0.5 μL, 目的基因上、下游引物各0.8 μL, 内参上、下游引物各0.3 μL, Tap酶2 U, cDNA模板5 μL, 加dH2O至反应体系为25 μL. PCR反应条件: 94 ℃预变性2 min, 然后按94 ℃ 30 s、60 ℃ 30 s、72 ℃ 1 min, 重复35个循环, 最后72 ℃延伸10 min, 反应结束后, 扩增产物8 μL+溴酚蓝指示剂2 μL, 点样于2%琼脂糖凝胶(1 g琼脂糖+50 mL 0.5×TBE缓冲液, 煮沸, 加溴化乙锭2 μL), 80 V电压, 电泳30 min, 用凝胶成像系统检测PCR产物特异性, 并进行条带灰度值分析, 目的带的灰度值与内参对照带相比, 比值>80%定为阳性.
统计学处理 采用统计学软件包SAS9.1及SPSS13.0进行; 采用Wilcoxon秩和检验、χ2检验和Kruskal-Wallis H秩和检验分别对两样本及多样本阳性表达情况进行比较; 相关性检验采用Spearman等级相关分析, 以P<0.05为差异有统计学意义.
RASAL1蛋白主要在细胞质内表达(图1), RASAL1蛋白在正常组织、癌旁组织、癌组织中的阳性表达率分别为96%(48/50)、85%(17/20)、46%(23/50), 表达的阳性率逐渐降低, 差异有统计学意义(均P<0.05, 表1).
本组50例结肠癌中RASAL1蛋白表达与患者肿瘤分化程度、侵袭深度、淋巴结转移、TNM分期呈负相关(P<0.05), 与患者性别、年龄及肿瘤大小间差异均无显著性(表2).
| 病理资料 | n | RASAL1蛋白表达(n) | W | P值 | |||
| - | + | ++ | +++ | ||||
| 性别 | |||||||
| 男 | 29 | 15 | 9 | 4 | 1 | 737.0 | 0.957 |
| 女 | 21 | 12 | 3 | 5 | 1 | ||
| 年龄(岁) | |||||||
| <69 | 23 | 10 | 7 | 5 | 1 | 631.0 | 0.217 |
| ≥70 | 27 | 17 | 5 | 4 | 1 | ||
| 肿瘤大小(cm) | |||||||
| <4 | 28 | 14 | 6 | 7 | 1 | 520.5 | 0.383 |
| ≥4 | 22 | 13 | 6 | 2 | 1 | ||
| 分化程度 | |||||||
| 中高 | 20 | 7 | 7 | 4 | 2 | 667.5 | 0.033 |
| 低 | 30 | 20 | 5 | 5 | 0 | ||
| 侵袭深度 | |||||||
| T1, T2 | 21 | 4 | 10 | 6 | 1 | 570.5 | 0.000 |
| T3, T4 | 29 | 23 | 2 | 3 | 1 | ||
| 淋巴结转移 | |||||||
| 无 | 15 | 5 | 3 | 7 | 0 | 769.5 | 0.025 |
| 有 | 35 | 22 | 9 | 2 | 2 | ||
| TNM分期 | |||||||
| 1, 2 | 27 | 10 | 10 | 5 | 2 | 426.0 | 0.044 |
| 3, 4 | 23 | 17 | 2 | 4 | 0 | ||
肿瘤是人类死亡的第二大原因, 因此对于肿瘤的研究一直为学者们所热衷. 既往研究多将重点放在抑癌基因及癌基因本身, 对于其调控蛋白及基因的研究很少; 而RASAL1作为新发现的Ras GAPs, 因参与Ras蛋白活化状态的调控而越来越受到关注. 事实上, RASAL1已经通过RNAi筛选被确认为候选抑癌基因[6], RASAL1的编码基因位于第12号染色体(12q24.13)[1,7], 其结构中含有外显子1、2(Exon1, 2), PITX1结合位点, 甲基化位点等结构区. PITX1目前已被证实为抑癌基因, 在多种肿瘤细胞或组织中发现PITX1基因表达下调[1,8]. 已有研究证明, RASAL1作为抑癌基因PITX1基因的转录靶点, 参与了PITX1抑制Ras基因的作用过程[9].
RASAL1具有Ras GAPs家族特征性的结构, 可调控Ras蛋白的活性. Ras蛋白有活化和失活两种状态, 当其与GTP结合(Ras-GTP), 形成活化状态(开), 与GDP结合(Ras-GDP), 即为失活状态(关), 这种"开关"分别由GTP酶活化蛋白(GTPase activating protein, GAP)和鸟苷酸交换因子(guanine nucleotide exchange factor, GEF)两种调节蛋白决定[1]. GEF作用于Ras-GDP将Ras蛋白游离出来, Ras再与GTP结合从而将其激活; 存在于正常细胞中的GAP, 主要作用是激活Ras蛋白的GTP酶, 从而将结合在Ras蛋白上的GTP水解成GDP, 成为失活型的蛋白. 若Ras蛋白持续处于活化状态, 可与下游的效应蛋白结合, 将信号传递到下游信号元件, 可能引起细胞的异常增殖, 导致肿瘤的发生. 目前已有Jin等[1]发现RASAL1在心脏、肾脏、胃肠道等多达23种正常组织中均有表达, 其中以甲状腺及肾上腺髓质表达最多; 同时, RASAL1在头颈部鳞状细胞癌、口腔鳞状细胞癌、膀胱癌、黑色素瘤、肺癌、乳腺癌、结肠癌细胞株中都有明显减少[1-3]. 另外Ohta等[2]发现随着细胞从早期结肠腺瘤到腺癌, RASAL1的表达呈下降趋势. 这一发现可能提示, RASAL1表达下降可能与肿瘤的发生发展有关. 再者, 在野生型K-ras/BRAF结肠癌细胞株, 通过诱导RASAL1的过表达, 可降低表皮生长因子激活的MAPK级联反应中Ras下游的信号传导分子MEK1/2和ERK1/2磷酸化, 即表示RASAL1表达增多可能是通过这一信号途径抑制肿瘤生长[2,3].
目前发现有多种机制参与了RASAL1表达的下调, 包括: (1)启动子的甲基化: Ohta等[2]在对于结直癌的研究中发现RASAL1存在启动子甲基化现象, 尤其是在野生型Ras活性增高的肿瘤细胞中. 通过5-阿扎胞苷的去甲基化作用, RASAL1可恢复表达. 研究认为, RASAL1基因甲基化后基因的功能被静默, 从而使Ras GTP酶活性减弱, 继而Ras-GTP灭活减少, Ras活性上调, 促使肿瘤的发生发展[1-3]; (2)PITX1基因的调控异常: PITX是新近通过RNA干扰文库技术发现的抑癌基因. RASAL1基因是PITX1的转录靶点, 可随着PITX1基因表达下调, 引起RASAL1基因表达的继发下调[9], 继而野生型Ras活性增高, Ras过度表达, 因而导致多种肿瘤的发生发展. 这一机制已在泌尿系及结肠肿瘤细胞株中得到证实[1,10]. 上述两种机制是通过导致RASAL1基因表达下降, 以致Ras GTP酶活性下降, Ras活性状态持续存在, 此为基因水平的调节, 而在蛋白水平, 存在钙偶联震荡调控: 即在RASAL1活化Ras的过程中, 则受到[Ca2+]i(胞内钙离子浓度)的调控. RASAL1是存在于胞质内的游离蛋白, 仅在黏附于质膜时才可发挥GTP的作用. 一般RASAL1并不黏附于质膜. 其分子结构中特征性的串联C2区域与磷脂有较强的亲和力, 但仅此并不足以使RASAL1蛋白黏附于质膜. Simon等研究证实, C2区域与质膜的黏附需通过钙离子诱导. 只有在[Ca2+]i峰值出现后, RASAL1才能与质膜相黏附. 研究也观察到, 使用激动剂使质膜呈多态震荡时, 引起反复发生的胞内钙离子浓度的震荡, 与此同时, 可以检测到RASAL1在向质膜转移的过程. 但RASAL1蛋白通过C2区域连接质膜的过程是短暂的, 此过程的长短受钙震荡频率的影响. 钙震荡的频率越高, RASAL1蛋白的亲和力越好[1,9,11-15]. 正常状态下, RASAL1可通过钙离子介导的这一过程黏附于质膜, 激活Ras GTP酶, 使与Ras结合的GTP转化为GDP, 继而导致Ras失活, 从而抑制肿瘤的发生发展. 而当这一过程受阻时, 则出现Ras的持续活化, 进一步激活下游的信号, 促进细胞增生、分化, 引起肿瘤的发生.
关于结肠腺癌组织中RASAL1的表达情况, 目前国内尚未见报道. 本研究发现, 50例正常组织RASAL1阳性表达率为96%, 此结果与Jin等[1]对于正常组织中RASAL1表达情况的检测结果基本一致. 结肠腺癌中的RASAL1 mRNA、蛋白阳性表达率达分别为50%(10/20)、46%(23/50)明显低于癌旁组织及正常组织, 此趋势与Otha等[2]的研究相同. 在正常组织、癌旁组织中RASAL1蛋白、mRNA的表达呈递减趋势. RASAL1蛋白及mRNA的表达明显正相关, 但前者的阳性率略高于后者, 可能跟检测方法不同、RT-PCR检测敏感性更高有关, 也可能与mRNA翻译成蛋白质的过程中出现信号的缩小及翻译后蛋白质的稳定性有关. 另有文献报道[2,3]: 在结肠癌组织中, RASAL1的过表达能导致野生型K-ras的失活, 即RASAL1的表达只与野生型的Ras相关, 亦仅能抑制野生型Ras的活化, 与突变型的Ras关系不密切, 这可能会导致某些具有突变型K-ras的RASAL1基因, 其RASAL1表达不下调. 而免疫组织化学及RT-PCR均不能检测出K-ras的突变情况, 因而无法得知其与RASAL1的相关性, 在今后的研究中将进一步关注. 本实验研究显示随着患者肿瘤分化程度降低、侵袭深度增加、淋巴结转移增多、TNM分期增大, 肠癌中RASAL1的表达下调更明显(P<0.05), 即RASAL1的表达与患者临床分期、疾病进展呈负相关, 而与患者性别、年龄及肿瘤大小间差异均无显著性, 说明RASAL1在结肠癌的发生发展中起着重要作用, 为结肠癌预后的评估提供了新的思路, 但这与Otha等[2]的报道不完全一致, 可能与取材及病例例数有关.
总之, RASAL1蛋白及 mRNA在结肠癌中的低表达, 可能与调节肿瘤的生长和增殖的细胞信号通路有关, 这方面仍需作进一步的研究, 寄希望RASAL1或能作为结肠癌治疗的新靶点.
我国恶性肿瘤的发病率和死亡率呈明显上升趋势, 已成为城乡居民的首要死因, 而消化系恶性肿瘤发生率最高, 约占所有恶性肿瘤的60%-70%, 近年来我国结肠癌发病趋势明显增高, 关于结肠癌分子水平的变化情况一直是研究的热点. RASAL1是新近发现的一种Ras活性的调节蛋白, 已有报道其可能参与了多种肿瘤的发生, 但RASAL1及其mRNA在结肠癌中的表达情况却鲜有报道.
唐世刚, 教授, 大连大学附属中山医院内科
Ras基因是第一个被鉴定的人类癌基因, 对于Ras基因、蛋白及其参与的信号转导通路的研究一直是分子肿瘤学的研究热点之一.
Ohta等通过对152例不同组织学分期的结直肠肿瘤的分析发现, RASAL1蛋白在腺癌及进展期腺瘤(直径>1 cm)中表达下降, 但在小腺瘤(直径<1 cm)中没有检测到明显下降, 即随着细胞从早期腺瘤到腺癌, RASAL1表达呈下降趋势, 这一发现提示结直肠癌的进展可能与RASAL1的表达下降有关.
本文检测了RASAL1在正常结肠组织、癌旁组织及癌组织中的表达情况, 并分析其与结肠癌临床病理特征的关系, 为癌基因调控蛋白在肠癌发生发展中的作用提供理论依据, 并为结肠癌的诊断及治疗提供了新的思路.
本文设计合理, 结果可靠, 为治疗结肠癌提供一定的实验基础.
编辑: 李薇 电编:何基才
| 1. | Jin H, Wang X, Ying J, Wong AH, Cui Y, Srivastava G, Shen ZY, Li EM, Zhang Q, Jin J. Epigenetic silencing of a Ca(2+)-regulated Ras GTPase-activating protein RASAL defines a new mechanism of Ras activation in human cancers. Proc Natl Acad Sci U S A. 2007;104:12353-12358. [PubMed] [DOI] |
| 2. | Ohta M, Seto M, Ijichi H, Miyabayashi K, Kudo Y, Mohri D, Asaoka Y, Tada M, Tanaka Y, Ikenoue T. Decreased expression of the RAS-GTPase activating protein RASAL1 is associated with colorectal tumor progression. Gastroenterology. 2009;136:206-216. [PubMed] [DOI] |
| 3. | Bernards A, Settleman J. Loss of the Ras regulator RASAL1: another route to Ras activation in colorectal cancer. Gastroenterology. 2009;136:46-48. [PubMed] [DOI] |
| 4. | Fromowitz FB, Viola MV, Chao S, Oravez S, Mishriki Y, Finkel G, Grimson R, Lundy J. ras p21 expression in the progression of breast cancer. Hum Pathol. 1987;18:1268-1275. [PubMed] [DOI] |
| 6. | Westbrook TF, Martin ES, Schlabach MR, Leng Y, Liang AC, Feng B, Zhao JJ, Roberts TM, Mandel G, Hannon GJ. A genetic screen for candidate tumor suppressors identifies REST. Cell. 2005;121:837-848. [PubMed] [DOI] |
| 7. | Allen M, Chu S, Brill S, Stotler C, Buckler A. Restricted tissue expression pattern of a novel human rasGAP-related gene and its murine ortholog. Gene. 1998;218:17-25. [PubMed] [DOI] |
| 8. | Chen Y, Knösel T, Ye F, Pacyna-Gengelbach M, Deutschmann N, Petersen I. Decreased PITX1 homeobox gene expression in human lung cancer. Lung Cancer. 2007;55:287-294. [PubMed] [DOI] |
| 9. | Kolfschoten IG, van Leeuwen B, Berns K, Mullenders J, Beijersbergen RL, Bernards R, Voorhoeve PM, Agami R. A genetic screen identifies PITX1 as a suppressor of RAS activity and tumorigenicity. Cell. 2005;121:849-858. [PubMed] [DOI] |
| 10. | Muallem S. Decoding Ca2+ signals: a question of timing. J Cell Biol. 2005;170:173-175. [PubMed] [DOI] |
| 11. | Tartaglia M, Pennacchio LA, Zhao C, Yadav KK, Fodale V, Sarkozy A, Pandit B, Oishi K, Martinelli S, Schackwitz W. Gain-of-function SOS1 mutations cause a distinctive form of Noonan syndrome. Nat Genet. 2007;39:75-79. [PubMed] [DOI] |
| 12. | Liu Q, Walker SA, Gao D, Taylor JA, Dai YF, Arkell RS, Bootman MD, Roderick HL, Cullen PJ, Lockyer PJ. CAPRI and RASAL impose different modes of information processing on Ras due to contrasting temporal filtering of Ca2+. J Cell Biol. 2005;170:183-190. [PubMed] [DOI] |
| 13. | Walker SA, Kupzig S, Bouyoucef D, Davies LC, Tsuboi T, Bivona TG, Cozier GE, Lockyer PJ, Buckler A, Rutter GA. Identification of a Ras GTPase-activating protein regulated by receptor-mediated Ca2+ oscillations. EMBO J. 2004;23:1749-1760. [PubMed] [DOI] |
| 14. | Kupzig S, Walker SA, Cullen PJ. The frequencies of calcium oscillations are optimized for efficient calcium-mediated activation of Ras and the ERK/MAPK cascade. Proc Natl Acad Sci U S A. 2005;102:7577-7582. [PubMed] [DOI] |