修回日期: 2011-01-10
接受日期: 2011-01-21
在线出版日期: 2011-02-18
目的: 评价实时超声造影技术对VX2兔肝癌影像学模型的诊断价值.
方法: 25只肝脏种植VX2移植瘤的新西兰大白兔于种植后第21天行彩色多普勒超声检查, 并经耳缘静脉团注造影剂SonoVue, 行实时超声造影检查, 观察肿瘤及其周边正常肝组织动态超声增强表现.
结果: 20只(80%)大白兔种植成功. 在二维超声上, 肿瘤为类圆形等回声肿块, 周边可见声晕, 部分中心可见低回声坏死区. 彩色多普勒血流显像(CDFI)能探测到肿瘤周边或内部点、条状血流信号. 注入造影剂后, 动脉相见肿瘤周边血管呈"环状"、"树枝状"渐进性回声增强, 而后门脉相随周边肝实质的强化而回声逐渐减弱, 对比正常肝实质呈低回声, 表现出典型的"快进快出"的强化特点. 超声造影对于d≤3 cm的小肝癌病灶检出率为90.6%, 特异性96.2%, 阳性预测值96.7%, 阴性预测值86.7%, 其中对于d<1 cm的微小肝癌检出率为85.7%.
结论: 实时超声造影技术可提供肿瘤的动态血流信息, 有助于微小病灶的诊断与鉴别诊断.
引文著录: 周悦, 高剑波, 郭华, 万娅敏, 张瑞芳, 潘元威. 实时超声造影技术对VX2兔肝癌影像学模型的诊断价值. 世界华人消化杂志 2011; 19(5): 472-476
Revised: January 10, 2011
Accepted: January 21, 2011
Published online: February 18, 2011
AIM: To assess hepatic VX2 tumors in rabbits by real-time contrast-enhanced ultrasonography.
METHODS: Twenty-five New Zealand white rabbits were used to develop hepatic VX2 tumor-bearing rabbit models. Twenty-one days after hepatic VX2 tumor implantation, the rabbits underwent color Doppler ultrasonography and real-time contrast-enhanced ultrasonography after bolus injection of SonoVue via a peripheral vein. The dynamic features of the tumors and normal liver identified by contrast-enhanced ultrasound were summarized.
RESULTS: Tumor implantation was successful in 20 (80%) rabbits. 2-D ultrasound revealed isoechoic round-shaped lesions with a peripheral halo and low-level echoes implying central necrosis. CDFI could detect spot-like or strip-like blood echoes in the periphery or centre of the lesions. After injection of the contrast agent, the lesions gradually showed round or branched hyperechoic enhancement during the arterial phase, which gradually decreased with the increase in enhancement of liver parenchyma. The sensitivity, specificity, positive predictive value, and negative predictive value of contrast-enhanced ultrasound were 90.6%, 96.2%, 96.7%, and 86.7% for diagnosis of small hepatic tumors whose diameters were less than or equal to 3 cm. The sensitivity of contrast-enhanced ultrasound was 85.7% for diagnosis of minute hepatic tumors whose diameters were less than 1 cm.
CONCLUSION: Real-time contrast-enhanced ultrasonography permits differential diagnosis of small liver tumors by detecting dynamic tumor blood flow.
- Citation: Zhou Y, Gao JB, Guo H, Wan YM, Zhang RF, Pan YW. In vivo assessment of hepatic VX2 tumors in rabbits by real-time contrast-enhanced ultrasonography. Shijie Huaren Xiaohua Zazhi 2011; 19(5): 472-476
- URL: https://www.wjgnet.com/1009-3079/full/v19/i5/472.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i5.472
肝细胞癌是我国原发性肝癌中最常见的一种类型, 其恶性程度高, 预后较差. 临床上, 超声可作为临床筛查和诊断实体占位性病变的常用手段之一. 近年来, 实时超声造影(contrast enhanced ultrasound, CEUS)作为一项新兴技术逐渐被临床推广. 本文通过观察微泡CEUS技术对兔肝癌组织和正常肝组织的增强效应, 了解肿瘤血流灌注情况, 提高微小病灶的诊断.
选取新西兰大白兔25只, 雌雄不限, 体质量2-3 kg, 由河南省医学动物实验中心提供. VX2肝癌荷瘤兔由中国医科大学第一附属医院介入科馈赠.
1.2.1 VX2瘤株制备: 荷瘤兔于接种后约23 d可在腹股沟区皮下扪及一实质性包块. 用10%水合氯醛7-8 mL/kg经耳缘静脉对兔行全麻, 无菌条件下剥离肿块, 寻找生长旺盛的灰白色鱼肉样组织, 置于盛有生理盐水的小烧杯中, 将瘤组织剪成小块备用.
1.2.2 VX2兔肝癌模型的制备: 动物于术前禁食12 h, 不禁水. 全麻后取仰卧位, 四肢固定于兔手术台上, 于剑突下备皮并常规消毒、铺巾. 取剑突下腹部正中切口, 暴露肝脏, 寻找肝左内叶, 在距膈面边缘约2 cm处用无齿镊刺破肝实质形成一小切口, 取约2 mm3的瘤组织块植入该切口中, 随后塞入3 mm3的明胶海绵块, 依次缝合切口. 当日给予庆大霉素4万单位腹腔内注射, 并在术后连续3 d内肌注.
1.2.3 超声检查方案: 种植后第21天对动物进行超声检查. 使用超声造影剂SonoVue(Bracco Italy), 其主要成分为六氟化硫微泡. 造影剂使用前注入生理盐水6 mL, 随即用力振摇成悬浮液. 使用日本ALOKA SSD-α10彩色多普勒超声诊断仪, 随机配套实时造影匹配成像技术软件CnTI(contrast tuned imaging), 探头接收频率为11 MHz, 机械指数为0.05. 检查前需禁食12 h, 仰卧位固定于超声检查床上. 先常规二维超声进行肝脏扫查, 发现肿瘤即记录其部位、大小、形态、CDFI血流情况, 固定探头并同时进入CnTI 状态, 经兔耳缘静脉团注造影剂0.1 mL/kg[1], 注射后立即尾随推注2 mL生理盐水冲洗, 同时实时观察肿瘤的增强效应变化情况, 采集时间2 min, 动态数据自动保存于机器硬盘上.
1.2.4 病理学检查: 实验毕后, 用空气栓塞法处死动物, 切除整个肝脏, 观察肿瘤的大小、数目, 取肿瘤周边、瘤旁肝组织及正常肝组织大体标本, 进行石蜡包裹, HE染色.
统计学处理 数据使用SPSS13.0统计软件进行处理. 计数资料用mean±SD表示. 二分类资料的比较采用χ2检验. 参考值范围为95%可信区间. 规定P<0.05有统计学意义.
25只新西兰大白兔中有20只成功长出肿瘤, 共形成瘤结节59个, 病灶直径约为0.2-4.0 cm, 59个瘤结节中d≤3 cm的小肝癌病灶32个, 其中d<1 cm的微小肝癌7个. 其中1只死于注射空气栓塞, 1只死于麻醉过量, 1只死于感染, 2只肝脏未形成瘤灶. 种植成功25只中, 2只出现腹壁切口转移, 2只出现大网膜转移, 1只出现肺底转移结节, 5只病灶边缘出现"子灶", 4只出现大量腹水.
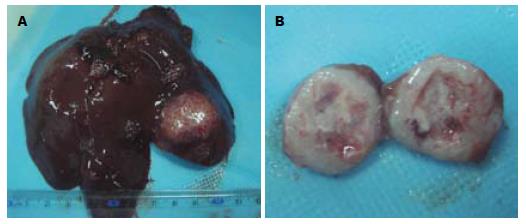
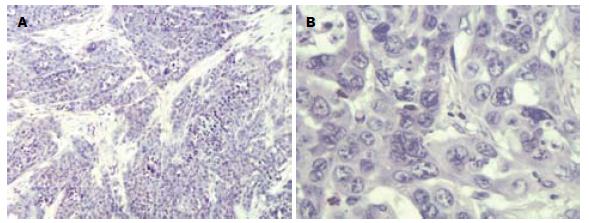
大体见肿瘤呈类圆形, 灰白色, 有完整的包膜, 切面质地较韧, 部分中心可见坏死区. 低倍镜下癌细胞呈巢状分布, 肿瘤间质内血管丰富, 周边见大量纤维组织增生. 高倍镜下肿瘤细胞体积大, 呈圆形或不规则形, 胞质较少, 核大浓染, 有明显的异形性, 核分裂相多见(图1, 2).
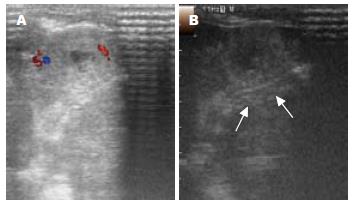
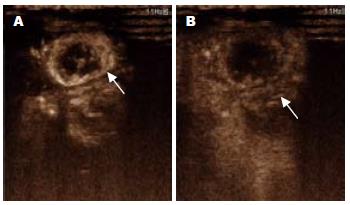
在二维超声上, 表现为类圆形等回声、低回声或略高回声肿块, 以等回声居多, 周边可见声晕, 部分病灶中心可见低回声液化坏死区. 彩色多普勒血流显像(color doppler flow imaging, CDFI)上, 7个瘤结节周边能探测到点、条状的血流信号, 3个瘤结节内部能探测到血流信号, 10个瘤结节周边及内部均能探测到血流信号. 经耳缘静脉注入造影剂后, 约3-5 s后见瘤结节周边动脉相呈"环状"、"树枝状"渐进性回声增强, 门脉相随着周边肝实质的强化而回声逐渐减弱, 对比正常肝实质呈低回声, 表现出典型的"快进快出"的强化特点, 其中动脉期表现为均匀增强20个, 不均匀增强10个(图3, 4).
与病理结果比较, 二维超声共检出瘤结节46个, 大小约1.1-3.3 cm, 检出率为78%(46/59), 检出d≤3 cm的小肝癌病灶27个, 其中2个病灶尸检后发现d>3 cm, 检出d<1 cm的微小肝癌病灶1个. 二维超声对于小肝癌和微小肝癌的检出率分别约为78.1%(25/32)和14.2%(1/7). CEUS共检出病灶54个, 大小约0.9-3.5 cm, 检出率约为91.5%(54/59), 检出d≤3 cm的小肝癌病灶30个, 其中1个病灶尸检后发现d>3 cm, 检出d<1 cm的微小肝癌病灶6个. CEUS对于小肝癌和微小肝癌的检出率分别约为90.6%(29/32)和85.7%(6/7)(表1). 二维超声和CEUS对小肝癌诊断的特异性分别为92.6%和96.2%, 阳性预测值分别为92.6%和96.7%, 阴性预测值分别约为78.1%和89.7%, 符合率分别约为84.7%和89.8%, 约登指数分别约为0.707和0.868. 经McNemar Test检验, 二维超声和CEUS两种方法对于d≤3 cm小肝癌诊断的敏感性有显著性差异(P<0.05), 特异性无统计学意义(P>0.05), 与尸检结果的符合率无统计学意义(P>0.05), 对于d<1 cm的微小肝癌诊断的敏感性有显著性差异(P<0.05). 结果表明, 对于微小病灶的诊断, CEUS明显优于二维超声.
| 肿瘤径线(cm) | 肿瘤数 | 二维超声检出数 | CEUS检出数 |
| d<1 | 7 | 1 | 6 |
| 1≤d≤3 | 25 | 24 | 25 |
实时CEUS技术对于诊断肝脏实性占位性病变具有很高的准确性, 甚至连d<1 cm的病灶也可以检出[2-4], 目前已和增强CT、增强MRI并列成为诊断肝脏局灶性病变的主要影像学手段[5-8]. 造影剂SonoVue是由磷脂外壳包裹的六氟化硫微泡组成, 注射后可在人体组织器官的血管内形成血池, 对肝被膜及脾脏产生增强效应, 分为动脉相, 静脉相及延迟相[9]. CEUS能够通过了解病灶局部血供特点来诊断肝脏占位性病变, 对比剂可以清楚地反映增强后的差异, 从而提供肝脏结节占位性病变的灌注及血流动力学信息和实时血管形态学的变化[10,11].
兔VX2肝癌影像学模型是由Shope病毒在兔皮肤诱发的鳞状细胞癌经72次传代而建立的转移性瘤细胞株[12]. 因其肝动脉供血丰富, 易出现坏死, 表现与人类原发性肝癌类似, 被广泛应用于肝癌动物模型的制作[13]. 在种植后第2-3周左右, 为肿瘤血管形成期. 本研究显示, 种植后第14天, 仅个别病例可在二维超声上发现边缘模糊的等回声小结节, 与邻近正常肝组织难以区分. 种植后第21天, 实验兔出现明显的厌食、精神萎靡、体质量下降等症状, 超声显示肿瘤体积增大, 其原因可能与肿瘤传代次数较多或从液氮取出后复苏时间不易控制导致瘤体活性下降、明胶海绵组织包裹影响其生长有关.
肝癌的CEUS表现具有一定的特征性. 本研究显示, 增强后VX2肝癌病灶边缘表现出典型的"快进快出"的强化特点, 动脉相呈现渐进性回声增强, 静脉相逐渐减弱, 此与国内外报道基本相符[14-18]. CDFI虽然对于肿瘤血管的显示具有一定的敏感性[19], 可是当病灶直径较小时, 血流速度偏低, CDFI难以确切的显示血流信号. 造影后, d≤3 cm小肝癌的检出率约为90.6%, 明显高于造影前78.1%的检出率. Xu等[20]研究指出, 实时CEUS技术可将d<2 cm小肝癌的检出率提高到90%以上, 本实验中, 对于d<1 cm的微小肝癌, CEUS的敏感性远高于二维超声. 小肝癌由于其新生血管细小, 血流速度低, 与周边正常肝组织声阻抗差别不大, 视频密度差异极小, 声晕显示率低, 因而影像对比分辨力弱[21]. 气体微泡可增加声波的反射, 显著增强二维和多普勒超声的信号, 明显提高微小病灶的检出率[22]. 对比增强CT的间歇性扫描方式, CEUS为实时动态成像, 可动态显示造影剂进入肿瘤和正常肝组织至消退的全过程, 动脉相增强较增强CT更敏感[23-25], 可降低小肝癌诊断的假阴性率.
总之, 增强CT虽然是目前诊断肝癌普遍采用的影像学方法, 但其容易对小肝癌发生漏诊[26,27]. CEUS能够显著提高对肝脏局灶性病变的诊断能力[28-30], 为肝癌的诊断提供新的手段. 本实验过程中, 也存在着一些不足之处, 如每次注射微泡后只能对探头扫查切面内病灶进行实时观察, 检查过程中对操作者的技术和经验要求较高, 兔体表被毛和胃肠道内气体干扰、呼吸频率较快以及实验的样本量不足也会对检查和结果造成一定影响, 需在今后的实验和研究中加以改进.
随着声学技术的不断发展, 实时超声造影(CEUS)技术逐渐兴起. 其主要借助于静脉注射造影剂和超声造影谐波成像技术, 显示微细血管和组织血流灌注情况, 目前已能有效地增强心肌、肝、肾、脑等实质性器官的二维CEUS和血流多普勒信号, 反映正常组织和病变组织的血流灌注情况, 有人把他称为继二维超声、多普勒和彩色血流成像之后的第三次革命.
肖恩华, 教授, 中南大学湘雅二医院放射教研室
Xu等研究指出, 实时CEUS技术可将直径<2 cm小肝癌的检出率提高到90%以上.
本实验通过活体种植的方式建立肝癌动物模型, 采用实时超声造影技术检测肿瘤生长情况. 实时超声造影可有效地反映肝癌的血流灌注情况, 有助于微小病灶的诊断与鉴别诊断, 为临床的应用提供了实验依据.
实时超声造影的成像技术较常规超声可更有效地接收造影剂谐波信号, 观察实质组织的微血管结构, 显示动态的病变增强特点, 为微小病灶的诊断提供依据.
本文可读性较好, 有助于微小病灶的诊断与鉴别诊断, 对临床工作和研究有借鉴作用.
编辑: 李薇 电编:何基才
| 2. | Jung EM, Schreyer AG, Schacherer D, Menzel C, Farkas S, Loss M, Feuerbach S, Zorger N, Fellner C. New real-time image fusion technique for characterization of tumor vascularisation and tumor perfusion of liver tumors with contrast-enhanced ultrasound, spiral CT or MRI: first results. Clin Hemorheol Microcirc. 2009;43:57-69. [PubMed] |
| 3. | Weskott HP. Emerging roles for contrast-enhanced ultrasound. Clin Hemorheol Microcirc. 2008;40:51-71. [PubMed] |
| 4. | Mita K, Kim SR, Kudo M, Imoto S, Nakajima T, Ando K, Fukuda K, Matsuoka T, Maekawa Y, Hayashi Y. Diagnostic sensitivity of imaging modalities for hepatocellular carcinoma smaller than 2 cm. World J Gastroenterol. 2010;16:4187-4192. [PubMed] [DOI] |
| 5. | 李 锐, 华 兴, 张 萍, 张 晓航, 郭 燕丽, 丁 俊, 薛 雅芳, 陈 朝辉. 转移性肝癌动脉相增强的实时超声造影与增强螺旋CT比较研究. 中国超声医学杂志. 2007;23:602-604. |
| 6. | Choi BI. Advances of imaging for hepatocellular carcinoma. Oncology. 2010;78 Suppl 1:46-52. [PubMed] [DOI] |
| 7. | Ross CJ, Rennert J, Schacherer D, Girlich C, Hoffstetter P, Heiss P, Jung W, Feuerbach S, Zorger N, Jung EM. Image fusion with volume navigation of contrast enhanced ultrasound (CEUS) with computed tomography (CT) or magnetic resonance imaging (MRI) for post-interventional follow-up after transcatheter arterial chemoembolization (TACE) of hepatocellular carcinomas (HCC): Preliminary results. Clin Hemorheol Microcirc. 2010;46:101-115. [PubMed] |
| 9. | Zuber-Jerger I, Schacherer D, Woenckhaus M, Jung EM, Schölmerich J, Klebl F. Contrast-enhanced ultrasound in diagnosing liver malignancy. Clin Hemorheol Microcirc. 2009;43:109-118. [PubMed] |
| 10. | Kim TK, Jang HJ, Wilson SR. Benign liver masses: imaging with microbubble contrast agents. Ultrasound Q. 2006;22:31-39. [PubMed] |
| 11. | Dai Y, Chen MH, Yin SS, Yan K, Fan ZH, Wu W, Wang YB, Yang W. Focal liver lesions: can SonoVue-enhanced ultrasound be used to differentiate malignant from benign lesions? Invest Radiol. 2007;42:596-603. [PubMed] [DOI] |
| 12. | 闫 庆, 王 朝华, 李 江涛, 谢 晓东. 兔肝VX2肿瘤模型的建立及影像学研究现状. 中国介入影像与治疗学. 2007;4:404-407. |
| 13. | Kuszyk BS, Boitnott JK, Choti MA, Bluemke DA, Sheth S, Magee CA, Horton KM, Eng J, Fishman EK. Local tumor recurrence following hepatic cryoablation: radiologic-histopathologic correlation in a rabbit model. Radiology. 2000;217:477-486. [PubMed] |
| 14. | Jang HJ, Kim TK, Wilson SR. Imaging of malignant liver masses: characterization and detection. Ultrasound Q. 2006;22:19-29. [PubMed] |
| 15. | Watanabe R, Matsumura M, Chen CJ, Kaneda Y, Fujimaki M. Characterization of tumor imaging with microbubble-based ultrasound contrast agent, sonazoid, in rabbit liver. Biol Pharm Bull. 2005;28:972-977. [PubMed] [DOI] |
| 17. | Wilson SR, Burns PN. Liver mass evaluation with ultrasound: the impact of microbubble contrast agents and pulse inversion imaging. Semin Liver Dis. 2001;21:147-159. [PubMed] [DOI] |
| 18. | 徐 金锋, 吴 瑛, 熊 奕, 彭 启慧, 董 发进, 谢 明星. 超声造影对肝脏实质性小病灶的早期诊断价值. 华中科技大学学报(医学版). 2008;37:266-269. |
| 19. | Du WH, Yang WX, Xiong XQ, Wang X, Zhou Y, Wang H. Contrast-enhanced ultrasonographic imaging diagnosis on assessment of vascularity in liver metastatic lesions. World J Gastroenterol. 2005;11:3610-3613. [PubMed] |
| 20. | Xu HX, Xie XY, Lu MD, Liu GJ, Xu ZF, Zheng YL, Liang JY, Chen LD. Contrast-enhanced sonography in the diagnosis of small hepatocellular carcinoma < or =2 cm. J Clin Ultrasound. 2008;36:257-266. [PubMed] [DOI] |
| 23. | Catalano O, Sandomenico F, Nunziata A, Raso MM, Vallone P, Siani A. Transient hepatic echogenicity difference on contrast-enhanced ultrasonography: sonographic sign and pitfall. J Ultrasound Med. 2007;26:337-345. [PubMed] |
| 24. | Krix M, Kiessling F, Essig M, Herth F, Karcher A, Le-Huu M, Kauczor HU, Delorme S. Low mechanical index contrast-enhanced ultrasound better reflects high arterial perfusion of liver metastases than arterial phase computed tomography. Invest Radiol. 2004;39:216-222. [PubMed] [DOI] |
| 25. | Kumada T, Nakano S, Toyoda H, Hayashi K, Kiriyama S, Sone Y, Tanikawa M, Hisanaga Y, Yamamoto A, Takeshima K. Assessment of tumor hemodynamics in small hepatocellular carcinoma: comparison of Doppler ultrasonography, angiography-assisted computed tomography, and pathological findings. Liver Int. 2004;24:425-431. [PubMed] [DOI] |
| 26. | Giorgio A, Ferraioli G, Tarantino L, de Stefano G, Scala V, Scarano F, Coppola C, Del Viscovo L. Contrast-enhanced sonographic appearance of hepatocellular carcinoma in patients with cirrhosis: comparison with contrast-enhanced helical CT appearance. AJR Am J Roentgenol. 2004;183:1319-1326. [PubMed] |
| 27. | Quaia E, D'Onofrio M, Palumbo A, Rossi S, Bruni S, Cova M. Comparison of contrast-enhanced ultrasonography versus baseline ultrasound and contrast-enhanced computed tomography in metastatic disease of the liver: diagnostic performance and confidence. Eur Radiol. 2006;16:1599-1609. [PubMed] [DOI] |
| 29. | Quaia E, Calliada F, Bertolotto M, Rossi S, Garioni L, Rosa L, Pozzi-Mucelli R. Characterization of focal liver lesions with contrast-specific US modes and a sulfur hexafluoride-filled microbubble contrast agent: diagnostic performance and confidence. Radiology. 2004;232:420-430. [PubMed] [DOI] |
| 30. | Li R, Guo Y, Hua X, He Y, Ding J, Guo A, Luo M. Characterization of focal liver lesions: comparison of pulse-inversion harmonic contrast-enhanced sonography with contrast-enhanced CT. J Clin Ultrasound. 2007;35:109-117. [PubMed] [DOI] |