修回日期: 2010-12-10
接受日期: 2010-12-21
在线出版日期: 2011-02-18
目的: 研究新型气体信号分子硫化氢(hydrogen sulfide, H2S)对大鼠肝硬化门脉高压的影响及其调节机制.
方法: 对照组(8只), 肝硬化(Cirrhosis, C)组(8只), C+NaHS(C+S)组(8只), C+左旋硝基精氨酸甲酯(L-NAME)+锌原卟啉(ZnPP)(C+L+Zn)组(8只), C+NaHS+ L-NAME+ZnPP(C+S+L+Zn)组(8只). 插管法测定各组大鼠门静脉压力(PVP), 同时测定血浆中H2S、NO、CO含量; Western blot技术检测各组大鼠肝组织中CSE、iNOS、HO-1蛋白表达情况.
结果: 与对照组相比, 其他各组大鼠PVP显著升高(均P<0.05), 血浆中H2S、NO、CO含量及CSE、iNOS、HO-1蛋白表达差别均有统计学意义(H2S: 134.49 µmol/L±12.25 µmol/L, 151.19 µmol/L±8.75 µmol/L, 160.82 µmol/L±6.79 µmol/L, 170.58 µmol/L±4.38 µmol/L vs 180.33 µmol/L±11.71 µmol/L; NO: 160.12 µmol/L±4.18 µmol/L, 129.25 µmol/L±3.09 µmol/L, 100.24 µmol/L±3.80 µmol/L, 90.23 µmol/L±2.87 µmol/L vs 81.11 µmol/L±2.91 µmol/L; CO: 111.12 µmol/L±2.25 µmol/L, 100.43 µmol/L±1.42 µmol/L, 83.72 µmol/L±1.78 µmol/L, 77.58 µmol/L±8.17 µmol/L vs 70.51 µmol/L±3.09 µmol/L; CSE: 121.72±1.61, 150.26±1.04, 142.79±1.13, 157.28±0.90 vs 159.30±1.37; HO-1: 155.79±1.29, 149.89±1.63, 139.88±1.73, 135.49±1.21 vs 125.44±0.93; iNOS: 165.69±1.17, 160.68±1.28, 150.66±1.42, 145.55±1.04 vs 135.22±0.54, 均P<0.05).
结论: 内源性H2S/CSE体系在缓解肝硬化门脉高压中发挥着重要的调节作用, 其机制可能与NO/NOS、CO/HO-1体系的改变有关.
引文著录: 陈卫刚, 郑勇, 宋丽秀, 刘维国, 李文娟, 刘清华, 张宁, 齐翠花. 内源性H2S对大鼠实验性肝硬化门脉高压的影响. 世界华人消化杂志 2011; 19(5): 467-471
Revised: December 10, 2010
Accepted: December 21, 2010
Published online: February 18, 2011
AIM: To investigate the effect of endogenous hydrogen sulfide (H2S) on portal vein pressure in rats with experimental hepatic cirrhosis-induced portal hypertension and to explore mechanisms involved.
METHODS: Forty Sprague-Dawley rats were randomly and equally divided into control group, cirrhosis group, sodium hydrogen sulfide (NaHS) group, L-arginine methyl ester (L-NAME) plus zinc protoporphyrin (ZnPP) group, and NaHS plus L-NAME plus ZnPP group. After treatment, portal vein pressure and the levels of H2S, NO, and CO in portal vein blood were measured, and the expression of cystathionine-γ-lyase (CSE), nitric oxide synthase (NOS), and heme oxygenase (HO-l) in liver tissue was determined by Western blot.
RESULTS: Compared with the control group, portal pressure was significantly elevated (all P < 0.05) and the levels of plasma H2S, NO, CO and hepatic CSE, iNOS, and HO-1 showed statistically significant differences in the other groups (H2S: 134.49 µmol/L ± 12.25 µmol/L, 151.19 µmol/L ± 8.75 µmol/L, 160.82 µmol/L ± 6.79 µmol/L, 170.58 µmol/L ± 4.38 µmol/L vs 180.33 µmol/L ± 11.71 µmol/L; NO: 160.12 µmol/L ± 4.18 µmol/L, 129.25 µmol/L ± 3.09 µmol/L, 100.24 µmol/L ± 3.80 µmol/L, 90.23 µmol/L ± 2.87 µmol/L vs 81.11 µmol/L ± 2.91 µmol/L; CO: 111.12 µmol/L ± 2.25 µmol/L, 100.43 µmol/L ± 1.42 µmol/L, 83.72 µmol/L ± 1.78 µmol/L, 77.58 µmol/L ± 8.17 µmol/L vs 70.51 µmol/L ± 3.09 µmol/L; CSE: 121.72 ± 1.61, 150.26 ± 1.04, 142.79 ± 1.13, 157.28 ± 0.90 vs 159.30 ± 1.37; HO-1: 155.79 ± 1.29, 149.89 ± 1.63, 139.88 ± 1.73, 135.49 ± 1.21 vs 125.44 ± 0.93; iNOS: 165.69 ± 1.17, 160.68 ± 1.28, 150.66 ± 1.42, 145.55 ± 1.04 vs 135.22 ± 0.54, all P < 0.05).
CONCLUSION: Endogenous H2S/CSE can regulate portal hypertension in rats with experimental hepatic cirrhosis perhaps via mechanisms associated with the changes in the NO/NOS and CO/HO-1 pathways.
- Citation: Chen WG, Zheng Y, Song LX, Liu WG, Li WJ, Liu QH, Zhang N, Qi CH. Endogenous hydrogen sulfide attenuates portal hypertension in rats with experimental hepatic cirrhosis. Shijie Huaren Xiaohua Zazhi 2011; 19(5): 467-471
- URL: https://www.wjgnet.com/1009-3079/full/v19/i5/467.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i5.467
门脉高压症是肝硬化失代偿期出现的一种严重的并发症. 其严重程度直接影响着患者的生命. 因此, 对其发病机制的探讨具有重要意义. 肝硬化发生时, 肝组织结构、肝脏血管床改建是门静脉高压形成的病理基础; 而维持和加重门静脉高压的主要原因是内脏高动力循环状态, 其发病机制目前尚不清楚. 以往研究发现, NO和CO可以引起内脏血管扩张而使门静脉系统血流量增加. H2S是近年新发现的一种气体信号分子, 在体内发挥着与NO、CO相似而又不同的生物学作用[1,2]. H2S/CSE体系参与门静脉高压的发病过程已被证实[3]. 本课题组前期研究也发现H2S体系在肝硬化发生发展中起着保持血管舒张状态的重要作用[4], 研究还发现, 当肝硬化大鼠模型接受外源性H2S供体-NaHS后, 门静脉高压状态得到缓解. 那么, 内源性H2S对肝硬化门脉高压到底发挥着什么作用?作用过程中是否有其他气体信号分子参与?目前尚不清楚.
本研究将NO合酶抑制剂-左旋硝基精氨酸甲酯(L-nitro arginine methyl ester, L-NAME)和CO合酶抑制剂-锌原卟啉(zinc protoporphyrin, ZnPP)同时应用于肝硬化门脉高压大鼠模型, 在阻断内源性NO、CO表达的基础上, 改变体内H2S的浓度, 观察其对门静脉压力的影响, 进一步探讨其作用机制.
硫氢化钠、炔丙基甘氨酸、锌原卟啉购于Sigma公司; iNOS、HO-1、CSE多克隆抗体购自Santa Cruz公司; NO测定试剂盒购自南京建成生物工程研究院; NaHS、左旋硝基精氨酸甲酯、锌原卟啉均购自Sigma公司. 其他试剂均为市售化学纯. 上海雷磁厂PXS-270离子计及敏感硫电极(Pag/S1)、T1800紫外分光光度计、美国BIOPAC公司MP150型多导生理仪、凝胶图像系统(BIO-RAD Gel 2000)等.
1.2.1 造模及分组: ♀SD大鼠40只(购于新疆医科大学实验动物中心, SPF级), 体质量在200 g左右, 随机分为5组: (1)正常对照组(n = 8); (2)肝硬化(cirrhosis C)组(n = 8); (3)肝硬化+NaHS(C+S)组(n = 8); (4)肝硬化+L-NAME+锌原卟啉(ZnPP)(C+L+Zn)组(n = 8); (5)肝硬化+NaHS+L-NAME+ZnPP(C+S+L+Zn)组(n = 8). 除对照组以外, 其余各组采用CCl4复合因素法复制肝硬化大鼠模型. 造模结束后, C+S组给予NaHS: 56 μmol/(kg•d)腹腔注射, C+L+Zn组给予L-NAME: 5 mg/(kg•d)腔注射及ZnPP: 20 μmol/(kg•d)颈部皮下注射[5]; C+S+L+Zn组给予NaHS: 56 μmol/(kg•d)和L-NAME: 5 mg/(kg•d)腹腔注射[6], ZnPP: 20 μmol/(kg•d)颈部皮下注射. 肝硬化组和对照组腹腔注射等量的生理盐水并常规喂养. 干预1 wk后经门静脉穿刺测量门静脉压力, 留取门静脉血浆及肝组织标本并处死大鼠.
1.2.2 门静脉压力测量: 用10%的水合氯醛腹腔麻醉大鼠(0.35 mL/100 g), 门静脉插管法测定门静脉压力(本课题组改良此方法, 利用头皮针法穿刺测定). 门静脉压力>12 mmHg为肝硬化门脉高压形成.
1.2.3 门静脉血浆H2S含量测定: 用敏感硫电极法[7]测定门静脉血浆中H2S含量.
1.2.4 门静脉血浆NO含量测定: 应用南京建成生物工程研究所提供的试剂盒(硝酸还原酶法), 按说明严格操作, 复管, 在DU-721型紫外分光光度计上读取A值. 应用公式计算结果: NO(μmol/L) = (样品管吸光度-空白管吸光度)×标准品浓度×样品测试前稀释倍数/(标准管吸光度-空白管吸光度).
1.2.5 门静脉血浆CO含量测定: 采用Chalmers[8]的方法, 取0.2 mL血浆加入1 mL新鲜的血红蛋白溶液, 然后在加入200 mg连二亚硫酸钠, 振荡混匀后静置10 min, 在DU-721型紫外分光光度计上分别测定在541 nm和555 nm处的A值, 计算其比值(R). 然后根据标准曲线得出一氧化碳血红蛋白(HbCO)的百分比. 然后应用Chalmers公式计算血浆CO含量. 其公式为: CO(μmol/L) = HbCO(%)×Hb(mg/L)×4 000/(100×0.2×64 456).
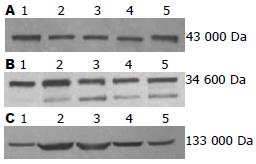
1.2.6 肝组织iNOS蛋白含量测定: 用Western blot检测各组大鼠肝组织中iNOS蛋白含量. 取各组大鼠相同部位肝组织, 根据组织大小加入约5倍体积蛋白裂解缓冲液在冰上将组织研磨成匀浆, 经4 ℃ 12 000 r/min离心10 min后, 取上清液用考马斯亮蓝法测定蛋白浓度. 以30 μg/孔上样, 在10%十二烷基酸钠聚丙烯酰胺凝胶(SDS-PAGE)中进行电泳分离, 半干转膜法将蛋白质从SDS-PAGE凝胶中转移至PVDF膜, 在含5%脱脂奶粉的TBST液中封闭1 h, 加入一抗(兔抗大鼠iNOS抗体, 1:500稀释, Santa Cruz)、二抗(辣根标记山羊抗兔IgG, 1:10 000稀释, 北京中杉金桥), TBST漂洗后ECL化学发光, X线胶片曝光. 用GEL DOC-2000凝胶成像系统对曝光后条带的灰度值进行分析. 用β-actin校正加样量.
1.2.7 肝组织HO-1蛋白含量测定: 用Western blot检测各组大鼠肝组织中HO-1蛋白含量, 具体步骤同上, 一抗(山羊抗大鼠HO-1抗体, 1:500稀释, Santa Cruz)、二抗(辣根标记兔抗山羊IgG, 1:10 000稀释, 北京中杉金桥).
1.2.8 肝组织CSE蛋白含量测定: 用Western blot检测各组大鼠肝组织中CSE蛋白含量, 具体步骤同上, 一抗(兔抗大鼠CSE抗体, 1:500稀释, Santa Cruz)、二抗(辣根标记山羊抗兔IgG, 1: 10 000稀释, 北京中杉金桥).
统计学处理 数据均以mean±SD表示, 应用SPSS16.0统计软件进行方差齐性检验, 组间比较采用单因素方差分析(one-way ANOVA); 以α = 0.05为检验水准.
与对照组相比, 各模型组PVP均升高(P<0.05), 以肝硬化组压力最高; 与肝硬化组相比, C+S组、C+L+Zn组、C+S+L+Zn组压力分别降低13.25%、12.13%、23.26%(P<0.05); 与C+S组或C+L+Zn组相比, C+S+L+Zn组压力进一步降低(P<0.05); C+S组和C+L+Zn组之间差异无统计学意义(表1).
与对照组相比, C组、C+S组、C+L+Zn组H2S含量均降低(P<0.05); C+S+L+Zn组与对照组之间差异无统计学意义; 与肝硬化组相比, C+S组、C+L+Zn组、C+S+L+Zn组H2S含量均升高(P<0.05); 与C+S组相比, C+S+L+Zn组H2S含量进一步升高(P<0.05); C+S组和C+L+Zn组、C+L+Zn组和C+S+L+Zn组比较差异无统计学意义(表1).
与对照组相比, 各模型组NO含量均升高(P<0.05), 以肝硬化组含量最高; C+S组较肝硬化组降低(P<0.05); C+L+Zn组较C+S组降低(P<0.05); C+S+L+Zn组较C+L+Zn组进一步降低(P<0.05, 表2).
与对照组相比, 各模型组CO含量均升高(P<0.05), 以肝硬化组含量最高; C+S组较肝硬化组降低(P<0.05); C+L+Zn组较C+S组降低(P<0.05); C+S+L+Zn组较C+L+Zn组进一步降低(P<0.05, 表2).
与对照组相比, 各模型组CSE蛋白含量均降低(P<0.05); 以肝硬化组含量最低; 与肝硬化组相比, C+S组、C+L+Zn组和C+S+L+Zn组CSE含量均升高(P<0.05); 与C+S组相比, C+L+Zn组CSE含量降低(P<0.05), C+S+L+Zn组CSE含量升高(P<0.05, 图1, 表3).
肝硬化门脉高压症主要是由于肝硬变时门静脉系统血流机械性受阻和血管活性物质代谢紊乱引起内脏高动力循环所导致. 而有关内脏高动力循环的发病机制至今尚未完全清楚. 内源性气体信号分子NO和CO的发现使得门静脉高压的发病机制研究进入了一个全新的领域. 国内外研究显示: NO和CO是近年发现的两种具有扩血管作用的气体信使分子, 对肝脏的血液循环有着重要的调节作用. 本课题组前期研究也证实内源性NOS-NO系统、HO-CO系统在肝脏的血液动力学及门静脉高压的发生、发展中起重要作用[9-11]. 有研究提出H2S是继NO和CO之后发现的心血管功能调节的新型气体信号分子[12], 具有扩张血管[13-15]、抑制平滑肌细胞增殖和诱导平滑肌细胞凋亡的作用[16]. 在哺乳动物体内, H2S通过5'磷酸吡哆醛依赖酶包括胱硫醚-β-合成酶(cystathionine-β-synzyme, CBS)和胱硫醚-γ-裂解酶(cystathionine-γ-splitting enzyme, CSE)催化半胱氨酸分解代谢而产生[17], 前者主要存在于神经系统, 而后者在主动脉、肺动脉、肠系膜动脉、尾动脉和门静脉有表达, 在肝脏中也有表达. 研究发现, H2S在高血压、低氧性肺动脉高压发病中发挥调节作用. 国内近期研究发现H2S参与了门静脉高压的形成与发展, 外源性给予NaSH可以加重门静脉高压, 其作用机制可能与H2S影响了NO/NOS2体系变化有关[3]. 本课题组前期研究发现: 随肝硬化病情进展, 下腔静脉血及门静脉血H2S的表达逐渐下降[4], 进一步研究发现外源性给予H2S供体-NaHS后, H2S/CSE体系上调, 门静脉压力降低. 表明内源性H2S/CSE在肝硬化门脉高压中确实发挥重要的调节作用? 但其机制目前尚不清楚.
本实验中发现在大鼠肝硬化模型中PVP升高, 同时NO/NOS、CO/HO-1体系上调, 而H2S/CSE下调, 与本课题组前期研究结果一致; 当外源性给予H2S供体-NaHS后, 体内CSE蛋白表达及H2S含量增高, PVP降低, NO/NOS、CO/HO-1体系均不同程度的下调, 表明H2S可能具有改善肝硬化门脉高压的作用, 其机制可能是内源性H2S/CSE体系通过影响NO/NOS、CO/HO-1体系的变化或直接舒张门脉系统血管而发挥作用. 为了更深入地研究H2S在肝硬化门脉高压中的作用机制, 本实验中同时采用NOS抑制剂L-NAME和HO-1抑制剂ZnPP, 以阻断肝硬化大鼠模型中内源性NO、CO表达, 尽量排除NOS-NO、HO-CO系统的干扰, 在此基础上增加H2S含量, 观察PVP变化. 实验发现: C+L+Zn组较肝硬化组门静脉血浆NO、CO含量降低, 肝组织NOS、HO-1蛋白表达减少, 表明干预成功, 而CSE蛋白表达增高, H2S含量升高, 同时门静脉压力降低, 表明内源性NO、CO被抑制, 机体内H2S/CSE体系和PVP同时都受到影响, PVP降低的原因可能是由于NO/NOS、CO/HO-1体系被抑制后直接降低机体内NO、CO水平或反馈性升高H2S含量所导致的; 进一步研究发现, 在C+L+Zn组基础上给予H2S供体后, 机体内H2S及CSE蛋白含量较前升高, 门静脉血浆NO、CO含量、肝组织NOS、HO-1蛋白表达较前减少, 而PVP进一步降低, 结果再次表明内源性H2S/CSE对肝硬化门脉高压及内源性NO/NOS、CO/HO-1体系变化具有重要的调节作用.
国内有学者对H2S在自发性高血压大鼠主动脉结构重建作用进行研究, 结果显示: H2S不仅具有显著的扩血管效应, 还能抑制体外培养的主动脉平滑肌细胞增殖, CSE-H2S体系下调是自发性高血压血管结构重建的重要原因之一[18]. 国外研究显示: 生理状态下H2S通过ATP敏感的K+通道途径作用于血管平滑肌; 在心血管系统中, H2S可能通过抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)的活性来抑制血管平滑肌细胞(vascular smooth muscle cell, VSMC)的增殖, 从分子水平上直接调节VSMC的张力[15]. 有学者证实实验性肝硬化时可见门静脉管壁增厚, 平滑肌细胞的数目及收缩力增加. 那么, 内源性H2S是否具有通过调节肝硬化门静脉血管结构重建而影响肝硬化门脉高压的作用呢? 需进一步研究证实.
总之, 本研究结果提示: (1)内源性H2S/CSE体系和NO/NOS、CO/HO-1体系三者之间可能存在相互影响; (2)内源性H2S/CSE体系对肝硬化门脉高压的调节作用可能与NO/NOS、CO/HO-1体系的改变有关.
NO、CO和H2S是近年新发现的一种气体信号分子, 在体内发挥着生物学作用, 三者参与门静脉高压的发病过程已被证实, 但具体机制尚不明确.
施晓雷, 副主任医师, 南京大学医学院附属鼓楼医院肝胆外科
国内近期研究发现H2S参与了门静脉高压的形成与发展, 外源性给予NaSH可以加重门静脉高压, 其作用机制可能与H2S影响了NO/NOS2体系变化有关.
外源性给予NO、CO抑制剂后, 改变硫化氢含量观察门静脉压力变化及NO、CO含量变化, 目前在肝硬化门静脉高压研究中相关报道甚少.
内源性H2S/CSE体系在缓解肝硬化门脉高压中发挥着重要的调节作用, 其机制可能与NO/NOS、CO/HO-1体系的改变有关.
本文学术性较好, 对进一步探讨门静脉高压的机制有一定作用.
编辑: 李薇 电编:李薇
| 1. | Chunyu Z, Junbao D, Dingfang B, Hui Y, Xiuying T, Chaoshu T. The regulatory effect of hydrogen sulfide on hypoxic pulmonary hypertension in rats. Biochem Biophys Res Commun. 2003;302:810-816. [PubMed] [DOI] |
| 2. | Qi J, Du J, Wang L, Zhao B, Tang C. Alleviation of hypoxic pulmonary vascular structural remodeling by L-arginine. Chin Med J (Engl). 2001;114:933-936. [PubMed] |
| 3. | 何 春萍, 田 德安, 王 波, 刘 梅, 但 自力, 罗 敏, 梅 凡, 徐 湖波, 梁 扩寰. 硫化氢供体对实验性门静脉高压及内源性一氧化氮/一氧化氮合酶体系的影响. 胃肠病学和肝病学杂志. 2007;16:572-575. |
| 4. | 张 宁, 郑 勇, 王 于理, 李 睿, 孙 侃, 常 向云, 陈 卫刚, 赵 瑾, 李 洪安. 内源性硫化氢在不同时期大鼠肝硬化中的作用. 世界华人消化杂志. 2009;17:307-311. [DOI] |
| 5. | Fernandez M, Bonkovsky HL. Increased heme oxygenase-1 gene expression in liver cells and splanchnic organs from portal hypertensive rats. Hepatology. 1999;29:1672-1679. [PubMed] [DOI] |
| 6. | Rees DD, Palmer RM, Schulz R, Hodson HF, Moncada S. Characterization of three inhibitors of endothelial nitric oxide synthase in vitro and in vivo. Br J Pharmacol. 1990;101:746-752. [PubMed] |
| 7. | 耿 彬, 杜 军保, 唐 朝枢. 敏感硫电极法在测定心血管组织细胞及血浆胱硫醚-γ-裂解酶/硫化氢的应用. 北京大学学报(医学版). 2005;5:545. |
| 8. | Chalmers AH. Simple, sensitive measurement of carbon monoxide in plasma. Clin Chem. 1991;37:1442-1445. [PubMed] |
| 10. | 郑 勇, 孙 侃, 周 婷, 陈 卫刚, 常 向云, 陈 辉, 王 吉耀. HO-1、HO-1mRNA在肝硬化病人肝组织中的表达及与门静脉压力的关系. 复旦学报(医学版). 2004;31:481-483. |
| 12. | 杜 军保, 陈 晓波, 耿 彬, 蒋 宏峰, 唐 朝枢. 硫化氢作为心血管信号分子的研究. 北京大学学报(医学版). 2002;34:187. |
| 13. | Hosoki R, Matsuki N, Kimura H. The possible role of hydrogen sulfide as an endogenous smooth muscle relaxant in synergy with nitric oxide. Biochem Biophys Res Commun. 1997;237:527-531. [PubMed] [DOI] |
| 14. | Zhao W, Zhang J, Lu Y, Wang R. The vasorelaxant effect of H(2)S as a novel endogenous gaseous K(ATP) channel opener. EMBO J. 2001;20:6008-6016. [PubMed] [DOI] |
| 15. | Du J, Hui Y, Cheung Y, Bin G, Jiang H, Chen X, Tang C. The possible role of hydrogen sulfide as a smooth muscle cell proliferation inhibitor in rat cultured cells. Heart Vessels. 2004;19:75-80. [PubMed] [DOI] |
| 16. | 陈 晓波, 杜 军保, 张 春雨, 唐 朝枢, 周 伟仅. 新型气体信号分子硫化氢对低氧大鼠肺动脉平滑肌细胞凋亡的影响. 北京大学学报(医学版). 2004;36:341-344. |
| 17. | Griffith OW. Mammalian sulfur amino acid metabolism: an overview. Methods Enzymol. 1987;143:366-376. [PubMed] [DOI] |
| 18. | Yan H, Du J, Tang C. The possible role of hydrogen sulfide on the pathogenesis of spontaneous hypertension in rats. Biochem Biophys Res Commun. 2004;313:22-27. [PubMed] [DOI] |