修回日期: 2011-01-11
接受日期: 2011-01-21
在线出版日期: 2011-02-08
目的: 探讨胃癌中P53和Ki67蛋白表达与临床病理参数的相关性及其临床意义.
方法: 收集在中国人民解放军南京军区福州总医院手术切除的胃癌组织标本1 107例, 采用EliVisionTM plus免疫组织化学染色方法检测其中临床资料完整的775例胃腺癌标本中Ki67和P53蛋白表达.
结果: 在775例胃腺癌组织标本中, P53和Ki67蛋白的阳性表达率分别为46.84%和78.97%, 在非肿瘤性胃黏膜中均未见其阳性表达; P53和Ki67蛋白表达, 在肠型胃癌中显著高于弥漫型胃癌(54.7% vs 38.0%; 86.0% vs 70.0%, 均P<0.05), 高中分化胃癌显著高于低分化胃癌(54.7% vs 35.4%; 87.0% vs 67.2%, 均P<0.05); P53蛋白表达在胃食管连接部胃癌和无远处转移的胃癌中显著高于胃部胃癌和有远处转移的胃癌(53.7% vs 41.9%; 49.0% vs 30.3%, 均P<0.05); Ki67蛋白表达随着浸润深度的增加而增高(80.3% vs 60.4%, P<0.05), 有淋巴结转移的患者显著高于无淋巴结转移的患者(81.4% vs 72.6%, P<0.05).
结论: 联合检测P53和Ki67蛋白表达有助于阐释胃癌发生发展、浸润转移的机制, 并可作为评估胃癌恶性生物学行为及预后的参考指标.
引文著录: 刘伟, 余英豪, 欧阳学农, 王烈, 武一曼, 陈娟, 熊喜生. P53和Ki67在胃癌中的表达及其临床意义. 世界华人消化杂志 2011; 19(4): 367-373
Revised: January 11, 2011
Accepted: January 21, 2011
Published online: February 8, 2011
AIM: To investigate the correlation of P53 and Ki67 protein expression with the clinicopathological parameters in gastric cancer.
METHODS: A total of 1 107 surgical specimens of gastric cancer were collected from the Fuzhou General Hospital of Nanjing Military Command, The expression of P53 and Ki67 was examined by immunohistochemistry in 775 gastric cancer specimens taken from patients with complete clinical data.
RESULTS: The positive rates of P53 and Ki67 protein expression were 46.84% and 78.97%, respectively. Higher positive rates of P53 and Ki67 protein expression were noted in intestinal-type gastric cancer than in diffuse-type gastric cancer (54.7% vs 38.0%, 86.0% vs 70.0%, both P < 0.05) and in well-differentiated cancer than in poorly-differentiated cancer (54.7 vs 35.4%, 87.0% vs 67.2%, both P < 0.05). A higher positive rate of P53 protein expression was noted in gastroesophageal junction (GEJ) cancer than in gastric cancer (53.7% vs 41.9%, P < 0.05) and in cancer without distant metastasis than in that with distant metastasis (49.0% vs 30.3%, P < 0.05). A higher positive rate of Ki67 protein expression was noted in invasive cancer than in less invasive cancer ( 80.3% vs 60.4%, P < 0.05) and in cancer with lymph node metastasis than in that without lymph node metastasis (81.4% vs 72.6 %, P < 0.05).
CONCLUSION: P53 and Ki67 protein expression might be associated with the development, invasion, and metastasis of gastric cancer, and can be used to evaluate the malignant behavior and prognosis of gastric cancer.
- Citation: Liu W, Yu YH, Ouyang XN, Wang L, Wu YM, Chen J, Xiong XS. Clinical significance of P53 and Ki67 expression in gastric cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(4): 367-373
- URL: https://www.wjgnet.com/1009-3079/full/v19/i4/367.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i4.367
胃癌居消化系肿瘤之首[1], 其发生、发展机制颇为复杂, 涉及一系列遗传学改变, 包括癌基因的激活和抑癌基因的失活, 其中P53基因是至今为止发现的与人类肿瘤关系最为密切的抑癌基因, 其缺失或突变, 可导致细胞向恶性转化[2], Ki67是反映细胞增殖活性的重要指标, 两者在肿瘤的发生、发展过程中有重要意义. 本研究采用大宗病例研究, 应用免疫组织化学方法检测775例胃癌组织中Ki67和P53蛋白表达, 分析二者的关系及其与胃癌生物学行为和预后的相关性.
收集2006-01/2009-08在中国人民解放军南京军区福州总医院手术切除的胃癌组织标本1 107例, 选择资料完整的胃腺癌病例775例进行研究, 手术标本经40 g/L中性甲醛固定, 石蜡包埋, 3 μm厚连续切片, 分别进行HE和免疫组织化学染色; 所有病例术前均未行放化疗. 患者中男576例, 女199例, 年龄27-85(平均58.2)岁. 胃癌TNM分期采用AJCC标准(2002). 组织分型采用Lauren分型, 分为肠型、弥漫型、混合型. 另外, 在775例胃腺癌病例中随机抽取100例癌旁(距癌灶距离>5 cm)非肿瘤性胃黏膜作为对照. 试剂均购自福州迈新生物技术开发公司, 一抗P53和Ki67均为鼠抗人单克隆抗体. 试剂盒选用EliVisionTM plus试剂盒. 石蜡切片机(LEICA RM2245); 显微镜(OLYMPUS BX51); 电热恒温干燥箱(上海-恒科技有限公司). 所有标记均设阳性对照并用PBS缓冲液代替一抗做阴性对照.
1.2.1 EliVisionTM plus免疫组化染色: 石蜡切片脱蜡、水化, PBS冲洗3×3 min; 高温高压抗原修复; 加3%过氧化氢溶液, 室温下孵育10 min, 以阻断内源性过氧化物酶; PBS冲洗3×3 min; 加第一抗体, 室温下孵育60 min; PBS冲洗3×5 min; 加聚合物增强剂(试剂A), 室温下孵育20 min; PBS冲洗3×3 min; 加酶标抗鼠聚合物(试剂B), 室温下孵育30 min; PBS冲洗3×3 min; 加新配制的DAB显色液, 显微镜下观察, 阳性显色为棕黄色; 自来水冲洗, 苏木素复染, 0.1%盐酸分化, 自来水冲洗, PBS冲洗返蓝; 梯度酒精脱水干燥, 中性树脂封片.
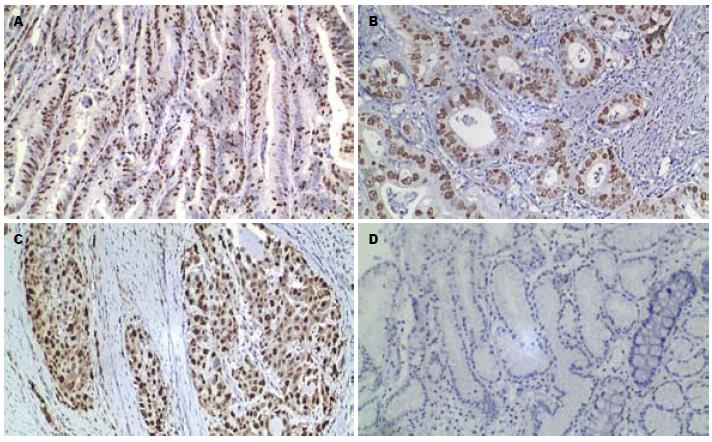
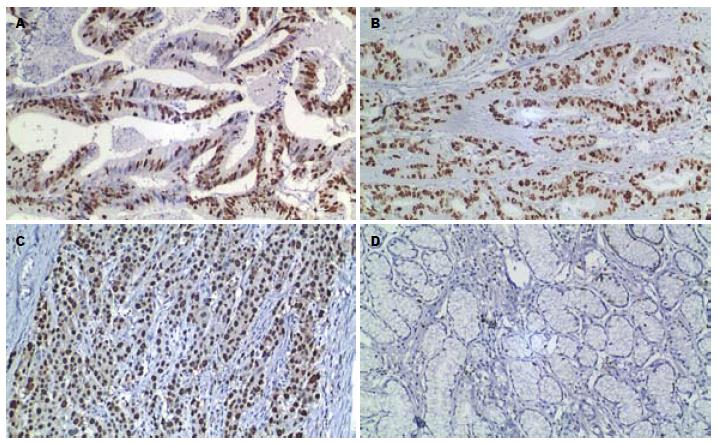
1.2.2 Ki67和P53蛋白过表达的判定标准: P53和Ki67阳性染色呈棕黄色颗粒, 均定位于细胞核. P53和Ki67均以肿瘤细胞不着色/<10%的肿瘤细胞着色为阴性(-), ≥10%的肿瘤细胞着色为阳性[3,4], 并根据肿瘤阳性细胞数所占比例分为: 10%-25%(+), 26%-50 %(++), 51%-75%(+++), >75%(++++).
统计学处理 采用SPSS16.0软件进行χ2检验分析.
P53、Ki67阳性染色呈棕黄色颗粒, 定位于细胞核(图1, 2). 其表达呈明显的异质性. 但癌旁非肿瘤性胃黏膜未见P53和Ki67的过表达(即肿瘤阳性细胞数所占比例均<10%).
775例胃癌组织中P53阳性表达363例, 表达率为46.84%; Ki67阳性表达612例, 表达率为78.97%. P53蛋白过表达与患者性别、年龄、浸润深度、TNM分期、淋巴结转移无相关性(均P>0.05); 而与肿瘤部位、Lauren分型、分化程度及远处转移相关(均P<0.05, 表1). Ki67蛋白过表达与患者性别、年龄、肿瘤部位、TNM分期、远处转移无相关性(均P>0.05); 而与Lauren分型、分化程度、浸润深度及淋巴结转移相关(均P<0.05, 表2).
| 临床病理参数 | n | - | + | ++ | +++ | ++++ | 阳性率n(%) | P值 |
| 性别 | ||||||||
| 男 | 576 | 297 | 34 | 57 | 52 | 136 | 279(48.4) | >0.05 |
| 女 | 199 | 115 | 8 | 17 | 18 | 41 | 84(42.2) | |
| 年龄(岁) | ||||||||
| <60 | 363 | 203 | 21 | 34 | 36 | 69 | 160(44.1) | >0.05 |
| ≥60 | 412 | 209 | 13 | 32 | 44 | 114 | 203(49.3) | |
| 肿瘤部位 | ||||||||
| 胃食管连接部1 | 324 | 150 | 14 | 38 | 34 | 88 | 174(53.7) | <0.05 |
| 胃部 | 451 | 262 | 25 | 37 | 37 | 90 | 189(41.9) | |
| Lauren分型 | ||||||||
| 肠型 | 285 | 129 | 13 | 6 | 21 | 116 | 156(54.7) | <0.05 |
| 弥漫型 | 313 | 194 | 14 | 34 | 30 | 41 | 119(38.0) | |
| 混合型 | 177 | 89 | 13 | 17 | 16 | 42 | 88(49.7) | |
| 分化程度 | ||||||||
| 高、中分化 | 461 | 209 | 28 | 20 | 41 | 163 | 252(54.7) | <0.05 |
| 低、未分化 | 314 | 203 | 12 | 30 | 29 | 40 | 111(35.4) | |
| TNM分期 | ||||||||
| 0+Ⅰ+Ⅱ | 351 | 187 | 26 | 30 | 32 | 76 | 164(46.7) | >0.05 |
| Ⅲ、Ⅳ | 424 | 225 | 18 | 43 | 39 | 99 | 199(46.9) | |
| 浸润深度 | ||||||||
| Tis+T1 | 53 | 31 | 2 | 7 | 6 | 7 | 22(41.5) | >0.05 |
| T2-T4 | 722 | 381 | 38 | 66 | 65 | 172 | 341(47.2) | |
| 淋巴结转移 | ||||||||
| N0 | 215 | 110 | 21 | 17 | 19 | 48 | 105(48.8) | >0.05 |
| N1 | 322 | 169 | 22 | 36 | 36 | 59 | 153(47.5) | |
| N2 | 168 | 91 | 12 | 14 | 12 | 39 | 77(45.8) | |
| N3 | 70 | 42 | 2 | 5 | 7 | 14 | 28(40.0) | |
| 远处转移 | ||||||||
| 有 | 89 | 62 | 2 | 9 | 2 | 14 | 27(30.3) | <0.05 |
| 无 | 686 | 350 | 47 | 65 | 65 | 159 | 336(49.0) |
| 临床病理参数 | n | - | + | ++ | +++ | ++++ | 阳性率n(%) | P值 |
| 性别 | ||||||||
| 男 | 576 | 126 | 75 | 147 | 130 | 98 | 450(78.1) | >0.05 |
| 女 | 199 | 37 | 33 | 38 | 52 | 39 | 162(81.4) | |
| 年龄(岁) | ||||||||
| <60 | 363 | 83 | 53 | 94 | 71 | 62 | 280(77.1) | >0.05 |
| ≥60 | 412 | 80 | 51 | 95 | 108 | 78 | 332(80.6) | |
| 肿瘤部位 | ||||||||
| 胃食管连接部1 | 324 | 57 | 41 | 80 | 84 | 62 | 267(82.4) | >0.05 |
| 胃部 | 451 | 106 | 65 | 113 | 93 | 74 | 345(76.5) | |
| Lauren分型 | ||||||||
| 肠型 | 285 | 40 | 32 | 62 | 58 | 93 | 245(86.0) | <0.05 |
| 弥漫型 | 313 | 94 | 51 | 74 | 63 | 31 | 219(70.0) | |
| 混合型 | 177 | 29 | 21 | 46 | 46 | 35 | 148(83.6) | |
| 分化程度 | ||||||||
| 高、中分化 | 461 | 60 | 50 | 112 | 109 | 130 | 401(87.0) | <0.05 |
| 低、未分化 | 314 | 103 | 50 | 68 | 59 | 34 | 211(67.2) | |
| TNM分期 | ||||||||
| 0+Ⅰ+Ⅱ | 351 | 77 | 52 | 73 | 81 | 68 | 274(78.1) | >0.05 |
| Ⅲ、Ⅳ | 424 | 86 | 55 | 119 | 96 | 68 | 338(79.7) | |
| 浸润深度 | ||||||||
| Tis+T1 | 53 | 21 | 7 | 10 | 6 | 9 | 32(60.4) | <0.05 |
| T2-T4 | 722 | 142 | 104 | 178 | 170 | 128 | 580(80.3) | |
| 淋巴结转移 | ||||||||
| N0 | 215 | 59 | 33 | 40 | 41 | 42 | 156(72.6) | <0.05 |
| N1 | 322 | 60 | 43 | 83 | 80 | 56 | 262(81.4) | |
| N2 | 168 | 26 | 25 | 41 | 46 | 30 | 142(84.5) | |
| N3 | 70 | 18 | 8 | 24 | 9 | 11 | 52(74.2) | |
| 远处转移 | ||||||||
| 有 | 89 | 14 | 8 | 30 | 27 | 10 | 75(84.3) | >0.05 |
| 无 | 686 | 149 | 96 | 164 | 153 | 124 | 537(78.3) |
本课题组前期对同组胃癌病例进行了Her-2和VEGF蛋白检测, 发现胃癌组织中存在Her-2和VEGF蛋白的过表达[5,6], 将本研究中胃癌P53、Ki67过表达与前期同组胃癌病例Her-2、VEGF蛋白表达进行关联性检验分析发现, P53与Ki67的表达呈正相关(P<0.005, Pearson列联系数C = 0.8290), 而与Her-2、VEGF蛋白表达无相关性((均P>0.05, 表3); P53与Her-2蛋白表达亦无相关性(P>0.05, 表4).
| Ki67 | 合计 | P值 | ||
| - | + | |||
| P53 | ||||
| + | 40 | 323 | 363 | <0.005 |
| - | 123 | 289 | 412 | |
| Her-2 | ||||
| + | 15 | 73 | 88 | >0.050 |
| - | 148 | 539 | 687 | |
| VEGF | ||||
| + | 36 | 161 | 197 | >0.050 |
| - | 127 | 451 | 578 | |
| 合计 | 163 | 612 | 775 | |
| P53 | Her-2 | 合计 | |
| - | + | ||
| + | 320 | 43 | 363 |
| - | 367 | 45 | 412 |
| 合计 | 687 | 88 | 775 |
胃癌的发生演变是多阶段和多基因参与的极为复杂的过程, 原癌基因的激活和抑癌基因的失活与肿瘤的发生发展密切相关. 人类P53基因定位于染色体17号染色体短臂(17q13), 长度约20 kb, 由11个外显子和10个内含子组成, 其蛋白质产物定位于细胞核, 为一种含393个氨基酸的核蛋白, 相对分子质量约为53 000 Da, 即P53. 野生型P53基因是细胞生长的负调节因子, 其能够监视细胞基因组的完整性, 修复各种因素导致的DNA损伤及清除各种有癌变倾向的细胞等作用而起抑癌作用[7-9]; 当P53基因发生突变时, 便失去了对细胞生长、凋亡、DNA修复等的调控作用, 由抑癌基因转变成癌基因, 引起细胞的转化和癌变, 而相关资料显示: 超过60%的胃癌表现P53基因突变和17p上的P53位点的杂合性丢失; 野生型P53蛋白的半衰期甚短, 且极不稳定, 用常规免疫组化方法很难检出, 突变型P53蛋白稳定性增加, 半衰期延长, 故目前免疫组织化学测出的P53蛋白为突变型[10-12]. 研究表明, 在胃癌、结直肠癌、肝癌、肺癌、乳腺癌等肿瘤中均存在突变型P53蛋白过表达, 而且针对P53的基因治疗也得到了广泛应用[11-16].
本研究中, 775例胃癌组织中P53阳性表达363例, 表达率为46.84%, 而在癌旁非肿瘤性胃黏膜中未见阳性表达, 初步表明P53在胃癌组织中的过表达与胃癌的发生密切相关, P53基因突变是胃癌发生的一个重要影响因素. P53的过表达与患者性别、年龄、浸润深度、TNM分期、淋巴结转移无相关性, 而与肿瘤部位、Lauren分型、分化程度及远处转移相关, 与相关文献报道基本一致. 在Song等[17]和Lee等[18]的大宗病例研究中发现, P53在胃癌中的阳性表达率分别为40.1%(295/736)和43%(362/841), P53的表达与年龄、肿瘤大小、分化程度、Lauren分型、临床分期等密切相关, 而且P53阳性患者的预后较阴性患者差. Lee等[19]对105例胃癌患者的研究中亦发现, P53过表达率为34.1%, 而且其表达与Lauren分型、淋巴结转移及远处转移密切相关, P53阳性患者5年生存率为60%, 明显低于阴性患者5年78%的生存率. 对于Lauren分型, 相关研究显示[20-22], 弥漫型胃癌的P53蛋白表达率和突变率较肠型胃癌低, 与本研究一致(肠型54.7%, 混合型49.7%, 弥漫型38.0%); 在早期和进展期分化型胃癌与进展期的未分化型胃癌中P53基因突变率相似, 均约为40%, 但早期未分化型胃癌的P53基因突变率则非常低, 而且在肠型胃癌中, P53突变类型相对以无义突变、内含子突变、沉默突变多见; 国内的一些研究[23,24]亦发现, P53的过表达与患者的性别、年龄、肿瘤部位、肿瘤大小、TNM分期无相关, 而与淋巴结转移密切相关; 而另一些研究[25,26]则认为, P53蛋白表达除与分化程度、远处转移相关等相关外, 还与浸润深度密切相关. 本研究结果提示P53与浸润深度无关, 这可能与样本量的大小不同、检测方法及评分标准不同有关. 以上临床资料初步证实, P53的过表达参与了胃癌的发生, 促进了胃癌的浸润、转移, 可以作为评价胃癌患者预后的一项参考指标.
Ki67基因定位于第10号染色体, 其蛋白质产物定位于细胞核, 由相对分子质量为345 000 Da和395 000 Da两条多肽链组成, 其在G1后期开始出现, 在S期和G2期逐渐升高, M期达到高峰, 有丝分裂结束后迅速降解消失, G0期无表达[27]. 相关研究发现, Ki67在胃癌、肺癌、肝癌及恶性软组织肿瘤中均有过表达, 并且与肿瘤的发生发展、浸润转移及预后有关, Ki67表达的高低, 对评价评价细胞增殖活性, 研究肿瘤的生物学行为和预后具有重要意义[28-30].
本研究中, 胃癌组织中Ki67阳性表达率为78.97%(612/775例), 在非肿瘤胃黏膜中未见过表达, 这表明胃癌细胞的增殖活性远远大于非肿瘤性胃黏膜, 这与胃癌的浸润性生长、转移等生物学行为密切相关. Ki67蛋白过表达与患者性别、年龄、肿瘤部位、TNM分期、远处转移无相关性, 而与Lauren分型、分化程度、浸润深度及淋巴结转移相关, 而且随着浸润深度的增加和淋巴结转移, Ki67的阳性率逐渐升高, 这表明Ki67的阳性表达率越高, 其浸润、侵袭能力越强. Tzanakis等[31]研究认为, Ki67和P53的过表达与肿瘤大小、TNM分期及淋巴结转移相关, 而且Ki67和P53单独表达或共表达的患者预后明显较阴性者差; 易伟等[32]对232例胃癌组织的研究发现, Ki67、P53的阳性表达率分别为44.8%(104/232)、40.9%(95/232); 且两者的表达水均平均与胃癌淋巴结转移密切相关, 而与性别、年龄、肿瘤大小、肿瘤部位、组织类型、浸润深度、远处转移、TNM分期等无关; Ki67、P53蛋白表达阳性者3年生存率显著低于表达阴性者. 另外一些相关研究证实[4], 胃癌组织中存在Ki67的过表达率且与浸润深度、淋巴结转移等相关. 这初步表明, Ki67过表达率越高, 提示胃癌细胞的生长越活跃, 侵袭、转移能力越强, 患者的预后越差.
本课题组前期对同组胃癌病例进行了Her-2和VEGF蛋白检测, 发现胃癌组织中存在Her-2和VEGF蛋白的过表达[5,6], 将本研究中胃癌P53、Ki67过表达与前期同组胃癌病例Her-2、VEGF蛋白表达进行相关性检验分析发现, P53与Ki67的表达密切相关, 这表明具有P53基因突变的胃癌细胞具有更强的增殖活性, 更强的浸润转移能力, 而相关报道亦显示[32], P53和Ki67蛋白表达呈显著正相关, 且两者均与胃癌的浸润转移有关, 阳性患者的预后较阴性者差. Ki67与Her-2、VEGF蛋白表达无相关性, 这初步表明虽然Her-2、VEGF基因在胃癌中有扩增, 促进了胃癌的浸润转移, 但Her-2、VEGF蛋白过表达并不意味着胃癌细胞有更强的增殖活性, 可能是通过其他机制促进了胃癌的发生发展、浸润转移. P53与Her-2蛋白表达亦无相关性, 但两者都与患者的预后密切相关, 可能与两者是通过相互独立的机制在胃癌的浸润转移中发挥作用有关.
总之, 联合检测胃癌组织中P53、Ki67、Her-2及VEGF蛋白表达有着重要的临床意义,这不但有利于揭示胃癌发生发展、浸润转移的机制, 并能作为评价患者预后的参考指标, 同时Her-2和VEGF的表达也为胃癌的靶向治疗及个体化治疗提供了参考依据, 从而为提高患者疗效, 延长患者生存期具有重要意义.
目前胃癌的治疗以手术为主, 放化疗为辅, 总体疗效不理想, 5年生存率较低, 研究筛选有助于分析胃癌生物学行为的临床指标, 有效预测胃癌患者的预后情况, 并制定个体化的治疗方案是临床的迫切需要.
钱睿哲, 教授, 复旦大学上海医学院生理与病理生理学系血管分子生物学实验室
Tzanakis等研究认为, Ki67和P53的过表达与肿瘤大小、TNM分期及淋巴结转移相关, 而且Ki67和P53单独表达或共表达的患者预后明显较阴性者差.
本文采用大宗病例研究, 综合分析P53和Ki67在胃癌中的表达情况及与胃癌生物学行为和预后的关系.
本研究采用免疫组织化学的方法检测P53和Ki67蛋白在胃癌组织的表达情况, 有助于阐释P53和Ki67在胃癌发生发展、浸润转移中的机制, 并为判断预后提供了参考依据.
本文可读性较好, 有一定的临床参考价值.
编辑: 李薇 电编:何基才
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 2. | Zhou Y, Li N, Zhuang W, Liu GJ, Wu TX, Yao X, Du L, Wei ML, Wu XT. P53 codon 72 polymorphism and gastric cancer: a meta-analysis of the literature. Int J Cancer. 2007;121:1481-1486. [PubMed] [DOI] |
| 3. | Zheng Y, Wang L, Zhang JP, Yang JY, Zhao ZM, Zhang XY. Expression of p53, c-erbB-2 and Ki67 in intestinal metaplasia and gastric carcinoma. World J Gastroenterol. 2010;16:339-344. [PubMed] [DOI] |
| 4. | Al-Moundhri MS, Nirmala V, Al-Hadabi I, Al-Mawaly K, Burney I, Al-Nabhani M, Thomas V, Ganguly SS, Grant C. The prognostic significance of p53, p27 kip1, p21 waf1, HER-2/neu, and Ki67 proteins expression in gastric cancer: a clinicopathological and immunohistochemical study of 121 Arab patients. J Surg Oncol. 2005;91:243-252. [PubMed] [DOI] |
| 5. | 陈 娟, 李 东石, 余 英豪, 王 烈, 欧阳 学农, 谢 飞来, 熊 喜生. Her-2蛋白在胃癌中的表达及其临床意义. 世界华人消化杂志. 2010;18:1375-1379. [DOI] |
| 7. | Wiman KG. Pharmacological reactivation of mutant p53: from protein structure to the cancer patient. Oncogene. 2010;29:4245-4252. [PubMed] [DOI] |
| 8. | Farnebo M, Bykov VJ, Wiman KG. The p53 tumor suppressor: a master regulator of diverse cellular processes and therapeutic target in cancer. Biochem Biophys Res Commun. 2010;396:85-89. [PubMed] [DOI] |
| 9. | Oren M, Rotter V. Mutant p53 gain-of-function in cancer. Cold Spring Harb Perspect Biol. 2010;2:a001107. [PubMed] [DOI] |
| 10. | Machado-Silva A, Perrier S, Bourdon JC. p53 family members in cancer diagnosis and treatment. Semin Cancer Biol. 2010;20:57-62. [PubMed] [DOI] |
| 11. | Chari NS, Pinaire NL, Thorpe L, Medeiros LJ, Routbort MJ, McDonnell TJ. The p53 tumor suppressor network in cancer and the therapeutic modulation of cell death. Apoptosis. 2009;14:336-347. [PubMed] [DOI] |
| 12. | Vazquez A, Bond EE, Levine AJ, Bond GL. The genetics of the p53 pathway, apoptosis and cancer therapy. Nat Rev Drug Discov. 2008;7:979-987. [PubMed] [DOI] |
| 13. | Tang NP, Wu YM, Wang B, Ma J. Systematic review and meta-analysis of the association between P53 codon 72 polymorphism and colorectal cancer. Eur J Surg Oncol. 2010;36:431-438. [PubMed] [DOI] |
| 14. | Tam CW, Liu VW, Leung WY, Yao KM, Shiu SY. The autocrine human secreted PDZ domain-containing protein 2 (sPDZD2) induces senescence or quiescence of prostate, breast and liver cancer cells via transcriptional activation of p53. Cancer Lett. 2008;271:64-80. [PubMed] [DOI] |
| 15. | Oguztüzun S, Aydin M, Demirag F, Yazici U, Ozhavzali M, Kiliç M, Işcan M. The expression of GST isoenzymes and p53 in non-small cell lung cancer. Folia Histochem Cytobiol. 2010;48:122-127. [PubMed] [DOI] |
| 16. | Baker L, Quinlan PR, Patten N, Ashfield A, Birse-Stewart-Bell LJ, McCowan C, Bourdon JC, Purdie CA, Jordan LB, Dewar JA. p53 mutation, deprivation and poor prognosis in primary breast cancer. Br J Cancer. 2010;102:719-726. [PubMed] [DOI] |
| 17. | Song HS, Kim IH, Sohn SS, Kwon KY, Lee WS. Prognostic significance of immunohistochemical expression of p53 and retinoblastoma gene protein (pRB) in curatively resected gastric cancer. Korean J Intern Med. 2005;20:1-7. [PubMed] |
| 18. | Lee KE, Lee HJ, Kim YH, Yu HJ, Yang HK, Kim WH, Lee KU, Choe KJ, Kim JP. Prognostic significance of p53, nm23, PCNA and c-erbB-2 in gastric cancer. Jpn J Clin Oncol. 2003;33:173-179. [PubMed] [DOI] |
| 19. | Lee HK, Lee HS, Yang HK, Kim WH, Lee KU, Choe KJ, Kim JP. Prognostic significance of Bcl-2 and p53 expression in gastric cancer. Int J Colorectal Dis. 2003;18:518-525. [PubMed] [DOI] |
| 20. | Luinetti O, Fiocca R, Villani L, Alberizzi P, Ranzani GN, Solcia E. Genetic pattern, histological structure, and cellular phenotype in early and advanced gastric cancers: evidence for structure-related genetic subsets and for loss of glandular structure during progression of some tumors. Hum Pathol. 1998;29:702-709. [PubMed] [DOI] |
| 21. | Shiao YH, Palli D, Buzard GS, Caporaso NE, Amorosi A, Saieva C, Fraumeni JF Jr, Anderson LM, Rice JM. Implications of p53 mutation spectrum for cancer etiology in gastric cancers of various histologic types from a high-risk area of central Italy. Carcinogenesis. 1998;19:2145-2149. [PubMed] [DOI] |
| 22. | Tamura G, Sato K, Akiyama S, Tsuchiya T, Endoh Y, Usuba O, Kimura W, Nishizuka S, Motoyama T. Molecular characterization of undifferentiated-type gastric carcinoma. Lab Invest. 2001;81:593-598. [PubMed] |
| 25. | Seo YH, Joo YE, Choi SK, Rew JS, Park CS, Kim SJ. Prognostic significance of p21 and p53 expression in gastric cancer. Korean J Intern Med. 2003;18:98-103. [PubMed] |
| 26. | Oh SY, Kwon HC, Kim SH, Jang JS, Kim MC, Kim KH, Han JY, Kim CO, Kim SJ, Jeong JS. Clinicopathologic significance of HIF-1alpha, p53, and VEGF expression and preoperative serum VEGF level in gastric cancer. BMC Cancer. 2008;8:123. [PubMed] [DOI] |
| 27. | Gerdes J, Lemke H, Baisch H, Wacker HH, Schwab U, Stein H. Cell cycle analysis of a cell proliferation-associated human nuclear antigen defined by the monoclonal antibody Ki-67. J Immunol. 1984;133:1710-1715. [PubMed] |
| 28. | Czyzewska J, Guzińska-Ustymowicz K, Lebelt A, Zalewski B, Kemona A. Evaluation of proliferating markers Ki-67, PCNA in gastric cancers. Rocz Akad Med Bialymst. 2004;49 Suppl 1:64-66. [PubMed] |
| 29. | Han B, Lin S, Yu LJ, Wang RZ, Wang YY. Correlation of 18F-FDG PET activity with expressions of survivin, Ki67, and CD34 in non-small-cell lung cancer. Nucl Med Commun. 2009;30:831-837. [PubMed] [DOI] |
| 30. | Ma YL, Peng JY, Zhang P, Liu WJ, Huang L, Qin HL. Immunohistochemical analysis revealed CD34 and Ki67 protein expression as significant prognostic factors in colorectal cancer. Med Oncol. 2010;27:304-309. [PubMed] [DOI] |
| 31. | Tzanakis NE, Peros G, Karakitsos P, Giannopoulos GA, Efstathiou SP, Rallis G, Tsigris C, Kostakis A, Nikiteas NI. Prognostic significance of p53 and Ki67 proteins expression in Greek gastric cancer patients. Acta Chir Belg. 2009;109:606-611. [PubMed] |