修回日期: 2010-12-05
接受日期: 2010-12-15
在线出版日期: 2011-02-08
目的: 探索建立大鼠缺血型胆道纤维化狭窄动物模型的方法.
方法: 选取48只成年SD大鼠, 随机分为假手术组、胆总管夹闭60、120和180 min组共4组, 每组12只. 假手术组只游离暴露胆总管, 其他各组分别用两枚微血管夹夹闭游离的胆总管两端60、120和180 min后取出微血管夹, 恢复夹闭处胆管的血供. 4个实验组分别于术后4 wk随机选取8只大鼠行下腔静脉取血, 分离血清进行肝功能测定. 取胆总管及肝组织石蜡包埋, HE染色, 观察组织病理变化并观察各组动物的存活率、体质量改变情况. 剩余大鼠于术后8 wk处死, 行肝功能的测定及组织病理学检查.
结果: 假手术组、60 min组和120 min大鼠的存活率为100%, 180 min组大鼠的存活率为75%(9/12). 术后4 wk, 60、120和180 min组大鼠体质量明显低于较假手术组(240.4 g±11.5 g, 212.7 g±13.6 g, 200.6 g±11.8 g vs 260.6 g±15.7 g, 均P<0.05). 各组大鼠肝功能指标存在明显差异, 60、120、180min组与假手术组相比显著增高(ALT: 55.3 IU/L±5.3 IU/L, 215.6 IU/L±26.8 IU/L, 245.5 IU/L±38.5 IU/L vs 45.5 IU/L±3.9 IU/L, 均P<0.05; AST: 161.3 IU/L±15.9 IU/L, 645.3 IU/L±50.5 IU/L, 698.8 IU/L±46.7 IU/L vs 140.3 IU/L±6.1 IU/L, 均P<0.05; TILB: 8.5 μmol/L±1.2 μmol/L, 72.6 μmol/L±11.0 μmol/L, 78.7 μmol/L±12.2 μmol/L vs 6.1 μmol/L±1.2 μmol/L, 均P<0.05; ALP: 202.4 IU/L±20.7 IU/L, 815.4 IU/L±68.1 IU/L, 902.9 IU/L±96.6 IU/L vs 158.5 IU/L±23.6 IU/L, 均P<0.05; GGT: 10.6 IU/L±2.7 IU/L, 52.3 IU/L±8.6 IU/L, 57.4 IU/L±11.3 IU/L vs 7.6 IU/L±1.4 IU/L, 均P<0.05); 120与60 min组相比显著增高; 180 min与120 min相比升高不明显. 组织病理检查显示: 假手术组、60 min组缺血处胆管组织管腔狭窄不明显, 管壁纤维化程度较轻. 120和180 min组缺血处胆管管腔变小, 管壁纤维增厚明显, 管壁上皮细胞出现坏死脱落, 夹闭处以上胆管扩张明显, 管壁变薄. 术后8 wk上述病变不能自行恢复.
结论: 采用微血管夹钳夹的方法可以建立稳定的大鼠缺血型胆道纤维化狭窄动物模型, 为研究肝移植术后胆道的缺血型病变形成的机制及病因学研究提供可靠的研究方法.
引文著录: 汪景洲, 曾勇, 蒋辉, 徐缨龙, 邱建国, 夏天. 缺血型胆道纤维化狭窄大鼠模型的建立. 世界华人消化杂志 2011; 19(4): 355-361
Revised: December 5, 2010
Accepted: December 15, 2010
Published online: February 8, 2011
AIM: To develop a rat model of extrahepatic biliary ischemic stenosis.
METHODS: Forty-eight Sprague-Dawley rats were divided randomly and equally into four groups: rats undergoing sham operation and those subjected to clamping of the common bile duct with a clip for 60, 120, or 180 min. After scheduled clamping, the clip was removed to recover blood supply. The animals were killed 4 and 8 wk after operation. The survival, liver function, and histopathological changes were observed in rats of each group.
RESULTS: The survival rate was 100% in rats undergoing sham operation and those undergoing clamping for 60 or 120min, and 75% in those undergoing clamping for 180 min. At week 4, the body weight of rats undergoing clamping for 60, 120 or 180 min was lower than that of rats undergoing sham operation (240.4 g ± 11.5 g, 212.7 g ± 13.6 g, 200.6 g ± 11.8 g vs 260.6 g ± 15.7 g, all P < 0.05). Liver function parameters were higher in rats undergoing clamping for 60, 120 or 180 min than in those undergoing sham operation (ALT: 55.3 IU/L ± 5.3 IU/L, 215.6 IU/L ± 26.8 IU/L, 245.5 IU/L ± 38.5 IU/L vs 45.5 IU/L ± 3.9 IU/L, all P < 0.05; AST: 161.3 IU/L ± 15.9 IU/L, 645.3 IU/L ± 50.5 IU/L, 698.8 IU/L ± 46.7 IU/L vs 140.3 IU/L ± 6.1 IU/L, all P < 0.05; TILB: 8.5 μmol/L ± 1.2 μmol/L, 72.6 μmol/L ± 11.0 μmol/L, 78.7 μmol/L ± 12.2 μmol/L vs 6.1 μmol/L ± 1.2 μmol/L, all P < 0.05; ALP: 202.4 IU/L ± 20.7 IU/L, 815.4 IU/L ± 68.1 IU/L, 902.9 IU/L ± 96.6 IU/L vs 158.5 IU/L ± 23.6 IU/L, all P < 0.05; GGT: 10.6 IU/L ± 2.7 IU/L, 52.3 IU/L ± 8.6 IU/L, 57.4 IU/L ± 11.3 IU/L vs 7.6 IU/L ± 1.4 IU/L, all P < 0.05). Histopathological examination showed that biliary stenosis was not apparent and wall fibrosis was milder in rats undergoing sham operation and those undergoing clamping for 60 min, while severe biliary stenosis and wall fibrosis were observed in those undergoing clamping for 120 or 180 min. At week 8, these lesions could not regress spontaneously.
CONCLUSION: An animal model of extrahepatic biliary ischemic stenosis is successfully established with the clamping method in rats, which provides a useful tool for basic and clinical research of the etiology, development and prophylaxis of extrahepatic biliary ischemic stenosis after liver transplantation.
- Citation: Wang JZ, Zeng Y, Jiang H, Xu YL, Qiu JG, Xia T. Establishment of a rat model of extrahepatic biliary ischemic stenosis. Shijie Huaren Xiaohua Zazhi 2011; 19(4): 355-361
- URL: https://www.wjgnet.com/1009-3079/full/v19/i4/355.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i4.355
自1963年Starzl开展首例原位肝移植以来, 肝移植已成为治疗终末期肝病的重要方法. 随着肝移植技术的日趋完善, 肝移植术后并发症如感染、排斥反应、血管并发症、神经系统并发症等逐渐减少, 而胆道并发症成为影响移植肝长期存活的重要因素, 由此造成的胆管引流问题成了肝移植的致命弱点. 肝移植术后胆道并发症是胆道外科长期以来所面临的严峻挑战, 其发生率为5%-15%[1], 国外另有报道其发生率高达26%[2], 其死亡率约为19%[3], 再移植率为6%-13%[4,5], 是肝移植临床实践的"阿喀琉斯之踵". 随着对胆道系统认识的不断深入统一、手术操作技术的不断提高规范, 由外科因素引起的吻合口狭窄、胆漏等发生率已呈下降趋势,但缺血性胆管损害、免疫性胆管损害与感染性胆管损害等非外科因素所致并发症的发生率仍可高达19%, 是当前临床上导致肝移植术后移植物丢失与受体死亡的主要原因. 传统临床对其缺乏有效治疗手段, 故被称为"阿喀琉斯之踵再现"[6]. 其中缺血型胆道病变(ischemic type biliary lesion, ITBL)因其发病原因复杂, 临床处理困难, 已成为影响肝移植患者长期存活及导致移植物丢失的主要原因之一[7]. 为此, 肝移植术后ITBL的研究已引起了全球移植专家的高度重视[8]. 因此探索建立缺血型胆道并发症的动物模型就成为当务之急, 他对研究肝移植术后缺血型胆道并发症的病因、疾病的发生发展过程和探寻更加有效的治疗方法都将起到重要作用. 本实验证明采用微血管夹夹闭SD大鼠胆总管120 min, 可以成功建立肝外胆道缺血型狭窄的动物模型.
选取♂SD大鼠48只, 体质量170-200 g(四川大学动物中心提供). 所有大鼠术前均饲养于22 ℃, 55%相对湿度, 12 h昼夜节律, 自由进食水. 适应1 wk后开始实验. 48只大鼠随机分为4组(每组12只)包括: 假手术组、胆总管夹闭60 min组、120 min组及180 min组.
1.2.1 造模: 所有大鼠于术前12 h禁食, 6 h禁水, 6 mL/kg水合氯醛腹腔注射麻醉后备皮, 麻醉满意后仰卧固定于实验台上, 腹部剪毛备皮后消毒铺巾, 取上腹正中切口约4 cm, 常规检查肝、胰、胃、肠等腹内脏器无器质性病变后, 按逆时针方向依次离断肝周韧带, 显露肝门、肝蒂, 充分游离十二指肠水平的肝十二指肠韧带, 暴露胆总管、肝动脉、门静脉, 假手术组只游离胆总管、肝动脉、门静脉; 其余各组于左右肝管汇成肝总管处向下解剖一段长约1.5 cm完全游离的胆总管, 用两枚微血管夹分别夹闭游离胆管的两端分别为60、120和180 min后取下微血管夹恢复胆管的血供后, 以3-0号丝线间断缝合关闭腹腔. 各组大鼠分别随机选取8只于术后4 wk处死, 剩余大鼠用于长时间观察.
1.2.2 观察指标: 存活率: 各组大鼠术后饲养于相同环境下4 wk, 观察各组大鼠的生存率. 体质量变化: 各组大鼠于术后4 wk观察术前与术后体质量的变化情况. 肝功能指标的检测: 各组大鼠每组随机选取8只于术后4 wk处死, 在处死前下腔静脉取血2 mL, 立即送华西医院检验科生化分析室行谷丙转氨酶(alanine amino transferase, ALT)、谷草转氨酶(glutamic oxalacetic transaminease, AST)、碱性磷酸酶(alkaline phosphatase, ALP)、谷氨酰转肽酶(glutamyl transpeptidase, GGT)、总胆红素(total bilirubin, TBIL)的测定. 同样剩余每组剩余的大鼠于术后8 wk行上述肝功能指标的测定. 组织病理检测: 各组大鼠分别选取8只于术后4 wk取缺血部位的胆管及肝门处肝脏组织, 4%的多聚甲醛固定, 常规石蜡包埋, HE及Masson染色, 观察病理变化. 剩余大鼠于术后8 wk取相应部位胆管及肝脏组织观察病理变化.
统计学处理 实验数据以mean±SD表示, 以SPSS18.0统计软件采用方差分析及多个均数间的两两比较的方法进行统计学处理分析, P<0.05认为有统计学意义.
假手术组、60及120 min组大鼠的存活率为100%, 180 min组于术后第5、7、10天各死亡1只, 存活率为75%. 引起大鼠死亡的原因经尸检证实包括胆漏、腹腔感染、肝脏缺血性坏所致. 其中60、120和180 min实验组大鼠术后与假手术组大鼠比较出现精神萎靡、体毛干枯无光泽.
120和180 min组术后4 wk体质量增长速度与假手术组和60 min组相比减慢(P<0.05, 表1).
在实验之前我们随机选择4只正常SD大鼠来测定上述指标的正常值范围(ALT: 40.3 IU/L±5.8 IU/L, AST: 132.1 IU/L±24.3 IU/L, ALP: 150.5 IU/L±37.1 IU/L, GGT: 6.1 IU/L±2.1 IU/L, TILB: 5.5 IU/L±2.6 IU/L). 术后4 wk在120、180 min组所有观察的生化指标都存在不同程度的增高, 而在假手术组、60 min组上述生化指标较正常SD大鼠无明显差异, 尤其是反应胆道系统受损的酶类(ALP、GGT)较术前有明显增高, 而各组剩余大鼠在术后8 wk测量上述生化指标较术前也有所增高, 但ALT、AST, 较术后4 wk有明显降低, 而ALP、GGT仍旧维持在较高水平. 考虑可能为肝脏储备代偿所致, 而胆系损坏没有得到恢复(表2, 3).
| 分组 | ALT (IU/L) | AST (IU/L) | TILB (μmol/L) | ALP (IU/L) | GGT (IU/L) |
| 假手术组 | 42.3±6.5 | 142.3±10.1 | 6.4±1.3 | 157.3±12.0 | 7.8±1.5 |
| 60 min组 | 48.5±8.1 | 148.5±11.1 | 8.8±1.5 | 178.8±15.5 | 8.5±2.4 |
| 120 min组 | 80.8±12.1 | 200.6±27.0 | 40.7±6.7 | 500.5±76.6 | 38.3±9.9 |
| 180 min组 | 90.0±0.0 | 242.0±0.0 | 42.6±0.0 | 605.0±0.0 | 41.0±0.0 |
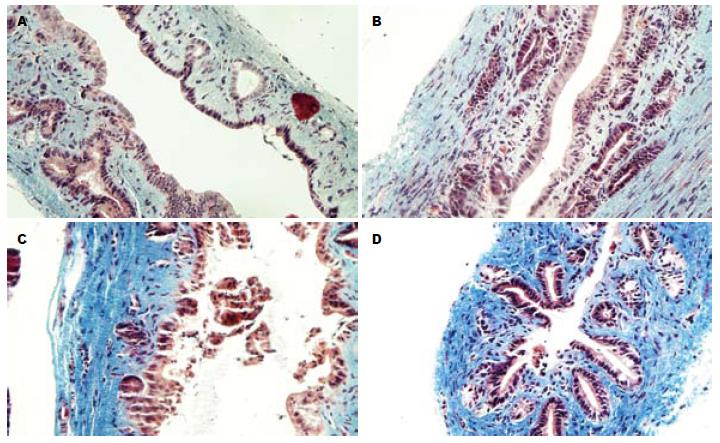
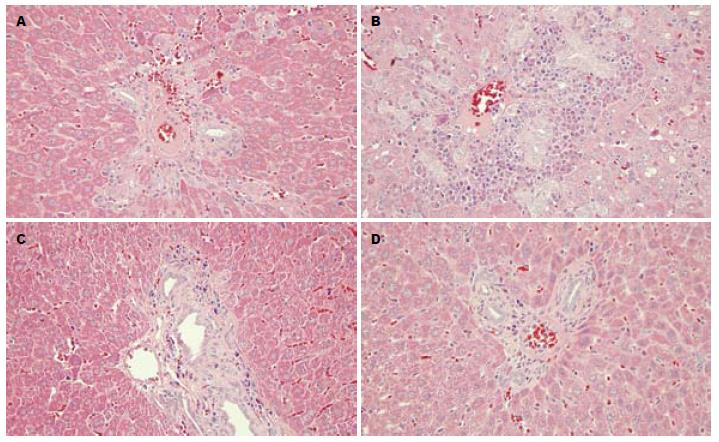
术后4 wk 4组分别随机选取8只大鼠夹闭处胆总管及肝门处肝脏组织行病理学检查, 夹闭处胆总管病理结果显示: 假手术组: 胆总管管壁上皮细胞形态正常, 管腔无明显增厚, Masson染色较浅, 纤维化不明显. 60 min组: 胆管上皮细胞形态基本正常, 管壁增厚不明显, 有轻度纤维化形成. 120 min: 胆总管管壁明显增厚, 腔内有坏死细胞形成, Masson染色较深, 纤维化形成明显. 180 min组: 胆管壁有大量胶原纤维形成, 胆管管腔变窄. 术后4 wk各实验组肝脏组织病理结果显示: 假手术组肝内胆管上皮细胞无坏死脱落, 管腔形态正常. 60 min组肝内胆管炎症增生明显, 但胆管形态基本正常. 120 min组肝内胆管管壁增厚, 周围有胶原纤维组织形成. 180 min肝内胆管管壁周围有大量胶原纤维形成, 管腔变窄. 术后8 wk处死取剩余大鼠取夹闭处胆管组织及肝组织行病理学检查可以看到胆总管纤维化仍旧存在, 说明上述病变无法自行恢复(图1, 2).
ITBL是指肝移植术后移植肝非吻合技术性的胆管树的破坏, 其发生率为2%-19%, 他以泥沙样结石的形成、胆管狭窄、胆管树的损伤以及造成移植物的失功为特征[9,10]. ITBL分为肝内胆管、肝外胆管和混合性病变三类. ITBL的确切病因现尚未清楚, 但随着研究的深入发现与移植器官冷缺血及热缺血时间的过长[11,12]、缺血再灌注损伤[13,14]、胆管周围动脉血供的破坏[15]、ABO溶血[16-18]、巨细胞病毒的感染[19,20]、CC趋化因子受体5Δ32[2]、胆盐的沉积有关[21], 其中胆管系统周围的动脉血管丛灌注不充分、微血管障碍是ITBL发生的主要原因[22]. 据Schlitt等[10]报道肝门部胆管狭窄是肝移植术后ITBL的高发部位, 其临床表现包括肝功能指标的升高, 特别是ALP、GGT的增高以及影像学检查表现为胆管的局限性及弥漫性狭窄. 目前对ITBL的诊断主要依靠影像学诊断, 近年来研究发现磁共振胆管成像诊断胆道有较好的敏感性和特异性[23,24]. 目前对肝门部胆管狭窄的治疗方法较为局限主要包括放射介入治疗和内镜治疗[25,26]. 虽然通过包括球囊扩张及铸型与放置内支架可以暂时缓解胆道梗阻, 但是远期效果欠佳[27], 往往需要多次介入治疗. 反复介入治疗可以导致肝门部炎症加重, 甚至导致肝内、膈下、肝上下腔静脉吻合口附近的多发脓肿形成, 增加再次肝移植的难度. 对于手术治疗目前采取较为谨慎的态度, 手术的方式主要采用肝外胆管狭窄处的切除以及高位肝胆管空肠吻合术, 由于肝门部二次手术的难度加大, 且有可能破坏已经形成的侧枝循环导致手术的失败. 基于上述等原因现在更加强调对ITBL早期预防以及积极探索新的可靠的治疗方法. 因此缺血性胆道狭窄模型的建立就成为当务之急, 出于上述考虑我们选取用微血管夹夹闭的方法造成大鼠夹闭处胆总管的缺血, 进而形成纤维化狭窄, 为进一步探索和寻求有效防治手段提供了实验模型.
本实验通过选择夹闭胆总管不同的时间点(不夹闭, 60、120、180 min)及对各个实验组大鼠实验前后体质量、肝功能以及组织病理学变化, 我们发现随着夹闭时间的延长, 各组肝功能指标出现不同程度增高, 其中以120、180 min两组较其他两组增高尤为明显(均P<0.01), 术后8 wk, ALT、AST与TILB等肝功能指标下降明显, 考虑为肝脏的代偿适应功能所致, 而反映胆系破坏的ALP与GGT下降幅度较低, 考虑为胆管损伤的持续破坏存在有关; 组织病理学显示肝外胆管缺血性狭窄的程度不断增加, 在60 min组胆总管纤维化的程度较轻, 肝内胆管出现炎症性增生, 而在120及180 min组可以看到胆总管壁增厚, 管腔变窄, 胆总管上皮细胞出现坏死脱落. 但是在180 min实验组大鼠术后4 wk的生存率为75%, 而在120 min组大鼠的生存率则为100%. 所以我们认为选择夹闭胆总管120 min建立大鼠缺血型胆道纤维化狭窄动物模型是较为理想的夹闭时间点.
一般认为缺血性胆道纤维化狭窄往往发生在肝移植术后的1-3 mo[3]. Sheng等[28]在建立兔子肝内胆管缺血性病变模型中选择术后4 wk观察病变的时间点发现肝内胆管上皮细胞缺血坏死明显, 正常上皮结构消失. Zhao等[29]在建立小鼠缺血型胆道纤维化模型同样选择4 wk为观察时限, 所以在本实验中我们也采用了术后4 wk为观察病变的时间点, 而且每个实验组我们都有剩余大鼠于术后8 wk再次行组织病理学观察, 没有发现病变存在显著变化. 从而也说明上述病变不会因观察时间的延长而自行恢复.
本实验存在以下优点: (1)我们选择采用统一规格的微血管夹夹闭胆总管建立肝外胆管缺血性模型具有较高的可比性, 而且建立动物模型的稳定性较高; (2)该实验通过两枚微血管夹夹闭胆总管的两端造成夹闭处胆总管完全热缺血, 然后选择不同的时间点松开, 可以较好反应热缺血以及缺血再灌注损伤在肝移植术后胆道缺血性损伤过程中作用; (3)本实验动物模型排除了其他手术因素的影响(胆管吻合、肝动脉吻合、T管引流)、移植器官的冷保存、药物因素的影响; (4)本实验具有操作简单、成功率高、动物模型稳定性高等特点而且选择大鼠做动物模型, 具有价格低廉、经济实惠等优点.
总之, 通过采用微血管夹夹闭的方法成功建立大鼠缺血型胆道纤维化狭窄动物模型可以为研究肝移植术后ITBL的病因学、发生发展过程以及探索更加有效可靠的治疗方法提供稳定的实验基础.
缺血型胆道病变(ITBL)是指肝移植术后非外科因素造成胆道并发症最主要的因素之一, 其发生率为2%-19%, 他以泥沙样结石的形成、胆管狭窄、胆管树的损伤以及造成移植物的失功为特征, 目前对于其治疗方式主要为内镜及介入治疗为主, 但治疗效果欠佳, 因此寻找新的治疗方法成为当务之急.
薛东波, 教授, 哈尔滨医科大学附属第一医院微创胆道外科
缺血型胆道病变(ITBL)因其发病原因复杂, 临床处理困难, 已成为影响肝移植患者长期存活及导致移植物丢失的主要原因之一. 为此, 肝移植术后ITBL的研究已引起了全球移植专家的高度重视.
Sheng等在建立兔子肝内胆管缺血性病变模型中选择术后4 wk观察病变的时间点发现肝内胆管上皮细胞缺血坏死明显, 正常上皮结构消失.
本实验证明采用微血管夹夹闭SD大鼠胆总管120 min, 可以成功建立肝外胆道缺血型狭窄的动物模型.
本文选题较好, 学术价值较高, 为进一步的实验奠定基础, 提供有益参考.
编辑: 李薇 电编:何基才
| 1. | Buis CI, Hoekstra H, Verdonk RC, Porte RJ. Causes and consequences of ischemic-type biliary lesions after liver transplantation. J Hepatobiliary Pancreat Surg. 2006;13:517-524. [PubMed] [DOI] |
| 2. | Moench C, Uhrig A, Lohse AW, Otto G. CC chemokine receptor 5delta32 polymorphism-a risk factor for ischemic-type biliary lesions following orthotopic liver transplantation. Liver Transpl. 2004;10:434-439. [PubMed] [DOI] |
| 3. | Greif F, Bronsther OL, Van Thiel DH, Casavilla A, Iwatsuki S, Tzakis A, Todo S, Fung JJ, Starzl TE. The incidence, timing, and management of biliary tract complications after orthotopic liver transplantation. Ann Surg. 1994;219:40-45. [PubMed] [DOI] |
| 4. | Osorio RW, Freise CE, Stock PG, Lake JR, Laberge JM, Gordon RL, Ring EJ, Ascher NL, Roberts JP. Nonoperative management of biliary leaks after orthotopic liver transplantation. Transplantation. 1993;55:1074-1077. [PubMed] [DOI] |
| 5. | Letourneau JG, Castañeda-Zuñiga WR. The role of radiology in the diagnosis and treatment of biliary complications after liver transplantation. Cardiovasc Intervent Radiol. 1990;13:278-282. [PubMed] [DOI] |
| 6. | Fisher A, Miller CH. Ischemic-type biliary strictures in liver allografts: the Achilles heel revisited? Hepatology. 1995;21:589-591. [PubMed] [DOI] |
| 7. | Wilson BJ, Marsh JW, Makowka L, Stieber AC, Koneru B, Todo S, Tzakis A, Gordon RD, Starzl TE. Biliary tract complications in orthotopic adult liver transplantation. Am J Surg. 1989;158:68-70. [PubMed] [DOI] |
| 9. | Hoffman A, Kiesslich R, Moench C, Bittinger F, Otto G, Galle PR, Neurath MF. Methylene blue-aided cholangioscopy unravels the endoscopic features of ischemic-type biliary lesions after liver transplantation. Gastrointest Endosc. 2007;66:1052-1058. [PubMed] [DOI] |
| 10. | Schlitt HJ, Meier PN, Nashan B, Oldhafer KJ, Boeker K, Flemming P, Raab R, Manns MP, Pichlmayr R. Reconstructive surgery for ischemic-type lesions at the bile duct bifurcation after liver transplantation. Ann Surg. 1999;229:137-145. [PubMed] [DOI] |
| 14. | Vajdová K, Smreková R, Kukan M, Lutterová M, Wsólová L. Bile analysis as a tool for assessing integrity of biliary epithelial cells after cold ischemia--reperfusion of rat livers. Cryobiology. 2000;41:145-152. [PubMed] [DOI] |
| 15. | Grewal HP, Shokouh-Amiri MH, Vera S, Stratta R, Bagous W, Gaber AO. Surgical technique for right lobe adult living donor liver transplantation without venovenous bypass or portocaval shunting and with duct-to-duct biliary reconstruction. Ann Surg. 2001;233:502-508. [PubMed] [DOI] |
| 16. | Nakamura Y, Matsuno N, Iwamoto H, Yokoyama T, Kuzuoka K, Kihara Y, Taira S, Sagara T, Jojima Y, Konno O. Successful case of adult ABO-incompatible liver transplantation: beneficial effects of intrahepatic artery infusion therapy: a case report. Transplant Proc. 2004;36:2269-2273. [PubMed] [DOI] |
| 17. | Warner PR, Nester TA. ABO-incompatible solid-organ transplantation. Am J Clin Pathol. 2006;125 Suppl:S87-S94. [PubMed] |
| 18. | Yang JM, Zhu B. Intrahepatic cholestasis after liver transplantation. Hepatobiliary Pancreat Dis Int. 2002;1:176-178. [PubMed] |
| 19. | Halme L, Hockerstedt K, Lautenschlager I. Cytomegalovirus infection and development of biliary complications after liver transplantation. Transplantation. 2003;75:1853-1858. [PubMed] [DOI] |
| 20. | Hellinger WC, Bonatti H, Machicao VI, Yao JD, Brumble LM, Alvarez S, Weigand SD, Dickson RC, Harnois DM, Spivey JR. Effect of antiviral chemoprophylaxis on adverse clinical outcomes associated with cytomegalovirus after liver transplantation. Mayo Clin Proc. 2006;81:1029-1033. [PubMed] [DOI] |
| 21. | Barton P, Steininger R, Maier A, Mühlbacher F, Lechner G. Biliary sludge after liver transplantation: 2. Treatment with interventional techniques versus surgery and/or oral chemolysis. AJR Am J Roentgenol. 1995;164:865-869. [PubMed] |
| 23. | 董 其龙, 陈 代文, 史 震山, 钟 群, 陈 自谦. 肝移植术后胆系并发症影像学特点及对防治的提示. 中国组织工程研究与临床康复. 2008;12:3410-3414. |
| 24. | Boraschi P, Donati F, Gigoni R, Urbani L, Femia M, Cossu MC, Filipponi F, Falaschi F. Ischemic-type biliary lesions in liver transplant recipients: evaluation with magnetic resonance cholangiography. Transplant Proc. 2004;36:2744-2747. [PubMed] [DOI] |
| 25. | Turrión VS, Alvira LG, Jiménez M, Lucena JL, Nuño J, Pereira F, Vicente E, Ardaiz J. Management of the biliary complications associated with liver transplantation: 13 years of experience. Transplant Proc. 1999;31:2392-2393. [PubMed] [DOI] |
| 26. | Patkowski W, Nyckowski P, Zieniewicz K, Pawlak J, Michalowicz B, Kotulski M, Smoter P, Grodzicki M, Skwarek A, Ziolkowski J. Biliary tract complications following liver transplantation. Transplant Proc. 2003;35:2316-2317. [PubMed] [DOI] |
| 28. | Sheng QS, Chen DZ, Lang R, He Q, Yang YJ, Qu ZW, Zhao DF, Zhang XS. Establishment of an animal model of ischemic type intrahepatic biliary lesion in rabbits. World J Gastroenterol. 2009;15:732-736. [PubMed] [DOI] |
| 29. | Zhao DF, Chen DZ, Lv JS, Lang R, Jin ZK, Qing H. Establishment of an animal model of biliary ischemic stenosis with clamping in mice. Transplant Proc. 2008;40:1303-1305. [PubMed] [DOI] |