修回日期: 2011-11-20
接受日期: 2011-12-18
在线出版日期: 2011-12-28
目的: 分析新疆食管鳞状细胞癌和食管正常上皮细胞的差异表达蛋白.
方法: 运用激光捕获显微切割技术(LCM)分别获取食管鳞状癌细胞和食管正常上皮细胞, 应用二维凝胶电泳技术(2-DE)分离纯化细胞, Imagemaster 2D软件比较分析两者电泳图谱的差异, 基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)鉴定分析两者表达的差异蛋白.
结果: 建立了食管鳞状癌细胞和食管正常上皮细胞的2-DE图谱, 获得43个差异蛋白点, 通过质谱鉴定出17种蛋白, 其中15种蛋白如Trangelin2、HSP27、S100A11、GSTP等在食管鳞状癌细胞中表达明显增高, 2种蛋白如SCCA1, 在食管鳞状癌细胞中表达明显降低.
结论: 提示17种差异蛋白可能与食管鳞状细胞癌的发生和发展有关, 为筛选食管鳞状细胞癌的特异性分子标志物奠定基础.
引文著录: 吕秀平, 蒲红伟, 龚晓瑾, 苗娜, 陈晓. MALDI-TOF-MS分析新疆食管鳞状细胞癌的蛋白组学. 世界华人消化杂志 2011; 19(36): 3682-3686
Revised: November 20, 2011
Accepted: December 18, 2011
Published online: December 28, 2011
AIM: To analyze differentially expressed proteins between human normal esophageal epithelial cells (NEEC) and esophageal squamous cell carcinoma (ESCC) cells.
METHODS: NEEC and ESCC cells were cut by laser capture microdissection (LCM), and total proteins of the cells were separated by two-dimensional gel electrophoresis (2-DE). 2-DE images were analyzed using Imagemaster 2D software. Differential proteins between NEEC and ESCC cells were identified by matrix-assisted laser desorption ionization time-of-flight mass spectrometry (MALDI-TOF-MS).
RESULTS: A total of 43 protein spots were discovered and there were 17 differentially expressed proteins between NECC and ESCC. Of them, 15 (such as Trangelin2, HSP27, S100A11 and GSTP) were up-regulated and two (such as SCCA1) down-regulated in ESCC.
CONCLUSION: The differentially expressed proteins identified in this study may play a role in the carcinogenesis and development of ESCC and represent potential molecular biomarkers for ESCC.
- Citation: Lv XP, Pu HW, Gong XJ, Miao N, Chen X. Proteomic analysis of differentially expressed proteins in esophageal squamous cell carcinoma by MALDI-TOF-MS. Shijie Huaren Xiaohua Zazhi 2011; 19(36): 3682-3686
- URL: https://www.wjgnet.com/1009-3079/full/v19/i36/3682.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i36.3682
食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)是世界上常见的消化系统恶性肿瘤之一, 在我国每年大约有24万食管癌新发病例[1], 据统计其5年生存率为3.5%-13.9%[2]. 在新疆维吾尔自治区食管癌死亡率为13.05/10万, 其中哈族死亡率为68.88/10万, 严重威胁着人们的健康[3]. 因此探讨食管癌的发生、发展机制, 寻找新的肿瘤标志物, 对食管癌的防治具有重要意义. 本研究采用激光捕获显微切割技术(laser capture microdissection, LCM)联合基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time of flight mass spectrometry, MALDI-TOF-MS), 分析食管鳞状癌细胞和食管正常上皮细胞的差异表达蛋白, 为筛选特异性肿瘤分子标志物奠定基础.
选取新疆医科大学第一附属医院2011-03/06新鲜手术切除标本12例, 术前未进行放化疗, 经病理组织学证实所有标本均为食管鳞状细胞癌, 切缘黏膜均为食管正常黏膜组织, 用冰盐水清洗干净后, 立即置于液氮中速冻, 然后放置-80 ℃冰箱保存. IPG胶条(pH3-10)购自GE公司, 2-DE试剂购自Amresco公司, 琼脂糖、BSA购自Promega公司, TFA购自Sigma公司, ACN购自Baker公司, 其他试剂购自国药集团化学试剂北京有限公司; 冰冻切割机(德国Leica CM 1900), LCM仪(美国Arcturus公司), PowerWave XS2型酶标仪(美国BioTek公司), 5417R冷冻型台式离心机(德国Eppendorf公司), Ettan IPGphorⅡ固相PH梯度等电聚焦仪、Ettan DALTtwelve system垂直电泳仪、Image Scanner扫描仪(瑞士Amersham Biosciences公司), 冷冻抽干机(美国Labconco公司), autoflexTOF/TOFⅡ质谱仪(德国Bruker公司).
1.2.1 冰冻切片的制备及激光捕获显微切割: 从-80 ℃冰箱取出待切冰冻组织后, 将其置于冰冻切片机中, 切片厚度10 μm, 冰冻切片用750 mL/L乙醇固定, 第一张切片用HE染色, 作为形态观察用, 以后每张切片只用苏木素染色. 用LCM分别切取食管鳞状癌细胞和食管正常上皮细胞.
1.2.2 样本制备: 将切下的细胞置于Eppendorf管中, 分别加入组织裂解缓冲液(7 mol/L尿素, 2 mol/L硫脲, 1%DTT, 4%CHAPS, 1 mmol/L EDTA•Na2, 40 mmol/L Tris), 迅速混匀, 并冰浴震荡30 min(温度不可超过37 ℃), 4 ℃裂解, 静置2 h, 12 000 g离心5 min, 提取上清, 用Bradford法测定蛋白质浓度.
1.2.3 二维凝胶电泳: 将蛋白质样品加入DTT, IPG buffer后与重泡胀液补齐到450 μL, 混合均匀, 高速离心2 min待用. 将重泡胀液均匀地加入到泡胀盘的凹槽中, 胶面向下放入24 cm IPG胶条, 胶条表面滴加覆盖油, 放置于等电聚焦仪上, 重泡胀过夜. 等电聚焦结束后, 将IPG胶条分别于平衡A液(1.5 mol/L Tris pH8.8, 6 mmol/L尿素, 0.2%DTT, 2%SDS, 30%甘油, 溴酚蓝), 平衡B液(1.5 mol/L Tris pH8.8, 6 mmol/L尿素, 3%碘乙酰胺, 2%SDS, 30%甘油, 溴酚蓝)中各平衡15 min, 平衡后的IPG胶条转移至13%SDS-PAGE胶上端, 胶条端滴加低分子量的蛋白标志物, 将胶板转移到Ettan DALT twelve system垂直电泳仪上, 加琼脂糖封胶液封胶, 进行第二项垂直电泳. 电泳结束后, 对2-D胶进行考马斯亮蓝染色. 在相同的实验条件和参数设置的情况下, 实验重复3次.
1.2.4 凝胶图像分析: 应用Image scanner扫描仪获取2D凝胶图像, Imagemaster 2D Platinum 7.0软件比较分析两者的2-DE图像的差异, 选取表达水平(相对体积)相差2倍以上的蛋白质点进行质谱分析.
1.2.5 质谱鉴定: 用刀片切取胶上差异蛋白点, 放入Eppendorf管, 进行胶内酶解, Trypsin冰上吸胀45 min, 37 ℃酶解16 h, 水溶液(35%, 65%, 100%乙腈, 0.1%TFA)超声3次, 真空冷冻浓缩至10 μL, 取样品进行点靶上样. 借助互联网上的蛋白质数据库检索程序Mascot(http://www.matrixscience.com), 通过NCBI蛋白质序列数据库进行检索.
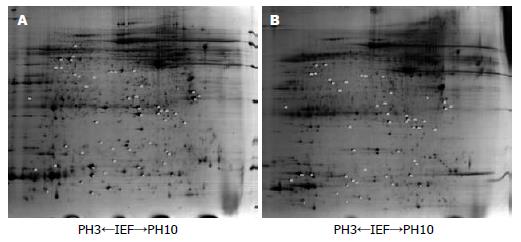
将切割的食管鳞状癌细胞和食管正常上皮细胞测定蛋白浓度后以蛋白浓度最低的样本为标准, 等体积混合, 在相同实验条件和参数设置的情况下, 试验重复3次, 通过2-DE分离技术, 创建了食管鳞状癌细胞和食管正常上皮细胞的二维凝胶电泳图谱(图1).
通过软件分析, 我们获得43个差异蛋白点, 应用质谱成功鉴定出17种差异蛋白(表1).
| Index | NCBI no | Mw/PI | Protein | score |
| 01 | gil5032057 | 11847/6.56 | ↑ protein S100-A11 | 75 |
| 02 | gil11935049 | 66198/8.16 | ↑keratin 1 | 70 |
| 03 | gil1869803 | 14878/6.29 | ↓ mammary-derived growth inhibitor | 81 |
| 04 | gil83754516 | 17268/6.18 | ↑Chain B, crystal structure of the chip-ubc13-uev1a complex | 111 |
| 05 | gil55960374 | 21244/7.63 | - transgelin 2 | 150 |
| 06 | gil186629 | 39832/4.72 | - keratin 10 | 93 |
| 07 | gil179032 | 22632/8.78 | ↑SM22 | 142 |
| 08 | gil4507669 | 19697/4.84 | ↑translationally-controlled tumor protein | 84 |
| 09 | gil47577 | 23250/5.02 | ↑rho GDP-dissociation inhibitor 1 isoform a | 96 |
| 10 | gil4504183 | 23569/5.34 | ↑glutathione S-transferase P | 141 |
| 11 | gil662841 | 22427/7.83 | ↑heat shock protein 27 | 142 |
| 12 | gil5454052 | 27871/4.68 | ↑14-3-3 protein sigma | 198 |
| 13 | gil2780871 | 16342/7.14 | ↑Chain B, Proteasome Activator Reg(Alpha) | 86 |
| 14 | gi62738525 | 43071/5.72 | ↑Chain A, The 2.8 A Structure Of A Tumour Suppressing Serpin | 162 |
| 15 | gil301030821 | 36874/6.17 | ↑c-myc promoter-binding protein 1 | 203 |
| 16 | gil239552 | 44564/6.35 | ↓squamous cell carcinoma antigen | 95 |
| 17 | gil20150229 | 13159/5.71 | ↑Chain A, Crystal Structure Of The Mrp14 Complexed With Chaps | 91 |
近年来随着蛋白组学实验技术和计算机生物信息处理技术的迅速发展, 以及激光捕获显微切割技术所具有的优点, 研究者们将其与蛋白组学研究技术相结合用于肿瘤发病机制的研究[4]. 本研究联合应用LCM和MALDI-TOF-MS对食管鳞状癌细胞和食管正常上皮细胞进行表达蛋白组学研究, 建立了2-DE图谱, 为筛选差异蛋白奠定基础.
Orimo等[5]应用LCM联合MALDI-TOF-MS分析研究肝细胞肝癌, 发现了EB-1蛋白, 指出该蛋白与肝癌预后有关, 对判定肝癌的预后和治疗有十分重要的意义. Cheng等[6]应用LCM获得纯化的贲门癌上皮细胞和正常的贲门上皮细胞, 比较二者的差异蛋白, 获得27个差异蛋白点. 这些蛋白涉及新陈代谢、分子伴侣、抗氧化、信号转导、凋亡、细胞增殖和分化等方面, 提示一些蛋白有望成为临床早期诊断的分子标志物. Xu等[7]联合应用LCM和质谱技术, 鉴定出一些新的分子标志物, 结果显示, S100A8在人类结直肠癌发展的不同阶段表达是上升的, 提出分子标志物的鉴定将有望为结直肠癌的发病机理研究奠定基础, 从而提高结直肠癌分子诊断的准确性. Mukherjee等[8]对12例食管正常组织, 12例食管癌在进行激光捕获显微切割后联合应用明胶酶谱分析基质金属蛋白酶的表达水平, 发现基质金属蛋白酶-3和基质金属蛋白酶-10的mRNA在食管癌中的表达水平明显高于正常食管组织, 认为这些表达上调的基因产物有望成为临床中一种新的早期检测标志物. 汪斌等[9]应用LCM 技术分离食管鳞状癌细胞和食管正常上皮细胞, 并结合二维凝胶电泳技术对两者的蛋白表达图谱进行分析, 发现48个差异蛋白点, 通过质谱鉴定出20种有意义的蛋白. 本实验针对新疆地区食管癌研究, 获得43个差异蛋白点, 通过质谱鉴定出17种有意义的蛋白, 其中15种蛋白仅在食管癌表达或高表达, 而2种蛋白在食管癌中表达下调. 这与上述研究的部分结果相一致, 这些蛋白涉及肿瘤的细胞信号转导、凋亡以及侵袭和转移等, 为研究新疆地区食管癌的发病机制及筛选食管癌的分子标志物奠定了基础.
在鉴定的差异蛋白质中, 热休克蛋白27(HSP27)及14-3-3 proteinε表达明显上调, 提示其对食管癌发生发展有重要的意义. HSP27是热休克蛋白家族中的低分子蛋白, 广泛存在与各种组织中, 近年来研究发现很多组织来源的肿瘤中存在着HSP27的持续高水平表达, 认为与肿瘤的发生、发展及肿瘤预后都有密切关系, 其机制可能与HSP27的抗凋亡有关[10,11]. Foster等[12]在对前列腺癌研究中发现HSP27可能通过促进内皮细胞的迁移, 参与肿瘤的侵袭转移过程而且认为HSP27可以作为一个独立的预后指标. Chen等[13]研究表明, HSP27在食管鳞状细胞癌中表达为62%, 但在低分化食管癌中表达降低, 提示HSP27的表达水平可能和食管癌的分化程度有关. 在本组研究中, HSP27在食管癌中的表达明显上调, 提示HSP27在新疆地区食管癌的发病机制中可能发挥重要作用.
14-3-3 proteinε是14-3-3蛋白家族中成员. 目前已经证实200多种蛋白与14-3-3家族成员之间存在相互作用, 14-3-3蛋白与其靶分子的相互作用有赖于14-3-3结合域的识别及14-3-3靶分子的丝氨酸/苏氨酸磷酸化[14]. 该家族可以和许多信号蛋白, 包括激酶、磷酸酶和跨膜受体等结合, 在信号传导、细胞周期以及细胞凋亡的调控等方面发挥重要作用. 在14-3-3蛋白的7个亚型中, 目前已知14-3-3 proteinσ和肿瘤的发生密切相关, 关于14-3-3 proteinε在肿瘤中的作用机制, 目前国内外的报道尚不多, 但有研究表明, 在某些肿瘤中14-3-3 proteinε基因有频繁的杂合子丢失[15], 王斌等[9]在研究中发现14-3-3proteinε在食管癌组织中表达上调, 这与本实验结果相符. 但Harada等[16]在对16例食管鳞状细胞癌进行蛋白组学的研究中发现14-3-3proteinε在食管癌组织中表达下调, 这可能与实验样本数目不同或与个体差异有关, 因为同一类型的肿瘤在不同的个体中, 分子生物学特性有所不同.
本实验建立了食管鳞状癌细胞和正常食管上皮细胞的二维凝胶电泳图谱, 鉴定出17种蛋白. 他们可能参与食管癌的发生发展, 为筛选食管癌的分子标志物提供依据. 关于他们在食管癌发生发展过程中的作用我们将在后续实验中进一步研究.
我国每年大约有24万食管癌新发病例, 其5年生存率较低. 我国新疆维吾尔自治区食管癌死亡率较高. 从蛋白水平研究肿瘤的发病机制, 筛选特异性肿瘤分子标志物为食管鳞状细胞癌的早诊早治提供依据.
李晟磊, 副主任医师, 郑州大学医学院病理教研室, 河南省肿瘤病理重点实验室
随着蛋白组学的发展, 从蛋白水平研究肿瘤的发病机制成为热点, 为寻找肿瘤分子标志物及新的治疗靶点提供了良好的技术平台.
Xu等联合应用LCM和质谱技术, 鉴定出一些新的分子标志物, 结果显示, S100A8在人类结直肠癌发展的不同阶段表达是上升的, 提出分子标志物的鉴定将有望为结直肠癌的发病机理研究奠定基础, 从而提高结直肠癌分子诊断的准确性.
本研究应用蛋白组学技术对食管鳞状细胞癌发病机制进行研究, 筛选特异性肿瘤分子标志, 对食管鳞状细胞癌的早诊早治及预后具有指导意义.
鉴定的差异蛋白可能与食管癌的发生发展有关, 筛选的特异性肿瘤分子标志物可能成为指导临床早期诊断、治疗及判断预后的重要指标.
本文利用蛋白组学的相关技术对正常食管上皮细胞和食管鳞状癌细胞的差异蛋白进行分析, 鉴定出的蛋白具有一定的意义.
编辑: 曹丽鸥 电编:闫晋利
| 3. | 马红, 陈晓, 马海梅, 尼加提•热合木, 蒲红伟. E-cadh-erin、β-catenin和CathepsinD在食管鳞状细胞癌中的表达及其意义. 世界华人消化杂志. 2008;16:1757-1762. [DOI] |
| 4. | Zhang D, Koay ES. Analysis of laser capture microdissected cells by 2-dimensional gel electrophoresis. Methods Mol Biol. 2008;428:77-91. [PubMed] [DOI] |
| 5. | Orimo T, Ojima H, Hiraoka N, Saito S, Kosuge T, Kakisaka T, Yokoo H, Nakanishi K, Kamiyama T, Todo S. Proteomic profiling reveals the prognostic value of adenomatous polyposis coli-end-binding protein 1 in hepatocellular carcinoma. Hepatology. 2008;48:1851-1863. [PubMed] [DOI] |
| 6. | Cheng Y, Zhang J, Li Y, Wang Y, Gong J. Proteome analysis of human gastric cardia adenocarcinoma by laser capture microdissection. BMC Cancer. 2007;7:191. [PubMed] [DOI] |
| 7. | Xu BJ, Li J, Beauchamp RD, Shyr Y, Li M, Washington MK, Yeatman TJ, Whitehead RH, Coffey RJ, Caprioli RM. Identification of early intestinal neoplasia protein biomarkers using laser capture microdissection and MALDI MS. Mol Cell Proteomics. 2009;8:936-945. [PubMed] [DOI] |
| 8. | Mukherjee S, Roth MJ, Dawsey SM, Yan W, Rodriguez-Canales J, Erickson HS, Hu N, Goldstein AM, Taylor PR, Richardson AM. Increased matrix metalloproteinase activation in esophageal squamous cell carcinoma. J Transl Med. 2010;8:91. [PubMed] [DOI] |
| 10. | Lebret T, Watson RW, Molinié V, O'Neill A, Gabriel C, Fitzpatrick JM, Botto H. Heat shock proteins HSP27, HSP60, HSP70, and HSP90: expression in bladder carcinoma. Cancer. 2003;98:970-977. [PubMed] [DOI] |
| 11. | Vanmuylder N, Evrard L, Daelemans P, Van Reck J, Dourov N. [Expression of heat shock proteins in salivary gland tumors. Immunohistochemical study of HSP27, HSP70, HSP90, and HSP110: apropos of 50 cases]. Ann Pathol. 2000;20:190-195. [PubMed] |
| 12. | Foster CS, Dodson AR, Ambroisine L, Fisher G, Møller H, Clark J, Attard G, De-Bono J, Scardino P, Reuter VE. Hsp-27 expression at diagnosis predicts poor clinical outcome in prostate cancer independent of ETS-gene rearrangement. Br J Cancer. 2009;101:1137-1144. [PubMed] [DOI] |
| 13. | Chen JH, Chen LM, Xu LY, Wu MY, Shen ZY. [Expression and significance of heat shock proteins in esophageal squamous cell carcinoma]. Zhonghua Zhongliu Zazhi. 2006;28:758-761. [PubMed] |
| 14. | Uchida S, Kuma A, Ohtsubo M, Shimura M, Hirata M, Nakagama H, Matsunaga T, Ishizaka Y, Yamashita K. Binding of 14-3-3beta but not 14-3-3sigma controls the cytoplasmic localization of CDC25B: binding site preferences of 14-3-3 subtypes and the subcellular localization of CDC25B. J Cell Sci. 2004;117:3011-3020. [PubMed] [DOI] |
| 15. | Fu H, Subramanian RR, Masters SC. 14-3-3 proteins: structure, function, and regulation. Annu Rev Pharmacol Toxicol. 2000;40:617-647. [PubMed] [DOI] |
| 16. | Harada T, Kuramitsu Y, Makino A, Fujimoto M, Iizuka N, Hoshii Y, Takashima M, Tamesa M, Nishimura T, Takeda S. Expression of tropomyosin alpha 4 chain is increased in esophageal squamous cell carcinoma as evidenced by proteomic profiling by two-dimensional electrophoresis and liquid chromatography-mass spectrometry/mass spectrometry. Proteomics Clin Appl. 2007;1:215-223. [PubMed] [DOI] |