修回日期: 2011-11-18
接受日期: 2011-12-18
在线出版日期: 2011-12-28
目的: 研究LY294002联合吉西他滨对体外培养的人胰腺癌PANC-1细胞内p-Akt和MRP表达的作用.
方法: 半定量RT-PCR和Western blot检测不同浓度的LY294002联合吉西他滨用药后PANC-1细胞内MRP mRNA以及p-Akt和MRP蛋白表达水平的变化.
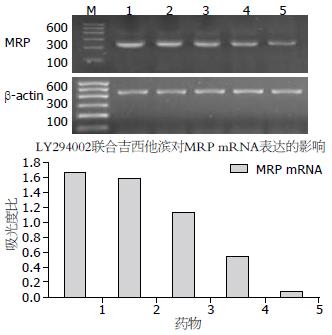
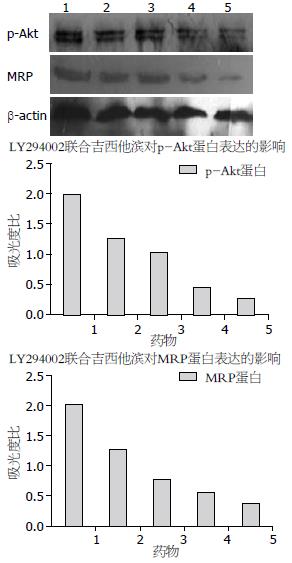
结果: LY294002联合吉西他滨能显著抑制PANC-1细胞内MRP mRNA的表达(1.47±0.03, 1.31±0.05, 1.02±0.04, 0.76±0.06, 0.37±0.02, P<0.05), 亦显著抑制p-Akt和MRP蛋白的表达, 并且这种抑制作用与药物浓度显著相关(p-Akt: 0.80±0.02, 0.63±0.01, 0.52±0.01, 0.41±0.02, 0.35±0.02, P<0.05; MRP: 0.93±0.05, 0.87±0.03, 0.81±0.03, 0.71±0.02, 0.40±0.03, P<0.05), 在其浓度最大组抑制效应达到最大.
结论: LY294002可能通过抑制PI3K/Akt信号途径抑制MRP mRNA和蛋白的表达, 逆转肿瘤的耐药.
引文著录: 柯晓煜, 王渝, 谢祚启, 刘志清, 赵秋. LY294002联合吉西他滨对胰腺癌PANC-1细胞p-Akt和MRP表达的影响. 世界华人消化杂志 2011; 19(36): 3678-3681
Revised: November 18, 2011
Accepted: December 18, 2011
Published online: December 28, 2011
AIM: To investigate the effect of LY294002 (a PI3K inhibitor) combined with gemcitabine on p-Akt and multidrug resistance-associated protein (MRP) expression in human pancreatic carcinoma PANC-1 cells.
METHODS: After PANC-1 cells were treated with different concentrations of LY294002 and gemcitabine, the expression of MRP mRNA and p-Akt and MRP proteins was detected by semi-quantitative RT-PCR and Western blot, respectively.
RESULTS: Compared to untreated control cells, treatment with LY294002 combined with gemcitabine significantly decreased the expression of MRP mRNA (1.47 ± 0.03, 1.31 ± 0.05, 1.02 ± 0.04, 0.76 ± 0.06, 0.37 ± 0.02, P < 0.05) and p-Akt and MRP proteins (p-Akt: 0.80±0.02, 0.63±0.01, 0.52±0.01, 0.41 ± 0.02, 0.35 ± 0.02, P < 0.05; MRP: 0.93 ± 0.05, 0.87 ± 0.03, 0.81 ± 0.03, 0.71 ± 0.02, 0.40 ± 0.03, both P < 0.05) in a concentration-dependent manner.
CONCLUSION: LY294002 could effectively strengthen the sensitivity of human pancreatic carcinoma PANC-1 cells to gemcitabine. LY294002 may down-regulate MRP transcription by inhibiting p-Akt expression and therefore reverse resistance of PANC-1 cells to gemcitabine.
- Citation: Ke XY, Wang Y, Xie ZQ, Liu ZQ, Zhao Q. LY294002 combined with gemcitabine inhibits p-Akt and MRP expression in human pancreatic carcinoma PANC-1 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(36): 3678-3681
- URL: https://www.wjgnet.com/1009-3079/full/v19/i36/3678.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i36.3678
PI3K家族参与多种信号通路, 以PI3K/Akt信号转导通路尤为重要. PI3K/Akt信号转导通路的异常活化在肿瘤发生发展中起重要作用, 并可能是导致肿瘤细胞对化疗药物敏感性低甚至耐药的一个重要原因[1,2]. LY294002是靶向PI3K催化亚基p110抑制剂, 能有效抑制PI3K/Akt信号转导通路[3,4]. 本实验研究将通过给予不同浓度的LY294002联合吉西他滨干预人胰腺癌PANC-1细胞, 探讨LY294002是否可通过PI3K/Akt信号途径抑制p-Akt、MRP mRNA和蛋白的表达, 增强胰腺癌细胞对化疗药物治疗的敏感性.
Trizol试剂购自上海生物工程技术服务有限公司; M-MLV逆转录酶购自美国Promega公司; Taq DNA聚合酶购自美国Fermentas公司; 兔抗人单克隆抗体和鼠抗人MRP单克隆抗体购自英国Abcam公司; 鼠抗人β-actin多克隆抗体购自美国Sant Cruz公司; HRP标记的羊抗兔IgG抗体和HRP标记的羊抗鼠IgG抗体购自美国Fermentas公司.
1.2.1 细胞株及其培养: 人胰腺癌PANC-1细胞株购自上海细胞库. 用100 mL/L胎牛血清高糖DMEM培养液培养PANC-1细胞株, 均在37 ℃、50 mL/L CO2、饱和湿度的普通CO2培养箱内贴壁培养. 吉西他滨用生理盐水溶解, LY294002用DMSO溶解, 用DMEM培养基稀释成设计浓度(保证培养瓶中的DMSO≤1%). 细胞常氧培养24 h, 待贴壁生长融合至80%时, 将细胞随机分为5组: (1)对照组, 不添加任何药物; (2)20 μmol/L吉西他滨处理组; (3)10 μmol/L LY294002联合20 μmol/L吉西他滨处理组; (4)25 μmol/L LY294002联合20 μmol/L吉西他滨处理组; (5)50 μmol/L LY294002联合20 μmol/L吉西他滨处理组. 20 μmol/L吉西他滨置于培养箱中持续培养24 h后, 加入LY294002置于培养箱中持续培养24 h.
1.2.2 RT-PCR检测MRP的mRNA表达: 收集经药物处理的胰腺癌PANC-1细胞, 采用Trizol试剂提取细胞总RNA, 逆转录合成cDNA. MRP上游引物: 5'-TGAAGGACTTCGTGTCAGCC-3', 下游引物: 5'-GTCCATGATGGTGTTGAGCC-3', 预扩增片断257 bp, 退火温度60 ℃; 以β-actin作为内参, 引物序列为: 5'-GTGGACATCCGCAAAGAC-3', 5'-GCTGTCACCTTCACCGTTC-3', 预扩增片断438 bp, 退火温度59 ℃. 各条引物均由上海生工生物工程技术服务有限公司合成. 扩增产物用1.5% TAE琼脂糖凝胶在120 V电压下电泳30 min, 紫外线下凝胶置于成像系统下进行拍照, 各组条带净灰度值进行半定量分析, 与内参照的测定结果比较, 计算其比值.
1.2.3 Western blot检测p-Akt和MRP蛋白的表达: 收集经药物处理的胰腺癌PANC-1细胞, 采用细胞裂解液提取总蛋白, 加热变性后-20 ℃保存. 取50 μg蛋白进行SDS-PAGE凝胶电泳, 将凝胶中的蛋白质用转移系统印转到硝酸纤维素膜上, 放入封闭液(TBS+5%脱脂奶粉+0.1% tween20)室温振荡封闭2 h. 分别加入兔抗人p-Akt单克隆抗体(1:500), 鼠抗人MRP单克隆抗体(1:250), 鼠抗人β-actin多克隆抗体(1:100), 4 ℃孵育过夜. 分别按1:7 000加入辣根过氧化物酶(HRP)标记的羊抗兔IgG或羊抗鼠IgG, 37 ℃孵育1 h. 采用化学发光法(ECL)曝光胶片, 采集图像及条带净灰度值, 并与内参照的测定结果比较, 计算其比值.
统计学处理 采用SPSS13.0进行统计学分析, 实验所得所有数据均以mean±SD表示. PCR和Western blot两组间比较采用S-N-K检验, 多组间比较采用方差分析. P<0.05有统计学意义.
RT-PCR结果显示, MRP mRNA在吉西他滨处理组中的表达明显低于其在空白对照组中的表达, 两者间有显著性差异(P<0.05), 不同浓度的LY294002联合吉西他滨处理组中, 随着LY294002作用浓度的增加, MRP mRNA的表达水平呈下降趋势, 并与药物浓度显著相关(P<0.05, 图1).
Western blot结果显示, p-Akt蛋白在吉西他滨处理组细胞内的表达与空白对照组相比无明显差异; 而吉西他滨处理组细胞中MRP蛋白的表达量明显低于其在空白对照组中的表达量, 两组间存在显著性差异(P<0.05). 在不同浓度的LY294002联合吉西他滨处理组, LY294002均可明显抑制PANC-1细胞内p-Akt、MRP蛋白的表达, 并且这种抑制作用与药物浓度显著相关(P<0.05), 在药物浓度最大组三者抑制效应均达最大(图2).
1984年发现的一类胞内特异性磷酸化肌醇磷脂3羟基的激酶PI3K是由p110催化亚基和p85调节亚基构成的异源二聚体, 称为PI3Ks家族, 以PI3K/Akt信号转导通路尤为重要[5-7]. PI3K/Akt信号转导通路的异常激活则在刺激肿瘤细胞恶性增殖和血管形成、增强肿瘤细胞的侵袭转移能力中起着中枢作用, 而且可能导致肿瘤细胞对化疗药物敏感性低甚至耐药[8,9]. Akt为蛋白激酶B(PKB), 是一种丝/苏氨酸蛋白激酶, 蛋白质产物与蛋白激酶A、蛋白激酶C有高度的同源性, 处于PI3K/Akt信号转导通路的核心部位. Akt只有催化结构域的Thr308位点和调节结构域的Ser473位点2个位点的磷酸化才能使Akt充分活化, 也就是只有磷酸化的Akt(p-Akt)才具有生物学活性. 多种生长因子、激素等均可刺激Akt的活化, Akt的活化除了能促进肿瘤发生发展, 还促使肿瘤细胞多药耐药的发生, 所以特异性抑制Akt活性可能是治疗肿瘤并增强化疗效果的有效途径[10-12]. Chen等[13]在肝细胞癌的研究中发现, Bortezomib能抑制PI3K下调活化的Akt水平, 进而克服细胞对TRAIL的耐药, 这进一步证明p-Akt的活化可能是肿瘤多药耐药的产生机制之一.
肿瘤多药耐药的重要机制是ABC超家族的几个运载体介导的药物外流量加大, 特别是BCRP(ABCG2)、MDR1P-glycoprotein(ABCB1)和MRP(ABCC)家族成员在介导多药耐药中起着重要作用[14,15]. 其中MRP的表达能影响胰腺癌的生物学行为, 并可能是胰腺癌产生多药耐药的部分原因, MRP的研究可能有助于预测胰腺癌患者的化疗效果[16].
PI3K-AKT信号转导通路是否通过上调多药耐药相关蛋白导致肿瘤细胞对化疗药物敏感性低甚至耐药尚在进一步研究中. LY294002是靶向PI3K催化亚基p110的抑制剂, 能有效抑制PI3K/Akt信号转导通路. 有研究表明LY294002能够有效抑制体内外肿瘤细胞的生长, 这种抑瘤效果经证实与其对PI3K及其下游的抑制有关[3]. 若LY294002与化疗药物联合使用能够更有效并降低毒性, 则表明PI3K抑制剂与传统化疗药物的联用为治疗那些已对传统化疗药物产生耐药性的肿瘤患者提供了更好地选择.
本研究通过给予不同浓度的LY294002联合吉西他滨干预人胰腺癌PANC-1细胞, RT-PCR检测不同浓度的LY294002联合吉西他滨对MRP mRNA表达的影响, Western blot检测不同浓度的LY294002联合吉西他滨对p-Akt和MRP蛋白表达的影响. 该研究发现不同浓度的LY294002联合吉西他滨可显著抑制PANC-1细胞MRP mRNA的表达, 亦可显著抑制PANC-1细胞p-Akt和MRP蛋白的表达, 而且LY294002联合吉西他滨的抑制效应随着LY294002药物作用浓度的增高而增大. 结果表明LY294002联合吉西他滨可通过PI3K/Akt信号途径抑制p-Akt和MRP的表达, 使药物抑制细胞恶性转化的能力增强.
总之, PI3K/Akt信号途径可诱导MRP的异常过表达, 其过表达在胰腺癌对化疗抵抗中起着很显著的作用. LY294002可能通过抑制PI3K/Akt信号途径抑制p-Akt和MRP的表达逆转耐药.
PI3K/Akt信号转导通路的异常活化在肿瘤发生发展中起重要作用, 并可能是导致肿瘤细胞对化疗药物敏感性低甚至耐药的一个重要原因. LY294002是能有效抑制PI3K/Akt信号转导通路, 吉西他滨是常见的胰腺癌化疗药物. 但未能明确LY294002是否能促进化疗药物的化疗作用.
谷俊朝, 主任医师, 首都医科大学附属北京友谊医院普外科
LY294002在胰腺癌中的研究刚刚起步, 其具体的作用机制有待进一步研究.
研究资料表明, PI3K/Akt除了能促进肿瘤发生发展, 还促使肿瘤细胞多药耐药的发生, 而MRP可能是胰腺癌产生多药耐药的部分原因, 但未能进一步揭示其中的具体机制从而增强化疗效果.
本研究首次检测LY294002联合吉西他滨对人胰腺癌PANC-1细胞内p-Akt、MRP基因表达的影响, 探讨LY294002是否增强吉西他滨对胰腺癌细胞的敏感性.
本研究为胰腺癌的基因治疗以及通过调控基因增强化疗药物对胰腺癌的治疗效果提供理论依据, 表明PI3K抑制剂与传统化疗药物的联用对治疗那些已对传统化疗药物产生耐药性的肿瘤患者提供更好的选择.
本文对LY294002对吉西他滨在胰腺癌化疗增敏效应中的作用进行了探讨, 得出初步结论, 具有一定的科学性.
编辑: 曹丽鸥 电编:闫晋利
| 2. | McCubrey JA, Steelman LS, Abrams SL, Lee JT, Chang F, Bertrand FE, Navolanic PM, Terrian DM, Franklin RA, D'Assoro AB. Roles of the RAF/MEK/ERK and PI3K/PTEN/AKT pathways in malignant transformation and drug resistance. Adv Enzyme Regul. 2006;46:249-279. [PubMed] [DOI] |
| 3. | Semba S, Itoh N, Ito M, Harada M, Yamakawa M. The in vitro and in vivo effects of 2-(4-morpholinyl)-8-phenyl-chromone (LY294002), a specific inhibitor of phosphatidylinositol 3'-kinase, in human colon cancer cells. Clin Cancer Res. 2002;8:1957-1963. [PubMed] |
| 4. | Lee CM, Fuhrman CB, Planelles V, Peltier MR, Gaffney DK, Soisson AP, Dodson MK, Tolley HD, Green CL, Zempolich KA. Phosphatidylinositol 3-kinase inhibition by LY294002 radiosensitizes human cervical cancer cell lines. Clin Cancer Res. 2006;12:250-256. [PubMed] [DOI] |
| 5. | West KA, Castillo SS, Dennis PA. Activation of the PI3K/Akt pathway and chemotherapeutic resistance. Drug Resist Updat. 2002;5:234-248. [PubMed] [DOI] |
| 6. | Stoll V, Calleja V, Vassaux G, Downward J, Lemoine NR. Dominant negative inhibitors of signalling through the phosphoinositol 3-kinase pathway for gene therapy of pancreatic cancer. Gut. 2005;54:109-116. [PubMed] [DOI] |
| 7. | Reichert M, Saur D, Hamacher R, Schmid RM, Schneider G. Phosphoinositide-3-kinase signaling controls S-phase kinase-associated protein 2 transcription via E2F1 in pancreatic ductal adenocarcinoma cells. Cancer Res. 2007;67:4149-4156. [PubMed] [DOI] |
| 8. | Takeda A, Osaki M, Adachi K, Honjo S, Ito H. Role of the phosphatidylinositol 3'-kinase-Akt signal pathway in the proliferation of human pancreatic ductal carcinoma cell lines. Pancreas. 2004;28:353-358. [PubMed] [DOI] |
| 9. | Chang F, Lee JT, Navolanic PM, Steelman LS, Shelton JG, Blalock WL, Franklin RA, McCubrey JA. Involvement of PI3K/Akt pathway in cell cycle progression, apoptosis, and neoplastic transformation: a target for cancer chemotherapy. Leukemia. 2003;17:590-603. [PubMed] [DOI] |
| 10. | Matsumoto J, Kaneda M, Tada M, Hamada J, Okushiba S, Kondo S, Katoh H, Moriuchi T. Differential mechanisms of constitutive Akt/PKB activation and its influence on gene expression in pancreatic cancer cells. Jpn J Cancer Res. 2002;93:1317-1326. [PubMed] [DOI] |
| 11. | Semba S, Moriya T, Kimura W, Yamakawa M. Phosphorylated Akt/PKB controls cell growth and apoptosis in intraductal papillary-mucinous tumor and invasive ductal adenocarcinoma of the pancreas. Pancreas. 2003;26:250-257. [PubMed] [DOI] |
| 12. | Altomare DA, Tanno S, De Rienzo A, Klein-Szanto AJ, Tanno S, Skele KL, Hoffman JP, Testa JR. Frequent activation of AKT2 kinase in human pancreatic carcinomas. J Cell Biochem. 2002;87:470-476. [PubMed] [DOI] |
| 13. | Chen KF, Yeh PY, Hsu C, Hsu CH, Lu YS, Hsieh HP, Chen PJ, Cheng AL. Bortezomib overcomes tumor necrosis factor-related apoptosis-inducing ligand resistance in hepatocellular carcinoma cells in part through the inhibition of the phosphatidylinositol 3-kinase/Akt pathway. J Biol Chem. 2009;284:11121-11133. [PubMed] [DOI] |
| 14. | O'Driscoll L, Walsh N, Larkin A, Ballot J, Ooi WS, Gullo G, O'Connor R, Clynes M, Crown J, Kennedy S. MDR1/P-glycoprotein and MRP-1 drug efflux pumps in pancreatic carcinoma. Anticancer Res. 2007;27:2115-2120. [PubMed] |
| 15. | König J, Hartel M, Nies AT, Martignoni ME, Guo J, Büchler MW, Friess H, Keppler D. Expression and localization of human multidrug resistance protein (ABCC) family members in pancreatic carcinoma. Int J Cancer. 2005;115:359-367. [PubMed] [DOI] |
| 16. | Yao J, Feng FY, Lin C, Zhang XY, Fu M, Liang X, Yang Y. [The mechanism of resistance to 2', 2'-difluorodeoxycytidine (gemcitabine) in a pancreatic cancer cell line]. Zhonghua Zhongliu Zazhi. 2005;27:721-726. [PubMed] |