修回日期: 2011-12-05
接受日期: 2011-12-18
在线出版日期: 2011-12-28
目的: 观察从人肝癌细胞系HepG2中分离的CD117+细胞生物学行为, 探讨肝癌中CD117+细胞亚群的干细胞特性.
方法: 采用无血清悬浮培养法培养HepG2细胞, 流式细胞术检测HepG2及球体细胞中CD117的表达比例. 用流式细胞分选技术从HepG2成球细胞中分离CD117+的肿瘤细胞, 进行无血清悬浮培养, 观察其成球能力. CCK-8法观察CD117+细胞的增殖能力和顺铂对CD117+细胞的抑制率, 计算IC50和耐药指数(RI).
结果: HepG2细胞能在无血清培养基中存活、增殖并形成细胞球, 成球率为6.21%±2.03%; 流式细胞检测发现球体细胞中CD117+细胞的比例比HepG2细胞提升了9倍; CD117+细胞在无血清培养基中成球率和增殖能力均显著高于未分选细胞和CD117-细胞; CD117+细胞在各浓度的顺铂作用下抑制率均较未分选细胞和CD117-细胞明显降低, 三者IC50分别为12.229 μmol/L、7.970 μmol/L 和7.345 μmol/L, CD117+细胞和未分选细胞耐药系数RI为1.165和1.076.
结论: 人肝癌细胞系HepG2中的CD117+细胞是具有肿瘤干细胞特性的细胞亚群, CD117可能是肝癌干细胞的候选表面分子标志物.
引文著录: 容雁, 王云霞, 孙立新, 张晓艳, 杨治华, 冉宇靓, 孙力超. CD117阳性细胞亚群在肝癌细胞系HepG2中的分离及其特性. 世界华人消化杂志 2011; 19(36): 3649-3655
Revised: December 5, 2011
Accepted: December 18, 2011
Published online: December 28, 2011
AIM: To isolate CD117+ cells from human hepatocarcinoma cell line HepG2 and to observe their biological behavior and stem cell properties.
METHODS: HepG2 cells were cultured in serum-free medium. Flow cytometry was used to detect the expression of CD117 in HepG2 cells and sphere cells. CD117+ and CD117- cells were sorted by FACS and their ability of proliferation and self-renewal was observed in vitro. Chemosensitivity to cisplatin was determined by CCK-8 assay. The inhibitory rate of cells treated with cisplatin, the half maximal inhibitory concentration (IC50) and resistance index (RI) were measured.
RESULTS: HepG2 cells could survive, proliferate and form sphere cells in serum-free medium. The sphere-forming rate was 6.21% ± 2.03%. The percentage of CD117+ cells population in sphere cells increased by 9 folds compared to HepG2 cells. The sphere-forming ability and proliferation ability of CD117+ subpopulation in serum-free medium were significantly higher than un-sorted cells and CD117- cells. The inhibitory rate of CD117+ cells treated with cisplatin of different concentrations was lower than un-sorted cells and CD117- cells. The IC50 were 12.229 μmol/L in CD117+ cells, 7.970 μmol/L in un-sorted cells, and 7.345 μmol/L in CD117- cells, and the RI of CD117+ cells and un-sorted cells were 1.165 and 1.076, respectively.
CONCLUSION: CD117+ cells are a subpopulation of HepG2 cells with stem cell properties. CD117 may be a candidate surface marker for liver cancer stem cells.
- Citation: Rong Y, Wang YX, Sun LX, Zhang XY, Yang ZH, Ran YL, Sun LC. CD117-positive cells in human hepatocarcinoma cell line HepG2: isolation and evaluation of their stem cell properties. Shijie Huaren Xiaohua Zazhi 2011; 19(36): 3649-3655
- URL: https://www.wjgnet.com/1009-3079/full/v19/i36/3649.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i36.3649
肝癌是常见的恶性肿瘤之一, 其死亡率居所有恶性肿瘤中的第3位, 近年来5年生存率未见显著提高, 耐药、复发、转移仍是中晚期肝癌病人死亡的重要原因. 越来越多的证据表明, 肿瘤干细胞与肿瘤的耐药、复发、转移密切相关[1,2], 其具有的自我更新、诱导分化、高致瘤性、抵抗放化疗能力, 被认为是肿瘤发生、发展、转移、耐药、复发的根源[3,4]. 目前, 对肝癌干细胞的研究尚处于探索阶段, 有报道应用CD90[5,6]从原代肝癌组织中分离获得肝癌干细胞, 但其操作过程复杂、易污染等问题限制了他在研究工作中的广泛应用. 肿瘤细胞系易获得、易保存的特点使其在肿瘤干细胞研究中存在一定优势. 已有多家研究小组应用SP[7,8]、CD133[9,10]、OV6[11]、EpCAM[12,13]等标志物从肝癌细胞系中分离肝癌干细胞. 因此, 本研究以肝癌细胞系HepG2为研究对象, 证明其中是否存在肝癌干细胞, 分离其表面标志物, 幷鉴定其生物学行为, 为肝癌干细胞研究提供合适的细胞系模型.
人肝癌细胞HepG2由中国医学科学院肿瘤研究所分子肿瘤学国家重点实验室保存, DMEM、DMEM/F12(1:1)培养基(Hyclone), 胎牛血清、人表皮生长因子(EGF)、人碱性成纤维生长因子(bFGF)、B27(Gibco)、白细胞抑制因子(LIF)、亲脂荧光染料PKH26(Sigma), 抗CD117-PE(ebioscience), 兔抗CD117多克隆抗体(ABcam), 488标记山羊抗兔IgG(Jackson), Matrigel(BD), transwell小室购自Millipore公司.
1.2.1 细胞培养及传代: HepG2细胞用含100 mL/L胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM培养基, 在37 ℃、50 mL/L CO2饱和湿度条件下培养; 2.5 g/L胰蛋白酶进行消化、传代.
1.2.2 HepG2球体细胞的培养: 取对数生长期的HepG2细胞消化后, HBSS洗2次, 精确计数, 用含EGF(20 ng/mL)、bFGF(20 ng/mL)、B27(1:50)、LIF(10 ng/mL)、100 U/mL青霉素和100 U/mL链霉素的DMEM/F12(1:1)无血清培养基, 以500个/孔接种于低黏附24孔板中, 在37 ℃、50 mL/L CO2孵箱中培养9 d, 倒置显微镜下观察成球数.
1.2.3 PKH26染色: 已有的研究[14]表明肿瘤干细胞能够在无血清培养基中成球生长, 是肿瘤干细胞的标志之一. 同时文献报道亲脂性染料PKH26能够被肿瘤干细胞长期保留可用于标记肿瘤干细胞[15], 因此我们对HepG2细胞进行PKH26染色后进行无血清悬浮培养. 参照PKH26染料说明书进行. 消化对数生长期的HepG2细胞, 血清终止后用无血清培养基洗1次, 用试剂盒中的C液稀释细胞至2×107/mL, 同时用C液将PKH26染料稀释为4×10-6 mol/L, 迅速将上述二者以1:1体积混合, 室温孵育5 min后用等量血清终止染色, 再用含血清培养基洗2次, 无血清培养基洗1次. 用无血清培养基重悬至500个/mL, 每孔1 mL种入低黏附24孔板中, 在不同时间点观察染料在球体细胞中的分布情况.
1.2.4 流式细胞术检测HepG2细胞及球体细胞CD117的表达: 分别收集HepG2细胞和球体细胞, 制备单细胞悬液幷调整浓度至1×106/mL, 加入抗CD117-PE(1:20), 室温避光孵育30 min, HBSS洗3次, 流式细胞仪检测阳性细胞比例.
1.2.5 CD117+和CD117-亚群细胞的分选: 消化球体细胞后用HBSS洗1次, 重悬至1×107/mL, 加入抗CD117-PE(1:20), 室温避光孵育30 min, HBSS洗2次, 用含1%BSA的PBS重悬细胞, 流式细胞仪分选.
1.2.6 自我更新能力比较: 分选获得的CD117+、CD117-和未分选细胞, 用含0.8%甲基纤维素的DMEM/F12(1:1)无血清培养基稀释细胞密度至500个/mL, 1 mL/孔接种至低黏附24孔培养板, 9 d后观察成球数.
1.2.7 体外增殖能力检测: 将分选获得的CD117+、CD117-、未分选细胞用无血清培养基稀释至1×104/mL, 每组设置3个平行孔, 200 μL/孔接种至96孔板, 在37 ℃、50 mL/L CO2孵箱中培养, 每2 d换液1次, 在2、4、6 d用CCK-8法测定细胞的增殖情况.
1.2.8 耐药能力比较: 将CD117+、CD117-和未分选细胞亚群, 以6 000细胞/孔接种至96孔板, 两组中每个药物浓度设置3个平行孔, 培养24 h待细胞完全贴壁后, 更换含顺铂的完全培养基, 药物浓度依次为0、3、6、9、12、15 μmol/L, 48 h更换1次含顺铂的完全培养基, 96 h采用CCK-8法检测A450值, 计算抑制率、IC50值及耐药系数RI. 抑制率(%) = [1-(Ax-A)/(Ao-A)]×100%, 公式中Ax为加药孔A450值, A为对照孔A450值, Ao为不加药孔A450值; IC50计算器软件计算50%细胞生长抑制时的药物浓度(IC50); 耐药指数RI = IC50 CD117+/IC50 CD117-.
统计学处理 数据以mean±SD形式表示, 应用SPSS13.0统计软件包分析, 组间差异采用t检验, 以P<0.05或P<0.01表示差异有统计学意义.
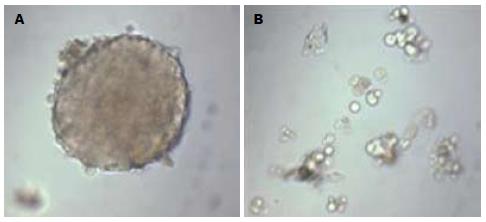
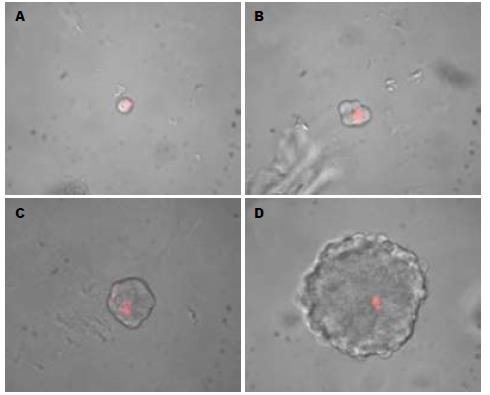
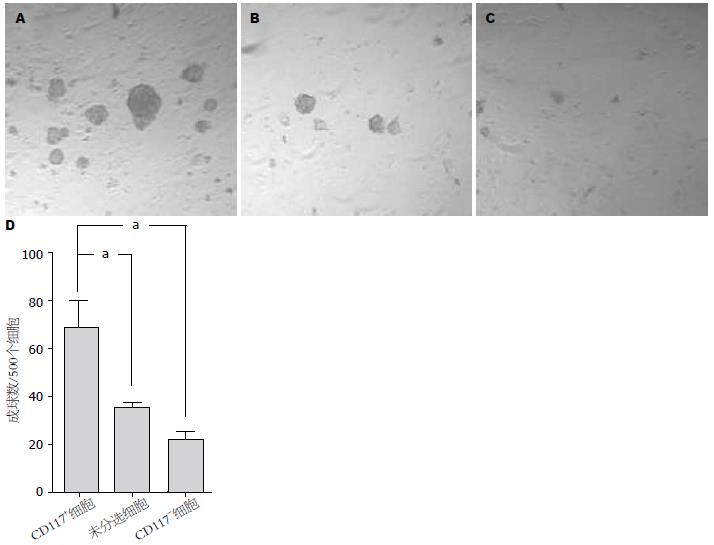
将人肝癌细胞系HepG2在无血清培养基中培养72 h后, 少量细胞贴壁, 大部分细胞悬浮生长, 可见少量由3-5个细胞形成的球体细胞, 随时间延长, 球体细胞逐渐增大, 细胞数目增多, 细胞间连接紧密(图1), 球体细胞形成率为6.21%±2.03%, 提示该细胞系中可能存在有干细胞特征的肿瘤细胞. 对HepG2细胞进行PKH26染色后进行无血清悬浮培养. 染色5 d时发现, 已有球体细胞形成, 荧光染料分布于2-3个细胞上(图2A, B); 13 d时, 可见球体细胞中仅有单个细胞着色(图2C, D), 无血清悬浮培养及PKH26染色实验证明了人肝癌细胞系HepG2中存在肿瘤干细胞.
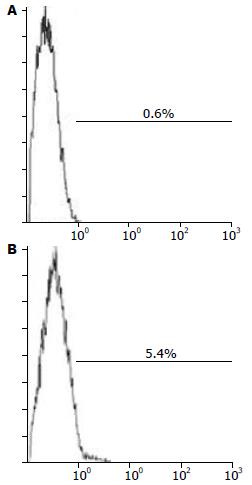
HepG2细胞中CD117+细胞比例约0.6%, 球体细胞中CD117+细胞比例约为5.4%, HepG2细胞经无血清悬浮培养后, CD117+细胞的比例提升了9倍, 提示CD117可能是HepG2细胞系中具有干细胞特性细胞的标志物(图3).
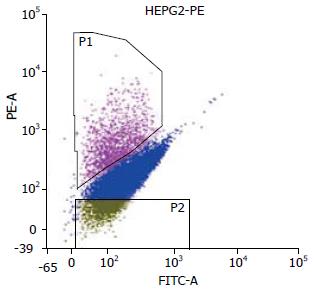
受检细胞大小、形态、胞内颗粒度均一致, 在488 nm激发光下(图4), 左上方有一高荧光区域P1, 即CD117+亚群细胞, 比例为4.9%, 左下方为低荧光区域P2, 为CD117-亚群细胞, 比例为5.0%.
培养9 d后, CD117+、未分选和CD117-细胞在每500个细胞中成球数分别为68.75±21.85、35.75±3.30和22.25±6.40, CD117+细胞较未分选和CD117-细胞成球能力明显增强, 差异有统计学意义(P<0.01, 图5).
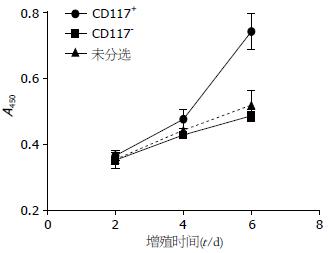
CCK-8法检测CD117+、CD117-和未分选细胞的增殖能力, 结果显示从第4天起, CD117+细胞增殖明显, 未分选细胞和CD117-细胞增殖缓慢, 至第6天, CCK-8法检测CD117+、未分选和CD117-细胞的A值分别为0.722±0.029、0.604±0.022和0.486±0.018, CD117+细胞较后两者增殖明显, 差异有统计学意义(P<0.01, 图6).
耐药是肿瘤干细胞的一个共同的特性, 我们将分选获得的CD117+、CD117-和未分选细胞经不同浓度的顺铂作用96 h后, 三者的IC50分别为12.229 μmol/L、7.345 μmol/L和7.970 μmol/L, CD117+细胞和未分选细胞的耐药系数RI分别为1.665和1.076(表1).
| 3 μmol/L | 6 μmol/L | 9 μmol/L | 12 μmol/L | 15 μmol/L | IC50 | RI | |
| CD117+细胞 | 5.052±3.807 | 11.230±1.280 | 36.945±1.142 | 47.838±1.945 | 64.407±0.988 | 12.229 | 1.665 |
| 未分选细胞 | 32.785±2.534 | 40.965±6.278 | 46.897±5.422 | 57.061±7.457 | 69.768±6.553 | 7.970 | 1.076 |
| CD117-细胞 | 34.358±0.551 | 43.264±9.611 | 48.850±7.779 | 58.561±12.756 | 70.896±4.413 | 7.345 |
肿瘤干细胞是目前肿瘤研究的热点. "肿瘤干细胞学说"认为, 肿瘤组织是由异质性的细胞群体组成, 肿瘤组织中存在的一小部分具有干细胞性质的细胞群体具有自我更新和无限增殖潜力, 是肿瘤产生的根源[3]. 目前, 血液系统肿瘤[16,17]、脑神经胶质瘤[14]、乳腺癌[18,19]、结肠癌[20]、前列腺癌[21]等的肿瘤干细胞均已成功得到分离. 通过这些研究, 肿瘤干细胞具有表达干细胞标志物、不对称分裂、被诱导分化、自我更新、无限增殖、高致瘤性、抵抗放化疗等生物学特征已被广泛证实和认可.
自我更新和无限增殖潜力是肿瘤干细胞的最主要特征. Collins等[21]研究发现, 从前列腺癌组织中分离得到的CD44+/α2β1high/CD133-细胞, 可以在体外无血清培养基中悬浮生长并形成不同表型的细胞群体, 其克隆形成能力是CD44+/α2β1low/CD133-的30倍. Blair等[22]研究发现, 白血病细胞体外悬浮培养6-8 wk后, 仅CD34+/CD38-的肿瘤干细胞集落仍然存活, CD34+/CD38+和CD34-的集落全部死亡. Kondo等[23]报道在脑神经胶质瘤细胞系C6中, SP细胞在可无血清培养基中存活并形成球体, 而非SP细胞增殖缓慢, 培养3 wk后全部死亡. 这些证据提示, 并非所有的肿瘤细胞均具有无限增殖能力, 大多数肿瘤细胞的寿命是有限的, 仅具有干细胞特性的一小部分肿瘤细胞通过自我更新维持着肿瘤的生长, 与肿瘤的转移、复发密切相关.
肿瘤对放化疗的抵抗也被认为与肿瘤干细胞相关. Bao等[24]研究发现, 神经胶质瘤中的CD133+细胞在接受放疗时表现出更强的生存能力, 其放射线诱导的凋亡比率也明显低于CD133-细胞. Guzman等[25]研究发现, 白血病干细胞对柔红霉素及阿糖胞苷的敏感性均低于普通白血病细胞. 以上结果提示肿瘤干细胞较普通肿瘤细胞对放化疗不敏感, 可能为传统治疗后肿瘤复发的根源.
与其他实体瘤干细胞研究相比, 目前对肝癌干细胞的研究尚处于探索阶段, 主要停留在分离与鉴定的工作上, 尚没有公认的表面标志物. 对于已报道的SP[7]、CD133[9]、CD90[5]、OV6[11]、EpCAM[12]等标志物, 尚无研究发现这些标志物有明显的交叉现象.
CD117又称c-kit, 是造血干细胞和卵圆细胞的标志物之一, 其基因位于人染色体4q12-13, 属于原癌基因, 编码受体酪氨酸家族蛋白, 是干细胞因子受体[26]. CD117是卵圆细胞一个重要的标志物, 研究发现, c-kit/SCF信号转导系统在卵圆细胞的增殖过程中扮演着重要作用[27], 与肝脏的发生、分化、损伤后再生、及肿瘤的发生密切相关. 已有研究表明, 大鼠在接受致癌物处理后, 表达CD117的卵圆细胞明显增多[28]. Yan等[29]研究发现, 人原发性肝癌组织中的CD117阳性细胞较阴性细胞在裸鼠体内成瘤能力显著增强. Ramadori等[30]采用选择性酪氨酸激酶抑制剂STI571成功治愈了1例酒精性肝硬化引起的肝癌患者.
本研究对人肝癌细胞系HepG2采用无血清悬浮培养技术证明了该细胞系中存在成球生长的肿瘤干细胞, 并用亲脂荧光染料PKH26染色证明该球体细胞是由单个肿瘤细胞增殖分化形成. 进一步采用流式细胞术证明无血清悬浮培养富集了肿瘤干细胞, 无血清培养后CD117+细胞比例提升了9倍, 提示CD117可能是HepG2的肿瘤干细胞标志物之一. 采用流式分选仪分选CD117+、CD117-两个细胞亚群, 体外成球实验发现CD117+细胞较未分选细胞和CD117-细胞有更强的自我更新能力; 增殖实验发现CD117+细胞在无血清培养基中的增殖能力较未分选细胞和CD117-细胞显著增强; 顺铂耐药实验证明了CD117+细胞较未分选细胞和CD117-细胞明显耐药. 以上结果均表明, 人肝癌细胞系HepG2中的CD117+细胞是具有肿瘤干细胞特性的细胞亚群, CD117可能是肝癌干细胞的候选表面分子标志物.
本研究初步探讨了HepG2细胞系中CD117+肿瘤细胞的干细胞生物学特性, 证实了CD117+细胞具有更强的自我更新能力、增殖能力及抗药性, 为下一步进行肝癌干细胞的分子生物学研究奠定了基础.
自2006年以来已有多家实验室应用SP、CD133、CD90、OV6、EpCAM等干细胞标志物从肝癌细胞系中分离获得肝癌干细胞, 但仍需要鉴定出新的肝癌干细胞的标志物, 研究该标志物阳性细胞的特性, 从而进一步证明肝癌的干细胞假说.
秦建民, 副主任医师, 上海中医药大学附属普陀医院普外科
目前肝癌干细胞的研究主要停留在分离和鉴定上, 尚无公认的标志物.
Ramadori等采用c-Kit受体的选择性酪氨酸激酶抑制剂伊马替尼成功治愈了一例酒精性肝硬化引起的肝癌患者.
采用流式细胞分选技术分选和分析肝癌细胞系HepG2中CD117+细胞亚群的生物学特性, 研究其自我更新、增殖及耐药能力, 证明其具有肿瘤干细胞的特征, 获得了一个新的肝癌干细胞标志物.
本研究证明了HepG2细胞系中的CD117+肿瘤细胞具有较强的自我更新能力、增殖能力及耐药能力, 为肝癌干细胞研究提供了有价值的细胞系模型.
PKH26染料: 是一种细胞膜标记染料, 可与细胞膜的脂质双分子层稳定结合, 且无明显的细胞毒性,可标记的细胞范围广. 肿瘤干细胞常处于G0期, 标记后的肿瘤干细胞在分裂过程中能长期保留PKH26染料, 且生物活性不受影响, 可应用于肿瘤干细胞的示踪标记.
本研究为深入研究肝癌干细胞的分子生物学特性、治疗奠定了重要的理论基础. 研究设计合理, 方法恰当, 数据结果可靠, 结论可信.
编辑: 李军亮 电编:闫晋利
| 1. | Frank NY, Schatton T, Frank MH. The therapeutic promise of the cancer stem cell concept. J Clin Invest. 2010;120:41-50. [PubMed] [DOI] |
| 2. | Zhou BB, Zhang H, Damelin M, Geles KG, Grindley JC, Dirks PB. Tumour-initiating cells: challenges and opportunities for anticancer drug discovery. Nat Rev Drug Discov. 2009;8:806-823. [PubMed] [DOI] |
| 3. | Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105-111. [PubMed] [DOI] |
| 4. | Couzin J. Medicine. Tracing the steps of metastasis, cancer's menacing ballet. Science. 2003;299:1002-1006. [PubMed] |
| 5. | Yang ZF, Ho DW, Ng MN, Lau CK, Yu WC, Ngai P, Chu PW, Lam CT, Poon RT, Fan ST. Significance of CD90+ cancer stem cells in human liver cancer. Cancer Cell. 2008;13:153-166. [PubMed] [DOI] |
| 6. | Yang ZF, Ngai P, Ho DW, Yu WC, Ng MN, Lau CK, Li ML, Tam KH, Lam CT, Poon RT. Identification of local and circulating cancer stem cells in human liver cancer. Hepatology. 2008;47:919-928. [PubMed] [DOI] |
| 7. | Chiba T, Kita K, Zheng YW, Yokosuka O, Saisho H, Iwama A, Nakauchi H, Taniguchi H. Side population purified from hepatocellular carcinoma cells harbors cancer stem cell-like properties. Hepatology. 2006;44:240-251. [PubMed] [DOI] |
| 8. | Haraguchi N, Utsunomiya T, Inoue H, Tanaka F, Mimori K, Barnard GF, Mori M. Characterization of a side population of cancer cells from human gastrointestinal system. Stem Cells. 2006;24:506-513. [PubMed] [DOI] |
| 9. | Suetsugu A, Nagaki M, Aoki H, Motohashi T, Kunisada T, Moriwaki H. Characterization of CD133+ hepatocellular carcinoma cells as cancer stem/progenitor cells. Biochem Biophys Res Commun. 2006;351:820-824. [PubMed] [DOI] |
| 10. | Yin S, Li J, Hu C, Chen X, Yao M, Yan M, Jiang G, Ge C, Xie H, Wan D. CD133 positive hepatocellular carcinoma cells possess high capacity for tumorigenicity. Int J Cancer. 2007;120:1444-1450. [PubMed] [DOI] |
| 11. | Yang W, Yan HX, Chen L, Liu Q, He YQ, Yu LX, Zhang SH, Huang DD, Tang L, Kong XN. Wnt/beta-catenin signaling contributes to activation of normal and tumorigenic liver progenitor cells. Cancer Res. 2008;68:4287-4295. [PubMed] [DOI] |
| 12. | Yamashita T, Ji J, Budhu A, Forgues M, Yang W, Wang HY, Jia H, Ye Q, Qin LX, Wauthier E. EpCAM-positive hepatocellular carcinoma cells are tumor-initiating cells with stem/progenitor cell features. Gastroenterology. 2009;136:1012-1024. [PubMed] [DOI] |
| 13. | Yamashita T, Forgues M, Wang W, Kim JW, Ye Q, Jia H, Budhu A, Zanetti KA, Chen Y, Qin LX. EpCAM and alpha-fetoprotein expression defines novel prognostic subtypes of hepatocellular carcinoma. Cancer Res. 2008;68:1451-1461. [PubMed] [DOI] |
| 14. | Singh SK, Clarke ID, Terasaki M, Bonn VE, Hawkins C, Squire J, Dirks PB. Identification of a cancer stem cell in human brain tumors. Cancer Res. 2003;63:5821-5828. [PubMed] |
| 15. | Pece S, Tosoni D, Confalonieri S, Mazzarol G, Vecchi M, Ronzoni S, Bernard L, Viale G, Pelicci PG, Di Fiore PP. Biological and molecular heterogeneity of breast cancers correlates with their cancer stem cell content. Cell. 2010;140:62-73. [PubMed] [DOI] |
| 16. | Lapidot T, Sirard C, Vormoor J, Murdoch B, Hoang T, Caceres-Cortes J, Minden M, Paterson B, Caligiuri MA, Dick JE. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 1994;367:645-648. [PubMed] [DOI] |
| 17. | Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997;3:730-737. [PubMed] [DOI] |
| 18. | Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci U S A. 2003;100:3983-3988. [PubMed] [DOI] |
| 19. | Ginestier C, Hur MH, Charafe-Jauffret E, Monville F, Dutcher J, Brown M, Jacquemier J, Viens P, Kleer CG, Liu S. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell Stem Cell. 2007;1:555-567. [PubMed] [DOI] |
| 20. | Ricci-Vitiani L, Lombardi DG, Pilozzi E, Biffoni M, Todaro M, Peschle C, De Maria R. Identification and expansion of human colon-cancer-initiating cells. Nature. 2007;445:111-115. [PubMed] [DOI] |
| 21. | Collins AT, Berry PA, Hyde C, Stower MJ, Maitland NJ. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 2005;65:10946-10951. [PubMed] [DOI] |
| 22. | Blair A, Hogge DE, Ailles LE, Lansdorp PM, Sutherland HJ. Lack of expression of Thy-1 (CD90) on acute myeloid leukemia cells with long-term proliferative ability in vitro and in vivo. Blood. 1997;89:3104-3112. [PubMed] |
| 23. | Kondo T, Setoguchi T, Taga T. Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line. Proc Natl Acad Sci U S A. 2004;101:781-786. [PubMed] [DOI] |
| 24. | Bao S, Wu Q, McLendon RE, Hao Y, Shi Q, Hjelmeland AB, Dewhirst MW, Bigner DD, Rich JN. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 2006;444:756-760. [PubMed] [DOI] |
| 25. | Guzman ML, Swiderski CF, Howard DS, Grimes BA, Rossi RM, Szilvassy SJ, Jordan CT. Preferential induction of apoptosis for primary human leukemic stem cells. Proc Natl Acad Sci U S A. 2002;99:16220-16225. [PubMed] [DOI] |
| 26. | Broecker-Preuss M, Sheu SY, Worm K, Feldkamp J, Witte J, Scherbaum WA, Mann K, Schmid KW, Schott M. Expression and mutation analysis of the tyrosine kinase c-kit in poorly differentiated and anaplastic thyroid carcinoma. Horm Metab Res. 2008;40:685-691. [PubMed] [DOI] |
| 27. | Matsusaka S, Tsujimura T, Toyosaka A, Nakasho K, Sugihara A, Okamoto E, Uematsu K, Terada N. Role of c-kit receptor tyrosine kinase in development of oval cells in the rat 2-acetylaminofluorene/partial hepatectomy model. Hepatology. 1999;29:670-676. [PubMed] [DOI] |
| 28. | Fujio K, Evarts RP, Hu Z, Marsden ER, Thorgeirsson SS. Expression of stem cell factor and its receptor, c-kit, during liver regeneration from putative stem cells in adult rat. Lab Invest. 1994;70:511-516. [PubMed] |
| 29. | Yan Z, Fang CH, Gao P. [Preliminary research of hepatocarcinoma stem cell markers]. Nanfang Yike Daxue Xuebao. 2006;26:1304-1306. [PubMed] |
| 30. | Ramadori G, Füzesi L, Grabbe E, Pieler T, Armbrust T. Successful treatment of hepatocellular carcinoma with the tyrosine kinase inhibitor imatinib in a patient with liver cirrhosis. Anticancer Drugs. 2004;15:405-409. [PubMed] [DOI] |