修回日期: 2011-11-12
接受日期: 2011-12-07
在线出版日期: 2011-12-18
目的: 检测重症急性胰腺炎(severe acute pancreatitis, SAP)大鼠血清中中性粒细胞弹性蛋白酶(neutrophil elastase, NE)、白介素-6(interfilon-6, IL-6)的含量及胰腺病理学改变, 探讨西维来司钠对大鼠SAP的治疗作用.
方法: 采用经十二指肠乳头逆行胆胰管注射5%牛磺胆酸钠的方法制备大鼠SAP模型; 药物治疗组静脉输入西维来司钠, 切取胰腺组织行病理学评分, 测定血清中NE、IL-6及淀粉酶的含量.
结果: 牛黄胆酸钠胰胆管注射可以制作典型的急性胰腺炎模型, 其血清淀粉酶升高、胰腺病理损伤符合急性胰腺炎表现. 西维来司钠治疗组血清淀粉酶值及NE、IL-6含量较模型组降低, 有显著性差异(3 h: 5636.22±713.57 vs 5835.75±681.52, 16.99±3.28 vs 22.93±4.74, 181.86±36.56 vs 281.82±30.79; 6 h: 5743.44±624.93 vs 6253.66±533.99, 23.63±4.47 vs 31.81±4.69, 184.15±28.56 vs 319.39±21.73; 12 h: 7098.93±698.42 vs 8420.74±779.72, 24.46±5.02 vs 39.21±6.23, 192.52±37.65 vs 354.21±23.72, 均P<0.05); 且药物治疗组胰腺损伤的组织病理学评分较模型组降低, 有显著性差异(P<0.05). NE、IL-6与胰腺病理学评分相关性分析显示, 血清中NE、IL-6含量与胰腺损伤程度呈正相关.
结论: 西维来司钠能够降低血清中NE、IL-6浓度, 减轻胰腺组织的病理损伤, 减轻SAP急性期的炎症反应.
引文著录: 脱红芳, 王京斌, 郭怀斌, 王丽, 张万星, 彭彦辉. 西维来司钠对大鼠重症急性胰腺炎炎症反应的治疗作用. 世界华人消化杂志 2011; 19(35): 3579-3584
Revised: November 12, 2011
Accepted: December 7, 2011
Published online: December 18, 2011
AIM: To evaluate the therapeutic effect of sivelestat on severe acute pancreatitis (SAP) in a rat model by measuring the levels of serum neutrophil elastase (NE) and interleukin-6 (IL-6) and examining pancreatic pathological changes.
METHODS: SAP was induced in rats by retrograde injection of 5% sodium taurocholate into the biliopancreatic duct. Sivelestat was instilled continuously with an infusion pump in rats in the treatment group. Pancreatic pathological changes were evaluated by HE staining. The levels of serum NE and IL-6 were measured by ELISA. The level of serum amylase was measured using a biochemical analyzer.
RESULTS: The level of serum amylase was higher and pancreatic pathological changes were obvious in SAP rats compared to control rats. The levels of serum amylase, NE and IL-6 at various time points were significantly lower in treated rats than in SAP rats (3 h: 5636.22 ± 713.57 vs 5835.75 ± 681.52, 16.99 ± 3.28 vs 22.93 ± 4.74, 181.86 ± 36.56 vs 281.82 ± 30.79; 6 h: 5743.44 ± 624.93 vs 6253.66 ± 533.99, 23.63 ± 4.47 vs 31.81 ± 4.69, 184.15 ± 28.56 vs 319.39 ± 21.73; 12 h: 7098.93 ± 698.42 vs 8420.74 ± 779.72, 24.46 ± 5.02 vs 39.21 ± 6.23, 192.52 ± 37.65 vs 354.21 ± 23.72, all P < 0.05). The score of pancreatic pathological changes was significantly lower in treated rats than in SAP rats (P < 0.05). Serum levels of NE and IL-6 had a positive correlation with the score of pancreatic pathology.
CONCLUSION: Sivelestat could reduce serum levels of IL-6 and NE, mitigate pancreatic injury, and inhibit inflammatory reaction in rats with SAP.
- Citation: Tuo HF, Wang JB, Guo HB, Wang L, Zhang WX, Peng YH. Sivelestat mitigates severe acute pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(35): 3579-3584
- URL: https://www.wjgnet.com/1009-3079/full/v19/i35/3579.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i35.3579
急性胰腺炎(acute pancreatitis, AP)是临床常见的急腹症之一, 发生率为4.8-80/10万, 且有逐年增高的趋势[1,2]. 按病情严重程度可分为轻症急性胰腺炎(mild acute pancreatitis, MAP)和重症急性胰腺炎(severe acute pancreatitis, SAP). AP患者中约20%-30%为SAP, 死亡率可达10%-40%. 在SAP的死亡病例中, 50.9%-73%在发病2 wk内死于多器官功能衰竭(multiple organ failure, MOF), 33.3%-49.1%在发病2 wk后死于感染并发症[3]. 急性胰腺炎发病过程中早期爆发性的炎症细胞因子释放, 引起全身炎症反应综合征, 导致多器官功能衰竭, 是患者死亡的主要原因之一[4-6]. IL-6等炎症因子可以作为评定急性胰腺炎严重程度及判断预后的指标[7-9]. 进入21世纪后急性胰腺炎的诊疗有了长足的发展, 由既往的内科或外科治疗到目前的药物治疗为主, 适时手术干预的总和治疗原则; 但医疗费用较高, 对于重症急性胰腺炎治疗效果仍不理想[10,11]. 如何控制SAP早期的炎症反应, 是目前实验研究的热点之一.
西维来司钠(Sivelestat)是一种小分子中性粒细胞弹性蛋白酶抑制剂, 能选择性地抑制中性粒细胞弹性蛋白酶活性(neutrophil elastase, NE), 是日本小野药品工业公司开发的全球首个治疗伴有全身炎症反应综合征的急性肺损伤的药物[12-14]. 本实验主要研究早期应用西维来司钠是否对SAP大鼠模型炎症反应的治疗作用, 为临床应用西维来司钠治疗SAP提供实验依据.
健康清洁级SD大鼠54只, 雌雄不限, 体质量250-280 g, 由河北医科大学实验动物中心提供(合格证编号: 706106). 编号后随机分成3组, 即对照组、AP模型组和AP药物治疗组(18只/组). 其中每个实验组又分成3个时间点, 分别为3 h、6 h和12 h, 每个时间点均对应6只模型鼠.
1.2.1 造模: 本文采用Aho等[15,16]的方法并进行改良. 模型组大鼠术前12 h禁食不禁水, 麻醉固定后, 首先在大鼠颈静脉穿刺并留置套管针, 连接微量注射泵给予生理盐水0.5 mL/(100 g•h). 然后开腹, 用24号套管针经十二指肠乳头向胆胰管穿刺, 同时用无创伤动脉夹阻断胆胰管出肝门端, 外套管末端连接微量注射泵注入5%牛磺胆酸钠0.1 mL/100 g, 5 mL/h, 约3 min注完后拔除外套管, 用无创伤动脉夹夹闭胆胰管十二指肠乳头端约5 min, 缝合肠壁戳孔, 放开两端动脉夹, 关腹; 药物治疗组大鼠麻醉后, 颈静脉微量注射泵静注西维来司钠, 剂量为5 mg/100 (g•h), 每毫克西维来司钠加入2 μL的0.5 mmol/L Na2CO3, 补液生理盐水0.5 mL/100 (g•h), 然后制备动物模型, 具体方法同模型组; 对照组大鼠麻醉后颈静脉持续静注与模型组等量等速度的生理盐水, 然后开腹, 轻翻动胰腺及十二指肠后关腹.
1.2.2 各项指标检测: 根据规定的时间点, 将大鼠再次开腹, 腹腔动脉穿刺取血后, 4 ℃下3 000 r/min离心10 min, 取血清应用全自动生化分析仪检测淀粉酶含量, ELISA法测定NE、白介素-6(IL-6)的含量; 取胰体尾部固定位置胰腺组织, 40 g/L多聚甲醛固定, 用HE染色, 参照Schmidt法[17]对胰腺损伤进行评分, 评分越高代表损伤程度越重(表1).
| 评分 | 水肿 | 炎症(小叶内或血管周围白细胞数/高倍视野) | 出血(血管外与间隔内红细胞数/高倍视野) | 腺细胞坏死(坏死细胞数/高倍视野) |
| 1分 | 小叶间隔局灶性扩张 | 1-10 | 1-50 | 1-4 |
| 2分 | 同1+小叶间隔广泛扩张 | 11-20 | 51-100 | 5-10 |
| 3分 | 同2+腺泡间隔扩张 | 21-30 | 101-150 | 11-16 |
| 4分 | 同3+细胞间隔扩张 | >30个或小脓肿形成 | >150 | >16 |
统计学处理 实验各组数据采用SPSS11.5统计学软件处理, 结果以mean±SD表示, 采用单因素方差分析, Pearson法计算NE、IL-6含量与胰腺组织病理学评分的相关性, 当P<0.05时认为具有统计学意义.
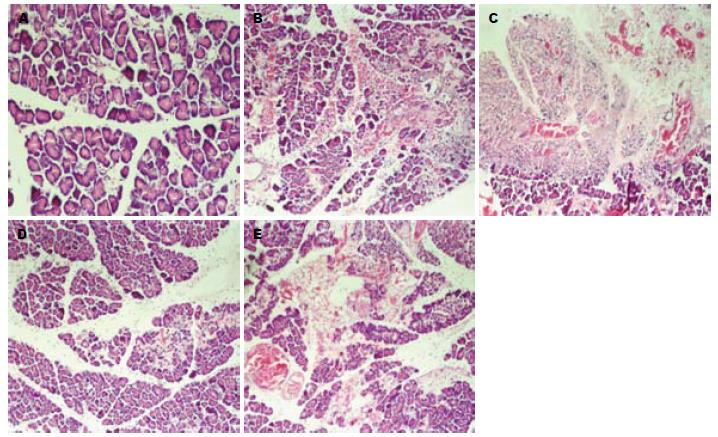
对照组各时间点胰腺无充血水肿, 腹腔未见积液、皂化斑; AP模型组3 h时间点腹腔内少量积液, 胰腺组织充血肿胀, 胃肠无明显扩张, 6、12 h时间点大鼠腹腔内可见大量血性积液, 胃肠扩张明显, 胰腺周围大网膜及肠系膜见较多皂化斑, 胰腺组织广泛瘀血坏死, 与周围组织粘连; AP药物治疗组大鼠腹腔内见少量积液, 胃肠轻度扩张, 胰腺肿胀呈点状坏死.
对照组见胰腺小叶结构清晰, 间质内未见炎症细胞及红细胞; AP模型组3 h和6 h时间点见胰腺组织间质显著增宽, 小叶间隔及腺泡间隔扩张, 有核炎症细胞浸润, 血管扩张充血, 红细胞分布于间质或片状存在于胰腺组织内, 实质内可见散在的灶状凝固性坏死, 细胞轮廓消失, 胞核破碎、溶解. 12 h可见胰腺小叶排列紊乱, 小叶间充斥大量炎症细胞及红细胞, 胰腺组织大片坏死, 坏死区内腺泡结构消失, 腺泡细胞萎缩、胞核溶解消失明显; AP药物治疗组各时间点均见胰腺小叶间隔有增宽, 可见红细胞及炎症细胞散在分布于间质内, 部分小叶内可见腺泡细胞坏死改变(图1).
AP模型组随时间延长损伤程度加重, 各时间点间差异具有显著性(P<0.05), 在各时间点与对照组相比评分均增高, 差异具有显著性(P<0.05); AP治疗组胰腺损伤较AP模型组同时间点降低, 病理学评分在各时间点与AP模型组相比差异具有显著性(P<0.0, 表2).
血清淀粉酶测定结果, B组各时间点血清淀粉酶含量较A组均有明显升高, 差异具有显著性(P<0.05), 各时间点的血清淀粉酶含量随时间延长而增加, 差异具有显著性(P<0.05); C组3 h、6 h时间点血清淀粉酶含量较B组同时间点无统计学意义(P>0.05), 12 h时间点血清淀粉酶值较B组含量降低, 差异具有显著性(P<0.05). 细胞因子检测结果, B组血清中NE及IL-6含量在各时间点较A组均升高, 差异具有显著性(P<0.05); 而且在各时间点间随时间延长而升高, 差异具有显著性(P<0.05); C组各时间点的NE及IL-6含量较B组同时间点均降低, 差异具有显著性(P<0.05, 表3).
| 分组 | 3 h | 6 h | 12 h | |
| Amy(U/L) | 对照组 | 1135.44±181.16 | 1215.82±132.12 | 1176.36±139.47 |
| 模型组 | 5835.75±681.52a | 6253.66±533.99ae | 8420.74±779.72ag | |
| 治疗组 | 5636.22±713.57a | 5743.44±624.93a | 7098.93±698.42ac | |
| NE(μg/L) | 对照组 | 9.25±2.16 | 9.51±2.53 | 9.32±2.08 |
| 模型组 | 22.93±4.74a | 31.81±4.69ae | 39.21±6.23ag | |
| 治疗组 | 16.99±3.28c | 23.63±4.47c | 24.46±5.02c | |
| IL-6(ng/L) | 对照组 | 91.23±18.09 | 91.18±14.98 | 90.11±16.84 |
| 模型组 | 281.82±30.79a | 319.39±21.73ae | 354.21±23.72ag | |
| 治疗组 | 181.86±36.56c | 184.15±28.56c | 192.52±37.65c |
SAP发病机制复杂, 发病后早期出现的炎症反应综合征是其主要的病理生理变化之一. 1988年Rinderknecht[18]提出白细胞过度激活学说后, 越来越多的研究认为, SAP是在异常激活的胰酶作用下, 机体释放出大量炎症介质与细胞因子, 激活粒细胞、内皮细胞和其他免疫细胞, 这些细胞再释放出大量的炎症介质, 从而诱发"炎症反应的瀑布效应", 造成胰腺局部炎症进一步的扩大及全身炎症反应综合征. 在这一炎症反应过程中各炎症因子之间相互作用, 互相影响. 近年中药在治疗重症胰腺炎方面取得了可喜的成绩: 血必净、清胰汤方剂等在控制炎症反应方面有着独特的作用, 主要是活血化淤、清热排毒[19,20]. 另外, 血液滤过透析也可以清除部分炎症因子, 对控制炎症反应有益[21,22]. 但从本质上说上述方法均为治标之法. 要想从根本上控制炎症反应就应从炎症反应机制着手, 切断炎症因子的级联瀑布效应.
中性粒细胞在炎症因子的作用下聚集、活化, 释放出大量的中性粒细胞弹性蛋白酶(neutrophil elastase, NE)[23]. 过量的弹性蛋白酶可降解胶原蛋白、层粘连蛋白和其他细胞的细胞内基质, 增加血管通透性, 促进中性粒细胞渗出、炎性因子释放. 弹性蛋白酶抑制剂(西维来司钠)抑制NE活性, 发挥抗炎作用. 目前研究较多的是西维来司钠控制肺的急性炎症损伤[23-25], 并且已应用于临床并取得了良好的临床效果[26]. 近年有关弹性蛋白酶抑制剂抑制炎症反应的研究较多. Fukatsu等[27]应用西维来司钠研究肠道缺血动物模型, 表明西维来司钠可能预防缺血后的系统炎症反应及保护其免疫能力. Suda等[28]研究脓毒血症动物模型显示, 西维来司钠可以降低白介素-1β和白介素-10的血清浓度, 降低实验期模型动物死亡率. "西维来司钠对实验动物大脑缺血/再灌注损伤的保护作用研究"也已报道[29]. 虽然20世纪90年代已经过报道NE在SAP的作用[30], 但是西维来司钠用于SAP的治疗研究未见报道.
本实验研究西维来司钠对AP的治疗作用显示: 淀粉酶、NE、IL-6在急性胰腺炎模型血清中的浓度升高, 应用西维来司钠可降低血清中IL-6、NE浓度. 淀粉酶是胰腺组织受损后首先在血液中表现的胰腺特异性受损指标. 应用西维来司钠后血清淀粉酶浓度的降低胰腺组织损伤减轻. IL-6是在炎性刺激下由多种细胞释放, 是介导急性炎症反应的主要因子. IL-6刺激血管内皮细胞收缩, 间隙增宽, 血管通透性增加, 使白细胞游出血管壁. Cruickshank等[9]认为IL-6水平可以反映SAP时粒细胞/单核巨噬细胞活性, 并可反映内皮细胞损伤程度. IL-6是目前认为与急性胰腺炎严重程度密切相关的炎症因子之一. 应用西维来司钠抑制NE活性, 同时降低血清中IL-6的浓度, 表明西维来司钠通过抑制NE活性, 可以达到抑制炎症反应的目的.
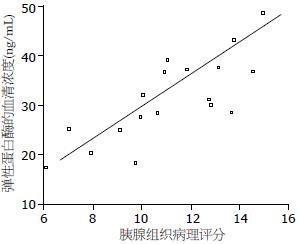
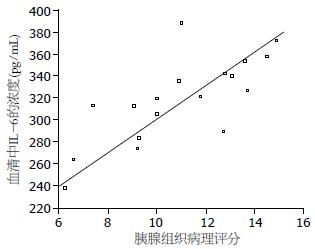
西维来司钠作为外源性NE抑制剂, 他不受活性氧的影响, 可到达中性粒细胞和组织间隙, 在炎症局部有效抑制弹性蛋白酶活性[14]. 本实验通过观察急性胰腺模型腹水量及对胰腺组织病理评分可以看出应用西维来司钠组无论是腹水量、胰腺病理学评分都有明显的改善. 相关性分析表明: 血清中IL-6、NE含量均与胰腺病理学评分的改善成正相关. 说明西维来司钠不仅可以改善系统炎症反应, 也能够对胰腺本身的炎症反应起到抑制作用.
总之, 应用西维来司钠治疗AP模型, 不仅能够减轻机体的全身炎症反应, 也能够减轻胰腺组织的损伤程度. 为临床应用西维来司钠治疗AP提供实验依据.
重症急性胰腺炎是临床难治疾病之一. 随着近年研究的深入, 对重症急性胰腺炎发病机制逐渐明确, 全身炎症反应综合症导致的多器官功能障碍是重症急性胰腺炎患者死亡的主要原因.
洪天配, 教授, 北京大学第三医院内分泌科
中性粒细胞释放的弹性蛋白酶是重要的炎症因子之一, 应用弹性蛋白酶抑制剂-西维来司钠可以抑制胰腺炎模型的急性炎症反应.
本文通过急性胰腺炎大鼠模型, 研究西维来司钠对急性胰腺炎的治疗作用. 此类研究尚未见报道.
本研究为临床急性胰腺炎的治疗提供实验依据, 接近临床需要, 实用性强, 研究价值大.
编辑: 张姗姗 电编:闫晋利
| 1. | Lowenfels AB, Sullivan T, Fiorianti J, Maisonneuve P. The epidemiology and impact of pancreatic diseases in the United States. Curr Gastroenterol Rep. 2005;7:90-95. [PubMed] [DOI] |
| 2. | Sekimoto M, Takada T, Kawarada Y, Hirata K, Mayumi T, Yoshida M, Hirota M, Kimura Y, Takeda K, Isaji S. JPN Guidelines for the management of acute pancreatitis: epidemiology, etiology, natural history, and outcome predictors in acute pancreatitis. J Hepatobiliary Pancreat Surg. 2006;13:10-24. [PubMed] [DOI] |
| 3. | Carnovale A, Rabitti PG, Manes G, Esposito P, Pacelli L, Uomo G. Mortality in acute pancreatitis: is it an early or a late event? JOP. 2005;6:438-444. [PubMed] |
| 6. | Al Mofleh IA. Severe acute pancreatitis: pathogenetic aspects and prognostic factors. World J Gastroenterol. 2008;14:675-684. [PubMed] [DOI] |
| 7. | Dambrauskas Z, Giese N, Gulbinas A, Giese T, Berberat PO, Pundzius J, Barauskas G, Friess H. Different profiles of cytokine expression during mild and severe acute pancreatitis. World J Gastroenterol. 2010;16:1845-1853. [PubMed] [DOI] |
| 9. | Cruickshank AM, Fraser WD, Burns HJ, Van Damme J, Shenkin A. Response of serum interleukin-6 in patients undergoing elective surgery of varying severity. Clin Sci (Lond). 1990;79:161-165. [PubMed] |
| 10. | Tonsi AF, Bacchion M, Crippa S, Malleo G, Bassi C. Acute pancreatitis at the beginning of the 21st century: the state of the art. World J Gastroenterol. 2009;15:2945-2959. [PubMed] [DOI] |
| 11. | Andersson B, Pendse ML, Andersson R. Pancreatic function, quality of life and costs at long-term follow-up after acute pancreatitis. World J Gastroenterol. 2010;16:4944-4951. [PubMed] [DOI] |
| 12. | 马 铁军, 高 宗科, 王 毅, 王 东平. 新型弹性蛋白酶抑制剂-西维来司钠的神经保护作用. 国际神经病学神经外科杂志. 2011;38:378-381. |
| 15. | Aho HJ, Koskensalo SM, Nevalainen TJ. Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol. 1980;15:411-416. [PubMed] [DOI] |
| 16. | Aho HJ, Nevalainen TJ, Aho AJ. Experimental pancreatitis in the rat. Development of pancreatic necrosis, ischemia and edema after intraductal sodium taurocholate injection. Eur Surg Res. 1983;15:28-36. [PubMed] [DOI] |
| 17. | Schmidt J, Lewandrowsi K, Warshaw AL, Compton CC, Rattner DW. Morphometric characteristics and homogeneity of a new model of acute pancreatitis in the rat. Int J Pancreatol. 1992;12:41-51. [PubMed] |
| 18. | Rinderknecht H. Fatal pancreatitis, a consequence of excessive leukocyte stimulation? Int J Pancreatol. 1988;3:105-112. [PubMed] |
| 23. | Tomoko Ishii, Kent Doi, Koji Okamoto. Neutrophil Elastase Contributes to Acute Lung Injury Induced by Bilateral Nephrectomy. Am J Pathol. 2010;177:1665-1673. [PubMed] [DOI] |
| 24. | Hayashida K, Fujishima S, Sasao K, Orita T, Toyoda Y, Kitano M, Hori S. Early administration of sivelestat, the neutrophil elastase inhibitor, in adults for acute lung injury following gastric aspiration. Shock. 2011;36:223-227. [PubMed] [DOI] |
| 26. | Aikawa N, Ishizaka A, Hirasawa H, Shimazaki S, Yamamoto Y, Sugimoto H, Shinozaki M, Taenaka N, Endo S, Ikeda T. Reevaluation of the efficacy and safety of the neutrophil elastase inhibitor, Sivelestat, for the treatment of acute lung injury associated with systemic inflammatory response syndrome; a phase IV study. Pulm Pharmacol Ther. 2011;24:549-554. [PubMed] [DOI] |
| 27. | Fukatsu K, Tanabe K, Maeshima Y, Omata J, Yasuhara H, Saitoh D. Neutrophil elastase inhibitor restores gut ischemia reperfusion-induced impairment of gut immunity with reduced plasma interleukin-6 concentrations in mice. Surg Infect (Larchmt). 2010;11:517-522. [PubMed] [DOI] |
| 28. | Suda K, Takeuchi H, Hagiwara T, Miyasho T, Okamoto M, Kawasako K, Yamada S, Suganuma K, Wada N, Saikawa Y. Neutrophil elastase inhibitor improves survival of rats with clinically relevant sepsis. Shock. 2010;33:526-531. [PubMed] |
| 30. | Gross V, Schölmerich J, Leser HG, Salm R, Lausen M, Rückauer K, Schöffel U, Lay L, Heinisch A, Farthmann EH. Granulocyte elastase in assessment of severity of acute pancreatitis. Comparison with acute-phase proteins C-reactive protein, alpha 1-antitrypsin, and protease inhibitor alpha 2-macroglobulin. Dig Dis Sci. 1990;35:97-105. [PubMed] [DOI] |