修回日期: 2011-11-20
接受日期: 2011-12-15
在线出版日期: 2011-12-18
目的: 研究HBV转基因小鼠的舌色表现和微血管血流变化.
方法: 10只C57BL/6J-HBV转基因小鼠和10只正常小鼠(C57BL/6J非转基因小鼠), 均雌雄各半, 采用小鼠舌象观察装置对小鼠舌色进行观察; 使用激光多普勒血流仪进行舌和肝脏微血管血流检测; 断头采血, 测定血清丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)的含量; HE染色观察肝和舌组织病理变化.
结果: HBV转基因小鼠中, 6只小鼠舌色呈紫色, 4只舌色呈暗红色, 而正常小鼠的舌色均为淡红色. HBV转基因小鼠舌色色调(H值)变深, 有显著性差异(P<0.01); 舌色亮度(V值)变弱, 有极显著性差异(P<0.001). 和正常鼠相比, 紫舌HBV转基因小鼠微血管血流灌注量和血流速度显著降低(0.206 ± 0.13 vs 0.794 ± 0.13; 0.479±0.07 vs 0.331±0.04, P<0.01, P<0.001), 该模型肝脏微血管血流灌注量和血流速度显著降低, HBV转基因小鼠肝脏和舌存在明显的炎性改变.
结论: HBV转基因小鼠舌色以紫色多见, 其形成机制与微循环障碍有关. 该模型存在肝脏和舌的炎症病理, 提示炎性微环境是形成其肝脏和舌微循环障碍的重要原因.
引文著录: 刘文兰, 车念聪, 唐佐青, 油红捷, 杨铮. HBV转基因小鼠的舌色改变及血流变化. 世界华人消化杂志 2011; 19(35): 3574-3578
Revised: November 20, 2011
Accepted: December 15, 2011
Published online: December 18, 2011
AIM: To examine the changes in color and microvascular blood flow of the tongue of HBV transgenic mice.
METHODS: Ten C57BL/6J-HBV transgenic mice and 10 normal mice were used in the study. The tongue color of the mice was observed daily. The microvascular blood flow of tongue and liver were detected with a laser Doppler blood flowmeter. Blood samples were taken to measure serum alanine aminotransferase (ALT) and aspartate aminotransferase (AST). Pathological changes in the tongue and liver were evaluated by HE staining.
RESULTS: The tongue was purple in color in six HBV transgenic mice and dark red in the remaining four transgenic mice. In contrast, the tongue of normal mice was light red in color. The hue of the tongue become darker and brightness become weaker in HBV transgenic mice (0.206 ± 0.13 vs 0.794 ± 0.13; 0.479 ± 0.07 vs 0.331 ± 0.04, P < 0.01, P < 0.001) compared to normal mice. The microvascular blood flow perfusion and velocity in the tongue and liver in HBV transgenic mice decreased significantly compared to normal mice. Obvious inflammatory changes were observed in the liver and tongue of HBV transgenic mice.
CONCLUSION: The tongue of most HBV transgenic mice became purple, whose mechanism is related with microcirculation disorder. Inflammatory changes in the liver and tongue in HBV transgenic mice are perhaps the main cause of microcirculation disorder.
- Citation: Liu WL, Che NC, Tang ZQ, You HJ, Yang Z. Changes in color and blood flow of the tongue of HBV transgenic mice. Shijie Huaren Xiaohua Zazhi 2011; 19(35): 3574-3578
- URL: https://www.wjgnet.com/1009-3079/full/v19/i35/3574.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i35.3574
舌色是中医学舌诊的重要方面, 对于辨别疾病的性质、判断病情的轻重具有重要的意义[1]. 临床研究表明, 慢性乙型肝炎紫舌患者病情重、预后差[2], 研究该舌色的形成机制对于病情程度的判断和预后的推测具有重要的临床意义. 将HBV的DNA或其片段转入受精卵建立起来的HBV转基因小鼠是目前研究慢性乙型肝炎理想的动物模型. C57BL/6J-HBV转基因小鼠, 其5-8周龄肝脏病理改变与慢性肝炎病变相似. 动态研究发现, 4月龄前属于慢性肝炎, 4月龄后在转基因小鼠肝脏可以见到非典型增生, 12 mo可发展为肝细胞癌[3]. 本研究观察HBV转基因小鼠舌色变化, 检测舌血流状况, 初步探讨慢性乙型肝炎紫舌的形成机制.
8周龄的SPF级C57BL/6J-HBV转基因小鼠(所转移的基因片段是编码包膜蛋白HBsAg的S基因、Pre-S基因及编码X抗原的X基因, 该基因片段为HBV的ayw亚型, 可稳定垂直遗传); 8周龄的遗传背景相同的C57BL/6J非转基因小鼠. 这些动物均来自北京大学医学部实验动物科学部, 动物生产许可证号: SCXK(京)2006-0008. 英国moorVMS-LDF型激光多普勒血流仪; 荧光显微镜(nikoneclipse 80i); 数码相机(Canon EOS 400D); OlympusAV全自动生化分析仪.
1.2.1 动物麻醉: 动物适应性饲养1 wk后, 先将小鼠禁食12 h后, 腹腔注射3%水合氯醛进行动物麻醉(350 mg/kg). 舌色诊断、微循环检测、取材. 实验过程中注意室温(20 ℃)的恒定.
1.2.2 HBV转基因小鼠模型的评价: 根据血清乙型肝炎表面抗原(HBsAg)的滴度, 血清丙氨酸氨基转移酶(ALT)和门冬氨酸氨基转移酶(AST)等肝功能指标, 肝组织病理形态等综合评价模型是否成功. 血清乙型肝炎表面抗原阳性、肝功能异常, 肝组织病理显示肝细胞弥漫性肿胀, 肝细胞胞质呈伊红均染(毛玻璃样变性), 可见核内嗜酸性小体, 肝内散在针状小灶状肝细胞坏死伴淋巴样细胞浸润, 散在单个肝细胞胞质固缩深染伴核固缩深染, 肝窦内可见淋巴样细胞聚集灶, 说明造模成功.
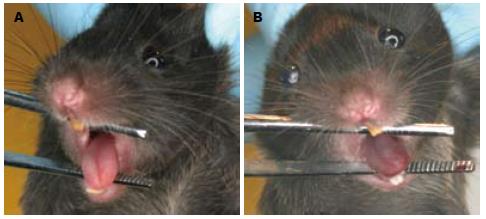
1.2.3 舌色观察和诊断: 在20 ℃的恒温实验室, 动物麻醉后即刻(麻醉后1-2 min), 将小鼠仰卧固定于北京工业大学研制的小鼠舌象观察装置, 该装置配有恒温垫(37 ℃-40 ℃), 以保证小鼠体温的恒定. 使用特制的金属环套住小鼠上门齿和下门齿, 使小鼠口呈45°张开使舌自然暴露, 用Canon EOS 400D数码相机在标准光源下(色温5300)距离舌面30 cm的位置拍摄动物舌面照片. 2名从事中医舌诊研究的副教授对舌色进行诊断, 达成共识后, 在舌象观察记录表上记录小鼠的舌象.
1.2.4 微血管血流检测: 舌表面微循环血流灌注量和流速检测: 小鼠仰卧于小鼠舌象观察装置上, 运用英国moorVMS-LDF型激光多普勒血流仪, 将激光光导纤维探头固定在舌前1/3靠近左侧舌边的舌面上, 但不重压. 仪器自动记录舌血流灌注量(flux, 单位PU)及血流速度(speed, 单位AU).
肝脏表面微循环血流灌注量和流速检测: 动物仰卧位于铺设恒温垫(37 ℃-40 ℃)的观察台上. 固定四肢后, 沿腹中线做3-5 cm切口, 暴露肝脏, 运用英国moorVMS-LDF型激光多普勒血流仪, 将激光光导纤维探头固定在肝脏左叶表面同一位置, 但不重压. 仪器自动记录肝脏表面微血管血流灌注量(flux, 单位PU) 及血流速度(speed, 单位AU).
1.2.5 取材及病理观察: 动物处于麻醉状态下, 断头收集血液, 3 500 r/min离心10 min, 取上清立即使用自动生化分析仪测定ALT等肝功能指标. 此后, 分离出肝脏, 生理盐水冲洗瘀血, 取肝左叶同一部位, 100 g/L福尔马林固定, 石蜡包埋, HE 染色, 进行肝组织病理检测. 避开舌中沟, 从舌两侧同一部位取材, 常规石蜡包埋,连续组织切片, HE染色. 光镜观察舌黏膜层组织形态.
研究结果显示, HBV转基因小鼠有6只小鼠的舌色是紫舌, 4只小鼠的舌色是暗红舌, 而正常小鼠的舌色均为淡红舌(图1).
将获取照片在photoshop7.0软件中提取RGB值, 进而在HSV空间计算H、S、V值, 结果提示, HBV转基因小鼠舌色色调(H值)变深, P<0.01; 舌色亮度(V值)变弱, P<0.001, 有显著性差异(表1).
2.3.1 舌微血管血流灌注量和速度的检测: 研究结果表明, HBV转基因小鼠紫舌微血管血流灌注量降低, 正常小鼠淡红舌血流灌注量为294.24 PU±62.34 PU, HBV转基因小鼠紫舌血流灌注量为110.41 PU±8.43 PU, 差异有统计学意义(P<0.001). HBV转基因小鼠紫舌微血管血流速度降低, 正常小鼠淡红舌血流灌注量为103.45 AU±19.83 AU, HBV转基因小鼠紫舌血流灌注量为74.01 AU±9.31AU, 有统计学意义(P<0.001).
2.3.2 肝脏微血管血流灌注量检测结果: HBV转基因小鼠肝脏微血管血流灌注量较正常小鼠显著降低, 正常小鼠肝血流灌注量为299.27 PU±87.36 PU, HBV转基因小鼠肝血流灌注量为192.92 PU±10.05 PU, 差异有统计学意义(P<0.01). HBV转基因小鼠肝微血管血流速度降低, 正常小鼠肝血流速度为97.99 AU±14.01 AU, HBV转基因小鼠肝血流速度为55.76 AU±4.82AU, 差异有统计学意义(P<0.001).
2.3.3 肝功能比较: HBV小鼠肝功能ALT值与正常小鼠存在显著差异(表2).
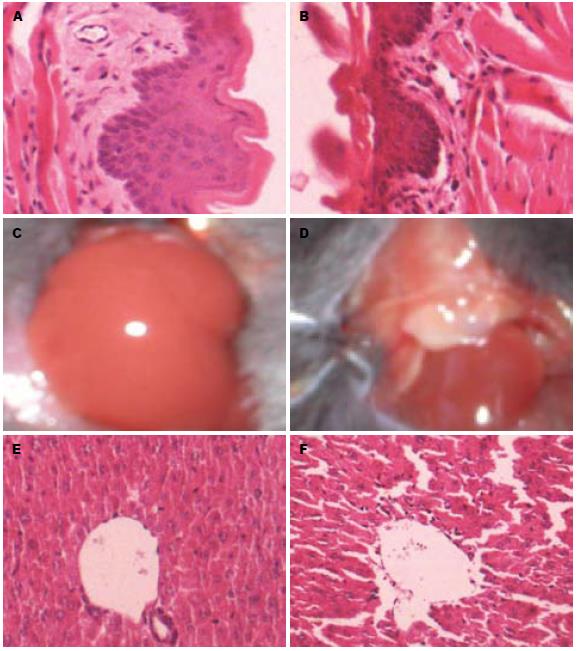
2.3.4 HBV转基因小鼠舌组织病理形态的观察: 研究显示, 小鼠的舌组织学结构包括黏膜层、固有层和肌层. HBV转基因小鼠舌组织有明显的炎性细胞浸润, 并有少量纤维蛋白渗出, 肌纤维排列疏松(图2A, B).
2.3.5 肝脏形态观察: 正常小鼠肝脏颜色鲜红、均匀; HBV转基因小鼠肝脏颜色暗红(图2C, D).
2.3.6 肝组织病理观察: 正常肝组织显示, 肝细胞排列整齐, 未见炎性细胞浸润; HBV转基因小鼠肝细胞肿胀, 排列疏松, 可见点状肝细胞坏死, 在中央静脉周围可见以淋巴细胞为主的炎细胞浸润(图2E, F).
中医舌诊是中医学独具特色的诊法之一[4,5], 是中医辨证重要的依据[6,7], 在临床辨证论治中发挥着重要的作用. 因此, 中医临床医师均十分重视察舌诊病、审舌用药[8-10]. 慢乙肝舌色调查表明, 该病常见舌色主要有红、淡红、紫、淡白, 紫舌是慢性肝病的主要表现, 提示瘀血内停, 舌色暗程度对于判断肝病发展趋势有一定意义[11,12]. 我们的临床研究亦提示随着舌暗到紫或瘀斑瘀点舌, 慢乙肝病情逐渐加重, 紫舌的紫暗程度对于判断病情的轻重和推测病势的发展具有重要的意义[13]. 对舌象形成机制的研究将会加深我们对该舌临床意义的认识, 从而充分地发挥舌诊对疾病诊治的指导作用[14]. 实验研究证实, 慢乙肝青紫舌的形成机制与微循环障碍相关[13,15], 但其具体的机制尚不清楚.
微循环是血液与组织细胞进行物质交换的主要场所[16], 其结构及功能状态直接影响组织、细胞的物质能量代谢及信息传递[17]. 很多研究认为, 炎症对微循环的结构和功能产生不良的影响[18-20]. 炎症状态下往往会产生大量ROS[21,22], ROS能够损害血管内皮细胞的功能[23]. 实验研究发现, 内皮细胞功能与组织的炎性改变相关[19,24]. 本实验发现HBV转基因小鼠肝脏和舌组织均表现炎性改变, 同时存在微循环障碍, 提示其微循环障碍的原因与组织的炎性改变相关. 炎性微环境是形成其微循环障碍的重要原因之一. 因此, 我们推测, 慢性乙型肝炎紫舌是该病微循环障碍的表现之一, 通过舌色的观察, 可以间接了解该病微循环状况, 对于判断病情轻重具有重要的意义. 本实验观察表明, HBV转基因小鼠慢性乙肝阶段的舌色以紫舌多见, 在HSV颜色空间检测结果表明, 其舌色色调变深, 颜色亮度变弱, 与正常小鼠舌色存在显著差异.
颜色模型(color model)是用来精确标定和生成各种颜色的一套规则和定义[25]. 某种颜色模型所标定的所有颜色就构成了一个颜色空间(color space). 颜色空间可以分为4大家族, 分别是RGB家族(含1个正RGB和1个负CMY模型), YUV家族(该家族将颜色分为亮度和色度2个方面, 含YUV, YIQ, YCbCr, YCbCr, YPbPr, YcgCr与YDbDr), HSV家族(该家族将颜色分为色调即Hue、饱和度即Saturation、亮度即Value 3个方面)和CIE家族(该家族将颜色精确测量为3个数值, 主要含CIE-XYZ模型)[26]. HSV(色调-饱和度-亮度)颜色空间是均匀的颜色空间, 反映了人的视觉对颜色的感觉[27]. 其一, 亮度分量与图像的彩色信息无关; 其二, 色调和饱和度分量与人感受颜色的方式是紧密相连的[28]. 因此, 本研究采用HSV颜色模型对HBV转基因小鼠的舌色进行分析, 研究发现HBV转基因小鼠舌色的色调变深, 颜色亮度变弱, 提示应用HSV颜色模型可以对小鼠舌色进行客观量化, 这与国内其他研究结果相一致[29,30].
总之, 本研究观察了HBV转基因小鼠的舌色表现, 该模型舌色以紫色多见, 其形成机制与微循环障碍有关. 该模型存在肝脏和舌的炎症病理, 提示炎性微环境是形成其肝脏和舌微循环障碍的重要原因.
慢性乙型肝炎是严重危害我国人民的传染性疾病之一, 中医以辨证论治为特色治疗该病取得了显著的效果. 舌诊是中医辨证论治重要的参考指标. 临床研究提示观察舌色对于判断病情的轻重十分重要. 然而, 目前导致舌色形成的机制尚不明确, 影响了舌诊在临床的推广和应用.
沈克平, 主任医师, 上海中医药大学附属龙华医院
舌象是临床上较为方便、较客观的观察指标, 与脏腑气血的变化密切相关, 能够灵敏地反映病情的进展. 因此, 阐释中医舌色的形成机制, 为临床提供机制清楚的诊断指标, 具有重要的意义, 目前, 国内该方面的研究尚不足.
王灵台认为暗舌是慢性肝病的主要舌象之一. 舌质暗一般认为是瘀血的表现, 瘀血主要在肝, 即肝血瘀滞, 舌色越暗, 肝瘀越重. 所以一般根据舌暗程度判别肝病发展趋势有一定意义. 张赤志发现随着舌色的加深, 肝脏病理变化逐渐恶化.
本文采用乙型肝炎理想的动物模型HBV转基因小鼠, 观察其舌色变化, 采用激光多普勒血流仪技术对其微循环进行检测, 同时观察舌、肝脏的病理变化, 发现HBV转基因小鼠紫舌的形成机制与微循环障碍有关, 导致微循环障碍的原因与局部炎性微环境相关.
本文发现炎性微环境是导致紫舌微循环障碍的重要原因, 因此, 治疗慢性乙型肝炎, 改善其炎性微环境对于减轻病情的发展具有重要的意义.
本文采用HBV转基因鼠研究炎症状态下小鼠舌色改变及血流变化, 为舌色动物模型研究及炎症舌色研究提供了新的研究模式, 具有重要的意义.
编辑: 张姗姗 电编:闫晋利
| 3. | 康 爱君, 董 宇红, 田 枫, 郑 杰, 王 美华, 郭 长占, 周 淑佩, 王 兆绰, 席 宏丽, 曾 争. 乙型肝炎病毒转基因小鼠病理学观察. 中国实验动物学杂志. 2002;12:8-10. |
| 18. | Granger HJ, Schelling ME, Lewis RE, Zawieja DC, Meininger CJ. Physiology and pathobiology of the microcirculation. Am J Otolaryngol. 1988;9:264-277. [PubMed] [DOI] |
| 19. | Hansen PR. Inflammatory alterations in the myocardial microcirculation. J Mol Cell Cardiol. 1998;30:2555-2559. [PubMed] [DOI] |
| 21. | 余莹, 李长明, 周沛然, 傅兰君, Lance Dworkin, 余晨. 坎地沙坦在炎症过程中抑制氧化应激反应机制的研究. 同济大学学报(医学版). 2010;31:59-63. |
| 22. | 温 韬, 刘 焱, 任 锋, 武 志明, 赵 金垣. 细胞色素P450 2E1在大鼠急性肝损伤中的表达及其意义. 胃肠病学和肝病学杂志. 2006;25:392-395. |
| 24. | 张 冀冠, 李 晓辉, 樊 继山, 张 海港, 刘 彦华, 李 淑惠, 王 秀琴, 汪 云利. 炎症促进大鼠动脉粥样硬化初期内皮功能病变机制研究. 现代生物医学进展. 2007;7:1461-1463. |
| 26. | Jose M. Chaves-González, Miguel A. Vega-Rodríguez, Juan A. Gómez-Pulido, Juan M. Sánchez-Pérez. Detecting skin in face recognition systems: A colour spaces study. Digital Signal Processing. 2010;20:806-823. [DOI] |
| 29. | 胡 申宁, 李 文书, 施 国生, 何 芳芳. 基于PCA-AdaBoost的舌象颜色分类研究. 广西师范大学学报(自然科学版). 2009;27:158-161. |