修回日期: 2011-11-09
接受日期: 2011-11-26
在线出版日期: 2011-12-08
目的: 检测UC患者血清及结肠组织中TRX及TXNIP的表达, 分析这两种氧化应激因子与UC病情严重程度的相关性, 探讨二者在UC发生发展中可能的作用.
方法: 收集29例UC患者(病例组)及25例正常人(对照组/C组)的外周静脉血和结肠黏膜活检组织. 按照Sutherland DAI评分标准予以患者评分后, 分为轻中度活动组(A组 = 17例)、重度活动组(B组 = 12例). 分别采用免疫组织化学染色法和酶联免疫检测技术(ELISA)检测各组患者血清和结肠组织中TRX及TXNIP的表达. 根据检测结果, 对TRX、TXNIP与UC患者病情严重程度的相关性进行统计学分析.
结果: 血清学检测显示: TRX和TXNIP在各组中的表达水平为: C组<A组<B组, A组和C组之间无明显差异(P>0.05), 余各组之间均有明显差异(P<0.05). 免疫组织化学染色显示: TRX在各组中的表达水平为: C组<A组<B组; TXNIP在各组中的表达水平为: C组>A组>B组. 各组间的表达均有明显差异(P<0.05). 相关性分析: 血清中TRX及TXNIP的表达与UC患者病情的严重程度均具有显著相关性(r = 0.421, P<0.01; r = 0.439, P<0.01); 结肠组织中TRX和TXNIP的表达与UC患者病情的严重程度均具有显著相关性(r = 0.940, P<0.01; r = -0.940, P<0.01).
结论: 活动期UC患者血清中及结肠组织中TRX与TXNIP的表达与病情的严重程度密切相关, 二者可能通过氧化应激机制参与了UC的发病, 其表达在一定程度上可以反映疾病的活动度.
引文著录: 杨婕琳, 冯丽英, 赵东强, 杨川杰, 刘丽, 姜慧卿. TRX及TXNIP在溃疡性结肠炎患者中的表达及作用. 世界华人消化杂志 2011; 19(34): 3532-3537
Revised: November 9, 2011
Accepted: November 26, 2011
Published online: December 8, 2011
AIM: To detect the expression of thioredoxin (TRX) and thioredoxin-interacting protein (TXNIP) in peripheral blood and colonic mucosa of patients with ulcerative colitis (UC) and to analyze their relationship with UC disease severity.
METHODS: Colonic mucosa and venous blood samples were collected from 29 patients with UC. According to the Sutherland activity index, the patients were divided into two groups: patients with mild to moderate disease (n = 17, group A) and those with severe disease (n = 12, group B). Meanwhile, samples from 25 normal persons were used as controls (group C). The expression of TRX and TXNIP in the colonic mucosa was detected by immunohistochemistry, and serum levels of TRX and TXNIP were determined by ELISA. Statistical analysis was carried out to analyze the correlation between expression of TRX/TXNIP and UC severity.
RESULTS: Serum levels of TRX and TXNIP were lowest in group C, followed by groups A and B. Serum levels of TRX and TXNIP showed no significant differences between groups A and C (both P > 0.05), but differed significantly among the three groups (P < 0.05). The expression of TRX in the colonic mucosa was lowest in group C, followed by groups A and B, while a reverse trend was observed for the expression of TXNIP. Significant differences were found in the expression of TRX and TXNIP between any of the two groups (all P < 0.05). Serum levels of TRX and TXNIP were correlated with the severity of UC activity (r = 0.421, 0.439; both P < 0.01). Expression of TRX and TXNIP in the colonic mucosa was also correlated with the severity of UC activity (r = 0.940, -0.940; both P < 0.01).
CONCLUSION: There is a significant correlation between TRX/TXNIP expression and the severity of UC. TRX and TXNIP may be involved in the pathogenesis of UC via mechanisms associated with oxidative stress.
- Citation: Yang JL, Feng LY, Zhao DQ, Yang CJ, Liu L, Jiang HQ. Expression of TRX and TXNIP in patients with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2011; 19(34): 3532-3537
- URL: https://www.wjgnet.com/1009-3079/full/v19/i34/3532.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i34.3532
溃疡性结肠炎(ulcerative colitis, UC)是一种病因尚未完全明确的结肠慢性非特异性炎症, 治愈难度较大且有一定的恶变率. 由于病因尚不完全明确, 临床疗效欠佳, 因此, UC病因学的研究已成为基础与临床研究公共关注的焦点. 目前研究主要集中在免疫因素、环境因素、遗传因素等方面. 氧化应激也是参与UC发病的因素之一. 氧化应激产生的大量氧化物在UC发病中起着重要的作用[1]. 近年来, 氧化应激相关因子硫氧还蛋白(thioredoxin, TRX)及硫氧还蛋白相互作用蛋白(thioredoxin interacting protein, TXNIP)在氧化应激疾病中的作用受到广泛关注[2-4]. 本课题通过检测UC患者结肠组织及血清中TRX及TXNIP的表达, 分析二者与UC病情严重程度的相关性, 探讨其在UC发生发展中可能的作用, 从而为UC的治疗提供新的靶点与方向.
病例选自2010-03/2010-12就诊于河北医科大学第二医院消化内科的UC患者29例, 入选病例均符合2007年中华医学会消化病学分会制定的我国"炎症性肠病诊断治疗规范的共识意见"中UC的诊断标准[5]. 根据Sutherland DAI评分标准, 将其分为轻中度活动组(A组, n = 17例)及重度活动组(B组, n = 12例). 同时选择肠镜及病理证实结肠组织为正常者为对照组(C组, n = 25例). 各组间在年龄、性别方面无显著差异(P>0.05). 人TRX定量ELISA试剂盒及人TXNIP定量ELISA试剂盒购自河北博海生物工程开发有限公司, 鼠抗人的TRX多克隆抗体及鼠抗人的TXNIP多克隆抗体购自上海瑞聪生物科技有限公司.
1.2.1 标本采集: (1)晨起空腹条件下取肘静脉血5 mL, 1 000 r/min离心20 min, 分离上清, -80 ℃冰箱保存. 测定时在室温下自溶. (2)患者于常规肠道准备后行电子结肠镜检查, 肠镜检查及黏膜组织活检由消化内科医师操作. 镜下观察结肠黏膜病变, 用活检钳夹取A、B组患者病变明显处结肠黏膜4块. 同法选取C组患者正常结肠黏膜组织. 所有组织经生理盐水冲洗后, 置于40 g/L甲醛溶液固定液固定, 4 ℃冰箱保存.
1.2.2 结肠组织病理学检查: 固定后的结肠组织每例取2块进行石蜡包埋、切片、HE染色. 光镜下观察其组织形态变化.
1.2.3 检测结肠黏膜TRX和TXNIP的表达: 免疫组织化学链霉卵白素-过氧化物酶(SP法)检测结肠黏膜TRX和TXNIP的表达(PBS代替一抗作阴性对照, 用已知阳性切片作阳性对照). 细胞内有棕黄色粗颗粒分布或棕黄色细腻颗粒弥漫分布者为阳性反应. 所有标本均在Motic Med 6.0数码医学图像分析系统内在相同的放大倍数下, 每个切片计数10个视野, 以阳性细胞染色的平均吸光度值(A)值来表示抗原表达量, 该值越大, 表明蛋白表达量越高.
1.2.4 检测血清中TRX和TXNIP的表达: 采用ELISA法, 严格按照试剂盒说明书进行操作.
统计学处理 用SPSS16.0软件, 计量资料用中位数表示, 小样本资料不满足正态性的均用非参数秩和检验及Spearman相关分析进行统计分析, P<0.05即认为有统计学意义.
TRX和TXNIP的表达水平均为: C组<A组<B组, A组和C组之间无明显差异(P>0.05), 其余各组之间均有明显差异(P<0.05, 表1).
2.2.1 结肠镜: 正常人结肠黏膜光滑完整, 血管纹理清晰; 活动期UC患者结肠黏膜呈不同程度的充血水肿, 伴有糜烂、溃疡形成, 表面或覆有脓性或血性分泌物, 血管纹理不清, 黏膜呈轻度至重度质脆.
2.2.2 光学显微镜: 正常人结肠组织黏膜腺体排列整齐, 上皮完整, 黏膜固有层可见少量炎性细胞浸润; UC组患者结肠黏膜呈不同程度水肿、糜烂、溃疡形成, 腺体萎缩、坏死, 杯状细胞减少或消失, 大量炎性细胞浸润, 隐窝脓肿形成.
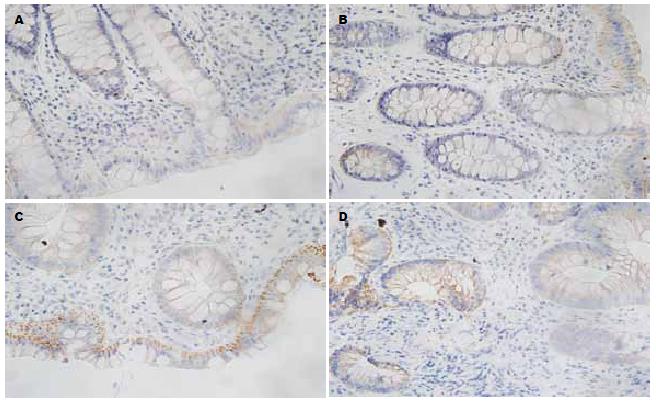
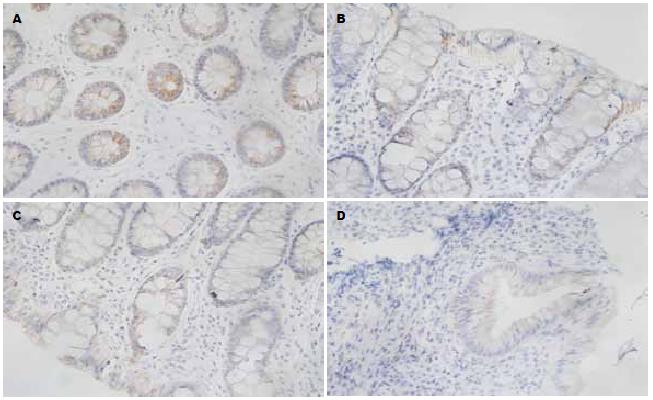
免疫组织化学染色显示: TRX及TXNIP的表达均为胞质着棕黄色, 主要表达于上皮细胞及腺上皮细胞, UC患者的结肠黏膜炎性细胞大量浸润, 伴有不同程度的组织结构破坏, TRX表达的阳性细胞较正常黏膜明显增多且染色较深, TXNIP表达的阳性细胞较正常黏膜明显减少且染色较浅(图1, 2). TRX在各组中的表达水平为: C组<A组<B组, 各组间的表达均有明显差异(P<0.05). TXNIP在各组中的表达水平为: C组>A组>B组, 各组间的表达均有明显差异(P<0.05, 表1).
血清中TRX的表达与UC患者病情的严重程度呈显著正相关(r = 0.421, P<0.01; TXNIP的表达与UC患者病情的严重程度呈显著正相关(r = 0.439, P<0.01). 结肠组织中TRX的表达与UC患者病情的严重程度呈显著正相关(r = 0.940, P<0.01); TXNIP的表达与UC患者病情的严重程度呈显著负相关(r = -0.940, P<0.01).
UC的发病是多因素的, 其具体的作用机制目前还尚不完全明确. 近年来研究发现, 机体活性氧的形成和抗氧化系统的失衡在UC发生发展及肠黏膜组织损伤中起重要作用. UC患者血管内皮细胞和单核细胞比正常人能够产生更多的超氧阴离子, 肠黏膜中吞噬细胞耗氧量也较正常人明显增加, 由此产生的大量活性氧自由基, 通过脂质过氧化反应生成前列腺素样物质、白三烯等因子, 促使机体发生炎症反应[6].
硫氧还蛋白系统是一类具有氧化还原活性的小分子蛋白系统, 由TRX、硫氧还蛋白还原酶(thioredoxin reductase, TRX-R)及还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate, NADPH)三部分构成[7], 在维持机体氧化还原平衡中发挥着重要的作用[4]. 人的TRX是由105个氨基酸组成, 相对分子质量约为12 000 Da[9]. 其氨基酸序列中含有能够调节氧化还原活性的二硫键/巯基(-S2/-SH)结构. 当机体处于氧化应激状态时, 大量产生的O2-、OH及脂质过氧化物均可诱导细胞中TRX的表达上调, 通过直接或者间接的方式抵抗氧化应激, 清除活性氧(reactive oxygen species, ROS), 从而减少DNA的损伤和蛋白质的失活[10]. TRX不仅能够抵抗氧化应激和炎症反应, 还具有抑制细胞凋亡, 促进细胞生长的作用. 还原状态的TRX能够与细胞凋亡信号调节激酶1(apoptosis signal-regulating kinase 1, ASK-1)相互结合, 进而抑制了ASK-1激酶的活性以及ASK-1依赖的凋亡[11]. 研究表明, 许多炎症相关性疾病中均能检测出TRX的表达上调[12-14]. Tamaki等[15]实验发现, 炎症性肠病患者血清中TRX的水平明显高于正常对照组, 并与疾病的活动具有相关性. 由此可见, TRX是一种反应氧化应激水平的指标. 血清TRX的表达升高可能是机体对抗氧化应激的防御反应.
本实验采用ELISA检测发现, TRX在UC组患者血清中表达上调, 与UC病情的严重程度呈正相关(P<0.05), 此结果与Tamaki的实验结果一致. 推测, 在UC活动期, 机体受到ROS的攻击, 使得氧化还原平衡遭到破坏, 为了抵抗氧化应激损伤, 机体代偿性分泌TRX, 因此TRX在UC组患者中的表达上调. A组患者血清TRX的表达水平与C组无明显差别(P>0.05). 可能因为在UC轻中度活动期, 炎症反应主要局限于结肠黏膜中, 或者因为患者病程短, 全身炎症反应尚小, 机体内原有的TRX处于消耗状态, 尚未能刺激机体产生更多的TRX以对抗氧化应激. 当体内原有的还原型TRX消耗至一定程度时, 不能继续抵抗ROS的持续刺激, 机体代偿性分泌更多的还原型TRX, 因此B组患者血清的TRX表达较A组和C组明显升高.
免疫组织化学结果显示, 结肠黏膜组织中TRX的表达随着UC病情的加重而增加(P<0.05), 并与病情严重程度呈正相关, 各组间的差别均有统计学意义(P<0.05). 根据研究结果分析, TRX可能是结肠黏膜抵御氧化应激损伤的重要因子之一. 组织中TRX的表达水平反映了结肠组织受到氧化应激损伤的程度. 而血清中TRX的表达则反映了全身炎症反应及氧化应激损伤的程度和抗氧化的能力.
TXNIP是TRX结合蛋白中的一种, 具有介导氧化应激, 促进细胞凋亡的作用[16]. Zhou等[17]研究发现, 在H2O2过度表达时, TXNIP能够从TRX中分离出来, 并与NLRP3炎性小体结合, 诱导细胞产生炎症反应. Takahashi等[18]用荧光定量RT-PCR及原位杂交研究检测出TXNIP在UC患者肠黏膜中上皮层细胞的表达低于正常组织, 其认为, 一方面选取的结肠上皮破坏较严重, 因此TXNIP表达下调, 可能非氧化应激因素导致, 此外, 在体外试验中短暂的氧化应激刺激下表达是上调的, 而体内氧化应激是持续存在, 两种氧化应激不同的条件, 可能导致TXNIP的表达不同. 由此推断出, TXNIP下调可能部分参与了UC的发病机制, 但具体的作用机制尚未明确.
本实验结肠组织中TXNIP的表达随着UC病情的加重逐渐减少, 与病情严重程度呈负相关(P<0.05), 此结果与Takahashi等[18]的研究一致. 分析本结果可能原因, 由于TXNIP介导了氧化应激的发生, 随着病情的加重, 体内TRX抗氧化作用不断增强, 致使TXNIP在局部黏膜中的表达及作用逐渐减弱. 还可能有免疫反应等多种因素参与到其中. 并且可能与UC相关结肠癌的发生存在一定的关系. 但具体的作用机制, 本实验尚不能明确, 需今后进一步研究.
血清中TXNIP的表达与UC病情严重程度呈正相关(P<0.05). 但A组TXNIP的表达与C组无明显差别(P>0.05). 推测TXNIP的表达上调可能是UC活动期患者体内氧化应激持续存在的原因, 并在介导全身炎症反应、诱导细胞凋亡中发挥着一定的作用. UC发生时, 机体氧化还原失衡, 许多相关的细胞因子被活化, 免疫系统被启动, 在细胞凋亡、组织损伤中发挥了一定的作用. 关于TXNIP在UC患者发病中的研究目前国内未见报道, 国外Takahashi等[18]研究报道一篇, 其具体的作用机制目前尚不明确, 考虑可能与多种未知的因素有关, 需今后进一步探究明确.
机体的氧化还原系统是个结构复杂关联甚广的体系, 氧化应激的诱因很多, 相关因子种类繁多, 且各因子之间联系紧密, 作用机制复杂. 因此, 很多未知的因素也参与到机体的氧化应激反应中, 需要从更多的角度去探讨这些因素与氧化应激以及UC发病的关系. 本实验发现, TRX和TXNIP在UC活动期发挥着一定的作用, 并与此病的发生发展关系密切, 但具体的作用机制, 还需进一步深入研究, 这也是我们今后工作的方向.
溃疡性结肠炎是常见的消化内科疾病之一, 病情轻重不等, 多呈反复发作. 病因迄今尚未完全明确, 临床治疗方面仍很棘手. 氧化应激在该病发病中起着重要作用.
李勇, 副教授, 上海中医药大学附属市中医医院消化科
氧化应激与UC发病的关系, 越来越受到人们的重视. TRX与TXNIP作为机体中维持氧化还原平衡的重要因子, 在该病的作用尚不清楚, 其表达程度与病情的关系目前亦不明确, 有必要深入研究.
国外有学者研究发现TRX在UC患者血清中表达上调, TXNIP在UC患者结肠黏膜中表达下调.
本研究有助于为UC的病情的监测提供新的指标, 为其治疗提供新的靶点与方向.
本研究思路较清晰, 实验设计尚合理, 统计学方法使用恰当, 有一定的参考价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Seril DN, Liao J, Yang GY, Yang CS. Oxidative stress and ulcerative colitis-associated carcinogenesis: studies in humans and animal models. Carcinogenesis. 2003;24:353-362. [PubMed] [DOI] |
| 2. | Kasuno K, Kimura H, Takahashi N, Mikami D, Yokoyama Y, Nobukawa Y, Shigemi K, Yoshida H. [Clinical application of urinary redox regulating protein, thioredoxin]. Rinsho Byori. 2011;59:189-195. [PubMed] |
| 3. | Deng ZH, Cao HQ, Hu YB, Wen JF, Zhou JH. TRX is up-regulated by fibroblast growth factor-2 in lung carcinoma. APMIS. 2011;119:57-65. [PubMed] [DOI] |
| 4. | Aon-Bertolino ML, Romero JI, Galeano P, Holubiec M, Badorrey MS, Saraceno GE, Hanschmann EM, Lillig CH, Capani F. Thioredoxin and glutaredoxin system proteins-immunolocalization in the rat central nervous system. Biochim Biophys Acta. 2011;1810:93-110. [PubMed] |
| 6. | Kruidenier L, Verspaget HW. Review article: oxidative stress as a pathogenic factor in inflammatory bowel disease--radicals or ridiculous? Aliment Pharmacol Ther. 2002;16:1997-2015. [PubMed] [DOI] |
| 7. | Kaimul AM, Nakamura H, Masutani H, Yodoi J. Thioredoxin and thioredoxin-binding protein-2 in cancer and metabolic syndrome. Free Radic Biol Med. 2007;43:861-868. [PubMed] [DOI] |
| 8. | Watanabe R, Nakamura H, Masutani H, Yodoi J. Anti-oxidative, anti-cancer and anti-inflammatory actions by thioredoxin 1 and thioredoxin-binding protein-2. Pharmacol Ther. 2010;127:261-270. [PubMed] [DOI] |
| 9. | Nakamura H, Masutani H, Yodoi J. Extracellular thioredoxin and thioredoxin-binding protein 2 in control of cancer. Semin Cancer Biol. 2006;16:444-451. [PubMed] [DOI] |
| 10. | Maulik N, Das DK. Emerging potential of thioredoxin and thioredoxin interacting proteins in various disease conditions. Biochim Biophys Acta. 2008;1780:1368-1382. [PubMed] |
| 11. | Yoshihara E, Chen Z, Matsuo Y, Masutani H, Yodoi J. Thiol redox transitions by thioredoxin and thioredoxin-binding protein-2 in cell signaling. Methods Enzymol. 2010;474:67-82. [PubMed] [DOI] |
| 12. | 覃 蒙斌, 王 平, 唐 国都, 钟 卫一, 黄 文福, 梁 志海. 硫氧还蛋白-1在急性坏死性胰腺炎并急性胃黏膜损伤中的作用. 胃肠病学和肝病学杂志. 2009;18:711-716. |
| 13. | Stroev SA, Tyul'kova EI, Glushchenko TS, Tugoi IA, Samoilov MO, Pelto-Huikko M. Thioredoxin-1 expression levels in rat hippocampal neurons in moderate hypobaric hypoxia. Neurosci Behav Physiol. 2009;39:1-5. [PubMed] [DOI] |
| 14. | Kamimoto Y, Sugiyama T, Kihira T, Zhang L, Murabayashi N, Umekawa T, Nagao K, Ma N, Toyoda N, Yodoi J. Transgenic mice overproducing human thioredoxin-1, an antioxidative and anti-apoptotic protein, prevents diabetic embryopathy. Diabetologia. 2010;53:2046-2055. [PubMed] [DOI] |
| 15. | Tamaki H, Nakamura H, Nishio A, Nakase H, Ueno S, Uza N, Kido M, Inoue S, Mikami S, Asada M. Human thioredoxin-1 ameliorates experimental murine colitis in association with suppressed macrophage inhibitory factor production. Gastroenterology. 2006;131:1110-1121. [PubMed] [DOI] |
| 16. | Kim SY, Suh HW, Chung JW, Yoon SR, Choi I. Diverse functions of VDUP1 in cell proliferation, differentiation, and diseases. Cell Mol Immunol. 2007;4:345-351. [PubMed] |
| 17. | Zhou R, Tardivel A, Thorens B, Choi I, Tschopp J. Thioredoxin-interacting protein links oxidative stress to inflammasome activation. Nat Immunol. 2010;11:136-140. [PubMed] [DOI] |