修回日期: 2011-10-25
接受日期: 2011-10-30
在线出版日期: 2011-12-08
目的: 研究神经性钙粘素(N-cad)和增殖细胞核抗原(PCNA)蛋白在胃癌组织中的表达及其临床意义.
方法: 选择手术切除的胃癌组织标本(n = 79)为试验组, 胃癌旁组织(n = 45), 以及正常胃黏膜组织(n = 19)为对照组. 应用免疫组织化学法检测胃癌组织、癌旁组织和正常组织中的N-cad和PCNA基因编码蛋白的表达情况, 用SPSS13.0统计软件对N-cad和PCNA蛋白的表达差异及其与患者的临床病理特征进行统计学分析.
结果: N-cad和PCNA蛋白在胃癌中阳性表达率分别为78.5(62/79)和88.6(70/79), 与癌旁组织(71.1, 80)比较无明显差异, 但二者与对照组(10.5, 15.8)比较有显著差异, 组间比较有明显统计学差异(P<0.01). 在试验组中, N-cad和PCNA蛋白表达与患者的年龄、性别、类型及是否淋巴结转移均无明显统计学差异, 而与肿瘤的分化程度及TNM分期有关(N-cad: 62.5% vs 89.4%, 64.5% vs 87.5%; PCNA: 83.3% vs 95.7%, 77.4% vs 95.8%, 均P<0.05).
结论: N-cad和PCNA蛋白在胃癌组织中表达明显上调, 二者呈正相关, 可联合作为评估胃癌恶性生物学行为和预后指标.
引文著录: 韩雪晶, 吴克俭, 肖烨, 孙旻, 朱亚男, 朱炳喜. N-cad和PCNA在胃癌组织中的表达及临床意义. 世界华人消化杂志 2011; 19(34): 3477-3482
Revised: October 25, 2011
Accepted: October 30, 2011
Published online: December 8, 2011
AIM: To investigate the expression of neural cadherin (N-cad) and proliferating cell nuclear antigen (PCNA) proteins in gastric carcinoma and to analyze their clinical significance.
METHODS: Seventy-nine surgical specimens of gastric cancer, 45 paracancerous tissue specimens, and 19 normal gastric mucosal tissue specimens were used in this study. N-cad and PCNA protein expression in these specimens was examined by immunohistochemistry. The correlation between the expression of N-cad and PCNA proteins and clinicopathologic parameters of gastric carcinoma was analyzed.
RESULTS: The rates of N-cad and PCNA protein overexpression in gastric carcinoma were 78.5% (62/79) and 88.6 (70/79), respectively. Although there were no statistical significances in the rates of N-cad and PCNA protein overexpression between gastric carcinoma and paracancerous tissue, they were significantly higher than those in normal control tissue (both P < 0.01). N-cad and PCNA protein overexpression was associated with tumor differentiation and TNM stage (N-cad: 62.5% vs 89.4%, 64.5% vs 87.5%; PCNA: 83.3% vs 95.7%, 77.4% vs 95.8%, all P < 0.05), but not with sex, age, tumor type or lymph node metastasis (all P > 0.05).
CONCLUSION: Up-regulation of N-cad and PCNA protein expression was observed in gastric carcinoma. Detection of N-cad and PCNA protein expression can be used to evaluate malignant biological behavior and prognosis of gastric cancer.
- Citation: Han XJ, Wu KJ, Xiao Y, Sun M, Zhu YN, Zhu BX. Clinical significance of expression of neural cadherin and proliferating cell nuclear antigen in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(34): 3477-3482
- URL: https://www.wjgnet.com/1009-3079/full/v19/i34/3477.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i34.3477
目前, 在全世界由于癌症导致的死亡中, 胃癌仅次于肺癌位居第2位. 而在我国, 胃癌是发病率及死亡率最高的恶性肿瘤之一, 严重威胁着人们的生活和健康. 胃癌是一个多基因疾病, 能引起一系列遗传学改变. 神经型钙粘素(N-cadherin, N-cad)是一种跨膜蛋白, 具有传递信号的功能. 目前研究发现, N-cad在多种肿瘤细胞内高表达[1,2], 参与肿瘤细胞的存活、迁移、浸润及增殖等. 增殖细胞核抗原(proliferation cell nucleus antigen, PCNA)是细胞增殖活性的重要指标. 本研究通过免疫组化检测N-cad和PCNA在胃癌中的表达, 初步探讨二者在胃癌发生发展中的作用及临床意义.
选择2005-01-03/2011-01徐州医学院附属医院外科手术切除并经病理确诊的胃癌组织(n = 79), 其中男(n = 57), 女(n = 22), 年龄19-85(平均年龄为45.37±11.2)岁. 高、中分化腺癌(n = 32), 低分化、未分化腺癌(n = 47); 临床和病理上证实有区域淋巴结转移(n = 45), 无淋巴结转移的(n = 34); 胃癌TNM分期按AJCC标准(2002)组织分型采用Lauren分型方法: 肠型、弥漫型和混合型. 收集癌旁组织(距离肿瘤边缘0.5-1 cm, n = 45). 镜下取手术肿瘤边缘(>5 cm)正常组织(n = 19)作为对照组. 兔抗人Anti-PCNA、鼠抗人Anti-N-cad购自北京中衫金桥生物技术有限公司; 荧光二抗FITC(山羊抗兔)、cy-3(山羊抗鼠)、Hoechst32243均购自碧云天生物技术有限公司; 石蜡切片机(LEICA RM2245); 荧光显微镜(OLYMPUS MF41).
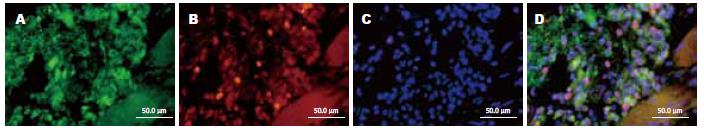
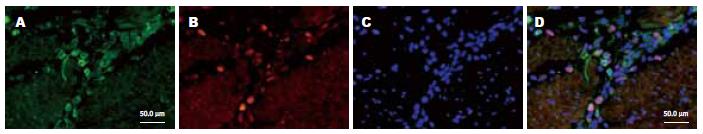
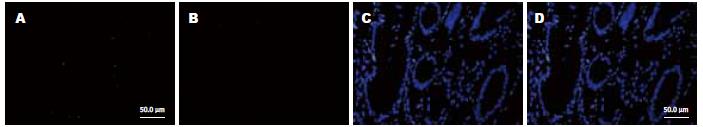
1.2.1 免疫荧光染色法: 石蜡切片、脱蜡、水化, PBS冲洗2×5 min; 高温2 min, 低温15 min行抗原修复; PBS冲洗2×5 min; 10%多聚甲醛固定10 min; 10%山羊血清封闭1 h; 加一抗N-cad 4℃过夜; 加二抗FITC室温2 h; 加一抗PCNA 4 ℃过夜; 加二抗Cy-3室温2 h; 加Hoechst33342室温10 min; 封片剂封片(加抗体后的PBS冲洗省略). 对照组一抗用PBS代替.
1.2.2 N-cad和PCNA蛋白表达荧光检测标准: 高倍镜(400倍)下, 每个视野计数100个细胞, 每张切片数10个视野. 荧光强度的判断标准: (-)阴性, 细胞无荧光显色; (+)为仅能见明确可见的荧光; (++)为可见有明亮的荧光; (+++)为可见耀眼的荧光.
统计学处理 数据处理运用SPSS13.0统计软件, 比率的比较采用两样本构成比(率)比较, χ2检验以P<0.05为差异有统计学意义. N-cad和PCNA蛋白表达相关性检验用Spearman相关分析, 检验水准a = 0.05.
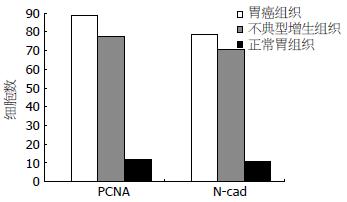
胃癌组织内高表达N-cad和PCNA, 其阳性产物N-cad表达于胞膜和胞浆, PCNA阳性产物表达于细胞核. 在胃癌组织(n = 79)中, N-cad表达的阳性率为78.5%(62/79); 在癌旁组织(n = 5)中, N-cad表达的阳性率为71.1%(32/45); 在对照组组织(n = 19)中, N-cad表达的阳性率为10.5%(2/19). 前两组与对照组比较差异具有统计学意义(P<0.05). 在胃癌组织(n = 79)中PCNA表达的阳性率为88.6%(70/79); 在癌旁组织(n = 45)中PCNA表达的阳性率为80%(36/45), 在对照组组织(n = 19)中, PCNA表达阳性率为15.8%(3/19). 前两组与对照组比较差异具有统计学意义(P<0.05, 表1、图1-4).
| 组织类型 | n | 阳性率(%) | |
| N-cad | PCNA | ||
| 胃癌 | 79 | 62(78.5) | 70(88.6) |
| 癌旁组织 | 45 | 32(71.1) | 36(80.0) |
| 对照组 | 19 | 2(10.5) | 3(15.8) |
在试验组中, N-cad和PCNA蛋白阳性表达与患者的性别、年龄(<60、≥60)、Lanren分型(肠型、弥漫型、混合型)及有无淋巴转移无明显统计学意义. 但在高、中分化胃癌组织中, N-cad阳性表达率为62.5%, 低分化胃癌组织中, N-cad阳性表达率为89.4%, 两组比较差异具有统计学意义(P<0.05). TNM分期Ⅰ、Ⅱ期胃癌组织中, N-cad阳性表达率为64.5%, Ⅲ、Ⅳ期胃癌组织中, N-cad的阳性表达率为87.5%, 两组比较差异具有统计学意义(P<0.05). 在高、中分化胃癌组织中, PCNA阳性表达率为83.3%, 低分化胃癌组织中, PCNA阳性表达率为95.7%, 两组比较差异具有统计学意义(P<0.05). TNM分期Ⅰ、Ⅱ期胃癌组织中, PCNA阳性表达率为77.4%, Ⅲ、Ⅳ期胃癌组织中, PCNA的阳性表达率为95.8%, 两组比较差异具有统计学意义(P<0.05, 表2, 3).
| 临床病理参数 | n | - | + | ++ | +++ | ++++ | 阳性率(%) | P值 |
| 性别 | ||||||||
| 男 | 57 | 11 | 8 | 11 | 15 | 12 | 51(89.5) | >0.05 |
| 女 | 22 | 6 | 4 | 6 | 5 | 4 | 19(86.4) | |
| 年龄(岁) | ||||||||
| <60 | 42 | 9 | 8 | 7 | 9 | 9 | 37(88.1) | >0.05 |
| ≥60 | 37 | 8 | 6 | 9 | 8 | 6 | 33(89.2) | |
| Lanren分型 | ||||||||
| 肠型 | 33 | 3 | 6 | 8 | 9 | 7 | 31(93.9) | >0.05 |
| 弥漫型 | 18 | 7 | 4 | 2 | 4 | 1 | 14(77.8) | |
| 混合型 | 28 | 7 | 5 | 6 | 7 | 3 | 25(89.3) | |
| 分化程度 | ||||||||
| 高、中分化 | 32 | 12 | 5 | 6 | 5 | 4 | 20(62.5) | <0.05 |
| 低、未分化 | 47 | 5 | 7 | 13 | 13 | 9 | 42(89.4) | |
| TNM分期 | ||||||||
| Ⅰ Ⅱ | 31 | 11 | 8 | 6 | 4 | 2 | 20(64.5) | <0.05 |
| Ⅲ Ⅳ | 48 | 6 | 8 | 8 | 14 | 12 | 42(87.5) | |
| 淋巴结转移 | ||||||||
| 有 | 45 | 8 | 6 | 9 | 14 | 8 | 37(82.2) | >0.05 |
| 无 | 34 | 9 | 6 | 10 | 6 | 3 | 25(88.2) | - |
| 临床病理参数 | n | - | + | ++ | +++ | ++++ | 阳性率(%) | P值 |
| 性别 | ||||||||
| 男 | 57 | 6 | 9 | 13 | 15 | 14 | 51(89.5) | >0.05 |
| 女 | 22 | 3 | 4 | 6 | 5 | 4 | 19(86.4) | |
| 年龄(岁) | ||||||||
| <60 | 42 | 5 | 8 | 7 | 13 | 9 | 37(88.1) | >0.05 |
| ≥60 | 37 | 4 | 6 | 9 | 10 | 8 | 33(89.2) | |
| Lanren分型 | ||||||||
| 肠型 | 33 | 2 | 6 | 9 | 9 | 7 | 31(93.9) | >0.05 |
| 弥漫型 | 18 | 4 | 5 | 3 | 4 | 2 | 14(77.8) | |
| 混合型 | 28 | 3 | 5 | 8 | 9 | 3 | 25(89.3) | |
| 分化程度 | ||||||||
| 高、中分化 | 32 | 7 | 6 | 8 | 7 | 4 | 25(83.3) | <0.05 |
| 低、未分化 | 47 | 2 | 5 | 10 | 11 | 9 | 45(95.7) | |
| TNM分期 | ||||||||
| Ⅰ Ⅱ | 31 | 7 | 8 | 8 | 6 | 2 | 24(77.4) | <0.05 |
| Ⅲ Ⅳ | 48 | 2 | 7 | 9 | 15 | 14 | 46(95.8) | |
| 淋巴结转移 | ||||||||
| 有 | 45 | 5 | 9 | 10 | 12 | 9 | 40(88.9) | >0.05 |
| 无 | 34 | 4 | 6 | 11 | 8 | 5 | 30(88.2) | - |
N-cad属于钙离子依赖性跨膜黏附蛋白超家族一员, 在胚胎发育过程中介导细胞分离和维持成年组织完整性上具有重要作用. 该蛋白是在研究抗体时发现的, 是在抗细胞接触结构上的钙离子敏感成分时所产生的一种抗体[3,4]. N-cad最初被鉴定为神经组织内表达的细胞黏附分子, 但是在多种非神经组织内也有表达, 如心肌、睾丸、肾、肝、胃等组织[5]. 近年来, N-cadherin被认为是肿瘤进展的启动子[6]和生物标志物[7], 其在许多肿瘤如黑色素瘤、乳腺癌及前列腺癌等中的含量与成年正常组织相比明显增高; 高表达量的N-cadherin可以通过激活PI3K/Akt信号通路抑制肿瘤细胞的凋亡、促进肿瘤细胞的存活、浸润及转移[8,9]. N-cadherin作为肿瘤治疗的靶点已经引起了相关科研工作者及药物研发人员的关注[10]. 最近的研究表明, N-cad的错误表达可能是乳腺癌和结肠恶化的一个标志[11,12]. Isabelle等[1]研究发现, N-cad在正常尿道上皮无表达, 但在肿瘤的pT1阶段开始表达, 在pT2-pT3阶段表达增加. 无进展生存期和多变量分析显示N-cad的表达对于pT1期肿瘤进展是一个独立的预后诊断标志. 但N-cadherin在胃癌中是否表达及其作用机制目前还不清楚, 因为目前国内外对N-cadherin与胃癌关系的研究比较少.
胃癌的发生演变是多阶段和多基因参与的极为复杂的过程, 与多种基因的激活或失活密切相关. 刘伟等[13]发现, 人类抑癌基因p53在胃癌组织内有表达, 但在癌旁非肿瘤性胃黏膜中未见阳性表达, 初步表明p53基因在胃癌组织中的高表达与胃癌的发生密切相关. N-cad除了具有细胞连接作用外, 还能够进行细胞信号传导, 可与b-catenin结合形成复合体, 介导细胞的存活、迁移和增殖等作用[14]. 本研究发现, N-cad的表达与患者的性别、年龄、肿瘤类型以及是否有淋巴转移无相关性, 但与肿瘤的分期和分化程度相关, 具有统计学意义. N-cad随着肿瘤的恶化程度的增高表达增强, 这可能预示N-cad参与了肿瘤细胞的侵袭和增殖等活动. 李斐等[15]的研究也证实了N-cad的表达随着胶质瘤的恶性程度的增高而增强; 但蒋军广等[16]在非小细胞肺癌组织中N-cad的表达研究发现, N-cad在低级别肿瘤中的表达强于高级别肿瘤, 具有统计学意义. 这可能与N-cad在不同肿瘤组织内的调控机制不同有关, 或者是存在着不同的突变株.
PCNA作为细胞增殖活性的主要指标, 与胃癌侵袭转移及预后密切相关, 这已被国内外学者所证实[17,18]. 本实验结果显示, N-cad与PCNA在胃癌组织中的表达具有相关性.
总之, 联合检测胃癌组织中N-cad和PCNA蛋白表达有着重要的临床意义, 不仅有利于揭示胃癌发生发展、浸润转移的机制, 为患者的预后评价提供参考指标, 而且也为胃癌的治疗提供新的药物靶点和基因靶点的可能.
胃癌是多基因疾病, 手术及放疗并不能从根本解除病症. 因此从基因水平根除疾病已经成为一种很有前途的方法. N-cad是一种跨膜蛋白, 具有细胞连接及信号传导功能. 目前, 已经发现其在多种肿瘤细胞内高表达.
杜雅菊, 主任医师, 哈尔滨医科大学附属第二医院消化内科
近年来, 研究发现N-cad在多种肿瘤组织中存在高表达, 目前已经成为肿瘤研究热点
本研究发现在不同胃组织内N-cad表达不同, 同时了解了N-cad与其他指标的相互关系, 揭示N-cad参与了胃癌组织的发生和发展过程, 并受到其他一些指标的影响.
本文通过免疫组织化学观察N-cad和PCNA在不同胃组织内的表达, 可推测N-cad与不同阶段胃癌的发生密切相关, 为进一步的胃癌临床治疗提供理论基础及药物靶点.
本文可联合作为评估胃癌恶性生物学行为和预后指标,有一定临床意义.
编辑: 李军亮 电编:何基才
| 1. | Lascombe I, Clairotte A, Fauconnet S, Bernardini S, Wallerand H, Kantelip B, Bittard H. N-cadherin as a novel prognostic marker of progression in superficial urothelial tumors. Clin Cancer Res. 2006;12:2780-2787. [PubMed] [DOI] |
| 2. | Alexander NR, Tran NL, Rekapally H, Summers CE, Glackin C, Heimark RL. N-cadherin gene expression in prostate carcinoma is modulated by integrin-dependent nuclear translocation of Twist1. Cancer Res. 2006;66:3365-3369. [PubMed] [DOI] |
| 3. | Hatta K, Takeichi M. Expression of N-cadherin adhesion molecules associated with early morphogenetic events in chick development. Nature. 1986;320:447-449. [PubMed] [DOI] |
| 4. | Volk T, Geiger B. A 135-kd membrane protein of intercellular adherens junctions. EMBO J. 1984;3:2249-2260. [PubMed] |
| 5. | Andersson AM, Edvardsen K, Skakkebaek NE. Expression and localization of N- and E-cadherin in the human testis and epididymis. Int J Androl. 1994;17:174-180. [PubMed] [DOI] |
| 6. | Cavallaro U. N-cadherin as an invasion promoter: a novel target for antitumor therapy? Curr Opin Investig Drugs. 2004;5:1274-1278. [PubMed] |
| 7. | Mosnier JF, Kandel C, Cazals-Hatem D, Bou-Hanna C, Gournay J, Jarry A, Laboisse CL. N-cadherin serves as diagnostic biomarker in intrahepatic and perihilar cholangiocarcinomas. Mod Pathol. 2009;22:182-190. [PubMed] [DOI] |
| 8. | Mariotti A, Perotti A, Sessa C, Rüegg C. N-cadherin as a therapeutic target in cancer. Expert Opin Investig Drugs. 2007;16:451-465. [PubMed] [DOI] |
| 9. | Giussani P, Brioschi L, Bassi R, Riboni L, Viani P. Phosphatidylinositol 3-kinase/AKT pathway regulates the endoplasmic reticulum to golgi traffic of ceramide in glioma cells: a link between lipid signaling pathways involved in the control of cell survival. J Biol Chem. 2009;284:5088-5096. [PubMed] [DOI] |
| 10. | Perotti A, Sessa C, Mancuso A, Noberasco C, Cresta S, Locatelli A, Carcangiu ML, Passera K, Braghetti A, Scaramuzza D. Clinical and pharmacological phase I evaluation of Exherin (ADH-1), a selective anti-N-cadherin peptide in patients with N-cadherin-expressing solid tumours. Ann Oncol. 2009;20:741-745. [PubMed] [DOI] |
| 11. | Knudsen KA, Wheelock MJ. Cadherins and the mammary gland. J Cell Biochem. 2005;95:488-496. [PubMed] [DOI] |
| 12. | Rosivatz E, Becker I, Bamba M, Schott C, Diebold J, Mayr D, Höfler H, Becker KF. Neoexpression of N-cadherin in E-cadherin positive colon cancers. Int J Cancer. 2004;111:711-719. [PubMed] [DOI] |
| 14. | Arnsdorf EJ, Tummala P, Jacobs CR. Non-canonical Wnt signaling and N-cadherin related beta-catenin signaling play a role in mechanically induced osteogenic cell fate. PLoS One. 2009;4:e5388. [PubMed] [DOI] |
| 15. | 李 斐, 江 普查, 袁 先厚, 文 志华, 马 超, 刘 细国, 许 锡镇, 吴 俊. N-cadherin、E-cadherin及b-catenin在胶质瘤中的表达及意义. 中国临床神经外科杂志. 2007;12:536-539. |
| 16. | 张 卫强, 王 云杰, 林 华, 周 勇安, 程 庆书, 刘 锟, 李 小飞, 王 小平. N-cadherin在非小细胞肺癌组织中的表达及临床意义. 第四军医大学学报. 2005;26:96-98. |