修回日期: 2011-10-28
接受日期: 2011-11-04
在线出版日期: 2011-11-28
目的: 分析miR-224在胰腺癌组织中的表达, 探讨其在胰腺癌细胞增殖、细胞周期及凋亡中的意义.
方法: 采用TagMan MGB探针法定量分析40例原发性胰腺癌及对应的癌旁组织MiR-224的表达; 利用反义技术降低胰腺癌细胞(Aspc-1和Bxpc-3)中miR-224的表达; 采用MTT比色法检测细胞增殖的改变, 利用流式细胞技术检测胰腺癌细胞周期和凋亡情况.
结果: 在40例胰腺癌病例中, 43%(17/40)的胰腺癌组织miR-224表达明显高于癌旁组织(P<0.05); 反义miR-224转染胰腺癌细胞Aspc-1和Bxpc-3后, miR-224的表达明显降低, Aspc-1和Bxpc-3胰腺癌细胞生长受到明显抑制, 其生长主要停滞在G0/G1期, 而S期和G2/M期细胞的比例下降; 另外降低miR-224的表达, Aspc-1和Bxpc-3胰腺癌细胞早期凋亡明显增加.
结论: miR-224在胰腺癌组织中表达上调, 降低其表达能明显抑制Aspc-1和Bxpc-3细胞的生长和诱导细胞早期凋亡增加, miR-224有可能成为胰腺癌基因表达调控的新靶点.
引文著录: 邹叶青, 刘川, 贺文凤, 吴琼, 余新, 肖卫东. 胰腺癌MiR-224的表达与细胞增殖和凋亡. 世界华人消化杂志 2011; 19(33): 3409-3414
Revised: October 28, 2011
Accepted: November 4, 2011
Published online: November 28, 2011
AIM: To investigate the expression of miR-224 in pancreatic carcinoma and to evaluate the role of miR-224 in pancreatic cancer cell proliferation and apoptosis.
METHODS: The expression of miR-224 in 40 pancreatic carcinoma tissue specimens and matched tumor-adjacent nontumorous tissue specimens was detected by real-time fluorescence PCR. After using the antisense technology to decrease the expression of miR-224 in pancreatic cancer cells (Aspc-1 and Bxpc-3), MTT assay and flow cytometry were performed to investigate the impact of miR-224 down-regulation on cell proliferation, cell cycle progression and apoptosis.
RESULTS: MiR-224 was found to be overexpressed in 43% of pancreatic carcinoma cases (P < 0.05). After antisense microRNA-mediated knockdown of miR-224, the proliferation of Aspc-1 and Bxpc-3 cells was significantly inhibited. Aspc-1 and Bxpc-3 cells were mainly arrested in G0/G1 phase, and the percentage of cells in S and G2/M phases decreased. In addition, miR-224 knockdown in Aspc-1 and Bxpc-3 cells resulted in an increase in early apoptosis.
CONCLUSION: MiR-224 is overexpressed in human pancreatic carcinoma. Inhibition of miR-224 expression can not only effectively suppress growth but also induce cell apoptosis of Aspc-1 and Bxpc-3 cells. MiR-224 may serve as a new molecular target for the treatment of pancreatic carcinoma.
- Citation: Zou YQ, Liu C, He WF, Wu Q, Yu X, Xiao WD. Association between miR-224 expression and cell proliferation and apoptosis in pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(33): 3409-3414
- URL: https://www.wjgnet.com/1009-3079/full/v19/i33/3409.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i33.3409
胰腺癌(Pancreatic cancer)是胰腺恶性肿瘤中最常见的一种, 且是引起癌症相关死亡的第4大原因[1-4]. 由于其临床表现和症状往往不典型, 恶性程度高, 加上病程发展速度快, 所以胰腺癌患者预后非常差[5-7]. 因此发现胰腺癌的早期诊断标记物和治疗靶点具有重要意义. MicroRNAs (miRNAs)是内源性非编码RNA经过一系列加工后产生的一类大小约20-22 nt的单链小分子RNA, 其功能为调控基因转录后的表达[8-10]. 在恶性肿瘤发生发展中, miRNAs扮演着"癌基因"和(或)"抑癌基因"的重要角色[11-17]. 近年研究发现miR-224在肝细胞癌、肠癌等恶性肿瘤中表达上调[18-19], 另外Wang等[20]报道miR-224不但在肝癌中表达上调, 且可以通过降低凋亡抑制因子-5(apoptosis inhibitor-5, API-5)而参与细胞凋亡活性的影响. Li[21]等发现miR-224在肝癌细胞HepG2中表达上调且参与细胞的侵袭和转移, 然而miR-224在胰腺癌中的表达及功能研究尚未见报道, 本研究拟采用TagMan MGB探针法检测miR-224在胰腺癌组织中的表达情况, 同时利用反义技术降低胰腺癌细胞miR-224的表达, 观察其生长、细胞周期和凋亡情况, 以便为胰腺癌早期诊治提供新的理论和试验基础.
收集2006-01/2011-01南昌大学第二附属医院和南昌大学第一附属医院肝胆外科胰腺癌及癌旁组织手术标本(n = 40). 所有标本均经病理学检查确诊, 其中男(n = 22), 女(n = 18), 年龄30-69岁.
TaqMan miRNA分析试剂盒(美国ABI公司); DMEM高糖培养基(美国Gibco公司)、胎牛血清(美国Hyclone公司)、脂质体Lipfectamine 2000(美国Invitrogen公司); 反义miR-224寡核苷酸(AMO-miR-224)(大连宝生物公司); Annexin V-FITC凋亡检测试剂盒(南京凯基公司); 人胰腺癌细胞系Aspc-1和Bxpc-3购自上海细胞研究所; 实时荧光定量PCR分析仪(美国ABI公司), 流式细胞仪(美国BD公司).
1.2.1 实时荧光定量PCR检测miR-224的表达: 采用TRIzol试剂提取组织总RNA, 紫外分光光度计测定浓度, -70 ℃保存备用, 用miR-224检测试剂盒检测miR-224的表达[22]. 取2 μg总RNA作为模板与3 μL逆转录酶混合, 在20 μL反应体系中, 16 ℃ 30 min, 42 ℃ 30 min, 85 ℃ 5 min, 进行逆转录反应; 收集cDNA, 将其稀释150倍, 取1 μL稀释的cDNA与2 μL TaqMan引物混合, 20 μL反应体系: 95 ℃ 10 min, 随后95 ℃ 15 s, 61 ℃ 60 s, 40个循环. 相对miRNA表达水平用CT值准确计算, U6 snRNA为内参.
1.2.2 反义miR-224单核苷酸序列设计: 根据MiRBase(http://www.sanger.ac.uk/software/Rfam/mirna)提供的miRNA基因序列, 获取人miR-224的序列, 设计相应的反义寡核苷酸序, 采用核酸序列数据库检索程序排除其他的可能同源序列. 同时确定一条随机对照序列, 如下所示: miR-224 sense: 5'-AGUCACUAGUGGUUCCGUUUA-3', 反义miR-224 antisense: 5'-TAAACGGAACCACTAGTGACT-3', 随机序列sense: 5'-UUCUCCGAACGUGUCACGUTT-3', antisense: 5'-ACGUGACACGUUCGGAGAATT-3', 提交大连宝生物合成, PAGE纯化, 全硫代修饰.
1.2.3 细胞株的培养及转染: Aspc-1和Bxpc-3细胞株接种于含100 mL/L胎牛血清的DMEM培养基, 37 ℃、50 mL/L CO2条件下培养. 严格按照脂质体LipfectamineTM 2000转染试剂说明书进行转染, 反义miR-224寡核苷酸终浓度分别为: 50 nmol/L、100 nmol/L, 150 nmol/L、200 nmol/L. 初步筛选出最佳终浓度为100 nmol/L; 分别培养24、48、72 h, 初步筛选出最佳作用时间为48 h. 将荧光对照反义寡核苷酸转染后在倒置荧光显微镜下观察, 重复3次, 转染效率为89%±5%.
1.2.4 反义miR-224单核苷酸转染后对miR-224表达的影响: 转染反义miR-224单核苷酸48 h后, 抽提总RNA经纯度分析, 逆转录为cDNA, (反应条件同1.3.1), 测定cDNA浓度, 同时设立空白对照组、干扰无意义组及转染PBS组. 用miR-224检测试剂盒检测miR-224的表达(具体条件同1.3.1).
1.2.5 MTT检测各组细胞的增殖: 在离心管内将各组细胞悬液充分打匀, 按8×103/孔接种于96孔培养板, 每孔加液量200 μL, 24 h后换液. 实验分组同1.3.4, 每组设6个复孔. 于转染后1 d-4 d每孔加入5 mg/mL MTT试剂20 μL, 于37 ℃, 50 mL/L CO2条件下继续孵育4 h. 吸取各孔上清, 加入DMSO 150 μL/孔, 室温下置水平摇床摇10 min以充分溶解MTT结晶. 在酶联免疫测定仪上选择波长490 nm, 空白孔调零, 测定各孔吸光度(A)值. 每组重复3次. 按下列公式计算细胞生长抑制率(%): 细胞生长抑制率 = (实验组平均A490-对照组平均A490)/对照组平均A490×100%
1.2.6 流式细胞术分析细胞周期变化情况: 实验分组同1.3.4, 细胞接种6孔板, 转染反义miR-224寡核苷酸48 h后收集细胞, 制成单细胞悬液, PBS洗2次, 离心、弃上清, 加PBS重悬细胞, 加-20 ℃预冷的75%乙醇并振荡, 4 ℃固定1 h, 离心、弃冰乙醇, PBS洗1遍, 弃上清; 加入含有50 μg/mL PI(碘化吡啶)和100 μg/mL无DNA酶污染的RNA酶PBS染色液, 4 ℃避光静置1 h, 上机检测. 每组重复3次.
1.2.7 流式细胞术分析细胞早期凋亡: 实验分组同1.3.4, 细胞接种6孔板, 转染反义miR-224寡核苷酸. 48 h后收集细胞, 制成单细胞悬液, PBS洗2次, 离心、弃上清. 利用Annexin V-FITC早期凋亡试剂盒, 流式细胞仪检测细胞早期凋亡情况.
统计学处理 采用SPSS13.0统计软件, 计量资料以(mean±SD)表示, 流式细胞数据经χ2检验分析, P<0.05为差异有统计学意义.
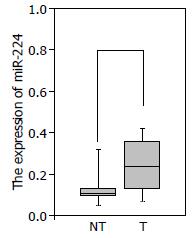
采用Trizol提取总RNA, 以U6 RNA为内参, 利用实时荧光定量PCR检测发现, 40例胰腺癌病人癌及癌旁组织中, 43%(17/40)的病例胰腺癌组织miR-224的表达明显高于相对应的癌旁组织, 结果有统计学意义(P<0.05, 图1).
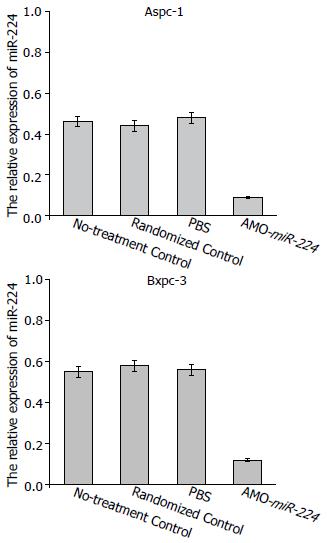
利用反义技术, 将浓度为100 nmol/L反义miR-224寡核苷酸转染到胰腺癌细胞Aspc-1和Bxpc-3中48 h后, 实时荧光定量PCR检测发现, miR-224的表达较对照组降低(P<0.05), 而空白对照组、随机对照组及PBS组间无明显差异(图2).
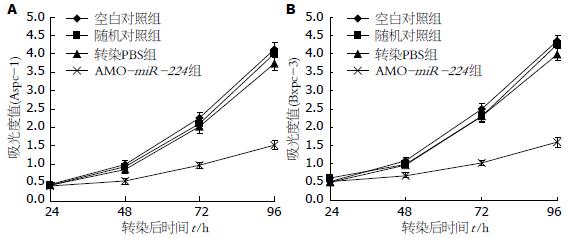
转染AMO-miR-224胰腺癌细胞生长明显慢于对照组(P<0.05), 而空白对照组、随机对照组及转染PBS组间肝癌细胞的生长无明显差异(图3).
转染AMO-miR-224后的胰腺癌细胞Aspc-1和Bxpc-3通过流式细胞周期分析, 转染AMO-miR-224组细胞阻滞于G0/G1期, 而S期和G2/M期明显降低. 数据经χ2检验, 转染AMO-miR-224组较空白对照组、随机对照组、转染PBS组有明显抑制作用(P<0.05), 而空白对照组、随机对照组、转染PBS组间无显著变化(表1, 2).
| 分组 | G0/G1(%) | S(%) | G2/M(%) |
| 空白对照组 | 49.55 | 26.57 | 23.87 |
| 随机对照组 | 46.98 | 21.93 | 31.09 |
| PBS组 | 49.02 | 17.05 | 33.93 |
| AMO-miR-224组 | 82.82 | 8.58 | 8.60 |
| 分组 | G0/G1(%) | S(%) | G2/M(%) | ||
| 空白对照组 | 61.74 | 33.74 | 4.52 | ||
| 随机对照组 | 69.39 | 20.40 | 10.21 | ||
| PBS组 | 68.01 | 21.50 | 10.49 | ||
| AMO-miR-224组 | 86.54 | 10.00 | 3.45 | ||
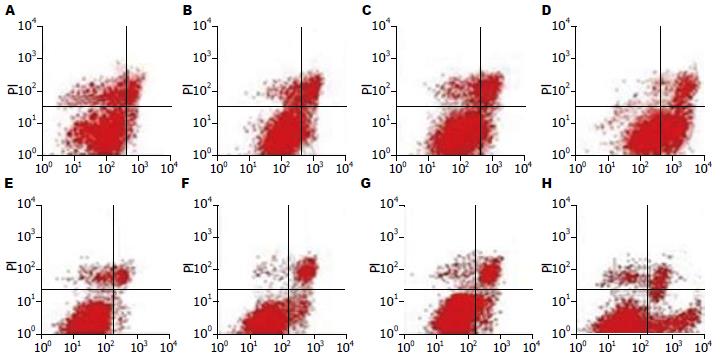
胰腺癌细胞Aspc-1和Bxpc-3转染AMO-miR-224后, 转染AMO-miR-224组较空白对照组、随机对照组、转染PBS组早期凋亡明显增加(P<0.05), 而晚期凋亡无明显改变; 空白对照组、随机对照组、转染PBS组之间各期细胞未见变化(图4).
miRNAs是一类新的基因调控因子, 参与调控细胞分化、血管形成以及细胞存活和生长等许多复杂的生命过程[11,23]. 近年发现, miRNAs与恶性肿瘤密切相关, 约52%调控miRNAs的编码基因位于肿瘤相关基因位点和染色体区域[24,25]. 因此miRNAs可能成为诊断肿瘤的新的分子标志和判断肿瘤治疗及预后的分子靶点. 且由于miRNAs在转录后调节目的基因的表达, 这将更有利于肿瘤的早发现、早诊断和早治疗, 这一发现必将具有广泛的临床应用前景[26].
胰腺癌起病隐匿、发展迅速、死亡率高、预后差, 被全球医学界列为"21世纪的顽固堡垒". 由于其不典型临床症状常被患者和医生忽视而延误诊断, 早期诊断非常困难[27]. 从而迫切需要寻找新的肿瘤标志物来进一步提高胰腺癌的诊疗水平. 近年随着miRNAs研究的不断深入, 发现大量异常表达的miRNAs通过调控靶基因的表达而调节包括胰腺癌在内的多种恶性肿瘤的发生发展, 因此大规模的筛选肿瘤发生发展过程中异常表达的miRNAs将为人们全面认识肿瘤的生物学特性发挥重要作用, 也为胰腺癌的早期诊治提供了新的希望. Murakami等[18]首次研究发现miR-224在肝癌呈过表达, 最近又研究发现miR-224在大肠癌、卵巢癌以及前列腺癌中的表达也失调[19,28,29], 但miR-224在胰腺癌中的表达及其作用目前还不清楚.
我们首先通过TagMan MGB探针法定量分析40例胰腺癌病人癌组织及对应的癌旁组织miR-224的表达, 发现43%(17/40)的胰腺癌病人癌组织miR-224表达上调(P<0.05). Krützfeldt等[30]针对miRNA122及miRNA192的反义寡核苷酸能够明显抑制小鼠不同组织中对应microRNAs的表达, 表明针对miRNAs的反义寡核苷酸可以有效抑制microRNAs的表达. 随后本研究同样利用反义技术成功降低胰腺癌细胞Aspc-1和Bxpc-3的miR-224表达, 并筛选出最佳作用浓度和时间. 转染终浓度为100 nmol/L的AMO-miR-224经过48 h后, 经荧光定量PCR反应检测发现miR-224表达抑制率达74%, 同时我们利用MTT法检测发现Aspc-1和Bxpc-3胰腺癌细胞的生长受到抑制. 最后我们应用流式细胞术对转染AMO-miR-224后的细胞的细胞周期各期DNA的含量及细胞凋亡情况进行分析, 其结果发现降低miR-224表达后, 两组细胞的细胞周期主要停滞在G0/G1期, 而 S期和G2/M期细胞的比例明显下降, 且两组细胞的早期凋亡也明显增加.
总之, miR-224在胰腺癌的发生中发挥重要作用, 很可能成为一个新的胰腺癌的癌前标记物, 为胰腺癌基因治疗提供新的靶点. 但其具体的作用机制, 如miR-224如何调控胰腺癌细胞的生长? 下游靶基因是什么? 都有待于进一步深入研究.
结直肠癌是常见的恶性肿瘤, 在我国发病率逐年上升. 在目前抗肿瘤分子靶向治疗中, 表皮生长因子受体(epidermal growth factor receptor, EGFR)是最受关注的治疗靶点之一.
刘宝林, 教授, 中国医科大学附属盛京医院普通外科
近年来国内外围绕着EGFR单抗在结直肠癌中的应用进行了广泛深入的研究, 取得了巨大的进展, 但仍有很多亟待解决的问题, 解决问题的关键在于对其抗肿瘤的具体机制仍不确切.
Spano等报道在结直肠癌中EGFR高表达, 并与肿瘤细胞的增殖、凋亡等关系密切, 是重要的抑制肿瘤增殖的治疗靶点.
本研究从细胞周期的角度来探讨RNA干扰抑制EGFR表达对结直肠癌细胞增殖影响的机制.
本研究以人结直肠癌细胞HCT-15为研究对象, 构建EGFR-短发夹RNA(short hairpin RNA, shRNA)载体, 采用脂质体转染的方法构建了稳定可信的转染细胞模型, 为进一步细胞周期调控因子的研究奠定基础.
课题设计合理, 方法科学, 手段先进, 统计分析得当, 结论可信, 是一篇较好的实验论文.
编辑: 李军亮 电编:闫晋利
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 2. | Castellanos EH, Cardin DB, Berlin JD. Treatment of early-stage pancreatic cancer. Oncology (Williston Park). 2011;25:182-189. [PubMed] |
| 3. | Krejs GJ. Pancreatic cancer: epidemiology and risk factors. Dig Dis. 2010;28:355-358. [PubMed] [DOI] |
| 4. | Welsch T, Büchler MW, Schmidt J. [Surgery for pancreatic cancer]. Z Gastroenterol. 2008;46:1393-1403. [PubMed] [DOI] |
| 5. | Maisonneuve P, Lowenfels AB. Epidemiology of pancreatic cancer: an update. Dig Dis. 2010;28:645-656. [PubMed] [DOI] |
| 6. | Orr RK. Outcomes in pancreatic cancer surgery. Surg Clin North Am. 2010;90:219-234. [PubMed] [DOI] |
| 7. | Löhr JM. Medical treatment of pancreatic cancer. Expert Rev Anticancer Ther. 2007;7:533-544. [PubMed] [DOI] |
| 8. | Zeng Y. Principles of micro-RNA production and maturation. Oncogene. 2006;25:6156-6162. [PubMed] [DOI] |
| 9. | Kloosterman WP, Plasterk RH. The diverse functions of microRNAs in animal development and disease. Dev Cell. 2006;11:441-450. [PubMed] [DOI] |
| 10. | Sayed D, Abdellatif M. MicroRNAs in development and disease. Physiol Rev. 2011;91:827-887. [PubMed] [DOI] |
| 11. | Croce CM. Causes and consequences of microRNA dysregulation in cancer. Nat Rev Genet. 2009;10:704-714. [PubMed] [DOI] |
| 12. | Munker R, Calin GA. MicroRNA profiling in cancer. Clin Sci (Lond). 2011;121:141-158. [PubMed] [DOI] |
| 13. | Szafranska AE, Davison TS, John J, Cannon T, Sipos B, Maghnouj A, Labourier E, Hahn SA. MicroRNA expression alterations are linked to tumorigenesis and non-neoplastic processes in pancreatic ductal adenocarcinoma. Oncogene. 2007;26:4442-4452. [PubMed] [DOI] |
| 14. | Yu DC, Li QG, Ding XW, Ding YT. Circulating MicroRNAs: Potential Biomarkers for Cancer. Int J Mol Sci. 2011;12:2055-2063. [PubMed] [DOI] |
| 15. | Tricoli JV, Jacobson JW. MicroRNA: Potential for Cancer Detection, Diagnosis, and Prognosis. Cancer Res. 2007;67:4553-4555. [PubMed] [DOI] |
| 16. | Zhang W, Dahlberg JE, Tam W. MicroRNAs in tumorigenesis: a primer. Am J Pathol. 2007;171:728-738. [PubMed] [DOI] |
| 17. | Cho WC. OncomiRs: the discovery and progress of microRNAs in cancers. Mol Cancer. 2007;6:60. [PubMed] [DOI] |
| 18. | Murakami Y, Yasuda T, Saigo K, Urashima T, Toyoda H, Okanoue T, Shimotohno K. Comprehensive analysis of microRNA expression patterns in hepatocellular carcinoma and non-tumorous tissues. Oncogene. 2006;25:2537-2545. [PubMed] [DOI] |
| 19. | Oberg AL, French AJ, Sarver AL, Subramanian S, Morlan BW, Riska SM, Borralho PM, Cunningham JM, Boardman LA, Wang L. miRNA expression in colon polyps provides evidence for a multihit model of colon cancer. PLoS One. 2011;6:e20465. [PubMed] [DOI] |
| 20. | Wang Y, Lee AT, Ma JZ, Wang J, Ren J, Yang Y, Tantoso E, Li KB, Ooi LL, Tan P. Profiling microRNA expression in hepatocellular carcinoma reveals microRNA-224 up-regulation and apoptosis inhibitor-5 as a microRNA-224-specific target. J Biol Chem. 2008;283:13205-13215. [PubMed] [DOI] |
| 21. | Li Q, Wang G, Shan JL, Yang ZX, Wang HZ, Feng J, Zhen JJ, Chen C, Zhang ZM, Xu W. MicroRNA-224 is upregulated in HepG2 cells and involved in cellular migration and invasion. J Gastroenterol Hepatol. 2010;25:164-171. [PubMed] [DOI] |
| 22. | Griffiths-Jones S, Grocock RJ, van Dongen S, Bateman A, Enright AJ. miRBase: microRNA sequences, targets and gene nomenclature. Nucleic Acids Res. 2006;34:D140-D144. [PubMed] [DOI] |
| 23. | Stefani G, Slack FJ. Small non-coding RNAs in animal development. Nat Rev Mol Cell Biol. 2008;9:219-230. [PubMed] [DOI] |
| 24. | Esquela-Kerscher A, Slack FJ. Oncomirs - microRNAs with a role in cancer. Nat Rev Cancer. 2006;6:259-269. [PubMed] [DOI] |
| 25. | Calin GA, Croce CM. MicroRNA signatures in human cancers. Nat Rev Cancer. 2006;6:857-866. [PubMed] [DOI] |
| 26. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Murray T, Thun MJ. Cancer statistics, 2008. CA Cancer J Clin. 2008;58:71-96. [PubMed] [DOI] |
| 27. | Klapman J, Malafa MP. Early detection of pancreatic cancer: why, who, and how to screen. Cancer Control. 2008;15:280-287. [PubMed] |
| 28. | White NM, Chow TF, Mejia-Guerrero S, Diamandis M, Rofael Y, Faragalla H, Mankaruous M, Gabril M, Girgis A, Yousef GM. Three dysregulated miRNAs control kallikrein 10 expression and cell proliferation in ovarian cancer. Br J Cancer. 2010;102:1244-1253. [PubMed] [DOI] |