修回日期: 2011-10-20
接受日期: 2011-11-04
在线出版日期: 2011-11-18
目的: 研究川芎嗪干预对68%(2/3)肝切除大鼠术后残肝组织的保护作用, 以及其对肝脏核因子κB(NF-κB)激活的影响.
方法: 60只SD大鼠随机分成3组(每组20只), 均行68%(2/3)肝切除术. 术后30 min分别给予以下处理: A组腹腔注射生理盐水, B组注射吡咯烷二硫代氨甲基甲酸盐(PDTC), C组注射川芎嗪. 术后2 h、6 h、10 h和24 h 观察各组大鼠术后一般情况和血清转氨酶变化. 组织切片观察残肝组织病理状况, Western blot方法检测NF-κB的激活.
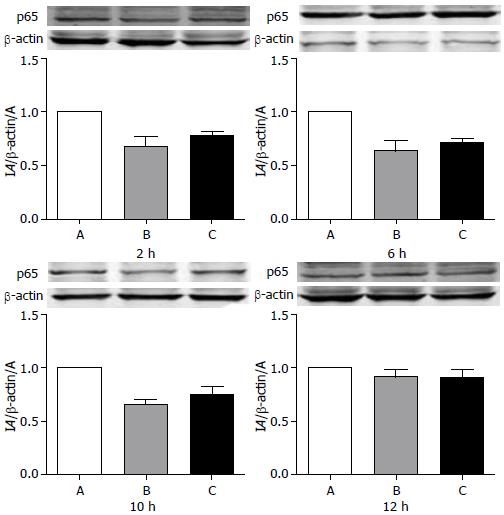
结果: C组大鼠残肝组织切片细胞水肿较A组轻; 丙氨酸氨基转氨酶(ALT)在6 h(488.9 U/L±59.2 U/L)、10 h(670.0 U/L±73.4 U/L), 较A组(651.6 U/L±65.3 U/L, 930.0 U/L±62.9 U/L)低, P<0.05; 天门冬氨酸氨基转移酶(AST)在6 h(1113.1 U/L±138.7 U/L)、10 h(1388.2 U/L±209.6 U/L), 较A组(1315.0 U/L±111.0 U/L, 1728.4 U/L±87.3 U/L)低, P<0.05; NF-κB 的激活在术后2 h(0.78±0.04)和10 h(0.75±0.07)均低于A组(均为1), 高于B组(0.68±0.09, 0.66±0.04), P<0.05, 6 h(0.71±0.07)低于A组(1), P<0.05, 与B组(0.64±0.09)接近, P>0.05.
结论: 川芎嗪通过抑制NF-κB的激活, 对创伤后肝组织产生保护作用, 其保护作用接近于PDTC.
引文著录: 陈战, 窦科峰, 王德盛, 杨平, 蔡佳辰, 李霄, 刘志佳, 李小磊. 川芎嗪对肝创伤后早期大鼠残肝组织保护作用的评价. 世界华人消化杂志 2011; 19(32): 3291-3296
Revised: October 20, 2011
Accepted: November 4, 2011
Published online: November 18, 2011
AIM: To investigate the effect of ligustrazine in alleviating inflammation and inhibiting the activation of NF-κB in rats after liver trauma.
METHODS: Sixty rats which underwent 2/3 hepatectomy were randomly and equally divided into three groups. Group A was intraperitoneally injected with normal saline, and groups B and C were injected with PDTC and ligustrazine, respectively. The general status of the rats was observed, and changes in serum levels of aminotransferases were measured. Hepatic pathological changes were examined, and the activation of NF-κB was investigated by Western blot.
RESULTS: Cellular swelling was milder in group C than in group A. Serum levels of ALT at 6 and 10 h after the operation were significantly lower in group C than in group A (6 h: 488.9 U/L ± 59.2 U/L vs 651.6 ± 65.3 U/L; 10 h: 670.0 U/L ± 73.4 U/L vs 930.0 U/L ± 62.9 U/L; both P < 0.05). Serum levels of AST at 6 and 10 h were also significantly lower in group C than in group A (6 h: 1113.1 U/L ± 138.7 U/L vs 1315.0 U/L ± 111.0 U/L; 10 h: 1388.2 U/L ± 209.6 U/L vs 1728.4 U/L ± 87.3 U/L; both P < 0.05). The levels of activated NF-κB in group C (0.78 ± 0.04, 0.75 ± 0.07) were lower than those in group A (both were 1), higher than those in group B (0.68 ± 0.09, 0.66 ± 0.04) at 2 and 10 h (all P < 0.05), but were comparable to that in group B at 6 h (0.71 ± 0.07 vs 0.64 ± 0.09, P > 0.05).
CONCLUSION: Ligustrazine protects the posttraumatic liver tissue possibly by inhibiting the activation of NF-κB.
- Citation: Chen Z, Dou KF, Wang DS, Yang P, Cai JC, Li X, Liu ZJ, Li XL. Protective effect of ligustrazine on residual liver tissue in rats after hepatectomy. Shijie Huaren Xiaohua Zazhi 2011; 19(32): 3291-3296
- URL: https://www.wjgnet.com/1009-3079/full/v19/i32/3291.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i32.3291
肝创伤是临床最常见的外伤之一, 在交通事故等暴力伤中占较大比例[1-5], 同时, 肝叶和半肝切除造成的医源性肝创伤的发生率也逐年升高. 如何促进肝创伤后的修复是普通外科医师面临的重要课题. 核因子κB(nuclear factor-κB)通路是肝创伤修复诸多生理病理反应的重要信号通路[6-10]. 我科实验室既往实验表明, 用特异性阻断剂吡咯烷二硫代氨甲基甲酸盐(PDTC)阻断NF-κB通路, 对创伤后肝脏可产生保护作用[11,12], 相关文献也支持这一论断[13,14]. 但PDTC作为人工合成的化学药物, 其安全性尚未证实, 目前尚未能在临床得以实际应用. 近年来, 手术配合中医药治疗肝创伤有较多成功报道, 其相应机制探索也成为研究热点[15-18]. 川芎嗪(Ligustrazine)是川芎的主要有效成分之一, 提取自川芎的根, 属酰胺类生物碱, 化学结构为四甲基吡嗪. 心脑血管相关研究报道, 川芎嗪具有强烈的抑制血管收缩作用, 并减少肿瘤坏死因子α(tumor necrosis factor-α)和多种白介素(包括IL-4、IL-6等)的产生, 从而保护组织细胞[19-21]. 在其他组织器官的研究中, 已发现其与NF-κB可能存在关系[22-23]. 我们将川芎嗪引入肝创伤术后的治疗, 以观察其对创伤后肝脏是否具有保护作用和对早期NF-κB激活的影响, 并与PDTC作对照, 比较两者作用差别.
SD大鼠由中国人民解放军第四军医大学动物实验中心提供, 体质量280-320 g, 约8 wk. PDTC和全蛋白提取试剂盒(RIPA)购自碧云天生物技术研究所, 川芎嗪注射剂为哈尔滨三联药业公司产品. NF-κB p65单抗购自Santa Cruz生物科技公司.
1.2.1 动物分组和处理: 将60只大鼠完全随机分配到3组: 生理盐水组(A组)、PDTC组(B组)和川芎嗪组(C组), 每组20只. 所有大鼠均以0.3%戊巴比妥钠腹腔注射麻醉下, 参照Higgins创建的方法, 切除大鼠肝左叶和中叶, 即68%(2/3)肝切除术. 术后30 min, A组腹腔注射0.9%氯化钠注射液(10 mL/kg体质量); B组大鼠腹腔注射10 mg/mL PDTC(100 mg/kg体质量); C组大鼠腹腔注射10 mg/mL川芎嗪(100 mg/kg体质量). 分别于术后2 h、6 h、10 h和24 h(每时间点5只)麻醉大鼠, 取出残肝组织. 大鼠术前和取残肝组织前均留取静脉血, 静置后高速离心, 取血清待检.
1.2.2 检测: 部分残肝组织以10%甲醛溶液固定, 48 h后作病理切片, HE染色, 光学显微镜(200倍)下观察. 所取血清送检丙氨酸氨基转氨酶(ALT)和天门冬氨酸氨基转移酶(AST), 以判断大鼠肝功能情况. 另取部分残肝组织提取全蛋白行Western-blot检测, 以NF-κB亚基p65的检出量反映NF-κB的激活情况. 过程遵循常规程序: 每个样品取40 mg残肝组织遵照全蛋白提取试剂盒说明提取全蛋白, 10%SDS-聚丙烯酰胺电泳并转移至硝酸纤维素膜. 所用抗体主要包括兔抗鼠NF-κB p65单抗(Santa Cruz Biotech, Santa Cruz, CA, USA, 1:200稀释), 山羊抗鼠β-actin单抗(博士德生物制品公司, 武汉, 中国, 1:500稀释), 结合IRDye800的荧光二抗(Rockland Inc, Gilbertsville, PA, USA, 1:20 000稀释)等, 经奥德赛红外图像处理系统扫膜, 并用Gelpro32软件分析, 获取目的条带整合光吸光度(Integrated optical density, IA)和内参β-actin光吸光度(β-actin/A). 为减小多次实验之间的误差干扰, 参照文献方法[24,25], 以"IA/β-actin/A"值作统计学分析.
统计学处理 实验结果以mean±SD表示, 所有数据利用SPSS13.0处理, 组间比较应用单因素方差分析, LSD-t检验. 以P<0.05为检验标准.
大鼠术后均存活, 均在术后2 h内苏醒, 2-4 h开始进食饮水, 8-10 h可自如活动, 24 h均恢复到术前状态.
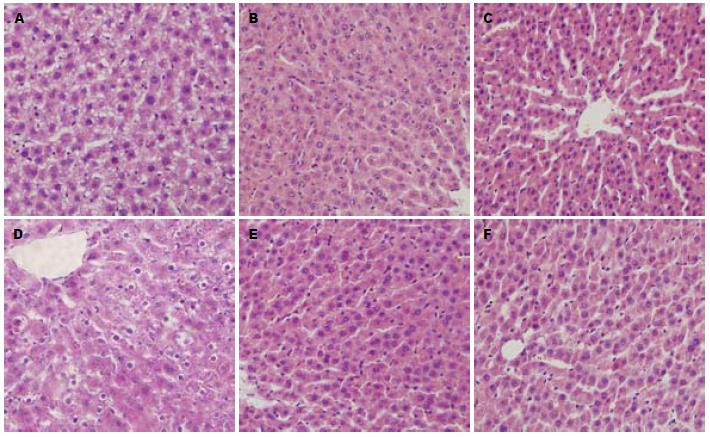
200倍光学显微镜下观察, B组和C组残肝组织细胞水肿变性等病理变化较A组轻(图1).
大鼠术后ALT及AST均明显升高. ALT检测, 2 h及24 h 3组之间没有明显差异, C组在6 h和10 h均低于A组高于B组, P<0.05; AST检测结果与ALT结果类似, 3组在2 h和24 h差异不显著, C组在6 h和10 h均低于A组, 在10 h高于B组(P<0.05, 表1, 2).
创伤后的肝组织修复再生是一个复杂的过程, 包含细胞增殖、凋亡、炎症反应等多个生理及病理反应, 很多信号传导通路参与其中. 创伤发生后, 一系列迅即-早期基因(Immediate-Early Genes)被迅速诱导激活, 主要的信号转导通路有JNK、NF-κB、STAT3等[26,27]. NF-κB广泛存在于各类细胞, 参与多种细胞因子基因的表达活化过程. NF-κB家族主要有5个亚基: RelA(p65)、RelB、c-Rel、p50(p105)和p52(p100). NF-κB非活化时与IκB亚基结合以三聚体的形式存在于细胞质中, 当受到脂多糖(LPS)、肿瘤坏死因子α(TNFα)等传导的刺激信号时, IκB磷酸化与NF-κB解聚, 活化的NF-κB进入胞核, 与靶基因结合[28-30]. NF-κB在肝脏中的作用比较复杂, 报道认为NF-κB可以通过调控TNFα、IL-6、集落刺激因子和细胞黏附因子等的表达, 参与肝脏炎症反应、肝细胞凋亡、肝纤维化等过程[31].
PDTC作用位点明确, 但文献报道的效应并不一致, 有文献认为PDTC的抑制作用使NF-κB介导的炎症反应减轻, 减少细胞凋亡和纤维化形成, 因而在毒素、缺血再灌注等造成的损伤中有保护作用[11-14,32]. 川芎嗪具有抗凝、抑制血小板聚集、扩张血管、改善微循环、抗内皮素和保护血管内皮、抗氧化和钙拮抗作用等广泛的生物作用[19-21,33-35]. 目前主要用于心脑血管疾病的临床治疗.
我们的实验显示, 川芎嗪干预的大鼠血清转氨酶水平明显较对照组降低; 病理切片也显示, 其炎性细胞浸润较对照组少, 细胞变性坏死较对照组轻微. 可以认为川芎嗪的干预降低了残肝组织的炎症反应, 减轻了残肝组织损伤, 发挥了保护效应. 虽然川芎嗪干预的大鼠转氨酶降低幅度较PDTC组略小, 但其总体保护效果接近于PDTC干预的大鼠, 表明其作为已经应用于临床的药物可能具有新的临床应用价值, 有进行进一步实验观察的价值.
既往实验表明, PDTC的保护作用与其对NF-κB的抑制密切相关, PDTC通过抑制NF-κB通路, 减轻了炎症反应, 减少了细胞凋亡等负面反应. 我们的实验也证明, 应用川芎嗪的大鼠, 其残肝组织NF-κB的激活较对照组低, 而与PDTC组接近, 从而提示川芎嗪可能也是通过相同的通路达到近似的保护残肝组织效果. 我们将在下一步的实验中进行进一步的观察研究.
NF-κB广泛存在于各类细胞, 参与多种细胞因子基因的表达活化过程. NF-κB在肝脏中的作用比较复杂. 报道认为NF-κB可以通过调控TNFα、IL-6、集落刺激因子和细胞黏附因子等的表达, 参与肝脏炎症反应、肝细胞凋亡、肝纤维化等过程.
王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科
中医药治疗肝创伤是目前研究的热点, 同时其机理研究也是该研究的重点.
首次采用创伤后给药的形式, 与创伤救治方式更为接近.
本文肯定了川芎嗪在肝保护方面的作用, 为其临床应用提供一定的实验基础.
川芎嗪(Ligustrazine): 川芎的主要有效成分之一, 提取自川芎的根, 属酰胺类生物碱, 化学结构为四甲基吡嗪.
本文的设计和思路很好, 对肝创伤的临床治疗提供了一定的借鉴和参考.
编辑: 李军亮 电编:闫晋利
| 1. | Miller PR, Croce MA, Bee TK, Malhotra AK, Fabian TC. Associated injuries in blunt solid organ trauma: implications for missed injury in nonoperative management. J Trauma. 2002;53:238-242; discussion 242-244. [PubMed] [DOI] |
| 2. | Clancy TV, Gary Maxwell J, Covington DL, Brinker CC, Blackman D. A statewide analysis of level I and II trauma centers for patients with major injuries. J Trauma. 2001;51:346-351. [PubMed] [DOI] |
| 3. | Bardenheuer M, Obertacke U, Waydhas C, Nast-Kolb D. [Epidemiology of the severely injured patient. A prospective assessment of preclinical and clinical management. AG Polytrauma of DGU]. Unfallchirurg. 2000;103:355-363. [PubMed] [DOI] |
| 4. | Matthes G, Stengel D, Seifert J, Rademacher G, Mutze S, Ekkernkamp A. Blunt liver injuries in polytrauma: results from a cohort study with the regular use of whole-body helical computed tomography. World J Surg. 2003;27:1124-1130. [PubMed] [DOI] |
| 5. | Shanmuganathan K, Mirvis SE, Chiu WC, Killeen KL, Hogan GJ, Scalea TM. Penetrating torso trauma: triple-contrast helical CT in peritoneal violation and organ injury--a prospective study in 200 patients. Radiology. 2004;231:775-784. [PubMed] [DOI] |
| 6. | Takahashi T, Togo S, Kumamoto T, Watanabe K, Kubota T, Ichikawa Y, Endo I, Kunisaki C, Nagashima Y, Fujimoto J. Transfection of NF-kappaB decoy oligodeoxynucleotides into macrophages reduces murine fatal liver failure after excessive hepatectomy. J Surg Res. 2009;154:179-186. [PubMed] [DOI] |
| 7. | Vainer GW, Pikarsky E, Ben-Neriah Y. Contradictory functions of NF-kappaB in liver physiology and cancer. Cancer Lett. 2008;267:182-188. [PubMed] [DOI] |
| 8. | Devi SS, Mehendale HM. The role of NF-kappaB signaling in impaired liver tissue repair in thioacetamide-treated type 1 diabetic rats. Eur J Pharmacol. 2005;523:127-136. [PubMed] [DOI] |
| 9. | Giakoustidis DE, Giakoustidis AE, Iliadis S, Koliakou K, Antoniadis N, Kontos N, Papanikolaou V, Papageorgiou G, Kaldrimidou E, Takoudas D. Attenuation of liver ischemia/reperfusion induced apoptosis by epigallocatechin-3-gallate via down-regulation of NF-kappaB and c-Jun expression. J Surg Res. 2010;159:720-728. [PubMed] [DOI] |
| 10. | Watson MR, Wallace K, Gieling RG, Manas DM, Jaffray E, Hay RT, Mann DA, Oakley F. NF-kappaB is a critical regulator of the survival of rodent and human hepatic myofibroblasts. J Hepatol. 2008;48:589-597. [PubMed] [DOI] |
| 13. | Uwe S. Anti-inflammatory interventions of NF-kappaB signaling: potential applications and risks. Biochem Pharmacol. 2008;75:1567-1579. [PubMed] [DOI] |
| 14. | Surh YJ, Chun KS, Cha HH, Han SS, Keum YS, Park KK, Lee SS. Molecular mechanisms underlying chemopreventive activities of anti-inflammatory phytochemicals: down-regulation of COX-2 and iNOS through suppression of NF-kappa B activation. Mutat Res. 2001;480-481:243-268. [PubMed] [DOI] |
| 21. | 缪 心军, 袁 国栋, 陈 玉熹, 黄 节, 徐 克, 蒋 贤高, 尤 荣开, 蔡 平平. 川芎嗪联合依达拉奉对脓毒血症大鼠自由基及细胞因子的影响. 实用医学杂志. 2009;25:2038-2040. |
| 24. | Cheng O, Ostrowski RP, Liu W, Zhang JH. Activation of liver X receptor reduces global ischemic brain injury by reduction of nuclear factor-kappaB. Neuroscience. 2010;166:1101-1109. [PubMed] [DOI] |
| 25. | Li Y, Shen L, Cai L, Wang Q, Hou W, Wang F, Zeng Y, Zhao G, Yao L, Xiong L. Spatial-temporal expression of NDRG2 in rat brain after focal cerebral ischemia and reperfusion. Brain Res. 2011;1382:252-258. [PubMed] [DOI] |
| 26. | Tarlá MR, Ramalho FS, Ramalho LN, Silva Tde C, Brandão DF, Ferreira J, Silva Ode C, Zucoloto S. A molecular view of liver regeneration. Acta Cir Bras. 2006;21 Suppl 1:58-62. [PubMed] |
| 27. | Michalopoulos GK. Liver regeneration after partial hepatectomy: critical analysis of mechanistic dilemmas. Am J Pathol. 2010;176:2-13. [PubMed] [DOI] |
| 28. | Sen R, Baltimore D. Inducibility of kappa immunoglobulin enhancer-binding protein Nf-kappa B by a posttranslational mechanism. Cell. 1986;47:921-928. [PubMed] [DOI] |
| 29. | Chakraborty JB, Mann DA. NF-kappaB signalling: embracing complexity to achieve translation. J Hepatol. 2010;52:285-291. [PubMed] [DOI] |
| 30. | Niederberger E, Geisslinger G. Analysis of NF-kappaB signaling pathways by proteomic approaches. Expert Rev Proteomics. 2010;7:189-203. [PubMed] [DOI] |
| 31. | Li JD, Peng Y, Peng XY, Li QL, Li Q. Suppression of nuclear factor-kappaB activity in Kupffer cells protects rat liver graft from ischemia-reperfusion injury. Transplant Proc. 2010;42:1582-1586. [PubMed] [DOI] |
| 32. | 李 英华, 田 晓峰, 王 真真, 张 雪松, 张 峰, 金 松, 姚 继红. NF-κB对肠缺血再灌注肝损伤P-选择素表达和中性粒细胞浸润的作用. 世界华人消化杂志. 2006;14:486-490. [DOI] |
| 33. | 孙 建华. 脑梗死患者脑循环动力学改变和川芎嗪对急性缺血性脑损伤的保护作用. 中国中西医结合急救杂志. 2005;12:248-249. |