修回日期: 2011-10-20
接受日期: 2011-11-04
在线出版日期: 2011-11-08
目的: 通过Meta分析探讨辅助放化疗在胰腺癌术后患者治疗中的意义.
方法: 计算机检索Pubmed(1970/2011-07)、EMbase(1974/2011-07)、Cochrane图书馆(2011年第7期)、中国生物医学文献数据库(1978/2011-07)、ASCO等论文集检索相关发表及未发表的文献, 查找有关胰腺癌术后辅助放化疗的临床试验研究. 由2名评价者独立选择试验、提取资料和评估方法学质量, 而后采用Cochrane协作网RevMan5.0软件进行统计分析. 对辅助治疗组和观察组2年生存率、5年生存率进行Meta分析.
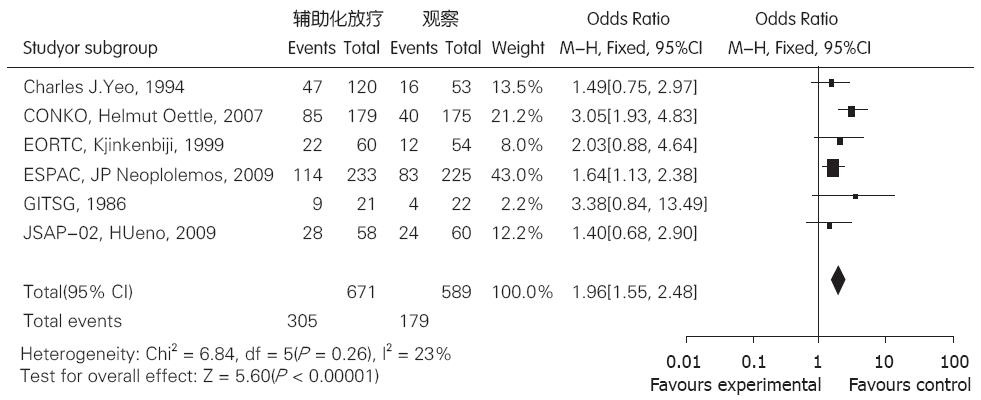
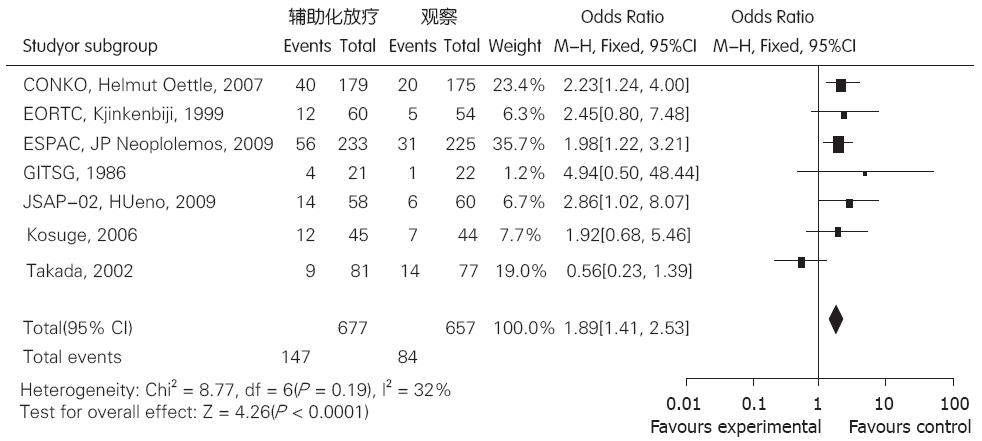
结果: 8个随机对照临床试验共1507例患者纳入分析, 放化疗联合治疗组与观察组比较, 2年生存率比较, 生存优势为OR = 1.96, 95%CI(1.55, 2.48), 结果具有统计学意义; 5年生存率比较, 生存优势为OR = 1.89, 95%CI(1.41, 2.53), 结果具有统计学意义.
结论: 现有证据支持胰腺癌术后进行辅助放化疗可提高生存率.
引文著录: 王思亮, 林艳, 高嵩, 胡天玉, 吴荣. 胰腺癌切除术后辅助放化疗治疗疗效的Meta分析. 世界华人消化杂志 2011; 19(31): 3272-3276
Revised: October 20, 2011
Accepted: November 4, 2011
Published online: November 8, 2011
AIM: To conduct a meta-analysis to evaluate the efficacy of adjuvant chemoradiotherapy in pancreatic cancer patients after surgical resection.
METHODS: PubMed (1970/2011-07), EMbase (1974/2011-07), the Cochrane Library (Issue 7, 2011), CBM (1978/2011-07) and ASCO were searched to retrieve relevant published and unpublished studies evaluating the efficacy of adjuvant chemoradiotherapy in pancreatic cancer patients after surgical resection. A meta-analysis of the overall survival (OS) data from randomized controlled trials (RCTs) was then performed using the RevMan5.0 software.
RESULTS: The meta-analysis included 8 RCTs totaling 1507 patients. Compared to the control group, the adjuvant chemoradiotherapy group had significantly higher 2- and 5-year survival rates (OR = 1.96, 95% CI (1.55, 2.48); OR = 1.89, 95% CI (1.41, 2.53).
CONCLUSION: According to present evidence, adjuvant chemoradiotherapy has significant survival benefit for pancreatic cancer patients after surgical resection.
- Citation: Wang SL, Lin Y, Gao S, Hu TY, Wu R. Efficacy of adjuvant chemoradiotherapy in pancreatic cancer patients after surgical resection: a meta-analysis. Shijie Huaren Xiaohua Zazhi 2011; 19(31): 3272-3276
- URL: https://www.wjgnet.com/1009-3079/full/v19/i31/3272.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i31.3272
胰腺癌是常见的消化系恶性肿瘤之一, 近年来, 胰腺癌的发病率和死亡率有逐渐上升的趋势. 胰腺癌是第4大肿瘤致死原因, 在中国死亡率为1.3/10万[1]. 对于可切除的胰腺癌患者, 手术是唯一明确的可以达到长期疾病控制的手段. 然而由于胰腺癌侵袭性的生物学特性, 起病隐匿, 较少有特异性症状和体征, 仅有很少一部分患者在确诊时有手术机会; 即使手术治疗, 胰腺癌胰十二指肠切除术后5年的生存率仅为20%左右, 术后复发率和转移率较高, 预后极差[2]. 对于其他恶性肿瘤来说, 如早期的乳腺癌, 有明确的证据支持辅助化疗和内分泌治疗可以降低术后患者的复发风险, 延长患者的生存期; 对于Ⅲ期的结直肠癌患者, 辅助化疗也是标准的治疗手段. 然而对于Ⅱ期的结肠癌的患者, 辅助化疗缺少证据, 他的作用仍有争议[3]. 20世纪80年代后, 许多观察胰腺癌术后辅助放化疗作用的临床试验被广泛开展, 尽管一些研究显示辅助放化疗可以延长总的生存期和无进展生存期, 但大部分试验缺乏正确的统计学方法和没有显示出生存期延长的统计学差异. 因此有必要对这一系列的随机对照临床试验(randomized controlled trial, RCT)进行Meta分析, 为临床提供更加明确的应用依据.
计算机检索Pubmed(1970/2011-07)、EMbase(1974/2011-07)、Cochrane图书馆(2011年第7期)、中国生物医学文献数据库(1978/2011-07)、ASCO等论文集检索相关发表及未发表的文献, 检索词包括: ("chemoradiotherapy" or "chemotherapy" or "radiotherapy") and "adjuvant therapy" and ("pancreatic cancer" or "pancreatic carcinoma" or "pancreatic neoplasia" or "pancreatic adenocarcinoma")等及对应的中文检索词. 同时采用了Mesh词和自由词进行检索. 对所有检索到的文献, 通过查阅其参考文献扩展检索范围, 以尽量增加RCT文献资料.
1.2.1 研究类型: 所有胰腺癌术后辅助放化疗对比观察组的随机对照试验. 不限研究地域, 仅限于英文和中文文献. 随机性合理设计, 患者同质性较好, 基线情况(性别、年龄、分期、病情轻重)基本一致.
1.2.2 研究对象: 所有患者均为胰十二指肠切除术后病理诊断证实为胰腺癌, 血常规、肝肾功基本正常, 预期寿命在12 wk以上.
1.2.3 干预措施: 试验组患者接受辅助化放疗或化疗或放疗(化疗以5-Fu、吉西他滨为主的方案), 对照组不采用化疗或放疗治疗进行观察.
1.2.4 结局指标: 主要的研究终点为总的生存率(2年和5年生存率).
1.2.5 排除标准: 研究对象患有胰腺癌以外肿瘤或晚期转移性胰腺癌、局部进展期胰腺癌的病例; 未手术或术前辅助治疗病例; 对照组不是观察的研究; 重复报道、信息太少以及数据描述不详的文献.
1.2.6 文献筛选、质量评价与数据提取: 由2名评估员(王思亮与林艳)独立筛选文献和评价文献质量, 并交叉核对, 如有分歧讨论解决或交第3方裁决. 纳入研究的方法学质量采用Cochrane Handbook for Systematic Reviews of Interventions5.0关于RCT的质量评价标准进行: 随机方法是否正确; 是否采用盲法; 是否做到分配隐藏; 有无失访或退出, 如有失访或退出时, 是否采用意向治疗(ITT)分析(在临床研究中, 对于患者入组后因各种原因未能完成试验的例数均应加以记录, 并在结果分析中进行处理); 基线是否一致. 据此标准将纳入文献质量分为A、B、C 3级, 完全满足以上5条标准, 发生各种偏倚的可能性最小, 为A级; 部分满足以上5条标准, 发生各种偏倚的可能性为中度, 为B级; 完全不满足以上5条标准, 发生各种偏倚的可能性为高度, 为C级. 对重复发表文献采用最新、最完整的文献报道.
统计学处理 采用Cochrane协作网RevMan5.0软件进行Meta分析. 首先用χ2检验分析纳入研究的临床异质性和方法学异质性. 当组内各研究间无统计学异质性时(P≥0.1, I2≤50%), 采用固定效应模型进行Meta分析; 如各研究间存在统计学异质性(P<0.1, I2>50%), 采用随机效应模型进行分析. 本文研究是比较胰腺癌的辅助治疗是否优于观察, 其结局变量为接受辅助化放疗治疗的患者和观察组的患者的2年和5年生存率的差值, 即治疗优势(risk difference, RD).
本研究纳入的8个RCT均为胰腺癌术后辅助治疗与观察对比的临床研究(表1). 其中3个研究观察组的干预措施为辅助放化疗, 5个研究观察组的干预措施为化疗; 2007年和2009年的2项研究, 化疗方案为吉西他滨单药, 其余方案的化疗均为5-FU为主的方案化疗. 放化疗辅助治疗(试验组)和非放化疗治疗(对照组)两组的生存率分别为19.7 mo和15.5 mo, 一项研究[10]未统计中位生存期.
| 研究 | 干预措施 | 入组人数 | 治疗方案 | 中位生存期(mo) | 2年生存率(%) | 5年生存率(%) |
| GITSG[4] | CRT | 21 | 40Gy+5FU | 21 | 43 | 19 |
| 22 | Observation | 10.9 | 18 | 5 | ||
| Charles[5] | CRT | 120 | RT+5FU | 19.5 | 39 | |
| 53 | Observation | 13.5 | 30 | |||
| EORTC, Klinkenbijl[6] | CRT | 60 | 40Gy+5FU | 17.1 | 37 | 20 |
| 54 | Observation | 12.6 | 23 | 10 | ||
| ESPAC, JP Neoptolemos[7] | CT | 233 | 5FU/FA | 23.2 | 49 | 24 |
| 225 | Observation | 16.8 | 37 | 14 | ||
| JSAP-02, H Ueno[8] | CT | 58 | Gemcitabine(3) | 22.3 | 48.3 | 23.9 |
| 60 | Surgery-only | 18.4 | 40.0 | 10.6 | ||
| CONKO, Helmut Oettle[9] | CT | 179 | Gemcitabine(6) | 22.1 | 47.5 | 22.5 |
| 175 | Surgery-only | 20.2 | 22.5 | 11.5 | ||
| Takada[10] | CT | 81 | MMF/5FU | 11.5 | ||
| 77 | - | 18 | ||||
| Kosuge[11] | CT | 45 | 5FU/cisplatin | 12.5 | 26.4 | |
| 44 | - | 15.8 | 14.9 |
6个研究[4-9]患者(n = 1 260)胰腺癌术后分别接受了放化疗辅助治疗(试验组)和非放化疗治疗(对照组). 其中有3组患者接受了放化疗治疗, 另3组接受了单纯化疗. 各研究结果间无统计学异质性(P = 0.26, I = 23%), 故均采用固定效应模型合并分析. 结果表明, 试验组2年生存率与对照组有明显区别, 差异有统计学意义[OR = 1.96, 95%CI(1.55, 2.48)], 胰腺癌术后辅助放化疗治疗对于患者2年生存率的提高有益(图1).
7个研究[4,6-11]中随访结果包括5年生存率, 患者(n = 1 334)胰腺癌术后分别接受了放化疗辅助治疗(试验组)和非放化疗治疗(对照组). 其中有2组患者接受了放化疗治疗, 另5组接受了单纯化疗. 各研究结果间无统计学异质性(P = 0.19, I = 32%), 故均采用固定效应模型合并分析. 结果表明, 试验组5年生存率与对照组有明显区别, 差异有统计学意义[OR = 1.89, 95%CI(1.41, 2.53)], 胰腺癌术后接受辅助放化疗治疗可提高患者5年生存率(图2).
目前认为外科手术治疗是唯一有可能治愈胰腺癌的方法. 手术的并发症和死亡率, 近年来已显著减小; 多个中心报道, 胰十二指肠切除术中及围手术期死亡率约为1%. 但是, 仅有少数患者确诊肿瘤时适合进行手术切除, 而且即使局限性胰腺癌术后切除后, 长期生存仍很差[12]. 由于现在很多医疗中心有能力完成胰腺癌切除手术, 因此增加了判断术后是否行辅助治疗的重要性. 判断辅助治疗是否有效, 给予辅助治疗能否使胰腺癌患者在长期生存方面获益.
随机进行的胃肠道肿瘤研究组(GITSG), 近20年来第一次明确了胰腺癌切除术后辅助治疗的潜在利益, 此后许多报告显示了胰腺癌术后辅助治疗的益处. 期间欧洲肿瘤治疗与研究组织(EORTC)进行了几个随机试验进行胰腺癌术后辅助治疗与观察的比较, 这项研究可以看出放化疗治疗组存在改善生存的趋势, 但结论无统计学差异. Neoptolemos和他的团队报道了欧洲胰腺癌研究组(ESPAC)的研究结果[13,14], 此项最大随机对照试验显示术后辅助化放疗可以使患者的长期生存获益, 然而部分学者指出此项研究在非放化疗组的数据合并方面存在选择性偏移.
近几年的部分研究也报道了胰腺癌术后辅助放化疗在长期生存方面的优势, 但均未显示出统计学差异. 本研究意在对术后辅助治疗相关文章进行Meta分析, 判断胰腺癌术后辅助治疗相对于观察或未放化疗的意义. 通过对国内外多个医学数据库、重要的肿瘤学术会议资料进行多重检索, 严格按研究前制定的纳入标准进行筛选. 文献质量评价要求Jadad评分3分及以上, 可见纳入分析的原始研究均为高质量的临床研究. 漏斗图基本对称、均匀散开, 提示文献的发表偏倚的可能性较小, 因而本研究具有较高的可信度. 对入选的8个RCT共1507例患者进行Meta分析显示, 术后辅助放化疗治疗与观察治疗相比, 2年生存率比较, 生存优势为OR = 1.96, 95%CI(1.55, 2.48), 结果具有统计学意义, 有明显的生存优势; 同时Meta分析显示术后辅助放化疗治疗与观察治疗相比, 5年生存率比较, 生存优势为OR = 1.89, 95%CI(1.41, 2.53), 结果具有统计学意义, 有明显的生存优势. 有文献对胰腺癌术后辅助放化疗与观察组进行分层Meta分析, 对预后相关因素进行评估, 切缘阴性与阳性相比放化疗和化疗的疗效差异显著. 辅助放化疗对于胰腺癌术后切缘阳性的患者更有意义, 然而这一结果的统计学方法不够严谨[15]. 本Meta分析未对预后因素进行分层分析, 亦是考虑对称性和方法学因素, 还需要进一步研究.
本研究纳入研究质量均为B级, 但仍存在选择性偏倚、实施偏倚和测量性偏倚的中度可能性. 检索的文献比较全面和可靠, 入选的临床随机对照试验的数据多为阴性的结果, 因此出版偏倚可能性较小. 本系统评价未检索到其他语种的随机对照研究, 可能造成分布偏倚. 本Meta分析显示胰腺癌术后辅助治疗与观察相比, 2年生存率和5年生存率方面具有优势, OR分别为1.96, 95%CI(1.55, 2.48)和1.89, 95%CI(1.41, 2.53), 优势均具有统计学意义. 胰腺癌术后行辅助放化疗有利于提高长期生存率.
前期研究显示胰腺癌术后辅助放化疗优于观察, 今后可能作为胰腺癌术后治疗的常规推荐, 但胰腺癌术后哪一部分患者(切缘、分期、分化程度等)能够从辅助放化疗中明确受益, 仍是今后努力的方向.
胰腺癌术后行辅助治疗是否有效, 是否能使患者在长期生存方面获益, 是胰腺癌治疗中比较争议的问题. 本研究通过Meta分析的方法, 对辅助放化疗在胰腺癌术后治疗中的意义进行讨论.
谷俊朝, 主任医师, 首都医科大学附属北京友谊医院普外科
放疗技术的提高, 抗肿瘤新药的不断问世以及靶向药物的深入研究, 能否作为辅助治疗的方法, 能否提高胰腺癌患者的长期生存, 都在不断深入的探讨中.
Assifi等的Meta分析显示, 对于不能手术的局部进展期胰腺癌患者, 可以从新辅助治疗中获得最大受益. 相反, 对于可以手术的患者受益很小, 并可能延误手术. 新辅助治疗有希望成为胰腺癌治疗的新选择.
本文采用Meta分析的方法, 对相关文献的研究质量予以评价, 并运用定量统计学方法对多个研究结果进行系统评价, 评估胰腺癌辅助治疗是否有效.
本文得出的结论对胰腺癌治疗具有一定的指导意义, 但还需高质量的RCT相关研究去验证和更新结论.
文章研究的是当前胰腺癌治疗中的热点问题-判断胰腺癌术后是否行需要辅助治疗, 以及判断辅助治疗是否有效, 给予相应的辅助治疗能否使胰腺癌患者在长期生存方面获益等是胰腺癌治疗中需要明确的问题. 该研究对胰腺癌临床治疗具有指导意义.
编辑: 李军亮 电编:闫晋利
| 1. | Vincent A, Herman J, Schulick R, Hruban RH, Goggins M. Pancreatic cancer. Lancet. 2011;378:607-620. [PubMed] [DOI] |
| 2. | Neoptolemos JP, Dunn JA, Stocken DD, Almond J, Link K, Beger H, Bassi C, Falconi M, Pederzoli P, Dervenis C. Adjuvant chemoradiotherapy and chemotherapy in resectable pancreatic cancer: a randomised controlled trial. Lancet. 2001;358:1576-1585. [PubMed] [DOI] |
| 3. | Benson AB, Schrag D, Somerfield MR, Cohen AM, Figueredo AT, Flynn PJ, Krzyzanowska MK, Maroun J, McAllister P, Van Cutsem E. American Society of Clinical Oncology recommendations on adjuvant chemotherapy for stage II colon cancer. J Clin Oncol. 2004;22:3408-3419. [PubMed] [DOI] |
| 4. | Kalser MH, Ellenberg SS. Pancreatic cancer. Adjuvant combined radiation and chemotherapy following curative resection. Arch Surg. 1985;120:899-903. [PubMed] [DOI] |
| 5. | Yeo CJ, Abrams RA, Grochow LB, Sohn TA, Ord SE, Hruban RH, Zahurak ML, Dooley WC, Coleman J, Sauter PK. Pancreaticoduodenectomy for pancreatic adenocarcinoma: postoperative adjuvant chemoradiation improves survival. A prospective, single-institution experience. Ann Surg. 1997;225:621-633; discussion 633-636. [PubMed] [DOI] |
| 6. | Klinkenbijl JH, Jeekel J, Sahmoud T, van Pel R, Couvreur ML, Veenhof CH, Arnaud JP, Gonzalez DG, de Wit LT, Hennipman A. Adjuvant radiotherapy and 5-fluorouracil after curative resection of cancer of the pancreas and periampullary region: phase III trial of the EORTC gastrointestinal tract cancer cooperative group. Ann Surg. 1999;230:776-782; discussion 782-784. [PubMed] [DOI] |
| 7. | Neoptolemos JP, Stocken DD, Tudur Smith C, Bassi C, Ghaneh P, Owen E, Moore M, Padbury R, Doi R, Smith D. Adjuvant 5-fluorouracil and folinic acid vs observation for pancreatic cancer: composite data from the ESPAC-1 and -3(v1) trials. Br J Cancer. 2009;100:246-250. [PubMed] [DOI] |
| 8. | Ueno H, Kosuge T, Matsuyama Y, Yamamoto J, Nakao A, Egawa S, Doi R, Monden M, Hatori T, Tanaka M. A randomised phase III trial comparing gemcitabine with surgery-only in patients with resected pancreatic cancer: Japanese Study Group of Adjuvant Therapy for Pancreatic Cancer. Br J Cancer. 2009;101:908-915. [PubMed] [DOI] |
| 9. | Oettle H, Post S, Neuhaus P, Gellert K, Langrehr J, Ridwelski K, Schramm H, Fahlke J, Zuelke C, Burkart C. Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA. 2007;297:267-277. [PubMed] [DOI] |
| 10. | Takada T, Amano H, Yasuda H, Nimura Y, Matsushiro T, Kato H, Nagakawa T, Nakayama T. Is postoperative adjuvant chemotherapy useful for gallbladder carcinoma? A phase III multicenter prospective randomized controlled trial in patients with resected pancreaticobiliary carcinoma. Cancer. 2002;95:1685-1695. [PubMed] [DOI] |
| 11. | Kosuge T, Kiuchi T, Mukai K, Kakizoe T. A multicenter randomized controlled trial to evaluate the effect of adjuvant cisplatin and 5-fluorouracil therapy after curative resection in cases of pancreatic cancer. Jpn J Clin Oncol. 2006;36:159-165. [PubMed] [DOI] |
| 13. | Carter R, Stocken DD, Ghaneh P, Bramhall SR, Olah A, Kelemen D, Bassi C, Friess H, Dervenis C, Spry N. Longitudinal quality of life data can provide insights on the impact of adjuvant treatment for pancreatic cancer-Subset analysis of the ESPAC-1 data. Int J Cancer. 2009;124:2960-2965. [PubMed] [DOI] |
| 14. | Thomas A, Dajani K, Neoptolemos JP, Ghaneh P. Adjuvant therapy in pancreatic cancer. Dig Dis. 2010;28:684-692. [PubMed] [DOI] |
| 15. | Stocken DD, Büchler MW, Dervenis C, Bassi C, Jeekel H, Klinkenbijl JH, Bakkevold KE, Takada T, Amano H, Neoptolemos JP. Meta-analysis of randomised adjuvant therapy trials for pancreatic cancer. Br J Cancer. 2005;92:1372-1381. [PubMed] [DOI] |