修回日期: 2011-10-20
接受日期: 2011-10-27
在线出版日期: 2011-11-08
目的: 探讨细胞因子信号转导抑制子3(SOCS3)在实验性重症急性胰腺炎(SAP)中的表达和作用.
方法: 32只♂Sprague-Dawley大鼠随机分为对照组(NC组)和3组SAP 6 h、12 h、18 h组, 每组8只. 以4%牛磺胆酸钠胰胆管逆行注射诱导SAP模型, 动态测定各组血清淀粉酶(AMY)水平; 光镜下观察胰腺大体及组织学表现; ELISA方法测定大鼠血清中IL-6、IL-18的表达情况; 蛋白印迹法(Western blotting)和免疫组织化学法测定胰腺组织中SOCS3的定位和表达.
结果: 与NC组相比, SAP各组AMY水平均明显升高(2675.18±278.32, 3541.15±215.43, 4568.89±357.86 vs 651.38±52.94, 均P<0.05); 光镜下胰腺组织损伤随病情进展而逐渐加重; 各组血清中均有IL-6、IL-18表达; 与NC组比较, SAP各组IL-6、IL-18表达水平显著上调(P<0.05); NC组有极少量的SOCS3表达, SAP各组SOCS3蛋白表达明显高于NC组, 且随造膜时间延长逐渐增高(P<0.05); SOCS3表达变化与胰腺组织的严重程度和血清炎症因子的变化均一致.
结论: SOCS3在SAP的发病和病情变化中起到非常重要的抑炎作用.
引文著录: 王彬, 张晓华, 朱人敏, 杨妙芳, 李敏利, 吴晓尉, 许小兵. SOCS3在重症急性胰腺炎大鼠胰腺中的表达和作用. 世界华人消化杂志 2011; 19(31): 3212-3216
Revised: October 20, 2011
Accepted: October 27, 2011
Published online: November 8, 2011
AIM: To investigate the mechanism of action of suppressor of cytokine signaling 3 (SOCS3) in experimental severe acute pancreatitis (SAP) in rats.
METHODS: A rat model of SAP was reproduced by retrograde injection of 4% sodium taurocholate into the biliopancreatic duct. Thirty-two male SD rats were randomly and equally assigned into four groups: normal control group (NC) and three SAP groups (6, 12 and 18 h). Serum amylase (AMY) was measured dynamically. Pathological changes in the pancreas and lung were observed under a light microscope. The concentrations of IL-6 and IL-18 were determined by ELISA. The localization and expression of SOCS3 protein in the pancreas were detected by immunohistochemical staining and Western blotting.
RESULTS: Compared to the NC group, serum level of AMY increased significantly in the three SAP groups (2675.18 ± 278.32, 3541.15 ± 215.43, 4568.89 ± 357.86 vs 651.38 ± 52.94, all P < 0.05). Pancreatic injuries revealed under a light microscope were gradually aggravated with disease progression. Serum concentrations of IL-6 and IL-18 in the SAP groups increased significantly compared to the NC group (all P < 0.05). The levels of SOCS3 protein in the SAP groups increased significantly compared to the NC group (all P < 0.05). The changes in SOCS3 protein expression were correlated with the severity of pancreatic injury and serum concentrations of IL-6 and IL-18.
CONCLUSION: SOCS3 plays an important role in inhibiting inflammatory reaction in rats with SAP.
- Citation: Wang B, Zhang XH, Zhu RM, Yang MF, Li ML, Wu XW, Xu XB. Expression and role of SOCS3 in severe acute pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(31): 3212-3216
- URL: https://www.wjgnet.com/1009-3079/full/v19/i31/3212.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i31.3212
重症急性胰腺炎(severe acute pancreatitis, SAP)是一种多系统疾病, 为临床常见急腹症之一, 可致全身炎症反应和远处器官损伤[1,2]. 已有研究发现JAK/STAT信号通路通过对多种炎症因子的信号转导和调控在全身的炎症反应中起到重要作用[3,4], 而炎症因子又通过JAK/STAT途径诱导细胞因子信号转导抑制子(suppressor of cytokine signaling, SOCS)基因表达, 其表达产物又特异性地抑制炎症因子介导的JAK/STAT通路, 构成一负反馈环路, 从而使机体处于动态平衡[5,6]. 其中SOCS3是SOCS家族中负性调控JAK/STAT信号通路作用最强的抑制蛋白之一, 但SAP时SOCS3介导机体分泌IL-6、IL-18等炎症因子的机制目前仍不清楚[7]. 本实验通过建立SAP大鼠模型, 探讨SAP时SOCS3与IL-6、IL-18炎症因子表达水平的关系, 明确SOCS3在SAP中的抗炎作用, 旨在为SAP的临床治疗提供一个新的思路.
健康清洁级SD大鼠32只, 体质量220-250 g; 牛磺胆酸、SABC免疫组织化学试剂盒(Sigma公司); 兔抗大鼠SOCS3单克隆抗体(Cell Signaling Technology); 兔抗大鼠β-actin抗体和GAPDH标记的山羊抗兔IgG(武汉博士德生物有限公司); 大鼠血清IL-6、IL-18 ElISA试剂盒(美国ADL公司); NC膜(Millipore公司); 增强化学发光(ECL)试剂盒(美国Amersham公司); X光胶片(柯达公司); 大鼠血清IL-6、IL-18 ElISA试剂盒(美国ADL公司); 组织裂解液购自上海碧云天公司; 其他常用试剂均为国产分析纯.
1.2.1 分组和造模: 将大鼠随机分为对照组和3组SAP模型组, 每组8只. 各组适应性饲养1 wk, 术前禁食18 h, 自由饮水. 大鼠腹腔注射100 mg/kg氯胺酮麻醉后固定, 无菌条件下取上腹正中切口入腹, 显露胰腺, 确认胰胆管, 于近肝门处以创动脉夹夹毕胰胆管(远端于近十二指肠处, 近端于左右肝管汇合处); 于贴近十二指肠开口处逆行穿刺胰管, 以微量注射泵注射4%牛磺胆酸钠1 mL/kg, 速度0.2 mL/min; 注射完毕后继续夹毕胰胆管以使牛磺胆酸钠充分进入胰腺, 约5 min后胰腺组织出现肉眼可见的充血、水肿, 表明SAP模型制作成[8,9]; 确认腹腔内无活动性出血后两层关腹, 术后立即背部皮下注10 mL/kg 0.9%NaCL溶液以补充液体量. 对照组模拟胰胆管穿刺操作, 但不予注射药物. 3组SAP模型组分别于造模后6 h、12 h、18 h处死, 每一时间点8只, 正常对照组于造模后12 h处死, 右心房取血, 并取胰腺组织2份, 一份放入10%中性甲醛溶液中固定24 h, 常规石蜡包埋. 另一份置于-70 ℃冰箱中保存备用.
1.2.2 血清淀粉酶检测及病理学观察: 采用Olympus AU2700型全自动生化分析仪检测血清淀粉酶(AMY)水平. 常规制作胰腺组织HE石蜡切片, 由病理科医生在光学显微镜下观察胰腺组织学改变.
1.2.3 血清IL-6、IL-18含量检测: 采用酶联免疫吸附(ELISA)法检测, 具体步骤严格按试剂盒使用说明书操作. 通过绘制标准曲线得出样品中相应细胞因子的含量(该方法检测灵敏度为1 pg/mL).
1.2.4 免疫组织化学SABC法测定胰腺组织SOCS
3定位和表达: 将石蜡包埋的胰腺组织4 μm连续切片, 常规脱蜡, 3%H2O2孵育10 min清除内源性过氧化物酶; 5%BSA封闭液室温孵育1 h; 加入兔抗大鼠SOCS3单克隆抗体(1∶100) 4 ℃过夜; 加入生物素标记的羊抗兔IgG室温放置1 h; 加入亲和素复合物室温反应1 h; DAB显色, 苏木素轻度复染; 脱水, 透明, 中性树胶封片. 以上各步骤间均以0.01 mol/L PBS洗5 min × 3次. 以PBS代替一抗作为阴性对照.
1.2.5 蛋白印迹法测定胰腺组织SOCS3表达: 取200 mg胰腺组织, RIPA裂解液裂解后冰浴下玻璃匀浆器中匀浆, 10 000 r/min 4 ℃离心15 min, 取上清液, -70 ℃冰箱冻存. Bradford法蛋白定量, 每孔加样量30 μg, 7.5%SDS-PAGE电泳; 蛋白转移至PVDF膜, 新鲜配制的含5%BSA的TBST液室温封闭1 h, 加入兔抗大鼠SOCS3单克隆抗体(1∶1 000)和兔抗大鼠β-actin抗体(1∶1 000), 4 ℃反应过夜; 将膜取出, TBST液洗5 min×3次, 加入HRP标记的山羊抗兔IgG二抗孵育; ECL显影, BandScan 5.0凝胶电泳图像分析软件行条带灰度扫描, 以β-actin为内参照对SOCS3行灰度值半定量分析. 以上实验重复3次, 取均值.
统计学处理 组间比较采用单因素方差分析, 进一步两两比较采用LSD-t检验, 数据采用SPSS17.0统计软件包进行统计分析, P<0.05为差异具有统计学意义.
NC组血清AMY水平(pg/mL)较低, SAP 6 h、12 h和18 h组血清AMY水平逐渐升高, 与NC组比较有显著性差异(2 675.18±278.32, 3 541.15±215.43, 4 568.89±357.86 vs 651.38±52.94, 均P<0.05), 各SAP组之间比较亦有显著性差异(P<0.05).
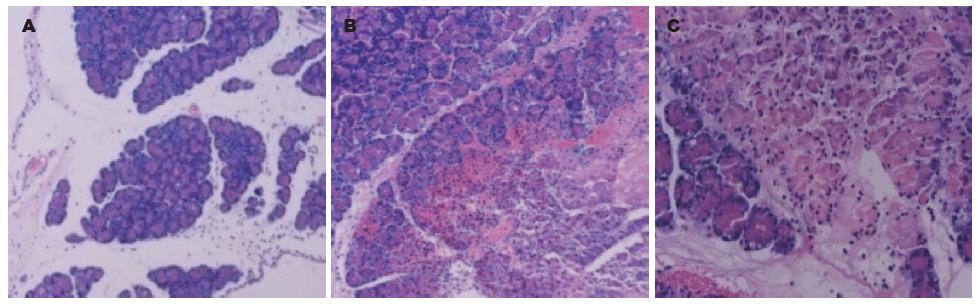
肉眼观察NC组胰腺外观正常; SAP 6 h组大鼠胰腺肿胀明显, 局部可见紫色坏死灶, 少量淡红色腹腔积液, 胰周皂化; SAP 12 h组胰腺大片坏死, 血性腹水增多, 胰周可见皂化斑; SAP 18 h组坏死程度进一步加重, 大量血性腹水, 皂化斑明显增多. 光镜下观察, NC组大鼠胰腺组织结构清晰, 腺泡小叶完整, 偶可见间质区轻度水肿, 红细胞及中性粒细胞少见; 各SAP组胰腺组织出现不同程度出血、坏死、炎性细胞浸润, 胰腺组织脂肪坏死, 且随造模时间延长逐渐加重(图1).
NC组及各SAP组均有IL-6、IL-10和IL-18表达. 造模后可见血清中IL-6、IL-18含量均明显升高, 各SAP组间比较有显著性差异(P<0.05, 表1).
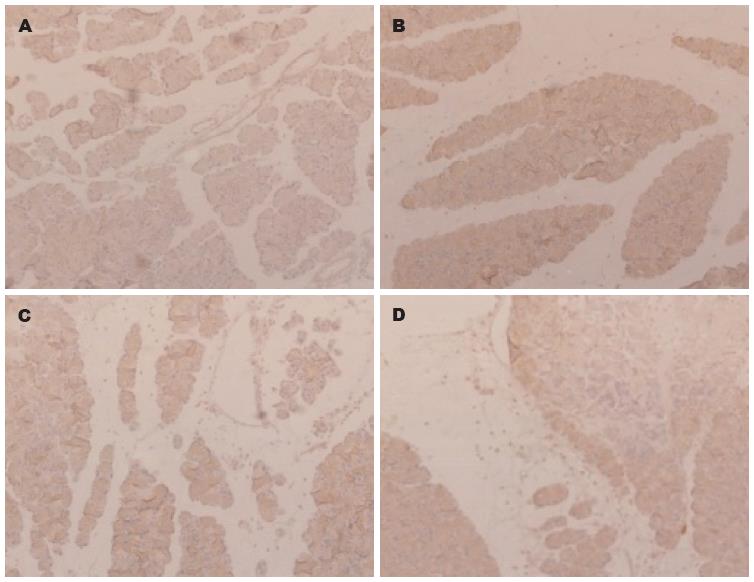
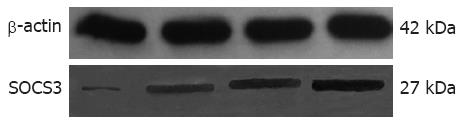
免疫组化染色显示, 正常对照组SOCS3不表达或弱阳性表达(图2A). SAP 6 h组胰腺组织可见少量SOCS3免疫阳性细胞[7], 免疫阳性物质呈棕褐色, 主要物质定位于细胞质(图2B); 12 h组SOCS3表达开始增强, 着色逐渐加深(图2C); 18 h组SOCS3表达最强, 以胰腺细胞坏死区最为明显, 胞质和胞核中均可见阳性表达(图2D). 蛋白印迹法检测结果显示, 正常胰腺组织几乎无SOCS3蛋白表达, SAP 6 h组胰腺组织可见少量SOCS3蛋白表达; SAP 12 h组表达开始增强; SAP 18 h表达最强, SAP各组相对表达量均显著高于NC组(P<0.05, 图3).
SOCS是JAK/STAT通路的反馈抑制因子, 又被称为细胞的"分子刹车". 其中SOCS3是SOCS家族中负性调节JAK/STAT信号通路作用最强的抑制蛋白之一, 因作用广泛尤受广大研究者的关注. 近几年对其功能以及临床研究等方面都取得了许多新的进展[10,11].
炎症因子通过JAK/STAT信号通路诱导SOCS3基因表达, 其表达产物又特异性地抑制炎症因子介导的JAK/STAT信号通路, 形成对JAK/STAT通路的负反馈调节. SOCS3的这种负反馈调节作用主要通过3种方式进行: 一种是利用和STAT相似的SH2结构域, 竞争结合细胞因子受体胞质区的磷酸化Tyr位点, 阻止转录因子STAT的活化; 另外SOCS3还可以利用SH2结构域与通路中的JAK结合, 竞争性抑制JAK与底物的结合, 靠近SH2结构域N端的激酶抑制区(kinase inhibitory region, KIR)在对JAK的抑制中也起了作用. 第3种作用方式是通过C端的SOCS盒与伸蛋白BC(elongin BC)复合体结合, 将SOCS3结合的信号蛋白如JAK和STAT等通过泛素化途径降解, 从而阻断细胞因子的信号传递. SOCS3蛋白通过以上3种方式形成对JAK/STAT信号通路的负反馈调节, 抑制炎症因子的表达与释放, 起到抑炎作用[12-14]. 目前, 有关SOCS3在SAP炎症反应中作用的研究尚未见文献报道, 为了进一步探讨SOCS3在SAP炎症反应中的作用机制, 笔者利用牛磺胆酸钠诱导建立了大鼠SAP模型, 并采用免疫组化染色及Western bloting检测胰腺组织中SOCS3的表达; IL-6、IL-18是2个较为敏感的炎症因子, 在炎症早期就有高度表达, 并可诱导IL-1等其他炎症介质的释放, 具有较好的代表性. 尤其IL-18是最近新发现的一种炎症因子, 是最近研究较热的炎症因子[15,16]; 有研究发现SAP患者血清IL-6、IL-18水平与SAP病情的发生发展有着密切的联系, 可较好的反映SAP炎症反应的严重程度[17,18]. 所以采用ELISA法检测血清中IL-6、IL-18含量, 代表整体炎症因子的水平, 观察SOCS3在SAP大鼠胰腺中的表达及与炎症因子的关系. 本研究发现NC组大鼠胰腺组织中有极少量SOCS3免疫反应阳性细胞及蛋白表达, 各SAP组大鼠胰腺组织中SOCS3表达则明显增加, 且与处理时间呈正相关. 同时, 与NC组相比, 各SAP组血清IL-6、IL-18表达水平均显著升高, 且与SOCS3表达在动态变化上基本保持一致. 该结果提示SAP发生时, JAK/STAT信号通路被激活, IL-6、IL-18炎症因子表达释放, IL-6、IL-18又通过JAK/STAT信号通路诱导SOCS3表达, 特异性的抑制炎症因子介导的JAK/STAT信号通路, 抑制炎症因子的过度释放. 另外, 结合血清淀粉酶、胰腺组织病理形态学改变可见, 随病程延长, 胰腺组织损伤程度增加, 胰腺SOCS3表达增加, 进一步提示SAP时炎症反应不断加重, SOCS3抑炎作用增强, 起到对机体自我保护作用.
总之, 本研究结果提示SOCS3在SAP的发病和病情变化中起到重要的抑炎作用. 全身炎症反应是SAP防治过程中最为棘手的问题之一, 抑制炎症因子的释放是抑制全身炎症反应的关键, SOCS3作为机体为数不多的抑炎蛋白之一, 在炎症反应中起到非常重要的抑炎作用, 可为SAP临床治疗提供一条新的思路, 但其详细作用机制还需大量基础和临床研究进一步证实.
目前关于细胞因子在SAP发病机制中作用的研究是危重症领域的前沿课题之一, 阐明其活化与调控机制将有助于从细胞和分子水平深化对SAP本质的认识, 并为临床治疗提供帮助.
韩天权, 教授, 上海交通大学医学院附属瑞金医院外科、上海消化外科研究所
SOCS3是SOCS家族中负性调控JAK/STAT信号通路作用最强的抑制蛋白之一, 在许多疾病的各种器官损伤中起着重要的调节作用, 是近几年的研究热点, 其通过对JAK/STAT信号通路的抑制调控炎症因子释放的作用有望成为治疗SAP的新思路.
SOCS3是近几年的研究热点, 但SOCS3在重症急性胰腺炎(SAP)炎症反应中的作用尚未见报道.
本文用ELISA法检测血清中IL-6、IL-18含量; 免疫组织化学和Western blotting方法直接检测胰腺组织中SOCS3表达量的变化, 结合胰腺组织的严重程度, 分析其在SAP中的抑炎作用.
本文主要研究SOCS3在SAP中的抑炎作用, 从而为SAP的临床治疗提供一条新的思路.
本文从动物实验研究细胞因子信号传导抑制因子3(SOCS3)重症急性胰腺炎(SAP)的表达. 结果显示, SAP大鼠的胰腺SOCS3表达高于对照组, 随时间延长而增高, 与胰腺病变严重程度以及炎症因子含量相关. SOCS是研究的热点, 文章对于临床与基础研究SAP有一定意义.
编辑: 曹丽鸥 电编:闫晋利
| 2. | Brisinda G, Vanella S, Crocco A, Mazzari A, Tomaiuolo P, Santullo F, Grossi U, Crucitti A. Severe acute pancreatitis: advances and insights in assessment of severity and management. Eur J Gastroenterol Hepatol. 2011;23:541-551. [PubMed] [DOI] |
| 3. | 李 敏利, 朱 人敏, 张 晓华, 史 薇, 杨 妙芳, 季 洪赞, 郭 婧芸. JAK/STAT信号通路在胰弹性蛋白酶诱导大鼠Kupffer细胞分泌IL-18中的作用. 世界华人消化杂志. 2009;17:877-881. [DOI] |
| 4. | Lim H, Park H, Kim HP. Effects of flavonoids on matrix metalloproteinase-13 expression of interleukin-1β-treated articular chondrocytes and their cellular mechanisms: inhibition of c-Fos/AP-1 and JAK/STAT signaling pathways. J Pharmacol Sci. 2011;116:221-231. [PubMed] [DOI] |
| 5. | Cooney RN. Suppressors of cytokine signaling (SOCS): inhibitors of the JAK/STAT pathway. Shock. 2002;17:83-90. [PubMed] [DOI] |
| 6. | Croker BA, Kiu H, Nicholson SE. SOCS regulation of the JAK/STAT signalling pathway. Semin Cell Dev Biol. 2008;19:414-422. [PubMed] [DOI] |
| 7. | Xu WP, Li WD. [SOCS3: a potential therapeutic target for many human diseases]. Yaoxue Xuebao. 2011;46:747-752. [PubMed] |
| 8. | Jenkins J, Dunn J. Siblings within families: levels of analysis and patterns of influence. New Dir Child Adolesc Dev. 2009;2009:79-93. [PubMed] |
| 9. | Aho HJ, Nevalainen TJ. Experimental pancreatitis in the rat. Ultrastructure of sodium taurocholate-induced pancreatic lesions. Scand J Gastroenterol. 1980;15:417-424. [PubMed] [DOI] |
| 10. | Yoshimura A, Naka T, Kubo M. SOCS proteins, cytokine signalling and immune regulation. Nat Rev Immunol. 2007;7:454-465. [PubMed] [DOI] |
| 11. | Drennan M, Elewaut D. Regulating the regulators: SOCS3 joins the dance. Ann Rheum Dis. 2011;70:2061-2062. [PubMed] [DOI] |
| 12. | Tamiya T, Kashiwagi I, Takahashi R, Yasukawa H, Yoshimura A. Suppressors of cytokine signaling (SOCS) proteins and JAK/STAT pathways: regulation of T-cell inflammation by SOCS1 and SOCS3. Arterioscler Thromb Vasc Biol. 2011;31:980-985. [PubMed] [DOI] |
| 13. | Arbouzova NI, Zeidler MP. JAK/STAT signalling in Drosophila: insights into conserved regulatory and cellular functions. Development. 2006;133:2605-2616. [PubMed] [DOI] |
| 14. | Yoshimura A. [Suppression of leptin and insulin signaling by SOCS3]. Nihon Rinsho. 2011;69 Suppl 1:782-789. [PubMed] |
| 15. | Kang M, Park KS, Seo JY, Kim H. Lycopene inhibits IL-6 expression in cerulein-stimulated pancreatic acinar cells. Genes Nutr. 2011;6:117-123. [PubMed] [DOI] |
| 16. | Bao Z, Ye Q, Gong W, Xiang Y, Wan H. Humanized monoclonal antibody against the chemokine CXCL-8 (IL-8) effectively prevents acute lung injury. Int Immunopharmacol. 2010;10:259-263. [PubMed] [DOI] |
| 18. | Pastor CM, Morel DR, Vonlaufen A, Schiffer E, Lescuyer P, Frossard JL. Delayed production of IL-18 in lungs and pancreas of rats with acute pancreatitis. Pancreatology. 2010;10:752-757. [PubMed] [DOI] |