修回日期: 2011-10-21
接受日期: 2011-10-25
在线出版日期: 2011-10-28
目的: 研究尾型同源盒转录因子2(CDX2) mRNA和DNA甲基化转移酶1(DNMT1) mRNA在胃癌组织中的表达, 探讨其临床意义.
方法: 应用实时定量PCR(qRT-PCR)检测60例患者胃癌与相应远癌胃组织中CDX2与DNMT1 mRNA的表达, 并分析其与胃癌临床病理特征的关系以及两者表达的相关性.
结果: CDX2和DNMT1 mRNA在远癌胃组织中表达较低, 在胃癌组织中表达显著升高; CDX2 mRNA的表达与胃癌的Lauren分型、临床TNM分期和淋巴结转移等因素有关(P<0.05), 而DNMT1 mRNA的表达与分化程度、临床TNM分期和淋巴结转移等因素有关(P<0.05). 两者在胃癌中的表达呈明显负相关(r = -0.385, P<0.05).
结论: 胃癌组织中CDX2表达下调与病情进展有关, DNMT1可能参与该过程的调控.
引文著录: 张健锋, 李增丽, 丁伟峰, 蒋伟, 张弘, 毛振彪. CDX2与DNMT1 mRNA在胃癌组织中的表达及临床意义. 世界华人消化杂志 2011; 19(30): 3168-3171
Revised: October 21, 2011
Accepted: October 25, 2011
Published online: October 28, 2011
AIM: To investigate the expression of caudal-type homeobox transcription factor 2 (CDX2) and DNA methyltransferase 1 (DNMT1) mRNAs in human gastric cancer and to evaluate their clinical significance.
METHODS: The expression of CDX2 and DNMT1 mRNA was detected by real-time PCR in 60 surgically dissected gastric cancer specimens and matched normal gastric mucosal specimens. The relationship of CDX2 and DNMT1 mRNA expression with clinicopathological characteristics of gastric cancer was investigated.
RESULTS: The expression of CDX2 and DNMT1 mRNAs was significantly higher in gastric cancer than in normal noncancerous tissue. Expression of CDX2 mRNA was correlated significantly with Lauren classification, TNM stage and lymph node metastasis (all P<0.05). DNMT1 mRNA expression was correlated significantly with TNM stage, pathologic differentiation and lymph node metastasis (all P<0.05). Expression of CDX2 mRNA was inversely correlated with that of DNMT1 mRNA in gastric cancer (r = -0.385, P<0.05).
CONCLUSION: Abnormal expression of CDX2 and DNMT1 mRNAs may play an important role in the progression of gastric cancer.
- Citation: Zhang JF, Li ZL, Ding WF, Jiang W, Zhang H, Mao ZB. Expression of CDX2 and DNMT1 mRNAs in human gastric cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(30): 3168-3171
- URL: https://www.wjgnet.com/1009-3079/full/v19/i30/3168.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i30.3168
胃癌是常见的恶性肿瘤之一, 居于恶性肿瘤死因的第3位, 亚洲人群中居第2位, 中国属于胃癌的高发地区. 外科治疗是胃癌目前的主要治疗手段, 而早期诊断及早期手术是降低胃癌病死率的关键[1]. 在正常组织中CDX2特异性表达于从十二指肠至直肠的上皮组织中, 正常食管和胃黏膜中不表达, 可异位表达于Barrett's食管、肠化生上皮和胃腺癌等组织[2-6]. 本实验应用实时荧光定量PCR (qRT-PCR)方法检测胃癌与相应远癌胃组织中CDX2和DNMT1 mRNA的表达, 分析两者在胃组织中表达水平及其相互关系, 探讨CDX2和DNMT1在胃腺癌发生发展中的作用, 为筛选胃癌新的标志物提供理论依据.
收集南通大学附属医院普外科2009-11/2010-08胃癌手术切除标本(n = 60), 采集后20 min内放入液氮速冻后转至-80 ℃冰箱保存备用. 远癌胃黏膜组织取自胃癌行胃切除的近侧断端胃黏膜, 距癌组织5 cm以上. 60例胃癌患者年龄31-84(平均年龄); 男(n = 42)、女(n = 18); 肿瘤直径大小<5 cm患者数(n = 35), ≥5 cm患者数(n = 25); 中、高分化腺癌(n = 29), 低分化腺癌(n = 31); 肠型胃癌(n = 28), 弥漫型胃癌(n = 32); 无淋巴结转移者(n = 19), 有淋巴结转移者(n = 41); 肿瘤分期Ⅰ-Ⅱ期胃癌(n = 26), Ⅲ-Ⅳ期胃癌(n = 34). 所有标本切片皆有2位病理医生双盲法核片分类确定病理类型. 入选病例皆查实未进行化疗或放疗, 无长期服用非甾体类抗炎药, 皮质激素药物史.
1.2.1 组织RNA提取: 按照说明书应用TRIzol试剂提取不同组织总RNA. -80 ℃取出组织, 剪取50-100 mg, 放于1.5 mL Eppendorf管中, 加入TRIzol 1 mL, 剪碎, 室温静置5 min. 加入0.2 mL氯仿, 振荡15 s, 静置2 min. 4 ℃离心, 12 000 g×15 min, 取上清. 加入0.5 mL异丙醇, 将管中液体轻轻混匀, 静置10 min. 4 ℃离心, 12 000 g×10 min, 弃上清. 加入1 mL 75%乙醇, 轻轻洗涤沉淀. 4 ℃离心, 7 500 g×5 min, 弃上清. 再次加入1 mL 75%乙醇, 轻轻洗涤沉淀. 4 ℃离心, 7 500 g×5 min, 弃上清. 真空离心干燥后, 加入30 mL的DEPC. 测RNA浓度, 分装, 于-20 ℃保存.
1.2.2 逆转录反应合成cDNA: 取总RNA 1 mg在PCR仪中进行逆转录反应: 总RNA 1 mg、Oligo(dT)1 mg、DEPC H2O补齐至12 mL, 70 ℃孵育5 min, 置冰上; 加5×Reaction Buffer 4 mL、RibolockTM Ribonuclease inhibitor 1 mL、10 mmol/L dNTP mix 2 mL, 37 ℃孵育5 min, 置冰上; 加 Revert AidTM M-Mulv Reverse Transcripts 1 mL, 42 ℃ 60 min; 70 ℃ 10 min. 逆转录成cDNA后, 分装, -20 ℃保存.
1.2.3 实时荧光定量PCR检测: 从GenBank查取CDX2、DNMT1和b-actin基因序列, Primer 5.0软件分别设计引物, 由上海生工生物工程技术有限公司合成. 序列分别为: CDX2: 5'-CGC CGC AGA ACT TCG TCA G-3', 5'-CGT AGC CAT TCC AGT CCT CCC-3'; DNMT1: 5'-CTA CCA GGG AGA AGG ACA GG-3', 5'-CTC ACA GAC GCC ACA TCG-3'; b-actin: 5'-TGA CGT GGA CAT CCG CAA AG-3', 5'-CTG GAA GGT GGA CAG CGA GG-3'. PCR反应体系: SYBR Premix Ex TaqTM 12.5 mL, PCR Forward Primer 1.0 mL, PCR Reverse Primer 1.0 mL, cDNA模板2.0 mL, 无菌双蒸水8.5 mL, 总体积25 mL. 反应条件为95 ℃ 30 s预变性, 95 ℃ 5 s、60 ℃ 34 s共40个循环. 扩增完毕后分析溶解曲线, 用2-DDCt法分析数据结果.
统计学处理 采用STATA11.0软件处理系统进行统计学分析. 样本mRNA的相对含量以mean±SD表示, 组间比较采用单因素方差分析和t检验, CDX2 mRNA与DNMT1 mRNA的相关性采用线性相关分析, 以P<0.05为差异有统计学意义.
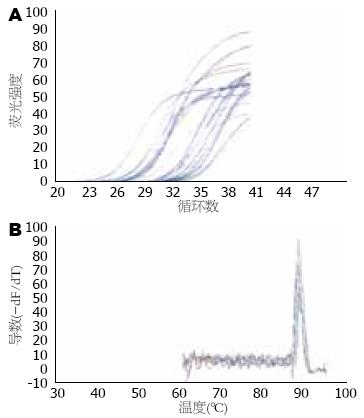
提取的总RNA经1%琼脂糖凝胶电泳, 结果样品呈现清晰的5S、18S和28S rRNA 3条带(图1), 显示RNA样品没有出现明显的降解; 核酸蛋白紫外分析仪检测各标本RNA的A260/280在1.80-2.00之间, 提示总RNA质量较好. 扩增曲线呈典型的S型, CDX2、DNMT1和b-actin mRNA熔解曲线都为单峰(图2), 说明引物特异; 峰温分别为88.9 ℃、89.6 ℃和89.7 ℃, 说明不存在引物二聚体的影响, 得到的Ct值可信. 以循环数Ct为纵坐标, 样品各稀释度的倍数值为横坐标作标准曲线, 观察到各个指标的扩增效率基本一致, 可以用2-DDCt分析数据.
qRT-PCR定量检测CDX2和DNMT1 mRNA在胃癌组织中的表达情况(表1, 2). CDX2和DNMT1 mRNA在远癌胃组织中表达较低, 但在胃癌组织中表达均明显升高, 差异具有统计学意义(P<0.05); CDX2 mRNA的表达与胃癌的Lauren分型、临床TNM分期和淋巴结转移等因素有关(P<0.05), 与年龄、性别、病灶大小、分化程度等因素无关; DNMT1 mRNA的表达与分化程度、临床TNM分期和淋巴结转移等因素有关(P<0.05), 与年龄、性别、病灶大小、Lauren分型等因素无关.
| 临床特征 | n | CDX2 | DNMT1 |
| 年龄(岁) | |||
| <60 | 25 | 20.34±23.31 | 38.25±14.28 |
| ≥60 | 35 | 16.98±21.21 | 42.12±13.67 |
| 性别 | |||
| 男 | 42 | 18.63±22.13 | 38.57±26.12 |
| 女 | 18 | 19.45±22.32 | 43.10±23.59 |
| 肿瘤大小(cm) | |||
| <5 | 32 | 17.35±18.54 | 41.17±24.38 |
| ≥5 | 28 | 19.53±20.12 | 39.65±34.17 |
| Lauren分型 | |||
| 肠型 | 28 | 29.31±23.15a | 38.33±21.56 |
| 弥漫型 | 32 | 7.24±11.75 | 43.43±18.33 |
| TNM分期 | |||
| Ⅰ+Ⅱ | 26 | 27.50±21.47a | 29.22±17.21a |
| Ⅲ+Ⅳ | 34 | 10.01±12.39 | 52.46±28.86 |
| 分化程度 | |||
| 高、中分化 | 29 | 19.37±20.41 | 30.56±26.04a |
| 低分化 | 31 | 18.15±21.20 | 51.53±24.23 |
| 淋巴转移 | |||
| 无 | 19 | 26.02±18.72a | 26.37±15.35a |
| 有 | 41 | 11.21±12.02 | 54.37±24.15 |
线性相关分析提示, 胃癌组织中CDX2 mRNA和DNMT1 mRNA两者呈明显负相关(r = -0.385, P<0.05).
目前认为, 胃癌的发生是由多基因改变、多因素参与, 涉及遗传学和表观遗传学的多阶段复杂过程. 其中, 癌基因显性作用与抑癌基因的失活是肿瘤发生的分子基础. CDX2是在人体肠道特异性表达的核转录因子, 他可表达于内胚层来源的肠道上皮以及胰腺的导管和腺泡上皮, 在正常上消化道黏膜组织中CDX2基因不表达, CDX2基因表达变化和失控对消化系肿瘤的发生和发展起着重要作用[3,6,7]. 近期发现, CDX2在上消化道中具有抑癌基因的功能. Liu等[8]报道从肠上皮化生-异型增生-胃癌过程中CDX2的表达逐渐下降, 且在肠上皮化生和异型增生中CDX2缺失表达的患者更易进展成胃癌. 国内谢玉波等[9]通过构建人CDX2真核表达载体, 并转染胃癌细胞MGC-803使其高表达CDX2, 结果提示CDX2基因可明显抑制胃癌细胞的生长和促进细胞凋亡. 我们前期研究亦发现[10], CDX2基因胃癌组织中的表达缺失率约40%, 但缺失表达的原因未进一步探讨.
DNMT1是维持DNA甲基化的关键酶, 涉及基因沉默、基因组印迹以及胚胎发生, 其主要功能是维持甲基化状态. DNA甲基化是除缺失与突变之外的第3种调控基因表达的机制, 属表观遗传调控中的一种最常见类型[11]. DNA甲基化可以在转录水平调控基因表达, 通过基因启动子及其附近区域内CpG岛胞嘧啶的甲基化关闭某些基因使其表达抑制[12,13]. Mizuno等[14]研究表明, 肿瘤细胞中DNMT1的表达较正常细胞高4-12倍, 证实DNMT1上调参与肿瘤发生.
本实验通过实时荧光定量PCR检测发现, 胃癌中CDX2和DNMT1 mRNA的表达明显高于远癌胃组织, 而在远癌胃黏膜组织两者表达较低. CDX2 mRNA在弥漫型、TNM Ⅲ-Ⅳ期和有淋巴结转移的患者中表达明显下调(P<0.05), 与年龄、性别、病灶大小、分化程度等因素无关; DNMT1 mRNA的表达与分化程度、临床TNM分期和淋巴结转移等因素有关(P<0.05), 与年龄、性别、病灶大小、Lauren分型等因素无关, 与文献报道类似[15]. 相关性分析提示, 胃癌组织中CDX2 mRNA和DNMT1 mRNA表达呈明显负相关, 我们推测CDX2在胃癌中表达下调可能与DNMT1高表达导致CDX2基因启动子区域CpG岛高甲基化有关, 具体机制有待进一步验证.
总之, 在胃黏膜癌变的过程中CDX2和DNMT1基因的异常表达是胃癌的"早期事件", 联合检测CDX2和DNMT1 mRNA有助于预测胃癌的组织学类型和肿瘤的进展情况, 可作为评估胃癌生物学行为的标志物.
胃癌发生是由多基因改变、多因素参与, 涉及遗传学和表观遗传学的多阶段复杂过程. 本文通过研究胃癌与相应远癌胃组织中CDX2和DNMT1 mRNA的表达及其相关性, 为探讨胃癌发生发展机制提供一定的科学依据.
刘云鹏, 教授, 中国医科大学附属第一医院肿瘤内科
癌基因显性作用与抑癌基因的失活是肿瘤发生的分子基础, 其中抑癌基因表观沉默是胃癌研究的热点. 近期发现, CDX2在上消化道中具有抑癌基因的功能, 本课题组前期研究亦发现, CDX2基因胃癌组织中的表达缺失率约40%, 但缺失表达具体机制有待进一步阐明.
文献报道从肠上皮化生-异型增生-胃癌过程中CDX2的表达逐渐下降, 且在肠上皮化生和异型增生中CDX2缺失表达的患者更易进展成胃癌, 转染高表达CDX2的人胃癌细胞株可明显抑制细胞生长和促进细胞凋亡.
联合检测CDX2和DNMT1 mRNA有助于预测胃癌的组织学类型和肿瘤的进展情况, 可作为评估胃癌生物学行为的标志物.
该研究检测了胃癌组织中CDX2与DNMT1 mRNA的表达, 并分析了与临床病理特征的关系, 具有一定的临床意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Leung WK, Wu MS, Kakugawa Y, Kim JJ, Yeoh KG, Goh KL, Wu KC, Wu DC, Sollano J, Kachintorn U. Screening for gastric cancer in Asia: current evidence and practice. Lancet Oncol. 2008;9:279-287. [PubMed] [DOI] |
| 3. | Werling RW, Yaziji H, Bacchi CE, Gown AM. CDX2, a highly sensitive and specific marker of adenocarcinomas of intestinal origin: an immunohistochemical survey of 476 primary and metastatic carcinomas. Am J Surg Pathol. 2003;27:303-310. [PubMed] [DOI] |
| 8. | Liu Q, Teh M, Ito K, Shah N, Ito Y, Yeoh KG. CDX2 expression is progressively decreased in human gastric intestinal metaplasia, dysplasia and cancer. Mod Pathol. 2007;20:1286-1297. [PubMed] [DOI] |
| 9. | Xie Y, Li L, Wang X, Qin Y, Qian Q, Yuan X, Xiao Q. Overexpression of Cdx2 inhibits progression of gastric cancer in vitro. Int J Oncol. 2010;36:509-516. [PubMed] |
| 12. | Robert MF, Morin S, Beaulieu N, Gauthier F, Chute IC, Barsalou A, MacLeod AR. DNMT1 is required to maintain CpG methylation and aberrant gene silencing in human cancer cells. Nat Genet. 2003;33:61-65. [PubMed] [DOI] |
| 13. | Guo G, Wang W, Bradley A. Mismatch repair genes identified using genetic screens in Blm-deficient embryonic stem cells. Nature. 2004;429:891-895. [PubMed] [DOI] |
| 14. | Mizuno S, Chijiwa T, Okamura T, Akashi K, Fukumaki Y, Niho Y, Sasaki H. Expression of DNA methyltransferases DNMT1, 3A, and 3B in normal hematopoiesis and in acute and chronic myelogenous leukemia. Blood. 2001;97:1172-1179. [PubMed] [DOI] |
| 15. | Ding WJ, Fang JY, Chen XY, Peng YS. The expression and clinical significance of DNA methyltransferase proteins in human gastric cancer. Dig Dis Sci. 2008;53:2083-2089. [PubMed] [DOI] |