修回日期: 2011-10-15
接受日期: 2011-10-23
在线出版日期: 2011-10-28
目的: 探讨Klotho基因在胃癌与癌旁组织中蛋白表达水平的差异及其与胃癌临床病理特征的关系.
方法: 采用免疫组织化学EnVision二步法, 检测Klotho蛋白在75对胃腺癌与其癌旁组织芯片中的表达情况, 并结合临床病理资料进行统计分析.
结果: 胃癌组织中Klotho蛋白表达阳性率(76.0%)低于癌旁组织(90.7%)(P<0.05). 胃癌组织中Klotho的蛋白表达与胃癌的临床分期、淋巴结转移呈负相关(P<0.05), 与患者性别、年龄、肿瘤大小、病理分级等的相关性无统计学意义(P>0.05).
结论: Klotho基因在胃腺癌中低表达, 可能参与了胃癌的转移与进展, 这为判断胃癌预后及有无淋巴结转移提供参考依据.
引文著录: 黄曙, 汤小伟, 林洁, 范志宁, 季国忠. Klotho基因在胃癌组织中的表达及意义. 世界华人消化杂志 2011; 19(30): 3159-3162
Revised: October 15, 2011
Accepted: October 23, 2011
Published online: October 28, 2011
AIM: To examine the expression of Klotho in gastric cancer and to analyze its relationship with the biological behaviors of gastric cancer.
METHODS: Tissue microarray technique and immunohistochemistry were used to examine Klotho expression in 75 gastric cancer tissue and tumor-adjacent tissue specimens. The correlation between Klotho expression and clinicopathological features of gastric cancer was then analyzed.
RESULTS: The positive rate of Klotho expression was significantly lower in gastric cancer than in tumor-adjacent tissue (76.0% vs 90.6%, P<0.05). Klotho expression was negatively correlated with tumor stage and lymph node metastasis (both P<0.05), but showed no significant correlation with sex, age, tumor size and pathological grade (all P>0.05).
CONCLUSION: Down-regulation of Klotho expression in gastric cancer may contribute to tumor metastasis and development. Klotho might be a novel and useful molecular marker for predicting outcome and lymph node metastasis in gastric cancer.
- Citation: Huang S, Tang XW, Lin J, Fan ZN, Ji GZ. Clinical significance of expression of Klotho in gastric cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(30): 3159-3162
- URL: https://www.wjgnet.com/1009-3079/full/v19/i30/3159.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i30.3159
胃癌是临床最常见的恶性肿瘤之一, 占全球癌症死亡原因的第2位. 对胃癌发生发展分子机制的探讨对于胃癌易感人群的筛选、肿瘤标志物的寻找以及基因治疗等具有重要的理论意义和临床应用价值. Klotho是1997年发现的与衰老相关的基因[1], 近年来, 该基因在肿瘤发生发展中的作用开始引起人们的关注[2]. 自2008年开始, 10余篇文章相继报道了Klotho基因与肿瘤的相关性, 如Klotho在乳腺癌、肺癌、结肠癌等中具有抑制肿瘤细胞生长与转移, 促进肿瘤细胞凋亡等功能[3-5]. 但是, 对于Klotho基因与胃癌的相关性研究甚少[6], Klotho基因在胃癌发生发展中的作用还不清楚. 本研究利用免疫组织化学EnVision二步法检测Klotho基因在胃癌与癌旁组织芯片中的表达情况, 探讨胃癌组织中Klotho基因的表达与胃癌临床病理特征的关系以及该基因在胃癌发生发展中的作用.
胃腺癌组织芯片为上海芯超生物技术有限公司产品(编号OD-CT-DgStm01-014), 每例芯片的直径为1.5 mm, 厚度为4 mm, 10×16双芯排列, 用统一标准的方法加工. 每片芯片的完整性>95%. 在75例标本中, 男(n = 50), 女(n = 25); 年龄30-84(中位年龄65)岁. 参照2000年世界卫生组织推荐的肿瘤分化分级标准, 低分化腺癌(n = 28), 中、高分化腺癌(n = 47). 按2002年国际抗癌联盟TNM分期法, Ⅰ期(n = 12), Ⅱ期(n = 25), Ⅲ期(n = 32), Ⅳ期(n = 6). 一抗山羊抗人Klotho多克隆抗体和相应驴抗山羊二抗均购自Santa Cruz公司(产品编号分别为sc-22218和sc-2020), -20 ℃保存, 一抗工作浓度为4 mg/L. 免疫组织化学EnVision二步法试剂盒购买自DAKO公司.
采用免疫组织化学EnVision二步法检测Klotho蛋白表达情况: 使用上海芯超生物技术有限公司的胃腺癌组织芯片, 采用免疫组织化学EnVision二步法检测胃癌和癌旁组织中Klotho蛋白表达情况, 按试剂盒说明书进行操作. PBS代替一抗作为阴性对照, 用Klotho阳性肾小管组织切片作为阳性对照. 2位病理医师用双盲法对芯片进行观察, 根据染色强度与阳性细胞比例综合计分, 细胞的染色强度可分为0分(染色阴性), 1分(淡黄色颗粒), 2分(棕黄色颗粒), 3分(褐色颗粒); 阳性细胞比例的评分方法为: 0分(阳性细胞比例≤5%), 1分(5%<阳性细胞比例≤25%), 2分(25%<阳性细胞比例≤50%), 3分(50%<阳性细胞比例≤75%), 4分(75%<阳性细胞比例≤100%). 根据两项剩积的分数分为4级, 分数≤4记为-4<分数≤8记为+, 8<分数≤12记为++, 分数>12记为+++. 其中-记为Klotho表达阴性; +、++、+++记为Klotho表达阳性.
统计学处理 采用SPSS13.0统计软件进行分析. Klotho蛋白在胃癌与癌旁组织中表达差异, 以及Klotho与临床病理指标(性别、年龄、胃癌分期、分级、淋巴结转移、癌块大小、浸润深度等)的关系均采用c2检验. P<0.05表示差异有统计学意义.
组织芯片经免疫组织化学染色后, 光镜下剔除染色效果差, 组织残缺不全的标本, 最后进入统计的组织芯片含75例胃癌组织与75例癌旁组织.
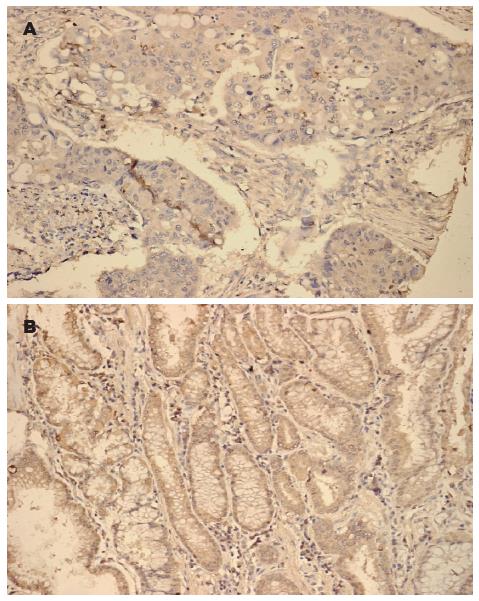
75例胃癌组织中, 57例Klotho表达阳性(76.0%), 显色部位主要为细胞浆; 75例癌旁组织中, 68例Klotho表达阳性(90.7%). 经分析, Klotho蛋白在胃癌与癌旁组织中表达差异有统计学意义(P<0.05, 图1, 表1).
| 部位 | n | Klotho的表达情况 | P值 | ||
| 阳性 | 阴性 | 阳性率(%) | |||
| 胃癌组织 | 75 | 57 | 18 | 76% | <0.05 |
| 癌旁组织 | 75 | 68 | 7 | 90.7% | |
Klotho表达阳性与胃癌患者性别、年龄、癌块大小、病理分级、是否有浆膜层浸润、浸润深度及发生部位等的相关性均无统计学意义(P>0.05), 而与临床分期、淋巴结转移有密切关系, 二者呈负相关(P<0.05, 表2).
| 临床病理特征 | n | Klotho表达情况 | P值 | ||
| 阳性 | 阴性 | 阳性率 | |||
| 性别 | |||||
| 男 | 50 | 38 | 12 | 76.0% | 1.000 |
| 女 | 25 | 19 | 6 | 76.0% | |
| 年龄 | |||||
| ≤65岁 | 38 | 26 | 12 | 83.8% | 0.119 |
| >65岁 | 37 | 31 | 6 | 68.4% | |
| 淋巴结转移 | |||||
| 有 | 47 | 31 | 16 | 66.0% | 0.008 |
| 无 | 38 | 26 | 12 | 92.9% | |
| 临床分期 | |||||
| 1期+2期 | 37 | 33 | 4 | 89.2% | 0.008 |
| 3期+4期 | 38 | 24 | 14 | 63.2% | |
| 病理分级 | |||||
| 高分化(I,I-II) | 7 | 6 | 1 | 85.7% | 0.682 |
| 中分化(II, II-III) | 40 | 31 | 9 | 77.5% | |
| 低分化(III, Ⅳ) | 28 | 20 | 8 | 77.4% | |
| 浸润深度 | |||||
| T1+T2 | 19 | 16 | 3 | 84.2% | 0.510 |
| T3+T4 | 56 | 41 | 15 | 73.2% | |
| 突破浆膜层 | |||||
| 是 | 65 | 52 | 13 | 80.0% | 0.095 |
| 否 | 10 | 5 | 5 | 50.0% | |
| 肿瘤大小 | |||||
| <5cm | 27 | 21 | 6 | 77.8% | 0.787 |
| ≥5cm | 48 | 36 | 12 | 75.0% | |
| 肿瘤发生部位 | |||||
| 贲门 | 17 | 13 | 4 | 76.5% | 0.190 |
| 胃体 | 17 | 12 | 5 | 70.6% | |
| 胃角 | 8 | 8 | 0 | 100% | |
| 胃窦 | 30 | 22 | 8 | 73.3% | |
Klotho基因于1997年被发现[1], 最先研究认为, 他是一种抗衰老基因, Klotho基因敲除的老鼠表现出一系列衰老的症状, 如骨质疏松、肺气肿、皮肤萎缩、动脉硬化等[1]. 近年来, 对Klotho基因的功能研究提示其与恶性肿瘤的发生发展密切相关, 他能抑制多种恶性肿瘤相关信号通路如Insulin/IGF-1、Wnt/b-catenin、TGF-b1等, 从而抑制肿瘤细胞的生长与迁移[3,7,8]. Wolf等[3]首先报道了Klotho在乳腺癌细胞中能与IGF-1受体结合, 阻止其磷酸化, 从而抑制IGF-1信号通路的激活, 使乳腺癌细胞的生长受限, 进而导致其衰老与凋亡. Lee等[7]将Klotho基因成功转染宫颈癌细胞后, 发现癌细胞的生长大大受限, 凋亡率明显增加, 细胞内的Wnt通路重要的信号分子b-catenin含量显著减少, c-Myc与CCND1明显降低. Doi等[8]将Klotho基因转染肺癌细胞, 削弱了癌细胞的转移能力, 进一步地研究发现Klotho可与TGF-b1竞争性结合TGF-bⅡ型受体, 从而阻止TGF-b1的信号转导. 其他研究还表明, Klotho能使促凋亡因子Bax表达升高, 使抑制凋亡因子Bcl-1表达降低, 从而促进癌细胞发生凋亡[9]. 然而, 2008年Lu等[10]发现在卵巢上皮细胞癌组织中存在Klotho蛋白的高表达, 由此推测, Klotho蛋白表达可能与卵巢癌进展有关, 而并非发挥抑癌因子样作用. 以上说明, Klotho基因在不同的肿瘤中可能发挥着不同的作用. 而目前, 在胃癌发生发展中, Klotho基因的功能尚不清楚, 尤其是其与临床、病理参数间关系等基本信息尚未见研究报道.
本实验通过组织芯片联合免疫组织化学法首次检测了胃腺癌及癌旁正常组织中Klotho蛋白的表达情况. 结果表明, 该蛋白在胃癌中的表达低于癌旁组织, 且Klotho的表达还与胃癌的临床分期、淋巴结转移密切相关, 随着胃癌淋巴结的转移、临床分期的增高, Klotho的表达阳性率降低. 结合我们的前期研究结果, Klotho基因启动子区G-395A多态与胃癌发病危险性呈显著相关, 携带A等位基因患者发生胃癌的危险性明显高于携带G等位基因的患者[6]. 而Klotho基因启动子-395区G突变为A可抑制基因的转录, 降低Klotho的表达[11], 进一步提示胃癌的发生与Klotho的低表达有关. 所以, Klotho可能作为一肿瘤抑制因子参与胃癌的进展过程.
总之, 本研究结果显示, Klotho基因的表达与胃癌的淋巴结转移与临床分期负相关, 可考虑将其作为评估胃癌转移潜能及判断预后的指标之一, 也为胃癌的靶向治疗提供了新的思路. Klotho基因与胃癌的关系及其分子机制有待进一步深入研究.
胃癌是一种常见的消化系恶性肿瘤, 发病率和死亡率高, 我国胃癌在各种恶性肿瘤中居首位. 对胃癌发生发展分子机制的探讨对于胃癌易感人群的筛选、肿瘤标志物的寻找以及基因治疗等具有重要的理论意义和临床应用价值. 寻找与胃癌相关的肿瘤标记性指标 始终是胃癌基础与临床研究的主题之一.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
近年来, 衰老相关基因在肿瘤发生发展中的作用开始引起人们的关注, 正成为肿瘤研究领域新的热点. 但Klotho在胃癌中的相关研究目前甚少, 其发挥的功能尚不清楚.
对Klotho基因的功能研究提示, 他能抑制多种恶性肿瘤相关信号通路如Insulin/IGF-1、Wnt/β-catenin、TGF-β1等, 从而抑制肿瘤细胞的生长与迁移. 自2008年始, 陆续有研究直接探讨了Klotho基因与肿瘤如乳腺癌、肺癌、结肠癌等的相关性, 但现有研究结果表明, Klotho并非总是发挥抑癌因子样作用, 该基因在不同的肿瘤中可能作用不同.
本研究选题新颖, 设计合理, 数据统计及分析方法正确, 对判断胃癌转移倾向及预后评估有参考价值.
编辑: 李军亮 电编:何基才
| 1. | Kuro-o M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugi T, Ohyama Y, Kurabayashi M, Kaname T, Kume E. Mutation of the mouse klotho gene leads to a syndrome resembling ageing. Nature. 1997;390:45-51. [PubMed] [DOI] |
| 2. | Duan ZX, Gu W, Du DY, Hu P, Jiang DP, Zhu PF, Wang ZG, Jiang JX. Distributions of glucocorticoid receptor gene polymorphisms in a Chinese Han population and associations with outcome after major trauma. Injury. 2009;40:479-483. [PubMed] [DOI] |
| 3. | Wolf I, Levanon-Cohen S, Bose S, Ligumsky H, Sredni B, Kanety H, Kuro-o M, Karlan B, Kaufman B, Koeffler HP. Klotho: a tumor suppressor and a modulator of the IGF-1 and FGF pathways in human breast cancer. Oncogene. 2008;27:7094-7105. [PubMed] [DOI] |
| 4. | Usuda J, Ichinose S, Ishizumi T, Ohtani K, Inoue T, Saji H, Kakihana M, Kajiwara N, Uchida O, Nomura M. Klotho predicts good clinical outcome in patients with limited-disease small cell lung cancer who received surgery. Lung Cancer. 2011;74:332-337. [PubMed] [DOI] |
| 5. | Pan J, Zhong J, Gan LH, Chen SJ, Jin HC, Wang X, Wang LJ. Klotho, an anti-senescence related gene, is frequently inactivated through promoter hypermethylation in colorectal cancer. Tumour Biol. 2011;32:729-735. [PubMed] [DOI] |
| 6. | 孟 庆玲, 黄 曙, 季 国忠, 范 志宁. Klotho基因G-395A和C1818T多态性与胃癌遗传易感性的研究. 南京医科大学学报(自然科学版). 2008;10:1258-1262. |
| 7. | Lee J, Jeong DJ, Kim J, Lee S, Park JH, Chang B, Jung SI, Yi L, Han Y, Yang Y. The anti-aging gene KLOTHO is a novel target for epigenetic silencing in human cervical carcinoma. Mol Cancer. 2010;9:109. [PubMed] [DOI] |
| 8. | Doi S, Zou Y, Togao O, Pastor JV, John GB, Wang L, Shiizaki K, Gotschall R, Schiavi S, Yorioka N. Klotho inhibits transforming growth factor-beta1 (TGF-beta1) signaling and suppresses renal fibrosis and cancer metastasis in mice. J Biol Chem. 2011;286:8655-8665. [PubMed] [DOI] |
| 9. | Chen B, Wang X, Zhao W, Wu J. Klotho inhibits growth and promotes apoptosis in human lung cancer cell line A549. J Exp Clin Cancer Res. 2010;29:99. [PubMed] [DOI] |
| 10. | Lu L, Katsaros D, Wiley A, de la Longrais IA, Puopolo M, Yu H. Klotho expression in epithelial ovarian cancer and its association with insulin-like growth factors and disease progression. Cancer Invest. 2008;26:185-192. [PubMed] [DOI] |
| 11. | Kawano K, Ogata N, Chiano M, Molloy H, Kleyn P, Spector TD, Uchida M, Hosoi T, Suzuki T, Orimo H. Klotho gene polymorphisms associated with bone density of aged postmenopausal women. J Bone Miner Res. 2002;17:1744-1751. [PubMed] [DOI] |