修回日期: 2011-10-18
接受日期: 2011-10-23
在线出版日期: 2011-10-28
目的: 通过观察脾虚状下大鼠oatp4a1蛋白表达来探讨oatp4a1与脾主运化本质的关系.
方法: 36只♂大鼠随机分为空白组、空白AA(AA为马兜铃酸I)组、脾虚组、脾虚AA组、高脂饮食组、高脂饮食AA组6组. 高脂饮食及利血平造模21 d, 造模成功后给予相应组别大鼠AA灌胃3 d, 末次给AA后1 h内采集标本, 免疫组化方法检测各组大鼠肺、肝、肾、胃、小肠、结直肠组织中oatp4a1的蛋白表达和分布情况.
结果: oatp4a1在上述6种脏器中都有不同程度的表达, 其在肺组织定位于细胞质和细胞核, 其余组织定位于细胞质. 正常情况下, oatp4a1在小肠中表达水平最高(P<0.01). oatp4a1在脾虚模型和高脂饮食模型组的小肠中表达水平下降(P<0.05), 结直肠中oatp4a1表达水平较高(P<0.05).
结论: 脾主运化功能可能与小肠吸收转运功能及定位于小肠的oatp4a1有着密切的关系.
引文著录: 孙保国, 陈泽雄, 张诗军, 项婷, 陈肖霖, 罗纯. 有机阴离子转运肽oatp4a1与脾主运化本质的关系. 世界华人消化杂志 2011; 19(30): 3154-3158
Revised: October 18, 2011
Accepted: October 23, 2011
Published online: October 28, 2011
AIM: To explore the relationship between organic anion transporter peptide-4a1 (oatp4a1) and nature of spleen governing transportation and transformation by examining oatp4a1 protein expression in rats with spleen deficiency syndrome.
METHODS: Thirty-six male SD rats were randomly divided into six groups: saline-treated control group (normal rats treated with saline), aristolochic acid (AA)-treated control group (normal rats treated with AA), spleen deficiency group (rats with reserpine-induced spleen deficiency syndrome), AA-treated spleen deficiency group (rats with spleen deficiency syndrome treated with AA), high-fat group (normal rats given a high fat diet), and AA-treated high-fat group (normal rats given a high fat diet and treated with AA). Rats were treated with reserpine or given a high-fat diet for 21 d, and AA was intragastrically administered for 3 d. Tissue samples were taken within an hour after the last administration of AA. Oatp4a1 protein expression in the lung, liver, kidney, stomach, small intestine and large intestine was detected by immunohistochemistry.
RESULTS: Oatp4a1 was expressed in all the six tissues and was located in both the cytoplasm and nucleus in the lung and in the cytoplasm in the other tissues. Under normal conditions, oatp4a1 expression level was highest in the small intestine (P<0.01). Oatp4a1 expression levels declined in the small intestine but increased in the large intestine in rats with spleen deficiency and those given a high fat diet (both P<0.05).
CONCLUSION: Spleen governing transportation and transformation might be closely associated with small intestine absorption and oatp4a1 expression in the small intestine.
- Citation: Sun BG, Chen ZX, Zhang SJ, Xiang T, Chen XL, Luo C. Relationship between organic anion transporter peptide-4a1 and nature of spleen governing transportation and transformation. Shijie Huaren Xiaohua Zazhi 2011; 19(30): 3154-3158
- URL: https://www.wjgnet.com/1009-3079/full/v19/i30/3154.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i30.3154
中医水液代谢理论是中医脏腑理论的重要组成部分, 是我国传统医学在长期临床实践的基础上发展起来的一种理论, 又有效地指导着临床实践. 随着气候环境、生活方式等的变化, "新"的疾病不断出现, 其中不乏与水液代谢障碍相关的"新"的疾病. 这就迫切需要有科学创意的假说提出, 从不同的角度对水液代谢的发生机制进行研究, 进而为临床提供有效的手段用于水液代谢障碍相关性病症的防治. 在目前的水液代谢研究中, 对水液中之精微物质、水的运化的研究较多, 但对水液中之湿浊的研究较少, 在一定程度上阻碍了中医水液代谢理论理论内涵的深入研究, 是中医基础理论研究的薄弱环节之一. 因此, 我们选取在机体内各组织中广泛分布的oatp4a1作为检测对象, 来探讨有关湿浊转运的分子学机制.
6周龄SPF级SD雄性大鼠36只, 体质量150-180 g, 由广东省实验动物中心提供, 许可证号SCXK(粤)2008-0002粤监证字2008A020. 马兜铃酸I(AA), 20 mg/支, 纯度达99%, 由芜湖甙尔塔医药科技有限公司提供; 利血平注射液1 mg/支, 购自广州中医药大学附属第一医院; Oatp4A1一抗抗体(羊抗)购自Santa Cruz公司, 羊抗小鼠IgG二抗(HRP标记)、兔抗羊IgG二抗(HRP标记)购自武汉博士德公司.
1.2.1 分组: 动物先饲养2 wk, 自由饮食、活动、睡眠, 使其体重增加至250-280 g. 36只大鼠随机分为空白组、空白AA(AA为马兜铃酸)组、脾虚组、脾虚AA组、高脂饮食组、高脂饮食AA组共6组, 每组6只.
1.2.2 脾虚大鼠模型复制方法: 给予利血平5 mg/(kg•d), 皮下注射, 连续15 d, 给予普通饲料; 造模方法参照脾虚大鼠模型参考文献并改进[1]. 脾虚的判别标准: 精神萎靡, 嗜卧懒动(扎堆); 食欲不振; 便溏(肛周不洁); 饮水减少. 对于高质饮食模型组, 给予高质饮食(77%的普通饲料, 15%的猪油, 8%的蛋黄), 每天自由食用, 连续21 d.
1.2.3 各组干预方法: 各组大鼠自由饮食、活动、睡眠. 造模成功后, 给予空白+AA组、脾虚+AA组、高脂饮食+AA组大鼠马兜铃酸20 mg/kg•d, 连续灌胃3 d[2]. 其余各组给予0.9%生理盐水(10 mL/kg)灌胃, 连续3 d. 各组大鼠在最后一次灌胃后1 h内进行取样.
1.2.4 一般体征的观察: 实验过程中每天密切观察大鼠的一般状态, 如饮食量、饮水量、体质量、生长体态、粪便情况、精神状态、活动状态、被毛色泽等.
1.2.5 取样: 用3%的戊巴比妥钠2 mL/kg进行腹腔注射, 对大鼠进行麻醉, 每只大鼠分别取肺、肝、肾、胃、小肠、结直肠等组织各1块, 放入40 g/L甲醛固定, 作免疫组织化学检测.
1.2.6 oatp4a1蛋白分布检测: 采用免疫组织化学染色检测, 免疫组化主要程序: 冰冻或石蜡切片→水化→血清封闭→Ⅰ抗孵育→Ⅱ抗孵育→加底物→显色(DAB)→复染→封片(具体操作参阅免疫组织化学试剂盒说明书), 图像采集利用OLYMPUS BX51生物显微镜及CCD感光系统, 所有图片在固定光源和恒定光强度下同一人一次性完成.
用Image-Pro Plus 6.0进行平均吸光度检测[3], HSI(色调、色饱和度、强度)通道进行光密度分析(参数设置H: 26-36, S: 255, I: 210-250). 对于结直肠、胃、小肠检测腺体染色强度, 肾组织检测肾小球染色强度, 肺组织检测肺肺泡染色强度, 肝组织检测肝小叶染色强度. 平均吸光度(A) = 积分吸光度(IA)/检测面积(area).
统计学处理 采用SPSS17.0软件进行数据处理, 正态计量资料采用单因素方差分析, P<0.05认为有统计学差异.
脾虚组大鼠造模后, 表现为食欲不振, 嗜卧懒动, 便溏, 消瘦, 身体羸弱, 毛色晦暗发黄, 精神萎靡. 高质饮食组大鼠造模后, 表现为体格硕大、被毛光泽、反应敏捷、饮食量大. 正常对照组情况介于两者中间. 结果提示, 高脂饮食在实验期间可以明显改善大鼠的营养状况, 促进蛋白质和脂肪蓄积; 而利血平引起的脾虚状态则削弱了大鼠的营养吸收能力; 由此推测, 大鼠机体所发生的变化可能与体内有机阴离子转运肽oatp4a1存在一定的相关性.
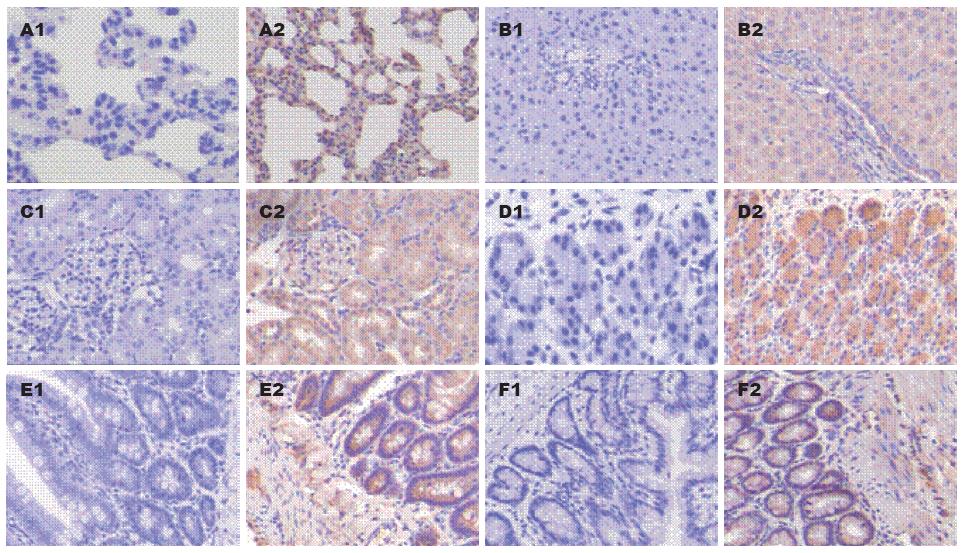
oatp4a1在大鼠的肝脏、肺脏、肾脏、胃、小肠、结直肠内均有表达, 具体为: 肝脏定位于肝细胞质内; 肺脏定位于肺细胞核及细胞质内; 肾脏定位于肾小球的细胞核及肾小管管腔上皮细胞的胞质内; 胃定位于胃腺上皮的细胞质内; 小肠定位于小肠腺上皮的细胞质内; 结直肠定位于结直肠腺上皮的细胞质内(图1).
在正常情况或正常给予马兜铃酸刺激的情况下, oatp4a1在小肠组织中表达水平均高于其在肺、肝、肾、结直肠、胃中的表达水平(P<0.01). oatp4a1在肾、结直肠、胃中的表达水平均高于其在肝和肺中的表达水平(P<0.01), 而其在肾、结直肠、胃中的表达水平无统计学差异(表1).
在脾虚状态下oatp4a1在小肠组织中表达水平低于其在结直肠中的表达水平(P = 0.007), 而从oatp4a1平均光密度的均数来看, 其均数水平在小肠中低于肾、胃、结直肠. oatp4a1在肺、肝中的表达水平低于其他组织(P<0.01). 脾虚给予马兜铃酸刺激的情况下, oatp4a1在小肠组织中表达水平均高于其在肺、肝、肾、结直肠、胃中的表达水平(P<0.01), 也高于脾虚状态下其在小肠中的表达水平(P = 0.006). 脾虚给予马兜铃酸刺激的情况下, oatp4a1在肾、结直肠、胃中的表达水平均高于其在肝和肺中的表达水平(P<0.01), 而其在肾、结直肠、胃中的表达水平无统计学差异(表2).
在高脂饮食下oatp4a1在小肠组织中表达水平低于其在结直肠中的表达水平(P = 0.017); 并且oatp4a1在结直肠组织中表达水平明显高于其在肺、肝、肾、胃中的表达水平(P<0.01). oatp4a1在肺、肝中的表达水平低于其他组织(P<0.01). 高脂饮食给予马兜铃酸刺激的情况下, oatp4a1在小肠组织中表达水平均高于其在肺、肝、结直肠、胃中的表达水平(P<0.01或0.05), 也高于高脂饮食下其在小肠中的表达水平(P = 0.048). 高脂饮食给予马兜铃酸刺激的情况下, oatp4a1在肾、结直肠、胃中的表达水平均高于其在肝和肺中的表达水平(P<0.01或0.05), 而其在肾、结直肠、胃中的表达水平无统计学差异, P>0.05(表3).
脾主运化是脾最为重要的生理功能, 脾主运化包括脾对水谷精微的转化和运输两方面的功能. 脾主运化功能是脏腑系统代谢水液、营养物质、代谢产物的中心环节, 进入消化道的食物、药物、水液以及机体生命活动过程中形成的种种代谢产物的运输、转化乃至最终排出体外的过程都离不开脾主运化的生理功能. 那么, 从微观上来讲, 脾主运化的具体功能载体为何物, 又是如何发挥作用的呢?
研究发现, 有机阴离子转运体(organic anion transporter polypeptides, oatps)广泛分布于机体各组织中, 可以高效运转多种异体代谢产物, 如食物代谢产物[4]、内源性及外源性毒素[5]、药物代谢产物[6]、内分泌激素[7]等, 在转运"湿浊"中起着关键作用[8]. oatp属于溶质载体超家族[9,10], 是人和动物体内重要的膜转运蛋白. 目前已在大鼠体内发现14个oatp家族基因, 分布在相应组织器官中, oatp表达的位置与被表达脏器的功能状态密切相关, 其中oatp4a1广泛分布于肠、肾、肺、肝等组织器官中, 由于功能需要其在不同组织器官细胞中的定位不尽相同, 介导内、外源物质的跨膜转运, 对保持机体和细胞内外环境的稳态平衡起重要作用[11,12].
通过研究oatp4a1在利血平诱导的脾虚大鼠模型和高脂饮食诱导的高脂饮食模型肺、肝、结直肠、胃、肾、小肠中的表达情况, 来探讨脾主运化功能的生理本质. 并通过观察外界湿邪马兜铃酸刺激机体后对oatp4a1表达水平的影响来反证oatp4a1转运水湿的功能及oatp4a1与脾主运化功能的相关性.
根据本研究结果, oatp4a1广泛分布于大鼠肺、肝、结直肠、胃、肾、小肠中, 并且其在结直肠、小肠、胃、肝、肾定位于细胞质内, 而在肺定位于细胞核和细胞质中, 说明oatp4a1因不同器官功能的不同而定位是有区别的. 正常情况下, oatp4a1在小肠腺体细胞质中的浓度最高, 并且马兜铃酸刺激可以一定程度上增强其表达水平, 说明在水谷精微代谢的主要器官是小肠. oatp4a1在肺、肝中的表达水平最低, 结直肠、胃、肾中的表达水平居中并且无差别, 说明oatp4a1主要参与水谷精微的转运和排泄. 所以, 对于脾主运化功能来说, oatp4a1是十分重要的功能载体.
在脾虚模型中, oatp4a1在小肠中的表达水平是降低的, 其在结直肠中表达水平最高, 但是马兜铃酸刺激后小肠中oatp4a1表达水平可以恢复为最高, 说明脾虚状态下小肠中oatp4a1表达水平下降, 结直肠中oatp4a1高表达可能是对小肠转运功能下降的代偿. 尹朋等[13]发现利血平致脾虚大鼠的小肠粘膜受到明显损害, 并且免疫防御功能也明显下降, 说明脾虚与小肠功能有着密切关系. 另外, 有研究[14]表明在炎症性肠病患者中, 肠道组织(53例克隆恩病和54例溃疡性结肠炎)oatp4a1 mRNA表达水平明显升高, 提示oatp4a1与肠道正常结构和功能有着密切的关系, 而肠道系统药物食物转运代谢的重要场所, 其功能是脾主运化功能的重要体现, 这也反映出oatp4a1与脾主运化的密切关系. 所以, 脾主运化与小肠和大肠及其oatp4a1可能有着的密切关系, 小肠吸收转运能力下降及其oatp4a1表达水平的下降可能是脾虚的重要微观表现.
高脂饮食是一种经典的湿浊邪气, 短期内给予高脂饮食可以缓解营养不良、促进脂肪和蛋白质的在体内的蓄积, 因此本研究中高脂饮食大鼠营养状况最好. 但是, 长期高脂饮食必然加重脾的负担, 进而损伤脾主运化功能, 造成湿浊的留滞, 产生痰湿. 有研究[15]发现高脂饮食可以明显改变大鼠肠道菌群的分布, 这可能是脾胃损伤的表现, 并且大鼠血清总胆固醇水平明显升高, 说明高脂饮食可以促进湿浊产生. 本研究中,给予大鼠高脂饮食21 d, 大约相当于人类进食高脂饮食360-500 d, 虽然表面上无脾虚表现, 但是小肠中oatp4a1表达水平已经明显下降, 而大肠中oatp4a1表达水平成为最高, 与脾虚组类似, 说明高脂饮食可能明显损伤脾主运化的功能, 通过进一步的延长高脂饮食干预动物, 动物可能出现脾虚的临床表现.
从组间比较(空白组、空白AA组、高脂饮食组、高脂饮食AA组、脾虚组、脾虚AA组)来看, 只有小肠组织和肝组织中oatp4a1表达水平有组间差异, 其余各组织中oatp4a1表达水平均无组间差异, 说明脾虚主要与小肠中oatp4a1的表达水平相关. 这个结果符合这样的假设: 小肠作为人体最长的消化器官, 是饮食物、药物吸收转运的主要器官, 脾主运化水谷精微的功能定位主要在小肠, 并且oatp4a1是其重要的功能载体.
总之, 本研究的结果初步说明脾主运化功能可能主要与小肠的吸收转运功能关系密切, oatp4a1是小肠吸收转运物质功能的重要载体, 也可能是脾主运化功能的物质基础之一.
脾主运化是脾的主要生理功能, 目前对于脾主运化本质的研究还较为薄弱. 机体对水、电解质、药物、饮食物消化分解产物的吸收和转运有着复杂的机制和系统, 他们的功能一定程度上反映了脾主运化的生理功能, 通过研究其与脾虚的关系, 对阐明脾主运化的微观基础有重要意义.
管冬元, 副教授, 上海中医药大学基础医学院实验中医学教研室
长期以来, 脾的生理功能是中医基础理论研究的重点和热点, 脾主运化有着广泛的生理基础, 有机阴离子转运肽是机体有机分子转运代谢的重要载体, 其与脾主运化的关系如何目前不明确.
从有机阴离子转运肽oatp4a1在脾虚状态下的表达情况探索脾主运化的微观基础, 目前在国内外研究报道很少.
本研究对于进一步确定定位于小肠的oatp4a1与脾主运化的本质关系有重要价值.
研究思路新颖, 具有较强的创新性, 对中医学的相关基础理论也是一种很好的前瞻性的研究.
编辑: 曹丽鸥 电编:何基才
| 1. | 李 仪奎. 中药药理实验研究方法学. 上海: 上海科学技术出版社 2006; 162-163. |
| 3. | Johansson AC, Visse E, Widegren B, Sjögren HO, Siesjö P. Computerized image analysis as a tool to quantify infiltrating leukocytes: a comparison between high- and low-magnification images. J Histochem Cytochem. 2001;49:1073-1079. [PubMed] [DOI] |
| 4. | Seden K, Dickinson L, Khoo S, Back D. Grapefruit-drug interactions. Drugs. 2010;70:2373-2407. [PubMed] [DOI] |
| 5. | 薛 翔, 宫 丽崑, 任 进. 有机阴离子转运蛋白在外源化学物毒性中的作用. 中国药理学与毒理学杂志. 2009;23:237-240. |
| 6. | Tamai I. Oral drug delivery utilizing intestinal OATP transporters. Adv Drug Deliv Rev. 2011; Epub ahead of print. [PubMed] |
| 7. | Visser WE, Friesema EC, Jansen J, Visser TJ. Thyroid hormone transport in and out of cells. Trends Endocrinol Metab. 2008;19:50-56. [PubMed] [DOI] |
| 8. | Hagenbuch B, Meier PJ. Organic anion transporting polypeptides of the OATP/ SLC21 family: phylogenetic classification as OATP/ SLCO superfamily, new nomenclature and molecular/functional properties. Pflugers Arch. 2004;447:653-665. [PubMed] [DOI] |
| 9. | Gao B, Hagenbuch B, Kullak-Ublick GA, Benke D, Aguzzi A, Meier PJ. Organic anion-transporting polypeptides mediate transport of opioid peptides across blood-brain barrier. J Pharmacol Exp Ther. 2000;294:73-79. [PubMed] |
| 10. | Mahagita C, Grassl SM, Piyachaturawat P, Ballatori N. Human organic anion transporter 1B1 and 1B3 function as bidirectional carriers and do not mediate GSH-bile acid cotransport. Am J Physiol Gastrointest Liver Physiol. 2007;293:G271-G278. [PubMed] [DOI] |
| 11. | Mikkaichi T, Suzuki T, Tanemoto M, Ito S, Abe T. The organic anion transporter (OATP) family. Drug Metab Pharmacokinet. 2004;19:171-179. [PubMed] [DOI] |
| 12. | Svoboda M, Riha J, Wlcek K, Jaeger W, Thalhammer T. Organic anion transporting polypeptides (OATPs): regulation of expression and function. Curr Drug Metab. 2011;12:139-153. [PubMed] [DOI] |
| 14. | Wojtal KA, Eloranta JJ, Hruz P, Gutmann H, Drewe J, Staumann A, Beglinger C, Fried M, Kullak-Ublick GA, Vavricka SR. Changes in mRNA expression levels of solute carrier transporters in inflammatory bowel disease patients. Drug Metab Dispos. 2009;37:1871-1877. [PubMed] [DOI] |