修回日期: 2011-10-14
接受日期: 2011-10-22
在线出版日期: 2011-10-28
目的: 研究姜黄素对STAT3活性的调控作用, 以探讨姜黄素对人类胰腺癌细胞增殖的影响.
方法: 应用MTT法检测姜黄素在不同浓度(20、40、60、80、100 mmol/L)及以中效浓度(IC50)的姜黄素分别作用于胰腺癌SW1990细胞0、4、12、24、48、32 h后对胰腺癌SW1990细胞增殖活性的影响; 不同浓度姜黄素(0、20、40、60、80、100 mmol/L)作用于胰腺癌后应用Western blot检测STAT3、pSTAT3蛋白表达水平; 半定量RT-PCR检测Bcl-2、Bax、Survivin、Bak的转录水平.
结果: 姜黄素作用于人胰腺癌细胞系SW1990后, 细胞增殖水平明显下降, 姜黄素呈时间、剂量依赖型方式抑制胰腺癌细胞增殖. 姜黄素对STAT3的蛋白表达水平无明显影响(F = 8.29, P>0.05), 而对pSTAT3蛋白表达水平的抑制作用呈现为剂量依赖型(F = 36.157, P<0.05), 姜黄素抑制SW1990细胞内STAT3靶基因Bcl-2、Bak以及Survivin的mRNA转录水平(F = 75.690, P<0.01; F = 62.301, P<0.01; F = 52.73, P<0.05), 而使Bax mRNA的表达上调(F = 65.93, P<0.05).
结论: 姜黄素能抑制胰腺癌细胞的增殖, 这种抑制作用可能和姜黄素抑制STAT3信号分子的活化, 并进一步抑制其下游靶基因的表达有关.
引文著录: 杨芳, 赵秋, 王渝, 马松林, 龚勇. 姜黄素抑制STAT3信号通路对胰腺癌细胞增殖的影响. 世界华人消化杂志 2011; 19(30): 3149-3153
Revised: October 14, 2011
Accepted: October 22, 2011
Published online: October 28, 2011
AIM: To investigate whether the signal transducer and activator of transcription 3 (STAT3) signal pathway is involved in the effect of curcumin on cell proliferation in pancreatic carcinoma cell line SW1990.
METHODS: SW1990 cells were incubated with different concentrations (20, 40, 60, 80, 100 mmol/L) of curcumin for different durations (0, 4, 12, 24, 48, 32 h). MTT assay was used to measure the proliferation of SW1990 cells. The protein expression of STAT3 and phosphorylated STAT3 (p-STAT3) in SW1990 cells was detected by Western blotting. Semi-quantitative RT-PCR was used to determine the mRNA expression of bcl-2, bax, survivin and bak in SW1990 cells.
RESULTS: Curcumin inhibited SW1990 cell proliferation in a time- and dose-dependent manner (P<0.05). Western blot analysis revealed that curcumin reduced the level of p-STAT3 protein expression (F = 36.157, P<0.05) in a dose-dependent manner, but had no significant impact on STAT3 level (F = 8.29, P>0.05). Moreover, curcumin inhibited mRNA expression levels of bcl-2, bak and survivin (F = 75.690, 62.301, 52.73; P<0.01, 0.01, 0.05) in a dose-dependent manner and up-regulated bax mRNA expression (F = 65.93, P<0.05).
CONCLUSION: Curcumin inhibits the proliferation of pancreatic carcinoma cells perhaps by inhibiting STAT3 phosphorylation and thereby reducing bcl-2, bak and survivin expression.
- Citation: Yang F, Zhao Q, Wang Y, Ma SL, Gong Y. Curcumin suppresses proliferation of pancreatic carcinoma cells by inhibiting the STAT3 signal pathway. Shijie Huaren Xiaohua Zazhi 2011; 19(30): 3149-3153
- URL: https://www.wjgnet.com/1009-3079/full/v19/i30/3149.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i30.3149
胰腺癌是较常见的消化系恶性肿瘤, 该疾病的早期诊断十分困难, 多数新发病例已存在周围器官侵犯和/或远处转移, 手术切除率不到30%, 5年生存率低于5%[1]. 胰腺癌的发病率仍呈逐年上升趋势, 2009年美国在因肿瘤致死疾患中居第4位[2]. 信号转导和转录激活因子家族(signal transducers and activators of transcription, STATs)是一类将由细胞因子受体和生长因子受体传递的细胞外信号传送至细胞核的转录因子[3]. 在多种肿瘤组织中皆发现有其成员的过度表达, 其中以STAT3最为活跃. 激活的STAT3对肿瘤细胞的形成、生长、增殖、凋亡抑制等过程均起着重要的调控作用. 姜黄素(curcumin, Cur)是从姜科植物姜黄中提取的b-二酮多酚类化合物, 具有抑制癌细胞增殖, 诱导癌细胞凋亡的抗癌活性, 可以减少肿瘤细胞体内外的侵袭和转移[4-7]. 为研究姜黄素对人类胰腺癌体外抗癌作用及其机制, 我们对姜黄素诱导胰腺癌细胞凋亡的可能途径进行初步探讨. 本研究拟选取胰腺癌细胞系SW1990, 通过外源性给予姜黄素, 观察姜黄素在胰腺癌细胞株中对STAT3的作用, 并进一步探索其对胰腺癌细胞增殖的作用, 再以此为依据, 探索胰腺癌治疗的新的靶点, 为临床上应用姜黄素治疗胰腺癌提供新的思路和理论依据.
人胰腺癌细胞SW1990由华中科技大学同济医学院附属同济医院肝病研究所保存; 姜黄素粉剂购自Sigma公司, 用二甲基亚砜(DMSO)稀释成5 mmol/L, 等量分装, -20 ℃保存; DMEM高糖培养基购自Hyclone公司; 标准胎牛血清购自杭州四季青生物工程材料有限公司; 兔抗人STAT3单克隆抗体、兔抗人pSTAT3单克隆抗体购自Cell Signaling公司; Taq DNA聚合酶为美国MBI公司产品; 莫洛尼氏鼠白血病病毒(M-MLV)逆转录酶试剂为Promega公司产品; 四甲基偶氮唑蓝购自Sigma公司.
1.2.1 细胞培养及处理: 细胞培养采用含100 mL/L胎牛血清的DMEM高糖培养基, 在37 ℃, 50 mL/L CO2的饱和湿度培养箱中培养, 每48 h换液传代1次, 倍增时间约24 h. 取生长良好, 细胞活性大于98%的细胞进行实验. 用不同浓度的姜黄素(0、20、40、60、80、100 mmol/L)作用后收集细胞进行相关检测.
1.2.2 四甲基偶氮唑蓝(MTT)比色实验: 取对数生长期细胞, 调节细胞浓度为1×105/mL, 细胞接种于96孔培养板中, 在37 ℃, 50 mL/L CO2及饱和湿度条件下培养24 h. 试验设试剂对照组、肿瘤细胞阴性组及五种不同浓度的试验组. 24 h后弃上清, 按实验要求加入终浓度为20、40、60、80、100 mmol/L的姜黄素, 同时取等量DMSO作为对照组, 每组设6个复孔, 以上各组培养24 h后, 弃上清, 每孔加20 mL MTT(5 g/L)和180 mL无血清DMEM培养液, 继续培养4 h, 去培养液, 加150 mL DMSO振荡溶解10 min, 以空白孔调零, 在自动酶标仪上测定每孔吸光度值A, 波长为492 nm, 计算各组药物浓度的抑制率及中效浓度(IC50), 试验重复3次取平均值. 再以IC50浓度的姜黄素分别作用于胰腺癌SW1990细胞0、4、12、24、48、32 h后, 在酶联免疫检测仪上测定各孔光吸收值, 计算出作用不同时间的增殖抑制率[8]. 增殖抑制率(%) = (1-实验孔A值/对照孔A值)×100%.
1.2.3 免疫印迹法(Western blot)检测STAT3和pSTAT3蛋白的表达: 用不同浓度的姜黄素(0、20、40、60、80、100 mmol/L)作用于胰腺癌细胞24 h后, 分别收获细胞, 用冷PBS洗3次, 尽量吸尽瓶内PBS, 加入裂解缓冲液, 剧烈振荡混匀约10 s, 放置冰上30 min后收集. 低温下12 000 r/min离心15 min, 取上清, 等量分装后-80 ℃冻存. 用Bradford比色法测所提核蛋白浓度后, 各组取等质量蛋白上样, 采用5%浓缩胶, 8%分离胶进行SDS-PAGE电泳, 电转蛋白至硝酸纤维素膜上. 37 ℃用5%的脱脂奶粉封闭2 h, PBST洗膜3次后加入1∶800稀释的鼠抗人STAT-3、p-STAT3单克隆抗体, 4 ℃下孵育过夜, TBS洗膜后, 加入PBST冲洗10 min, 共洗3次. 加入1∶50稀释的辣根过氧化物酶(HRP)标记羊抗兔的二抗, 37 ℃孵育2 h, 洗去未结合的二抗, 滴加ECL化学发光试剂, X线曝光显影, 洗片显示蛋白条带, 各组均以b-actin蛋白作为内参照. 用图像分析软件分析条带的平均光密度值, 蛋白相对表达水平以STAT3/b-actin、pSTAT3/b-actin平均光密度比值表示.
1.2.4 半定量RT-PCR检测各组细胞内Bcl-2、Bax、Survivin、Bak基因mRNA的表达水平: 25 mL逆转录反应体系, 取2 mg总RNA, M-MLV逆转录酶42 ℃逆转录1 h, 之后进行PCR反应. 反应体系25 mL, 取2 mL cDNA, 用Taq DNA聚合酶进行PCR反应. 程序设置如下: 94 ℃预变性5 min, 94 ℃变性45 s, 梯度退火45 s, 72 ℃延伸35 s, 共31个循环. 各条引物序列如下: Bcl-2: 5'TATCCAATCCTGTGCTGC3', 5'GCAGTTAAGATGCAGATGTG 3'; Bax: 5'ATGCGTCCACCAAGAAGC3', 5'AGTCTCACCCAAC CACCCT3'; Survivin: 5'GGGAAACGGGGT GAACTT3', 5'CAAATCCATCATCTTACGCC3'; Bak: 5'GGATTGGTGGGTCTATGTTC3', 5'CTACACCCCTGGATTACACTG3', b-actin: 5'GTTGCGTTACACCCTTTCTTG3', 5'GACTGCTGTCACCTTCACCGT3'. 上述引物均由上海生工生物工程技术服务有限公司合成. 将PCR产物用1.5% TAE琼脂糖凝胶电泳后, 凝胶成像分析系统测得各组条带的平均灰度值以进行半定量分析.
统计学处理 采用SPSS13.0进行数据录入和统计分析. 实验数据以mean±SD表示, 多组间比较采用单因素方差分析, P<0.05有统计学意义.
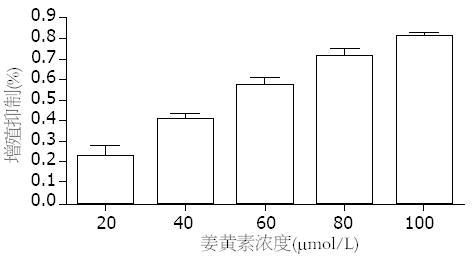
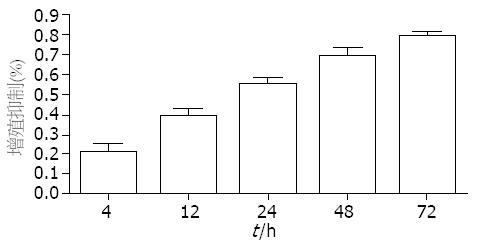
浓度分别为20、40、60、80、100 mmol/L的姜黄素对SW1990细胞作用24 h后, MTT检测各实验组细胞的增殖抑制率分别为: 22.60%±12.65%、40.45%±7.30%、57.09%±8.20%、71.52%±8.67%、81.42%±4.39%, 与对照组相比, 均有显著性差异(F = 58.37, P<0.01), 而浓度分别为80与100 mmol/L的两组间比较无显著性差异(P>0.05). 姜黄素对SW1990细胞的增殖抑制作用呈剂量依赖性(图1). Bliss法计算出IC50 = 56.78 mmol/L. 我们选浓度为60 mmol/L的姜黄素分别作用于SW1990细胞4、12、24、48、72 h后MTT检测各组细胞的增殖抑制率分别为: 11.23%±8.51%、39.08%±8.78%、55.72%±6.79%、69.19%±10.56%、80.05%±3.59%. 随着姜黄素作用时间的延长, 细胞增殖率逐渐降低, 姜黄素对SW1990细胞的增殖抑制作用呈时间依赖性(F = 58.37, P<0.01, 图2).
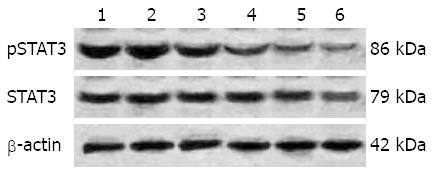
各组STAT3和pSTAT3蛋白相对表达量以STAT3/b-actin和pSTAT3/b-actin比值表示. Western blot检测显示: 随着姜黄素作用浓度的升高, pSTAT3蛋白表达水平逐渐减低, 当姜黄素浓度为100 mmol/L时, pSTAT3蛋白条带明显变弱, 姜黄素抑制pSTAT3蛋白表达呈明显的剂量依赖性(F = 36.157, P<0.05). 而随着姜黄素作用浓度的升高, 细胞内STAT3蛋白均呈强表达, 并且其表达水平不随姜黄素作用浓度的增高而变化(F = 8.29, P>0.05, 图3).
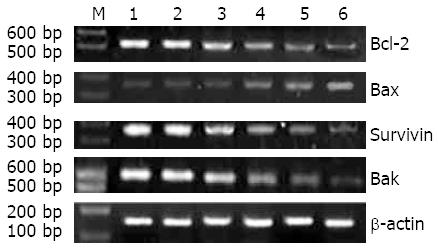
姜黄素作用SW1990细胞株后, 明显下调Bcl-2、Bak以及Survivin水平(F = 75.690, P<0.01; F = 62.301, P<0.01; F = 52.73, P<0.05), 上调Bax水平(F = 65.93, P<0.05). 并且其表达水平随姜黄素作用浓度的变化而变化, 呈剂量依赖性(图4).
STAT3是存在于细胞浆与酪氨酸磷酸化信号通道偶联的双功能蛋白, 在细胞内起着重要的信号传递作用. 目前已发现多种细胞外信号可激活STAT3, 之后可形成二聚体入核, 识别并结合于特定的DNA启动子序列, 激活靶基因的转录[9,10]. 研究发现, STAT3信号转导通路在多种原发癌灶和肿瘤来源细胞株中异常激活和过表达[11-16]. 激活的STAT3对肿瘤细胞的形成、生长、增殖、凋亡抑制等过程起着重要的调控作用, 这可能与STAT3的活化导致一系列靶基因的激活有关[17].
近年来关于STAT3与胰腺癌关系的研究较多, Pham等[18]发现胰腺癌细胞中存在STAT3的过表达. Wei等[19]的研究表明, 80%以上的胰腺癌细胞株显示组成型激活的STAT3的表达. Toyonaga等[20]研究发现, 在人胰腺癌细胞系(Panc1, Kp4, AsPC-1, BxPC-3)中STAT3组成型激活. 这些结果均提示, STAT3的活化与胰腺癌密切相关, 而以STAT3作为靶点可能为胰腺癌的治疗提供一种新的治疗策略.
姜黄素(curcumin, Cur)具有抗癌谱广、不良反应小的优点, 最近被肿瘤学家们认为是一种潜在的第3代抗癌化疗药. 姜黄素抗癌作用的机制是多方面的, 其中诱导肿瘤细胞凋亡可见于多种肿瘤研究中, 但其诱导肿瘤细胞凋亡的机制仍不清楚. 体外研究表明, 姜黄素抑制癌细胞增殖和诱导凋亡是通过多条通路和调节多种肿瘤基因表达实现的, 其作用靶点可以从DNA、mRNA到蛋白水平. 我们通过研究姜黄素对胰腺癌细胞STAT3信号分子的作用, 初步探讨了姜黄素对胰腺癌的可能作用机制.
我们的研究结果显示, 姜黄素能有效抑制人类胰腺癌细胞株SW1990的增殖, 胰腺癌SW1990细胞增殖活力随姜黄素药物浓度增大和作用时间的延长而不断下降, 其抑制作用呈剂量和时间依赖方式, 与Jutooru等[21]的报道一致. 本研究结果还显示, 随着姜黄素浓度升高, STAT3蛋白表达无明显变化, 而pSTAT3蛋白表达水平逐渐下降, 姜黄素可以抑制胰腺癌细胞中活化的pSTAT3的表达水平. Glienke等[22]的研究结果显示, 姜黄素可以明显抑制胰腺癌细胞系的STAT3的磷酸化, 并且下调Survivin/BIRC5基因的表达, 这与我们的研究结果相同. 本实验显示, 姜黄素作用SW1990细胞株后, 明显下调Bcl-2 mRNA和上调Bax mRNA, 而Survivin mRNA表达水平也明显下降. 表明姜黄素可能是通过抑制STAT3活化从而抑制了其下游靶基因的转录, 以削弱其抑制肿瘤细胞凋亡的作用, 进而促进胰腺癌细胞的凋亡.
本研究初步探讨了姜黄素抑制胰腺癌生长的作用机制, 结果表明, 姜黄素可阻断高表达STAT3的人胰腺癌细胞系SW1990细胞STAT3活化, 并可能通过下调Bcl-2的表达抑制人胰腺癌细胞增殖, 诱导其凋亡. 此外, 姜黄素对STAT3的功能有显著影响, 但STAT3途径是不是姜黄素抑制效应的主要或唯一途径, 仍需进一步研究.
STAT3是JAK-STAT信号通路中一个至关重要的转录因子, 在细胞内起着重要的信号传递作用. 姜黄素具有明显的抗肿瘤作用, 作用机制是否与STAT3有关尚不清楚.
王炳元, 教授, 中国医科大学附属第一医院消化内科
近年来, 研究针对肿瘤细胞内异常信号通路为靶点的特异性抗肿瘤药物已成为肿瘤治疗研究的热点.
Pham等发现胰腺癌细胞中存在STAT3的过表达. Wei等的研究表明, 80%以上的胰腺癌细胞株显示组成性激活的STAT3的表达.
本文观察了不同剂量姜黄素作用下, 人胰腺癌细胞STAT3及pSTAT3蛋白表达的变化, 并探讨了可能的分子机制. 发现姜黄素能抑制STAT3的活化, 继而下调其下游靶基因的表达, 抑制人胰腺癌细胞增殖, 诱导其凋亡.
姜黄素是姜黄最重要的生物活性成分, 近年来其抗肿瘤作用得到越来越多的实验证实. 本研究结果加深了对其作用机制的认识, 为其进一步开发应用奠定了理论基础.
本文采用姜黄素来研究其对肿瘤的抑制作用, 有一定的学术研究和临床意义.
编辑: 李军亮 电编:何基才
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Murray T, Thun MJ. Cancer statistics, 2008. CA Cancer J Clin. 2008;58:71-96. [PubMed] [DOI] |
| 2. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 3. | Bowman T, Garcia R, Turkson J, Jove R. STATs in oncogenesis. Oncogene. 2000;19:2474-2488. [PubMed] [DOI] |
| 4. | Goel A, Aggarwal BB. Curcumin, the golden spice from Indian saffron, is a chemosensitizer and radiosensitizer for tumors and chemoprotector and radioprotector for normal organs. Nutr Cancer. 2010;62:919-930. [PubMed] [DOI] |
| 5. | Reuter S, Eifes S, Dicato M, Aggarwal BB, Diederich M. Modulation of anti-apoptotic and survival pathways by curcumin as a strategy to induce apoptosis in cancer cells. Biochem Pharmacol. 2008;76:1340-1351. [PubMed] [DOI] |
| 6. | Tharakan ST, Inamoto T, Sung B, Aggarwal BB, Kamat AM. Curcumin potentiates the antitumor effects of gemcitabine in an orthotopic model of human bladder cancer through suppression of proliferative and angiogenic biomarkers. Biochem Pharmacol. 2010;79:218-228. [PubMed] [DOI] |
| 7. | Cheng CY, Lin YH, Su CC. Curcumin inhibits the proliferation of human hepatocellular carcinoma J5 cells by inducing endoplasmic reticulum stress and mitochondrial dysfunction. Int J Mol Med. 2010;26:673-678. [PubMed] |
| 8. | Yang CR, Guh JH, Teng CM, Chen CC, Chen PH. Combined treatment with denbinobin and Fas ligand has a synergistic cytotoxic effect in human pancreatic adenocarcinoma BxPC-3 cells. Br J Pharmacol. 2009;157:1175-1185. [PubMed] [DOI] |
| 9. | Herrmann A, Kortylewski M, Kujawski M, Zhang C, Reckamp K, Armstrong B, Wang L, Kowolik C, Deng J, Figlin R. Targeting Stat3 in the myeloid compartment drastically improves the in vivo antitumor functions of adoptively transferred T cells. Cancer Res. 2010;70:7455-7464. [PubMed] [DOI] |
| 10. | Spano JP, Milano G, Rixe C, Fagard R. JAK/STAT signalling pathway in colorectal cancer: a new biological target with therapeutic implications. Eur J Cancer. 2006;42:2668-2670. [PubMed] [DOI] |
| 11. | Klampfer L. The role of signal transducers and activators of transcription in colon cancer. Front Biosci. 2008;13:2888-2899. [PubMed] [DOI] |
| 12. | Chen CL, Cen L, Kohout J, Hutzen B, Chan C, Hsieh FC, Loy A, Huang V, Cheng G, Lin J. Signal transducer and activator of transcription 3 activation is associated with bladder cancer cell growth and survival. Mol Cancer. 2008;7:78. [PubMed] [DOI] |
| 13. | Lee SO, Lou W, Qureshi KM, Mehraein-Ghomi F, Trump DL, Gao AC. RNA interference targeting Stat3 inhibits growth and induces apoptosis of human prostate cancer cells. Prostate. 2004;60:303-309. [PubMed] [DOI] |
| 14. | Hsieh FC, Cheng G, Lin J. Evaluation of potential Stat3-regulated genes in human breast cancer. Biochem Biophys Res Commun. 2005;335:292-299. [PubMed] [DOI] |
| 15. | Leeman RJ, Lui VW, Grandis JR. STAT3 as a therapeutic target in head and neck cancer. Expert Opin Biol Ther. 2006;6:231-241. [PubMed] [DOI] |
| 16. | Yu LF, Cheng Y, Qiao MM, Zhang YP, Wu YL. Activation of STAT3 signaling in human stomach adenocarcinoma drug-resistant cell line and its relationship with expression of vascular endothelial growth factor. World J Gastroenterol. 2005;11:875-879. [PubMed] |
| 17. | Haura EB, Turkson J, Jove R. Mechanisms of disease: Insights into the emerging role of signal transducers and activators of transcription in cancer. Nat Clin Pract Oncol. 2005;2:315-324. [PubMed] [DOI] |
| 18. | Pham NA, Schwock J, Iakovlev V, Pond G, Hedley DW, Tsao MS. Immunohistochemical analysis of changes in signaling pathway activation downstream of growth factor receptors in pancreatic duct cell carcinogenesis. BMC Cancer. 2008;8:43. [PubMed] [DOI] |
| 19. | Wei D, Le X, Zheng L, Wang L, Frey JA, Gao AC, Peng Z, Huang S, Xiong HQ, Abbruzzese JL. Stat3 activation regulates the expression of vascular endothelial growth factor and human pancreatic cancer angiogenesis and metastasis. Oncogene. 2003;22:319-329. [PubMed] [DOI] |
| 20. | Toyonaga T, Nakano K, Nagano M, Zhao G, Yamaguchi K, Kuroki S, Eguchi T, Chijiiwa K, Tsuneyoshi M, Tanaka M. Blockade of constitutively activated Janus kinase/signal transducer and activator of transcription-3 pathway inhibits growth of human pancreatic cancer. Cancer Lett. 2003;201:107-116. [PubMed] [DOI] |
| 21. | Jutooru I, Chadalapaka G, Lei P, Safe S. Inhibition of NFkappaB and pancreatic cancer cell and tumor growth by curcumin is dependent on specificity protein down-regulation. J Biol Chem. 2010;285:25332-25344. [PubMed] [DOI] |
| 22. | Glienke W, Maute L, Wicht J, Bergmann L. Curcumin inhibits constitutive STAT3 phosphorylation in human pancreatic cancer cell lines and downregulation of survivin/BIRC5 gene expression. Cancer Invest. 2010;28:166-171. [PubMed] [DOI] |