修回日期: 2011-10-22
接受日期: 2011-10-25
在线出版日期: 2011-10-28
多种因素引起的原癌基因激活和抑癌基因失活是导致肝癌发生发展的主要原因. EZH2是新近发现的具有组蛋白甲基转移酶活性的癌相关基因, 主要通过催化H3K27me3修饰介导基因沉默, 参与X染色体失活、细胞分化和胚胎发育调节. 近来发现, EZH2在多种机制调节下在肝癌组织中过度表达, 通过多种机制调控其下游基因异常表达, 从而参与肝癌发生发展的多个过程. 本文针对以上进行了总结和讨论.
引文著录: 张莹莹, 周晓巍, 黄培堂. EZH2在肝癌发生发展中功能的研究进展. 世界华人消化杂志 2011; 19(30): 3137-3142
Revised: October 22, 2011
Accepted: October 25, 2011
Published online: October 28, 2011
Primary hepatocellular carcinoma (HCC) is one of the most common malignancies, with a multifaceted molecular pathogenesis. The activation of proto-oncogenes and the inactivation of tumor suppressor genes induced by genetic and epigenetic alterations are major mechanisms of hepatocarcinogenesis. The Polycomb-group gene EZH2 is a newly identified oncogene with gene silencing function, which is mediated by intrinsic histone methyltransferase activity for trimethylation of histone h3 lysine 27 (H3K27me3) and involved in regulation of X-inactivation, cell differentiation and embryonic development. In recent years, EZH2 has been reported to be highly expressed in HCC and is closely related to hepatocarcinogenesis by aberrant regulation of tumor-associated gene expression. In this paper we give an overview of the role of EZH2 in the development of HCC.
- Citation: Zhang YY, Zhou XW, Huang PT. Progress in understanding the role of EZH2 in the pathogenesis of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(30): 3137-3142
- URL: https://www.wjgnet.com/1009-3079/full/v19/i30/3137.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i30.3137
原发性肝癌是世界上最常见的恶性肿瘤之一, 病死率高, 我国每年因肝癌死亡人数约30万人, 占世界肝癌死亡人数的45%, 严重威胁人们的生命健康和生活质量[1]. 多种因素可导致肝癌的发生, 如病毒感染、黄曲霉素暴露和重度脂肪肝等. 目前认为, 肝癌发生是一个多基因表达异常引起的综合病变过程, 原癌基因和抑癌基因在多种调控机制作用下被异常激活或失活是导致肿瘤发生的主要原因[1]. 一直以来, 遗传学上的基因突变、缺失或扩增被认为是影响基因表达的主要机制, 但近年来也发现通过DNA甲基化[2]和组蛋白修饰[3,4]等表观遗传学机制调控肿瘤相关基因表达在肝癌发生过程中也发挥着同等重要的作用, 成为目前肝癌机制研究的热点. Polycomb group(PcG)蛋白复合体成员EZH2(enhancer of zeste homolog 2)是新近发现具有组蛋白甲基转移酶活性的癌相关蛋白, 在胚胎发育早期普遍存在, 与SUZ12(suppressor of Zeste 12)和EED(embryonic ectoderm development)共同组成PRC2(polycomb-repressive complex 2)沉默复合物, 通过催化组蛋白3第27位三甲基化(H3K27me3)修饰介导基因沉默, 参与X染色体失活、细胞分化和胚胎发育调节[5]. 在肿瘤中的研究发现[6], EZH2在前列腺癌、乳腺癌、淋巴瘤等多种肿瘤中过度表达, 与肿瘤的形成和生长密切相关, 具有促进细胞增殖、肿瘤细胞扩散和转移的恶性表型. 最近研究发现[7,8], EZH2在肝癌发生过程中也发挥重要作用, 并且与肝癌的恶性程度及预后密切相关. 本文仅就EZH2结构功能及其与肝癌发生发展的关系作简要综述.
PRC2沉默复合物是新近发现的具有组蛋白甲基转移酶活性的多亚基复合物, 主要通过介导H3K27me3修饰参与基因沉默调控过程[9]. 研究发现, PRC2复合物在多种物种中保守存在, 并具有相似的亚基组成和功能, EZH2是其唯一的催化亚基, 在PRC2的组蛋白甲基转移活性中发挥关键作用[6].
EZH2是果蝇zeste基因增强子[E(z)]的人源同系物, 最早在研究与原癌基因Vav相互作用中发现[10], 同年Chen等[11]从DNA文库中克隆出人EZH2编码序列, 并将其基因定位于染色体21q22.2位置上. 随后Cardoso等[12]将其定位更正为染色体7q35位置, 并证实在染色体21q22.2位置的EZH2拷贝是假基因. 人源EZH2基因共编码751个氨基酸, 含有5个功能性结构域, 分别为EID(EED-interaction domain)结构域, Domain I和Domain II结构域, CXC结构域(cysteine-rich domain)和SET结构域(suppressor of variegation 39, enhancer of zeste and trithorax domain), 除EID外, 其余结构域均与果蝇E(Z)蛋白相应区域高度同源[6,13]. EID结构域位于EZH2蛋白最N端第39-68氨基酸, 是介导与PRC2复合物EED亚基相互作用的充分必要区域, 在维持PRC2复合物稳定性上发挥重要作用[14]. Domain I和Domain II结构域分别位于EZH2 94-160氨基酸和218-335氨基酸区域, 与果蝇E(Z)蛋白相应区域同源性分别为77%和62%, 主要介导EZH2与DNA甲基转移酶DNMTs、Polycomb样蛋白PHF1和SUZ12亚基等蛋白的相互作用. CXC结构域为半胱氨酸富含区, 且在多个物种中高度保守, 是EZH2发挥其甲基转移酶活性的必要区域. SET结构域紧邻着CXC结构域, 约113个氨基酸, 是EZH2中最为保守的结构域(人与果蝇同源性为88%), 在多个组蛋白赖氨酸甲基转移酶中广泛存在, 是催化甲基转移的关键结构域[13]. SET结构域中两个保守的基序相互穿插, 形成一个独特的"绳结"样结构(knot like structure), 底物蛋白的赖氨酸和甲基供体辅助因子分别结合于SET结构域两侧, 从而在"绳结"样结构的帮助下完成甲基转移过程[15].
尽管EZH2具有甲基转移酶活性, 但是其单独作用并不足够催化组蛋白甲基化修饰, 至少需要与另外3个polycomb蛋白EED、SUZ12和RbAp46/48共同组成PRC2核心复合物, 才能完整发挥组蛋白甲基转移酶活性[6,16,17]. 近来也发现, PRC2复合物中还有一些亚基如PHF1、MTF2及DNA结合蛋白AEBP2和JARID2等可进一步增强EZH2的甲基转移酶活性[17-20]. 研究已经证实, EZH2参与形成的PRC2复合物主要介导H3K27me3修饰, 而较少影响H3其他位点赖氨酸的甲基化修饰[5]. 在此基础上, 组蛋白H3K27me3可进一步募集另一个由polycomb蛋白组成的PRC1(polycomb-repressive complex 1)沉默复合物结合至核小体结构[21]. PCR1沉默复合物亚基RING1B蛋白具有泛素连接酶活性, 可通过催化组蛋白2A第119位赖氨酸泛素化(H2A K119)诱导染色体结构改变, 进而导致稳定的转录抑制和基因沉默. EZH2可通过这种基因沉默作用调控多种细胞分化和胚胎发育相关基因如oct3/4及Hox等[17,22]表达, 从而在细胞分化和胚胎发育中发挥作用.
除此之外, 研究还发现, EZH2还在介导X染色体失活过程中发挥重要作用[21]. 胚胎发育过程中, EZH2所在的PRC2复合物可在Xist RNA的引导下募集于失活的X染色体, 催化H3K27me3修饰, 从而参与Xist RNA沉默X染色体过程. 最近有报道[23], 在PRC2复合物参与的情况下, EZH2在人骨肉瘤U2OS细胞中可与DNA甲基化酶DNMTs相互结合, 并募集DNMTs至启动子区特定位点催化CpG岛从头甲基化诱导基因沉默, 且DNMTs介导的启动子区DNA甲基化依赖于EZH2的存在, 表明EZH2在调控DNA甲基化过程中也发挥着重要作用. 进一步研究发现, 在正常细胞中受H3K27me3修饰调控的基因, 其启动子区往往在肿瘤细胞中发生超甲基化, 这表明EZH2介导的H3K27me3修饰可能是抑癌基因在肿瘤中从头甲基化的预标记(pre-mark), 从而使抑癌基因在H3K27me3修饰和DNA甲基化修饰的双重作用下被深度沉默, 从而导致肿瘤的发生[24].
EZH2介导的H3K27me3修饰不仅与DNA甲基化相关, 而且与组蛋白乙酰化修饰也密切相关[25]. EZH2可与组蛋白去乙酰化酶HDACs组合成一个包括PRC2复合物在内的大蛋白复合物共同参与基因沉默, 且HDAC抑制剂TSA能够消除EZH2所诱导的基因沉默[26]. 但是, HDACs并不是PRC2复合物的核心成员, 而是在特定情况下与PRC2暂时结合催化H3K27去乙酰化, 从而利于EZH2介导的H3K27me3修饰, 协同参与EZH2所介导的基因沉默过程[5]. 综上可知, EZH2生物学功能的发挥需要多种调控因子的共同参与, 尤其在肿瘤发生过程中, EZH2介导的H3K27me3修饰, DNMTs介导的DNA超甲基化和HDACs介导的组蛋白去乙酰化修饰三者之间的调控异常导致下游基因的表达水平异常, 进而可能进一步促进肿瘤的发生发展. 在肿瘤的研究中的确发现, EZH2蛋白在前列腺癌、乳腺癌、淋巴瘤、结肠癌和胃癌等多种肿瘤中呈高水平表达, 且与肿瘤的进展和预后密切相关[6]. 最近在肝癌的多项研究发现[7,8,27], EZH2的过度表达与肿瘤细胞的增殖及血管浸润性呈正相关, 并可能成为治疗靶点.
从2002年Varambally等[28]首次在前列腺癌中报道EZH2与肿瘤的关系至今, 不到10年间已有近300篇文章在10多种肿瘤中发现EZH2呈过度表达, 且与肿瘤的发生发展密切相关. 在肝癌中, Sudo等[7]首次于2005年利用定量PCR方法在66例肝细胞癌及相应癌旁组织中检测了EZH2 mRNA的表达水平差异, 结果发现EZH2在肝癌组织中的表达水平显著高于癌旁组织, 且常发现癌细胞的门静脉浸润, 这与在前列腺癌、乳腺癌等肿瘤中的检测结果一致. 随后, Sasaki等[8]和Yonemitsu等[29]利用免疫组织化学方法检测了EZH2在肝细胞癌和增生性结节中的表达情况, Cai等[30]利用Western blot方法检测EZH2在肝癌组织和癌旁组织中的表达情况, 均得到了与Sudo一致的结果. 进一步利用RNAi方法敲低肝癌细胞中EZH2的表达水平, 可显著抑制细胞的增殖活性和裸鼠成瘤能力, 将针对EZH2的siRNA或者表达shRNA的慢病毒注射入裸鼠肝癌模型可显著降低移植肿瘤的生长, 这些结果从细胞模型和动物模型进一步确定了EZH2在肝癌发生发展中的作用[27].
在肝癌组织中对EZH2表达情况的研究还发现, EZH2高表达水平不仅仅与肝癌发生及肝癌进展过程相关, 而且还与肝癌分化程度显著相关. Sasaki等[8]利用定量PCR发现, EZH2 mRNA水平在高、中、低分化肝癌组织中具有显著差异, 与肝癌的分化程度呈负相关. 国内Cai等[30]利用免疫组织化学方法对不同分化程度的肝癌组织检测发现, EZH2在高、中、低分化的肝癌组织中表达水平差异显著, 进一步通过联合检测HSP70和GPC3 2个蛋白分子, 可用于不同分化程度的肝癌及高分化肝癌与增生性结节的鉴别诊断标记, 且具有较高的灵敏度和特异性.
在研究EZH2表达水平与肝癌预后的关系上, 得到了与在前列腺癌、乳腺癌等肿瘤中不同的结论. 在前列腺癌和乳腺癌中, EZH2的高表达水平与较差的临床预后显著相关[28,31], 而在肝癌研究中, Sudo等[7]发现尽管EZH2在肝癌组织高表达水平与癌细胞门静脉浸润显著相关, 且癌细胞门静脉浸润是临床预后不良重要因素之一, 但Kaplan-Meier生存曲线显示EZH2在肝癌的表达水平与临床预后并无明显相关性. Yonemitsu等[29]在研究EZH2与临床预后的关系时发现, 虽然EZH2的高表达水平与肝癌术后较高的复发率密切相关, 但EZH2表达水平与临床预后并无显著关系. 同时对另一个polycomb蛋白Bmi1的检测也发现, 尽管Bmi1在肝癌组织呈过度表达, 且可与EZH2协同作用参与肝癌的发生发展过程, 但Bmi1的表达水平与临床预后也无显著关系. 由于EZH2主要介导H3K27me3修饰, 因此Cai等[32]进一步检测了H3K27me3的修饰水平与肝癌及肝癌预后的关系, 结果发现H3K27me3的高修饰水平同EZH2一样与肝癌显著相关. 同时还发现, H3K27me3修饰水平与肝癌预后不良显著相关, 并可作为一个独立的分子指标用于肝癌预后分析.
大量数据表明[1,33], 肿瘤的发生与癌相关基因的异常表达调控密切相关, 从而导致细胞获得持续的生长信号和不受调控的增殖能力. 在前列腺癌、乳腺癌等其他肿瘤中研究证实, EZH2导致肿瘤发生发展主要与其影响细胞周期进程和H3K27me3修饰介导的抑癌基因失活有关[6,34,35]. 也有研究表明[36], 胞质分布的EZH2可通过不依赖于其组蛋白甲基转移酶活性的作用影响细胞骨架及F-actin的聚合, 从而在肿瘤侵袭转移过程中发挥作用. Chen等[37]利用蛋白双向电泳技术在肝癌细胞中检测了敲低EZH2表达后下游蛋白表达谱的变化, 发现了18个差异表达蛋白, 这些蛋白大多参与肿瘤的发生发展过程. 其中, 核糖体蛋白L10E在敲低EZH2的肝肿瘤细胞中表达水平显著上调, 且在MIHA细胞中外源表达L10E能够显著抑制EZH2对细胞促增殖作用. 癌相关蛋白stathmin 1是双向电泳鉴定的另一个蛋白, 在敲低EZH2的肝肿瘤细胞中表达水平显著下调. Chen等[27]发现, stathmin 1在EZH2促进细胞增殖中发挥重要作用, 其在肝肿瘤细胞的高表达能够拯救敲低EZH2对细胞增殖的抑制作用, 但是EZH2调控stathmin 1表达的具体机制目前尚不清楚. Kondo等[4]在肝癌组织中检测了孕激素受体(progesterone receptor, PGR)和雌激素受体a(estrogen receptor a, ERa)基因表达情况及其启动子区DNA甲基化水平, 结果发现PGR和ERa在肝癌组织中表达水平显著下调, 但其启动子区DNA甲基化水平与正常肝组织相比并无明显差异. 进一步在多种肝癌细胞系中检测发现, PGR和ERa启动子区主要结合H3K27me3蛋白, 利用组蛋白去乙酰化酶抑制剂TSA去除启动子区H3K27me3修饰能够显著恢复PGR和ERa表达水平, 表明在肝癌组织中EZH2介导的H3K27me3修饰在PGR和ERa表达水平下调中发挥重要作用.
近来研究还发现, EZH2在维持生物体昼夜节律上发挥重要作用. Etchegaray等[38]发现EZH2在体内可与昼夜节律调控复合物CLOCK-BMAL1结合, 并通过介导基因启动子区H3K27me3修饰调控昼夜节律相关蛋白PER1和PER2的表达. 改变EZH2在细胞的表达水平将会影响到细胞正常昼夜节律的运转过程. 有研究表明[39,40], 调控昼夜节律的相关基因表达紊乱将可能会导致疾病的发生. Lin等[41]比较了肝癌组织与正常组织中9个昼夜节律相关基因的表达水平差异, 结果发现在肝癌组织中PER1、PER2、PER3、CRY2和TIM的表达水平显著降低, 且与肿瘤的大小和分级密切相关. 进一步检测发现, 这些基因在肝癌组织中并未发现遗传学上的缺失或突变, 而是以表观遗传学的机制诱导基因沉默. EZH2在肝组织中的异常表达, 进而导致肝脏昼夜节律生物钟调控紊乱, 可能是导致肝癌发生的原因之一.
EZH2不仅可通过调控癌相关基因表达直接导致肝癌的发生, 近来发现在肝纤维化过程中也发挥重要作用[42]. 在各种刺激因子的作用下, 甲基化CpG结合蛋白2(methyl CpG binding protein 2, MeCP2)上调肝星状细胞中EZH2的表达水平, 进而通过介导H3K27me3修饰抑制过氧化物酶增殖体激活受体g(peroxisome proliferator-activated receptor g, PPARg)表达, 诱导肝星状细胞向成肌纤维细胞转化[42,43]. 肝纤维化是一切慢性肝病发展至肝硬化甚至肝癌的必经途径, 因此EZH2在肝癌发生早期过程中也发挥间接作用.
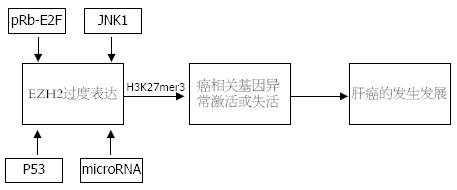
多项研究表明[7,8,29], EZH2在肝癌细胞中高水平表达, 进而通过介导H3K27me3修饰调控下游基因异常表达, 从而导致肿瘤的发生. 但是, 在肝癌细胞中调控EZH2过度表达的机制目前尚不十分清楚, 可能主要与EZH2的正向调控途径的激活和负向调控途径的失活有关. Bracken等[44]发现, EZH2处于pRb-E2F信号途径下游, 并受转录因子E2Fs的直接调控. Chang等[45]发现, JNK1激酶在肝癌细胞中的持续激活能够诱导EZH2表达及其介导的H3K27me3修饰. 因此, 在肝癌中常常发现多种原因导致的pRb-E2F途径和JNK1途径激活, 可能是EZH2在肝癌中过度表达的原因之一. 另有一些研究表明, 抑癌基因P53[46]和microRNA-101[47]在负性调控EZH2表达中发挥重要作用, 在肝癌发生过程中常常伴随p53基因突变或功能丧失[48], Su等[49]还发现在肝癌组织中microRNA-101表达水平显著低于正常组织, 这可能是EZH2在肝癌中过度表达的另一原因.
在肝癌的发生发展过程中, 多种癌相关基因的异常激活或失活, 是导致肝癌多阶段进展的重要原因[1,48,50]. 组蛋白甲基转移酶EZH2可通过多种机制在肝癌发生过程中过度表达, 进而通过介导H3K27me3修饰调控下游基因异常表达, 在肿瘤发生发展过程中发挥重要作用[6](图1). EZH2通过组蛋白修饰机制调控下游基因表达, 并不涉及基因组遗传学上的变化, 因此开发针对EZH2的特异性抑制剂可能用于逆转EZH2介导的肿瘤发生发展过程. 同时也应注意到, 在EZH2的功能研究中, EZH2复杂的调控模式尤其与DNA甲基化和组蛋白其他修饰的相互作用对下游基因表达的影响, 以及与肝癌发生发展的关系仍需进一步研究.
肝癌的发生发展与多种癌基因的激活和抑癌基因的失活密切相关. 组蛋白甲基化酶EZH2在多种机制调解下在肝癌组织中过度表达, 从而参与肝癌发生发展的多个过程. 了解更多EZH2与肝癌发生的关系及其分子机制, 将对开发针对EZH2的特异性药物用于肝癌治疗具有重要价值.
黄志勇, 教授, 华中科技大学同济医院普外科; 王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科
表观遗传学机制异常在肿瘤发生发展中的作用目前已成为肿瘤发生机制的研究热点, 同时从表观遗传学机制角度开发肿瘤治疗药物已逐渐成为药物研发的重要方向. 目前已有DNA甲基化酶抑制剂5'-aza-2'dC, 组蛋白去乙酰化酶抑制剂TSA和组蛋白甲基化酶抑制剂DZNep等用于肿瘤治疗的研究.
Cai等利用免疫组织化学方法对不同分化程度的肝癌组织检测发现, EZH2在高、中、低分化的肝癌组织中表达水平差异显著, 进一步通过联合检测HSP70和GPC3两个蛋白分子, 可用于不同分化程度的肝癌及高分化肝癌与增生性结节的鉴别诊断标记, 且具有较高的灵敏度和特异性.
本文创新性地综述了组蛋白甲基化酶EZH2近年来在肝癌发生发展中的研究进展, 着重介绍了EZH2导致肝癌发生的多种作用机制, 为基础研究和临床治疗提供了新的思路.
EZH2通过组蛋白修饰机制调控下游基因表达, 并不涉及基因组遗传学上的变化, 因此开发针对EZH2的特异性抑制剂可能用于逆转EZH2介导的肿瘤发生发展过程.
该文语言简练准确, 内容反映该领域的最新进展, 具有一定的科学和参考价值.
编辑: 李军亮 电编:何基才
| 1. | Aravalli RN, Steer CJ, Cressman EN. Molecular mechanisms of hepatocellular carcinoma. Hepatology. 2008;48:2047-2063. [PubMed] [DOI] |
| 2. | Moribe T, Iizuka N, Miura T, Kimura N, Tamatsukuri S, Ishitsuka H, Hamamoto Y, Sakamoto K, Tamesa T, Oka M. Methylation of multiple genes as molecular markers for diagnosis of a small, well-differentiated hepatocellular carcinoma. Int J Cancer. 2009;125:388-397. [PubMed] [DOI] |
| 3. | Bai X, Wu L, Liang T, Liu Z, Li J, Li D, Xie H, Yin S, Yu J, Lin Q. Overexpression of myocyte enhancer factor 2 and histone hyperacetylation in hepatocellular carcinoma. J Cancer Res Clin Oncol. 2008;134:83-91. [PubMed] [DOI] |
| 4. | Kondo Y, Shen L, Suzuki S, Kurokawa T, Masuko K, Tanaka Y, Kato H, Mizuno Y, Yokoe M, Sugauchi F. Alterations of DNA methylation and histone modifications contribute to gene silencing in hepatocellular carcinomas. Hepatol Res. 2007;37:974-983. [PubMed] [DOI] |
| 5. | Cao R, Zhang Y. The functions of E(Z)/EZH2-mediated methylation of lysine 27 in histone H3. Curr Opin Genet Dev. 2004;14:155-164. [PubMed] [DOI] |
| 6. | Simon JA, Lange CA. Roles of the EZH2 histone methyltransferase in cancer epigenetics. Mutat Res. 2008;647:21-29. [PubMed] [DOI] |
| 7. | Sudo T, Utsunomiya T, Mimori K, Nagahara H, Ogawa K, Inoue H, Wakiyama S, Fujita H, Shirouzu K, Mori M. Clinicopathological significance of EZH2 mRNA expression in patients with hepatocellular carcinoma. Br J Cancer. 2005;92:1754-1758. [PubMed] [DOI] |
| 8. | Sasaki M, Ikeda H, Itatsu K, Yamaguchi J, Sawada S, Minato H, Ohta T, Nakanuma Y. The overexpression of polycomb group proteins Bmi1 and EZH2 is associated with the progression and aggressive biological behavior of hepatocellular carcinoma. Lab Invest. 2008;88:873-882. [PubMed] [DOI] |
| 9. | Hansen KH, Bracken AP, Pasini D, Dietrich N, Gehani SS, Monrad A, Rappsilber J, Lerdrup M, Helin K. A model for transmission of the H3K27me3 epigenetic mark. Nat Cell Biol. 2008;10:1291-1300. [PubMed] [DOI] |
| 10. | Hobert O, Jallal B, Ullrich A. Interaction of Vav with ENX-1, a putative transcriptional regulator of homeobox gene expression. Mol Cell Biol. 1996;16:3066-3073. [PubMed] |
| 11. | Chen H, Rossier C, Antonarakis SE. Cloning of a human homolog of the Drosophila enhancer of zeste gene (EZH2) that maps to chromosome 21q22.2. Genomics. 1996;38:30-37. [PubMed] [DOI] |
| 12. | Cardoso C, Mignon C, Hetet G, Grandchamps B, Fontes M, Colleaux L. The human EZH2 gene: genomic organisation and revised mapping in 7q35 within the critical region for malignant myeloid disorders. Eur J Hum Genet. 2000;8:174-180. [PubMed] [DOI] |
| 13. | Laible G, Wolf A, Dorn R, Reuter G, Nislow C, Lebersorger A, Popkin D, Pillus L, Jenuwein T. Mammalian homologues of the Polycomb-group gene Enhancer of zeste mediate gene silencing in Drosophila heterochromatin and at S. cerevisiae telomeres. EMBO J. 1997;16:3219-3232. [PubMed] [DOI] |
| 14. | Han Z, Xing X, Hu M, Zhang Y, Liu P, Chai J. Structural basis of EZH2 recognition by EED. Structure. 2007;15:1306-1315. [PubMed] [DOI] |
| 15. | Qian C, Zhou MM. SET domain protein lysine methyltransferases: Structure, specificity and catalysis. Cell Mol Life Sci. 2006;63:2755-2763. [PubMed] [DOI] |
| 16. | Cao R, Zhang Y. SUZ12 is required for both the histone methyltransferase activity and the silencing function of the EED-EZH2 complex. Mol Cell. 2004;15:57-67. [PubMed] [DOI] |
| 17. | Cao R, Wang H, He J, Erdjument-Bromage H, Tempst P, Zhang Y. Role of hPHF1 in H3K27 methylation and Hox gene silencing. Mol Cell Biol. 2008;28:1862-1872. [PubMed] [DOI] |
| 18. | Simon JA, Kingston RE. Mechanisms of polycomb gene silencing: knowns and unknowns. Nat Rev Mol Cell Biol. 2009;10:697-708. [PubMed] |
| 19. | Li G, Margueron R, Ku M, Chambon P, Bernstein BE, Reinberg D. Jarid2 and PRC2, partners in regulating gene expression. Genes Dev. 2010;24:368-380. [PubMed] [DOI] |
| 20. | Peng JC, Valouev A, Swigut T, Zhang J, Zhao Y, Sidow A, Wysocka J. Jarid2/Jumonji coordinates control of PRC2 enzymatic activity and target gene occupancy in pluripotent cells. Cell. 2009;139:1290-1302. [PubMed] [DOI] |
| 21. | Schoeftner S, Sengupta AK, Kubicek S, Mechtler K, Spahn L, Koseki H, Jenuwein T, Wutz A. Recruitment of PRC1 function at the initiation of X inactivation independent of PRC2 and silencing. EMBO J. 2006;25:3110-3122. [PubMed] [DOI] |
| 22. | Erhardt S, Su IH, Schneider R, Barton S, Bannister AJ, Perez-Burgos L, Jenuwein T, Kouzarides T, Tarakhovsky A, Surani MA. Consequences of the depletion of zygotic and embryonic enhancer of zeste 2 during preimplantation mouse development. Development. 2003;130:4235-4248. [PubMed] [DOI] |
| 23. | Viré E, Brenner C, Deplus R, Blanchon L, Fraga M, Didelot C, Morey L, Van Eynde A, Bernard D, Vanderwinden JM. The Polycomb group protein EZH2 directly controls DNA methylation. Nature. 2006;439:871-874. [PubMed] [DOI] |
| 24. | Schlesinger Y, Straussman R, Keshet I, Farkash S, Hecht M, Zimmerman J, Eden E, Yakhini Z, Ben-Shushan E, Reubinoff BE. Polycomb-mediated methylation on Lys27 of histone H3 pre-marks genes for de novo methylation in cancer. Nat Genet. 2007;39:232-236. [PubMed] [DOI] |
| 25. | van der Vlag J, Otte AP. Transcriptional repression mediated by the human polycomb-group protein EED involves histone deacetylation. Nat Genet. 1999;23:474-478. [PubMed] [DOI] |
| 26. | Garrick D, De Gobbi M, Samara V, Rugless M, Holland M, Ayyub H, Lower K, Sloane-Stanley J, Gray N, Koch C. The role of the polycomb complex in silencing alpha-globin gene expression in nonerythroid cells. Blood. 2008;112:3889-3899. [PubMed] [DOI] |
| 27. | Chen Y, Lin MC, Yao H, Wang H, Zhang AQ, Yu J, Hui CK, Lau GK, He ML, Sung J. Lentivirus-mediated RNA interference targeting enhancer of zeste homolog 2 inhibits hepatocellular carcinoma growth through down-regulation of stathmin. Hepatology. 2007;46:200-208. [PubMed] [DOI] |
| 28. | Varambally S, Dhanasekaran SM, Zhou M, Barrette TR, Kumar-Sinha C, Sanda MG, Ghosh D, Pienta KJ, Sewalt RG, Otte AP. The polycomb group protein EZH2 is involved in progression of prostate cancer. Nature. 2002;419:624-629. [PubMed] [DOI] |
| 29. | Yonemitsu Y, Imazeki F, Chiba T, Fukai K, Nagai Y, Miyagi S, Arai M, Aoki R, Miyazaki M, Nakatani Y. Distinct expression of polycomb group proteins EZH2 and BMI1 in hepatocellular carcinoma. Hum Pathol. 2009;40:1304-1311. [PubMed] [DOI] |
| 30. | Cai MY, Tong ZT, Zheng F, Liao YJ, Wang Y, Rao HL, Chen YC, Wu QL, Liu YH, Guan XY. EZH2 protein: a promising immunomarker for the detection of hepatocellular carcinomas in liver needle biopsies. Gut. 2011;60:967-976. [PubMed] [DOI] |
| 31. | Kleer CG, Cao Q, Varambally S, Shen R, Ota I, Tomlins SA, Ghosh D, Sewalt RG, Otte AP, Hayes DF. EZH2 is a marker of aggressive breast cancer and promotes neoplastic transformation of breast epithelial cells. Proc Natl Acad Sci U S A. 2003;100:11606-11611. [PubMed] [DOI] |
| 32. | Cai MY, Hou JH, Rao HL, Luo RZ, Li M, Pei XQ, Lin MC, Guan XY, Kung HF, Zeng YX. High expression of H3K27me3 in human hepatocellular carcinomas correlates closely with vascular invasion and predicts worse prognosis in patients. Mol Med. 2011;17:12-20. [PubMed] |
| 33. | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144:646-674. [PubMed] [DOI] |
| 34. | Sellers WR, Loda M. The EZH2 polycomb transcriptional repressor--a marker or mover of metastatic prostate cancer? Cancer Cell. 2002;2:349-350. [PubMed] [DOI] |
| 35. | Zeidler M, Kleer CG. The Polycomb group protein Enhancer of Zeste 2: its links to DNA repair and breast cancer. J Mol Histol. 2006;37:219-223. [PubMed] [DOI] |
| 36. | Bryant RJ, Winder SJ, Cross SS, Hamdy FC, Cunliffe VT. The Polycomb Group protein EZH2 regulates actin polymerization in human prostate cancer cells. Prostate. 2008;68:255-263. [PubMed] [DOI] |
| 37. | Chen Y, Lin MC, Wang H, Chan CY, Jiang L, Ngai SM, Yu J, He ML, Shaw PC, Yew DT. Proteomic analysis of EZH2 downstream target proteins in hepatocellular carcinoma. Proteomics. 2007;7:3097-3104. [PubMed] [DOI] |
| 38. | Etchegaray JP, Yang X, DeBruyne JP, Peters AH, Weaver DR, Jenuwein T, Reppert SM. The polycomb group protein EZH2 is required for mammalian circadian clock function. J Biol Chem. 2006;281:21209-21215. [PubMed] [DOI] |
| 39. | Toh KL. Basic science review on circadian rhythm biology and circadian sleep disorders. Ann Acad Med Singapore. 2008;37:662-668. [PubMed] |
| 40. | Feng D, Liu T, Sun Z, Bugge A, Mullican SE, Alenghat T, Liu XS, Lazar MA. A circadian rhythm orchestrated by histone deacetylase 3 controls hepatic lipid metabolism. Science. 2011;331:1315-1319. [PubMed] [DOI] |
| 41. | Lin YM, Chang JH, Yeh KT, Yang MY, Liu TC, Lin SF, Su WW, Chang JG. Disturbance of circadian gene expression in hepatocellular carcinoma. Mol Carcinog. 2008;925-933. [PubMed] [DOI] |
| 42. | Mann J, Chu DC, Maxwell A, Oakley F, Zhu NL, Tsukamoto H, Mann DA. MeCP2 controls an epigenetic pathway that promotes myofibroblast transdifferentiation and fibrosis. Gastroenterology. 2010;138:705-714, 714.e1-e4. [PubMed] |
| 43. | Matarazzo MR, De Bonis ML, Strazzullo M, Cerase A, Ferraro M, Vastarelli P, Ballestar E, Esteller M, Kudo S, D'Esposito M. Multiple binding of methyl-CpG and polycomb proteins in long-term gene silencing events. J Cell Physiol. 2007;210:711-719. [PubMed] [DOI] |
| 44. | Bracken AP, Pasini D, Capra M, Prosperini E, Colli E, Helin K. EZH2 is downstream of the pRB-E2F pathway, essential for proliferation and amplified in cancer. EMBO J. 2003;22:5323-5335. [PubMed] [DOI] |
| 45. | Chang Q, Zhang Y, Beezhold KJ, Bhatia D, Zhao H, Chen J, Castranova V, Shi X, Chen F. Sustained JNK1 activation is associated with altered histone H3 methylations in human liver cancer. J Hepatol. 2009;50:323-333. [PubMed] [DOI] |
| 46. | Tang X, Milyavsky M, Shats I, Erez N, Goldfinger N, Rotter V. Activated p53 suppresses the histone methyltransferase EZH2 gene. Oncogene. 2004;23:5759-5769. [PubMed] [DOI] |
| 47. | Varambally S, Cao Q, Mani RS, Shankar S, Wang X, Ateeq B, Laxman B, Cao X, Jing X, Ramnarayanan K. Genomic loss of microRNA-101 leads to overexpression of histone methyltransferase EZH2 in cancer. Science. 2008;322:1695-1699. [PubMed] [DOI] |
| 48. | Hussain SP, Schwank J, Staib F, Wang XW, Harris CC. TP53 mutations and hepatocellular carcinoma: insights into the etiology and pathogenesis of liver cancer. Oncogene. 2007;26:2166-2176. [PubMed] [DOI] |
| 49. | Su H, Yang JR, Xu T, Huang J, Xu L, Yuan Y, Zhuang SM. MicroRNA-101, down-regulated in hepatocellular carcinoma, promotes apoptosis and suppresses tumorigenicity. Cancer Res. 2009;69:1135-1142. [PubMed] [DOI] |
| 50. | Cornellà H, Alsinet C, Villanueva A. Molecular pathogenesis of hepatocellular carcinoma. Alcohol Clin Exp Res. 2011;35:821-825. [PubMed] [DOI] |