修回日期: 2010-11-26
接受日期: 2010-12-01
在线出版日期: 2011-01-28
目的: 探讨三叶因子2(TFF2)、血管内皮生长因子(VEGF)和微血管密度(MVD)在胃癌发生、发展、浸润和转移中的作用.
方法: 选取广西医科大学第一附属医院2008- 01/2009-06接受胃大部切除术的胃癌标本50例, 采用SP免疫组织化学方法检测30例正常胃黏膜组织、50例癌旁组织和50例胃癌组织中TFF2、VEGF和MVD的表达情况.
结果: 正常胃黏膜组织→癌旁组织→胃癌组织中, TFF2表达呈逐渐减弱趋势(165.80±16.42, 184.44±19.02, 206.79±17.62, 均P<0.01), TFF2的表达与肿瘤的分化程度和淋巴结转移有关(均P<0.01), 而VEGF的表达和MVD值呈逐渐上升趋势(36.7%, 42.0%, 72.6%; 26.35±4.54, 30.78±5.64, 40.13±6.92, 均P<0.01), 两者表达与肿瘤的分化程度、浸润深度和淋巴结转移有关(均P<0.01). TFF2与MVD的表达呈负相关(r = -0.781, P<0.01).
结论: TFF2作为一种胃癌的抑制因子, 在胃癌发展过程中表达逐渐减弱, 对胃癌的抑制作用降低, 同时一些促进肿瘤浸润转移的因子如VEGF、MVD表达水平逐渐增强, 促进了肿瘤的发展转移.
引文著录: 石磊, 赖铭裕, 梁志海, 刘诗权, 黄杰安, 唐国都, 姜海行. TFF2在胃癌、癌旁及正常胃黏膜组织中的表达及其与血管生成的关系. 世界华人消化杂志 2011; 19(3): 246-250
Revised: November 26, 2010
Accepted: December 1, 2010
Published online: January 28, 2011
AIM: To investigate the correlation among the expression of trefoil factor 2 (TFF2) and vascular endothelial growth factor (VEGF) and microvessel density (MVD) in gastric carcinoma.
METHODS: The expression of TFF2 and VEGF and MVD were determined by immunohistochemistry in 50 gastric carcinoma specimens, 50 tumor-adjacent gastric mucosal specimens, and 30 normal gastric mucosa specimens.
RESULTS: The expression level of TFF2 was highest in normal gastric mucosa, followed by tumor-adjacent gastric mucosa and gastric carcinoma (165.80 ± 16.42, 184.44 ± 19.02, 206.79 ± 17.62, all P < 0.01). The expression of TFF2 in gastric cancer was significantly associated with the degree of tumor differentiation and lymph node metastasis (both P < 0.01). The expression level of VEGF and MVD were lowest in normal gastric mucosa, followed by tumor-adjacent gastric mucosa and gastric carcinoma (36.7%, 42.0%, 72.6%; 26.35 ± 4.54, 30.78 ± 5.64, 40.13 ± 6.92, all P < 0.01). The expression of VEGF and MVD in gastric cancer were associated with tumor differentiation, invasion and lymph node metastasis (all P < 0.01). There is a negative correlation between the expression of TFF2 and MVD (r = -0.781, P < 0.01).
CONCLUSION: TFF2 may be a negative regulatory factor of gastric carcinogenesis. The expression of TFF2 is down-regulated during the development of gastric cancer, while that of VEGF and MVD are up-regulated during this process.
- Citation: Shi L, Lai MY, Liang ZH, Liu SQ, Huang JA, Tang GD, Jiang HX. Correlation between TFF 2 expression and tumor angiogenesis in gastric carcinoma, adjacent carcinoma and normal gastric mucosa. Shijie Huaren Xiaohua Zazhi 2011; 19(3): 246-250
- URL: https://www.wjgnet.com/1009-3079/full/v19/i3/246.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i3.246
近年来, 关于胃癌发病机制的研究中, 三叶因子(trefoil factor, TFF)与胃癌的发生、发展逐渐引起关注. TFF2是TFF家族之一, TFF2作为TFF家族中唯一具有两个三叶型结构域(P-结构域), 这种结构的稳定性使其具有明显的抗酸、抗蛋白酶和抗热分解特性, 对胃肠道黏膜有保护和修复作用. TFF2与胃癌之间的关系尚不十分明确, 因此, 我们用免疫组织化学方法研究TFF2、血管内皮生长因子(vascular endothelial growth factor, VEGF)和微血管密度(microvessel density, MVD)在正常胃黏膜组织、癌旁组织和胃癌组织的表达情况及其与各临床病理特征的关系, 初步探讨其在胃癌发生发展中的作用.
选取广西医科大学第一附属医院2008- 01/2009-06接受胃大部切除术的胃癌标本50例, 均经组织病理学检查证实. 所有标本术前均未接受非甾体抗炎药治疗及放化疗. 男32例, 女18例, 年龄31-76(中位年龄54.7)岁. 其中高分化、中分化腺癌14例, 低未分化腺癌36例; 未侵及浆膜层者18例, 侵及浆膜层及浆膜外者32例; 发生局部淋巴结转移者30例, 无局部淋巴结转移者20例. 同时取距癌缘3-5 cm的癌旁组织50例, 正常胃黏膜组织30例作为对照组. 试剂采用鼠抗人TFF2单克隆抗体(工作浓度1∶100), 购自美国Abcam公司, 链霉菌抗生素蛋白-生物素-过氧化物酶(SP)免疫组织化学试剂盒、二氨基联苯(DAB)显色剂、鼠抗人VEGF单克隆抗体和鼠抗人CD34单克隆抗体均购自福建迈新生物技术开发公司.
所有标本均经40 g/L甲醛固定, 常规脱水、透明、渗蜡、包埋, 4 μm厚连续切片. 常规脱蜡、水化, 采用免疫组织化染色超敏两步法(SP染色), DAB显色, 苏木素复染, 吹干, 具体操作按SP试剂盒说明书进行. 阴性对照采用生理盐水磷酸盐缓冲液(PBS)代替一抗, 以已知阳性病例作阳性对照. 操作严格按产品说明书进行. 评判标准: (1)TFF2: 阳性信号为细胞胞质和胞膜上出现黄色或棕黄色染色. 每例取5个高倍视野(×400), 用病理图像分析仪测定阳性信号平均灰度值, 灰度值越高, TFF2表达越弱; (2)VEGF: 阳性信号为细胞胞质和胞膜上出现黄色或棕黄色染色, 每张切片中看到有>5%的肿瘤细胞胞质或胞膜染色阳性, 即判定为VEGF阳性; (3)MVD: 被染成棕色的血管内皮细胞或血管内皮细胞簇均作为一个血管计数. 每例先在低倍镜(×100)下观察全片以确定肿瘤内血管密度最高处, 再在中倍镜(×200)下记录5个视野内的微血管数, 取其平均值作为该病例的MVD值.
统计学处理 使用统计学软件SPSS13.0进行分析, 计量资料采用mean±SD来表示, 组间均数比较采用单因素方差分析和SNK法检验, 计数资料比较采用χ2检验, 等级相关性采用Spearman等级相关分析, P<0.05为差异具有统计学意义.
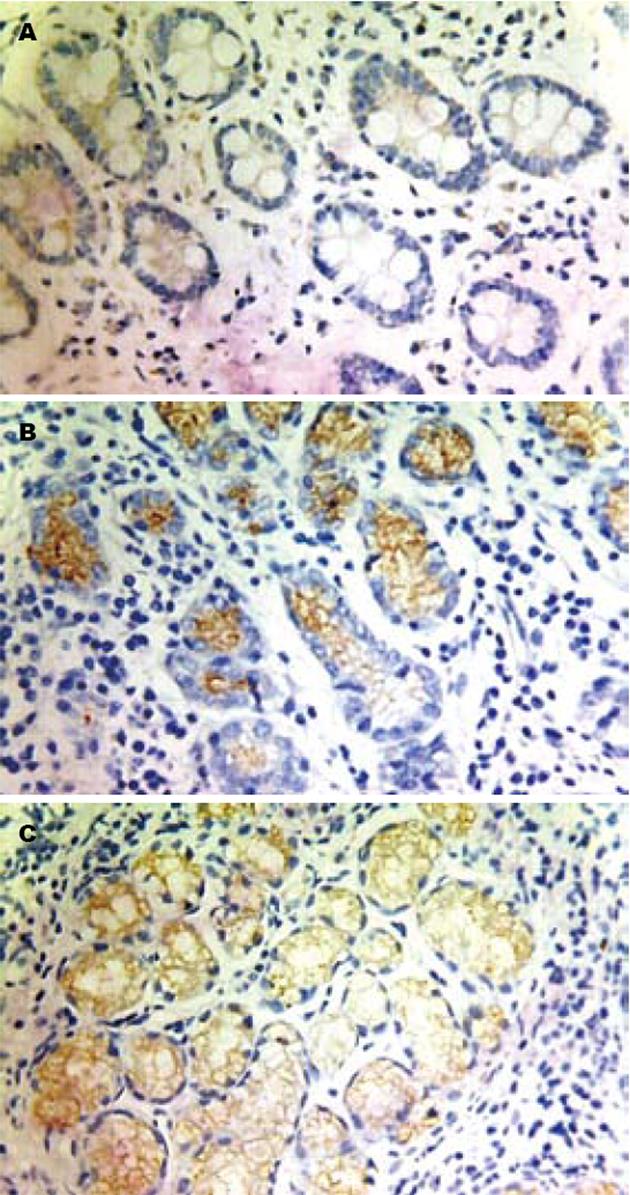
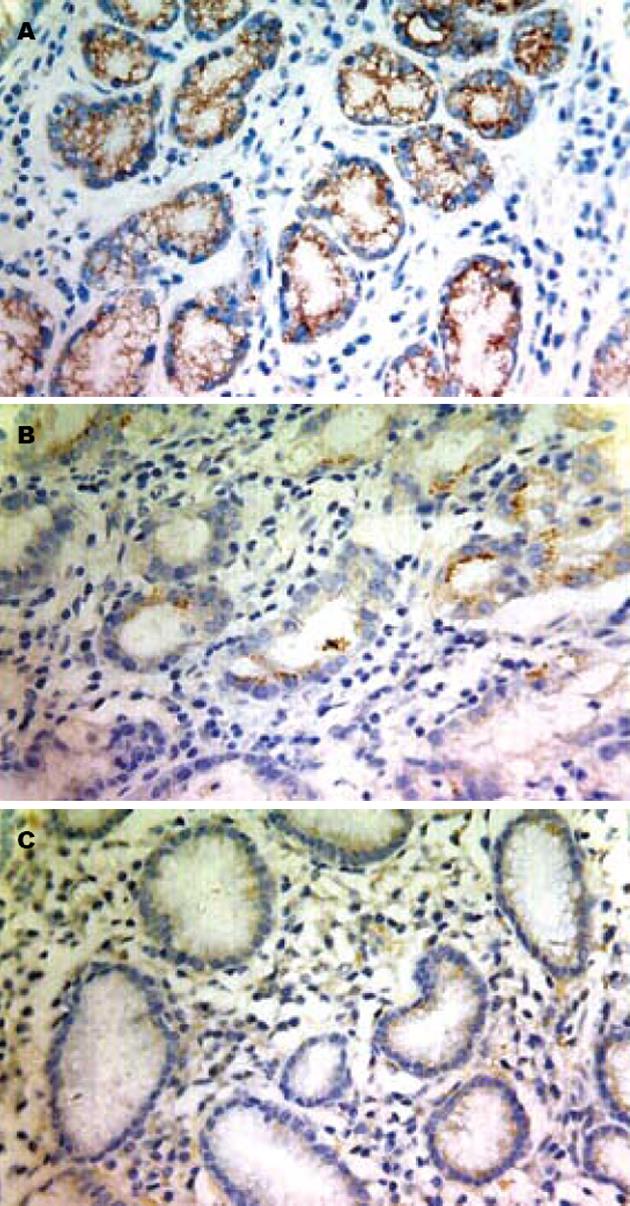
TFF2在正常胃黏膜组织、癌旁组织和胃癌组织中的阳性信号平均灰度值分别为165.80±16.42, 184.44±19.02和206.79±17.62, 各组间两两比较, 差异均有统计学意义(P<0.01); VEGF在正常胃黏膜组织、癌旁组织和胃癌组织中的阳性表达率分别为36.7%(11/30), 42.0%(21/50)和72.6%(36/50), 各组间两两比较, 差异均有统计学意义(P<0.01, 图1, 2).
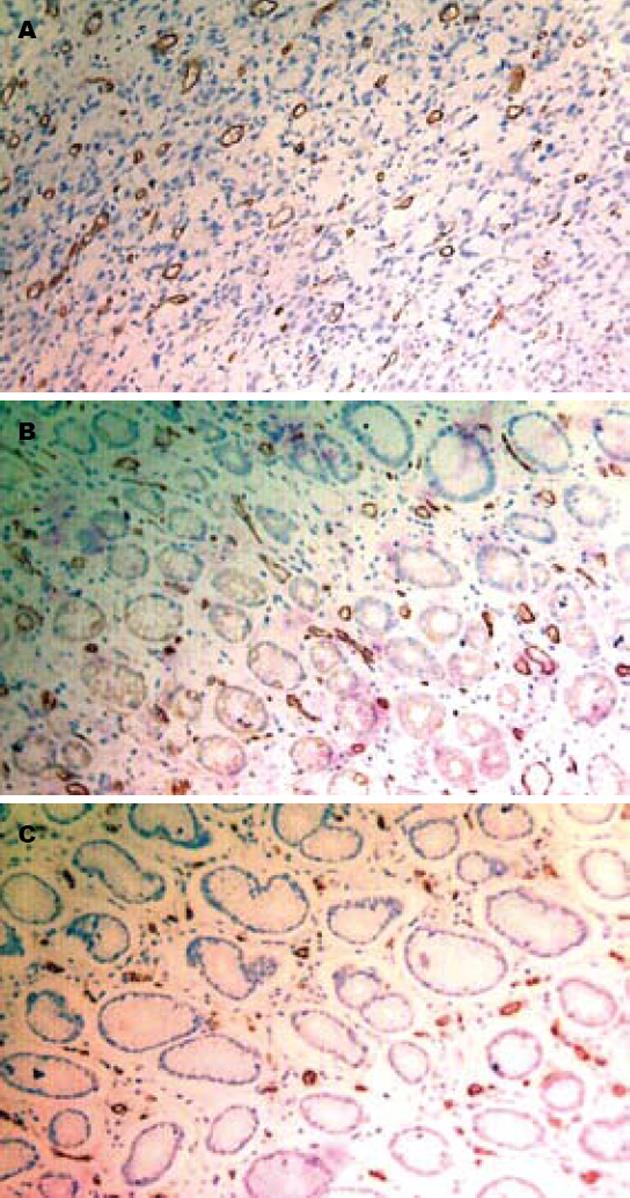
MVD在胃癌组织、癌旁组织和正常胃黏膜组织中的平均值分别为40.13±6.92, 30.78±5.64和26.35±4.54, 差异均有统计学意义(P<0.01, 图3).
TFF2的表达与胃癌的分化程度和淋巴结转移有关(P<0.01), 而VEGF的表达和MVD值呈逐渐上升趋势(P<0.01), TFF2的表达与患者的性别、年龄、胃癌的浸润程度无关. VEGF和MVD表达还与胃癌浸润深度程度有关(P<0.01, 表1).
| 临床病理特征 | n | TFF2(mean±SD) | VEGF阳性率%(n) | MVD(mean±SD) |
| 性别 | ||||
| 男 | 32 | 206.27±18.32 | 71.9(23) | 40.25±7.46 |
| 女 | 18 | 207.71±13.58 | 77.8(14) | 39.92±5.78 |
| 年龄(岁) | ||||
| ≥55 | 29 | 206.39±17.30 | 75.9(22) | 39.93±7.25 |
| <55 | 21 | 207.34±17.93 | 66.7(14) | 40.41±6.32 |
| 分化程度 | ||||
| 高中分化 | 14 | 197.63±15.52 | 42.9(6) | 35.57±6.82 |
| 低未分化 | 36 | 210.35±16.47b | 80.5(29)b | 41.90±7.27b |
| 浆膜浸润 | ||||
| 有 | 32 | 207.45±15.78 | 84.4(27)d | 41.75±7.36d |
| 无 | 18 | 205.62±12.09 | 44.4(8) | 37.25±6.19 |
| 淋巴结转移 | ||||
| 有 | 32 | 211.47±14.89f | 84.5(27)f | 41.26±6.80e |
| 无 | 18 | 198.47±14.43 | 55.6(8) | 38.12±6.46 |
TFF2在VEGF阳性表达组和阴性表达组中的阳性信号平均灰度值分别为211.34±17.29和198.09±12.16(P<0.01); VEGF阳性表达组和阴性表达组中MVD平均值分别为42.28±7.08和35.49±2.32, VEGF阳性表达组的MVD值高于阴性表达组中的MVD值(P<0.01); FF2与MVD的表达呈负相关(r = -0.781, P<0.01).
20世纪80年代发现TFF家族, 家族成员包括TFF1、TFF2及TFF3. TFF2是TFF家族中的重要成员, TFF2 在胃、十二指肠特异性表达, 主要由胃体颈黏液细胞、胃窦和幽门腺基底细胞和十二指肠布伦纳氏腺合成及分泌[1]. 已有大量研究发现TFF2对胃肠道有上皮保护和促进破损黏膜愈合的功能[2,3]. 还有研究发现TFF2蛋白有助于从损伤胃肠黏膜保护, 稳定黏液凝胶, 刺激上皮恢复原状, 并抑制相关炎症[4,5]. Shi等[6]研究发现TFF2在低分化胃癌组织中的表达均低于高分化胃癌, Dhar等[7]研究发现TFF2在有肿瘤浸润以及已出现淋巴结和血行转移患者中的表达明显增高. Yamachika等[8]则认为TFF2有抑制细胞黏附, 促进癌细胞侵袭, 阻断细胞凋亡的作用, 提出TFF可作为胃癌预后不良的标志物. 本研究结果显示, 正常胃黏膜组织→癌旁组织→胃癌组织中, TFF2表达呈逐渐减弱趋势(P<0.01), TFF2的表达与胃癌的分化程度和淋巴结转移有关(P<0.01).
VEGF是1989年Ferrara等[9]从牛垂体滤泡星状细胞培养液首先纯化出来, 并发现具有促进血管内皮细胞有丝分裂的活性. VEGF被认为是肿瘤血管形成中最关键的驱动因子[10], 与微血管的形成密切相关, 而微血管的生成是直接影响胃癌浸润、转移和预后的重要因素. VEGF通过与细胞膜上的相应VEGF结合而发挥作用. 血管内皮生长因子受体(KDR)作为的一种表面受体, 与VEGF结合后可上调VEGF表达, 诱导肿瘤血管形成. VEGF直接刺激KDR阳性表达的肿瘤细胞, 提示在促进肿瘤生长和转移过程中起重要作用[11]. Lazăr等[12]则对高表达VEGF的胃癌组织进行了MVD检测, 结果显示MVD与VEGF之间存在明显正相关性.
血管生成是肿瘤细胞适应局部缺氧环境而发生的, 缺氧导致新生血管形成基因的表达, 是肿瘤生长和扩散的必要条件. 近年来有研究发现TFF家族成员TFF3可促进鸡胚绒毛尿囊膜的血管生成, 诱导人脐静脉内皮细胞形成类微血管结构, 提示其在血管生成中的作用[13], 我们以前的研究发现TFF1在胃癌发生发展过程中并未促进新生血管的生成[14].
目前有关TFF2和胃癌新生血管生成的研究较少, 本研究观察到在正常胃黏膜组织→癌旁组织→胃癌组织中, TFF2表达呈逐渐减弱趋势(P<0.01), 而VEGF、MVD表达率呈逐渐上升趋势(P<0.01); TFF2的表达与肿瘤的分化程度和淋巴结转移有关(P<0.01), 而VEGF的表达和MVD呈逐渐上升趋势(P<0.01), 两者表达与肿瘤的分化程度、浸润深度(P<0.01)和淋巴结转移有关(P<0.05). TFF2与MVD的表达呈负相关(r = -0.781, P<0.01). 可认为在TFF2作为一种可能的胃癌特异性抑制因子, 其在胃癌发生发展过程中的表达逐渐减弱, 对胃癌的抑制作用降低, 同时一些促进肿瘤浸润转移的因子如VEGF、MVD表达水平逐渐增强, 促进了肿瘤的发展转移. TFF2在胃癌发生、发展中的作用及调控机制, 需要进一步研究.
血管生成是肿瘤生长和扩散的必要条件, VEGF被认为是肿瘤血管形成中最关键的驱动因子. 国外研究发现TFF1、TFF3具有同VEGF的血管生成作用, 但TFF2作为胃癌的一个抑制因子, 在胃癌的发生、发展过程中与血管生成的关系尚未阐明.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
Shi等研究发现TFF2在低分化胃癌组织中的表达均低于高分化胃癌, Dhar等研究发现TFF2在有肿瘤浸润以及已出现淋巴结和血行转移患者中的表达明显增高.
本实验联合检测胃癌组织的TFF2、VEGF及MVD有助于了解TFF2在胃癌发病机制中的作用途径, 了解他与其他指标的相互关系,以及各观察指标在胃癌发病机制中各自的地位.
本课题采用免疫组织化学技术对TFF2、VEGF及MVD在不同胃黏膜病变中的表达进行了检测分析, 结果提示TFF2在胃癌演进过程中起重要作用, 为胃癌的防治提供理论依据.
本文学术性较好, 对于探讨胃癌的发生机制及其转归有一定的参考价值.
编辑: 李薇 电编:何基才
| 1. | Katoh M. Trefoil factors and human gastric cancer (review). Int J Mol Med. 2003;12:3-9. [PubMed] |
| 2. | Cook GA, Thim L, Yeomans ND, Giraud AS. Oral human spasmolytic polypeptide protects against aspirin-induced gastric injury in rats. J Gastroenterol Hepatol. 1998;13:363-370. [PubMed] [DOI] |
| 3. | Leung WK, Yu J, Chan FK, To KF, Chan MW, Ebert MP, Ng EK, Chung SC, Malfertheiner P, Sung JJ. Expression of trefoil peptides (TFF1, TFF2, and TFF3) in gastric carcinomas, intestinal metaplasia, and non-neoplastic gastric tissues. J Pathol. 2002;197:582-588. [PubMed] [DOI] |
| 4. | Dubeykovskaya Z, Dubeykovskiy A, Solal-Cohen J, Wang TC. Secreted trefoil factor 2 activates the CXCR4 receptor in epithelial and lymphocytic cancer cell lines. J Biol Chem. 2009;284:3650-3662. [PubMed] [DOI] |
| 5. | Chi AL, Lim S, Wang TC. Characterization of a CCAAT-enhancer element of trefoil factor family 2 (TFF2) promoter in MCF-7 cells. Peptides. 2004;25:839-847. [PubMed] [DOI] |
| 6. | Shi SQ, Cai JT, Yang JM. Expression of trefoil factors 1 and 2 in precancerous condition and gastric cancer. World J Gastroenterol. 2006;12:3119-3122. [PubMed] |
| 7. | Dhar DK, Wang TC, Maruyama R, Udagawa J, Kubota H, Fuji T, Tachibana M, Ono T, Otani H, Nagasue N. Expression of cytoplasmic TFF2 is a marker of tumor metastasis and negative prognostic factor in gastric cancer. Lab Invest. 2003;83:1343-1352. [PubMed] [DOI] |
| 8. | Yamachika T, Werther JL, Bodian C, Babyatsky M, Tatematsu M, Yamamura Y, Chen A, Itzkowitz S. Intestinal trefoil factor: a marker of poor prognosis in gastric carcinoma. Clin Cancer Res. 2002;8:1092-1099. [PubMed] |
| 9. | Ferrara N, Henzel WJ. Pituitary follicular cells secrete a novel heparin-binding growth factor specific for vascular endothelial cells. Biochem Biophys Res Commun. 1989;161:851-858. [PubMed] [DOI] |
| 10. | Saito H, Tsujitani S, Ikeguchi M, Maeta M, Kaibara N. Relationship between the expression of vascular endothelial growth factor and the density of dendritic cells in gastric adenocarcinoma tissue. Br J Cancer. 1998;78:1573-1577. [PubMed] [DOI] |
| 11. | Zhang H, Wu J, Meng L, Shou CC. Expression of vascular endothelial growth factor and its receptors KDR and Flt-1 in gastric cancer cells. World J Gastroenterol. 2002;8:994-998. [PubMed] |
| 12. | Lazăr D, Tăban S, Raica M, Sporea I, Cornianu M, Goldiş A, Vernic C. Immunohistochemical evaluation of the tumor neoangiogenesis as a prognostic factor for gastric cancers. Rom J Morphol Embryol. 2008;49:137-148. [PubMed] |