修回日期: 2011-09-25
接受日期: 2011-10-06
在线出版日期: 2011-10-18
目的: 探讨去唾液酸糖蛋白受体抗体(Auto-antibodies to asialoglycoprotein receptor, anti-ASGPR)阳性和阴性Ⅰ型自身免疫性肝炎(type Iauto-immune hepatitis AIH-Ⅰ)在临床、生化、免疫学、遗传学、组织学特点及其治疗应答反应的差异.
方法: 应用酶联免疫分析法(ELISA)检测79例确诊的AIH-Ⅰ患者血清中anti-ASGPR, 将其分为anti-ASGPR阳性组及阴性组.
结果: 患者中anti-ASGPR阳性的百分比为75%, 阳性患者(n = 59)中, 男性(n = 7), 女性(n = 52), 平均年龄(49.1±8.6)岁; 阴性患者(n = 20)中, 男性(n = 2), 女性(n = 18), 平均年龄(47.1±7.9)岁, 阳性患者与阴性患者在年龄、性别、ALT、AST、ALP、GGT、ANA、SMA、DR3、DR4比较差异无统计学意义, 而在IgG、补体C3水平, 组织学炎症活动及纤维化程度、治疗应答方面有统计学意义(P<0.05).
结论: anti-ASGPR与AIH-Ⅰ患者炎症活动及病理改变存在一致性, 且其对治疗应答有一定的提示.
引文著录: 吴虹杰, 徐芸. 去唾液酸糖蛋白受体抗体阳性的Ⅰ型自身免疫性肝炎生物学性状及其意义. 世界华人消化杂志 2011; 19(29): 3070-3074
Revised: September 25, 2011
Accepted: October 6, 2011
Published online: October 18, 2011
AIM: To investigate the differences in clinical, biochemical, immunoserologic, genetic, histological features and response to treatment between patients with type 1 autoimmune hepatitis (AIH-Ⅰ) who were positive for autoantibodies to asialoglycoprotein receptor (ASGPR) and those negative for anti-ASGPR.
METHODS: A total of 79 patients with AIH-Ⅰ were screened for the presence of anti-ASGPR by ELISA and were divided into anti-ASGPR-positive group and anti-ASGPR-negative group.
RESULTS: There were 59 patients in the anti-ASGPR-positive group and 20 patients in the anti-ASGPR-positive group. No significant differences were found between anti-ASGPR-positive and-negative patients in age, gender, alanine transaminase (ALT) activity, aspartate aminotransferase (AST) activity, alkaline phosphatase (ALP) activity, gamma glutanmic transpeptidase (γ-GT) activity, antinuclear autoantibodies (ANA), smooth muscle autoantibodies (SMA), DR3, and DR4. The levels of immunoglobulin G, C3, histological inflammatory activity and fibrosis, and response to treatment differed significantly between the two groups.
CONCLUSION: The presence of anti-ASGPR is correlated, to a certain extent, with inflammatory activity, pathological changes, and response to treatment in patients with AIH-Ⅰ.
- Citation: Wu HJ, Xu Y. Biological significance of autoantibodies to asialoglycoprotein receptor in patients with type Ⅰ autoimmune hepatitis. Shijie Huaren Xiaohua Zazhi 2011; 19(29): 3070-3074
- URL: https://www.wjgnet.com/1009-3079/full/v19/i29/3070.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i29.3070
自身免疫性肝炎(autoimmune hepatitis, AIH)是一种与自身免疫有关的肝脏疾病, 但目前对其病因和发病机制尚不十分清楚. 基于自身抗体谱特点, 可将其分为Ⅰ型和Ⅱ型两种亚型, 其中Ⅰ型最为常见, 但其自身抗体多不具有特异性. 近年来研究发现, 去唾液酸糖蛋白受体抗体具有特异性, 而有关该抗体阳性的Ⅰ型自身免疫肝炎的生物学特点报道甚少. 本研究对去唾液酸糖蛋白受体抗体阳性及阴性的Ⅰ型自身免疫性肝炎患者的临床、生化、免疫、病理特点及治疗应答进行了系列分析, 以对其诊治提高认识.
2010-07/2011-08郑州大学一附院住院及门诊确诊的AIH-Ⅰ患者(n = 79), 女性(n = 70, 89%), 平均年龄(48±9)岁; 男性(n = 9, 12%), 平均年龄(49±6)岁. 收集其资料. 所有患者均排除病毒性肝炎、药物性肝炎、遗传代谢性肝病、酒精性及非酒精性脂肪性肝病. AIH的诊断参照2002年美国肝病学会(AASLD)制定的AIH诊疗指南[1], 总分在治疗前>15分为确诊, 10-15分可能诊断, 治疗后>17分为确诊, 12-17分可能诊断.
1.2.1 ELISA检测anti-ASGPR: 采用ELISA法检查患者的血清去唾液酸糖蛋白受体抗体, 试剂盒由CUSABIO公司生产, 操作步骤严格安试剂盒说明书.
1.2.2 肝脏组织学检查: B超引导下经皮肝穿取1.5-2 cm肝组织, 置40 g/L甲醛溶液固定, 石蜡包埋, 制成厚度约为3-4 μm的切片, 常规HE染色, 用于组织定位. 免疫组化染色所有的单克隆抗体CD138、CD38由中杉金桥公司生产, 依照试剂盒说明按Envision二步法进行. 显微镜下观察免疫组化染色后阳性细胞分布, 每张切片取10个汇管区及肝小叶, 于400倍视野下计算平均阳性细胞数.
1.2.3 治疗: 参照2002年美国肝病学会(AASLD)制定的AIH诊疗指南[1].
1.2.4 治疗应答评估方法: 参考国际自身免疫性肝炎小组(IAIHG)推荐的治疗应答标准进行评估.
统计学处理 计量资料用mean±SD表示, 计数资料以例数或百分率进行描述, 应用SPSS17.0对计量资料进行t检验, 计数资料进行χ2检验、Yates校正χ2检验、Fisher确切概率法、秩和检验、率等统计处理.
AIH-Ⅰ以中年女性患者为主, anti-ASGPR阳性与阴性组在年龄、性别、临床症状及体征比较方面无明显差异(P<0.05, 表1).
| Anti-ASGPRAb(+) (n = 59)(%) | Anti-ASGPRAb(-) (n = 20)(%) | t/χ2值 | P值 | |
| 年龄 | 49.1±8.6 | 47.1±7.9 | 0.899 | 0.371 |
| 性别(男/女) | 8/51 | 1/19 | 0.402 | 0.526 |
| 症状 | ||||
| 疲劳 | 50(85) | 16(80) | 0.021 | 0.884 |
| 食欲减退 | 48(68) | 13(65) | 2.271 | 0.132 |
| 腹部不适 | 40(68) | 10(50) | 2.036 | 0.154 |
| 低热 | 21(36) | 6(30) | 0.208 | 0.649 |
| 体征 | ||||
| 肝掌、蜘蛛痣 | 36(61) | 8(40) | 2.674 | 0.102 |
| 脾大 | 28(48) | 7(35) | 0.939 | 0.332 |
| 黄疸 | 6(10) | 1(5) | 0.061 | 0.804 |
| 腹水 | 12(20) | 3(15) | 0.039 | 0.844 |
| 无症状 | 8(14) | 4(20) | 0.111 | 0.739 |
anti-ASGPR阳性及阴性组患者均有不同程度的肝功能损伤, 但肝功损伤程度无明显差异, anti-ASGPR阳性AIH-Ⅰ患者具有显著异常的球蛋白IgG、补体C3, 与anti-ASGPR阴性组有明显差异(P<0.05); 两组间在ANA、SMA阳性率及DR3、DR4检出率方面无明显差异(P>0.05, 表2).
| Anti-ASGPRAb(+) (n = 59)(%) | Anti-ASGPRAb(-) (n = 20)(%) | t/χ2值 | P值 | |
| 生化 | ||||
| ALT(U/L) | 326.3±153.0 | 308.8±139.7 | 0.451 | 0.653 |
| AST(U/L) | 324.1±150.8 | 298.1±151.9 | 0.660 | 0.514 |
| ALP(U/L) | 213.8±106.0 | 182.5±93.8 | 1.172 | 0.245 |
| r-GT(U/L) | 211.7±108.9 | 179.3±97.3 | 1.179 | 0.242 |
| 白蛋白(g/L) | 37.2±6.0 | 41.6±5.9 | -2.773 | 0.070 |
| 免疫学 | ||||
| r-球蛋白(g/L) | 35.0±7.8 | 26.5±4.5 | 4.622 | 0.000 |
| IgG(mg/L) | 33.7±7.0 | 25.7±5.3 | 4.675 | 0.000 |
| C3(mg/L) | 0.4±0.3 | 0.6±0.2 | -2.305 | 0.002 |
| ANA 阳性 | 54(92) | 17(85) | 0.166 | 0.684 |
| SMA 阳性 | 13(22) | 2(10) | 0.733 | 0.392 |
| 遗传学 | ||||
| DR3 | 3(5) | 1(5) | 0.000 | 1.000 |
| DR4 | 21(36) | 11(55) | 1.599 | 0.206 |
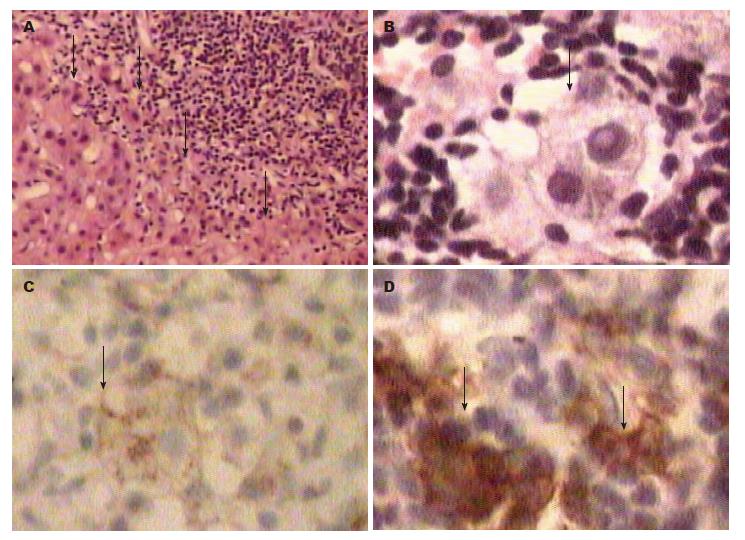
anti-ASGPR阳性组中, 有81%的患者出现界面性肝炎(图1A), 20%出现玫瑰花结样改变(图1B), 27%肝硬化; anti-ASGPR阴性组中, 有45%的患者出现界面行肝炎, 10%出现玫瑰花结样改变, 20%肝硬化; anti-ASGPR阳性组较阴性组有高频率的界面性肝炎及更明显的CD138浆细胞和CD38细胞(图1C, D)浸润(P<0.05). 两组炎症活动分级情况有统计学差异(P<0.05), anti-ASGPR阳性组炎症重度明显高于anti-ASGPR阴性(54% vs 10%). 纤维化情况两组比较无差异(P>0.05), 但anti-ASGPR阳性组早期肝硬化及重度纤维化比率明显高于阴性组(48% vs 25%, 表3).
| Anti-ASGPRAb(+) (n = 59)(%) | Anti-ASGPRAb(-) (n = 20)(%) | t/χ2值 | P值 | |
| 界面性肝炎 | 48(81) | 9(45) | 9.826 | 0.020 |
| 玫瑰花结 | 12(20) | 2(10) | 0.501 | 0.479 |
| 肝硬化 | 16(27) | 3(15) | 0.629 | 0.428 |
| CD138(/HP) | 9.3±4.4 | 5.6±3.3 | 3.365 | 0.001 |
| CD38(/HP) | 23.2±6.6 | 18.1±5.8 | 3.076 | 0.003 |
| 炎症活动分级 | 9.848 | 0.015 | ||
| G1- G2 (轻度) | 27(46) | 18(90) | ||
| G3(中度) | 27(46) | 2(10) | ||
| G4(重度) | 5(8) | 0(0) | ||
| 纤维化活动分期 | 2.952 | 0.450 | ||
| S1 | 10(17) | 8(40) | ||
| S2 | 15(25) | 7(35) | ||
| S3 | 18(31) | 2(10) | ||
| S4 | 16(27) | 3(15) |
anti-ASGPR阳性组55例患者接受治疗, 第1年随访观察期间, 缓解27例(49%), anti-ASGPR阴性组18例接受治疗, 缓解14例(78%), anti-ASGPR阳性组较阴性组缓解率低(P<0.05).
AIH以高球蛋白血症, 自身抗体阳性, 组织学存在界面炎和汇管区浆细胞浸润, 以及免疫抑制剂治疗有效为主要特点. 根据血清自身抗体类型的不同可将其分为2型[2]. 其中, I型抗核抗体(ANA)和(或)抗平滑肌抗体(SMA)阳性; Ⅱ型抗肝肾微粒体抗体1阳性(LKM-1), 但这些抗体本身的测定无法监测该疾病的活动规律, 也不具备预测治疗应答的能力[3]. 因此,寻找具有预测意义的血清标志物对监测疾病活动、预测疗效、建立个体化治疗方案以及指导撤药时机都具有重要意义. ASGPR是仅存在于肝细胞肝窦面细胞膜上的一类跨膜蛋白, 可参与含半乳糖末端的唾液酸糖蛋白的结合和内化, 具有肝组织特异性[4], 显然该抗原是AIH自身免疫应答中重要的靶抗原. 目前认为唾液酸糖蛋白受体是Ⅰ型AIH主要的候选自身抗原[5], 与自身免疫性肝炎的发生、活动、严重程度及进展密切相关[6-8].
本研究中的AIH-Ⅰ患者多为女性, 高发年龄为40-60岁; 而在白种人群中, Ⅰ型发病率的年龄呈现两个高峰, 分别为10-25岁, 45-70岁. 本研究年龄分布特点与邱德凯等研究一致, 推测这种差别可能与种族间不同遗传背景有关[9]. 性别及年龄在anti-ASGPR阳性组及阴性组患者中无明显差别, 临床上两组患者均可出现乏力、食欲减退、腹部不适、低热、肝掌、蜘蛛痣、脾大、腹水等多样化特征, 与一般慢性肝病如慢性乙型肝炎无明显差别, 且两组之间也无明显差异.
anti-ASGPR阳性组与阴性组相比, 血清中存在更高的γ-球蛋白、IgG, 补体C3水平较低, 而血清ANA、SMA无明显差别. 本研究中ANA检测的阳性率高于anti-ASGPR的阳性率, 与国外报道不同[10], 原因不明. 组织学检查中, 两组均可出现界面性肝炎、玫瑰花结及淋巴细胞及浆细胞浸润, 且anti-ASGPR阳性组出现了界面性肝炎、玫瑰花结、CD38细胞、CD138浆细胞浸润情况明显高于anti-ASGPR阴性组(P<0.05), 且炎症活动情况也较阴性组重, 阳性组中炎症活动中重度比例明显高于阴性组(54% vs 10%). 分析原因可能如下: (1)ASGPR在肝小叶1带中的细胞高表达, 血清中anti-ASGPR与门脉周围的肝损伤有明显关系, 导致界面性肝损伤[11]. (2)Guy等[12]研究表明,肝细胞可通过ASGPR识别介导细胞毒性反应而杀死周围病变细胞, 以达到在肝内免疫调节及局限炎症反应的功能, 并且在体外实验中此作用对CD4淋巴细胞亦有效. 由此可推断, 当血液中出现大量anti-ASGPR时, 会减弱上述肝细胞功能, 由此引起更严重的炎症反应, 以致anti-ASGPR阳性组中界面性肝炎、玫瑰花结及淋巴细胞及浆细胞浸润明显高于阴性组, 炎症活动分级也说明了这一点. (3)在anti-ASGPR阳性组中CD138细胞(CD138为浆细胞最特异性的标志[13])、γ-球蛋白、IgG明显高于阴性组(P<0.05),表明anti-ASGPR阳性组中浆细胞浸润情况及循环抗体产生较阴性组重, 导致更严重的体液免疫反应活动, 加重了肝组织内自身免疫炎症. CD38(除浆细胞外, 还可表达于成熟的淋巴、单核和粒细胞)细胞浸润数目, anti-ASGPR阳性组较阴性组多, 这也从一些方面说明了阳性组炎症活动较阴性组重. (4)显著的炎症活动导致肝细胞变性坏死, 大量纤维组织增生, 以致肝纤维化. 遗憾的是本研究未测定anti-ASGPR的滴度, 无法明确其滴度高低与肝组织损伤严重程度的相关性.
在第1年随访观察治疗中, anti-ASGPR阳性组缓解率低于阴性组(P<0.05), 说明anti-ASGPR的存在使AIH-Ⅰ型患者不易产生缓解, Czaja等[10]研究表明, anti-ASGPR阳性组中缓解情况较阴性组无差异, 我们推测,这可能与Czaja等进行治疗观察均达到治疗终点而本研究只进行1年观察有关. 我们将进行进一步的观察至治疗终点, 并观察患者复发及持续缓解情况.
总之, Anti-ASGPR与AIH-Ⅰ患者炎症活动及肝组织活检情况存在相关性, 并对治疗应答有一定的提示, 可提高我们对其临床诊治的认识.
去唾液酸糖蛋白受体是仅存在于肝细胞肝窦面细胞膜上一类跨膜蛋白, 具有肝组织特异性, 是AIH自身免疫应答中重要的靶抗原, 与自身免疫性肝炎的发生、活动、严重程度及进展密切相关.
郑素军, 副主任医师, 首都医科大学附属北京佑安医院
去唾液酸糖蛋白受体抗体与AIH-Ⅰ患者炎症活动及病理改变存在一致性, 且其对治疗应答有一定的提示, 有助于提高对AIH-Ⅰ患者的临床诊治认识.
本文对我国AIH-Ⅰ患者进行了去唾液酸糖蛋白受体抗体检测, 并研究了其临床意义, 对于判断AIH-Ⅰ患者炎症活动有一定作用.
本研究主要探讨了ASGPR阴性的Ⅰ型自身免疫性肝炎的生物学性状, 有助于该病 的诊断和治疗.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Czaja AJ, Freese DK. Diagnosis and treatment of autoimmune hepatitis. Hepatology. 2002;36:479-497. [PubMed] [DOI] |
| 2. | Makol A, Watt KD, Chowdhary VR. Autoimmune hepatitis: a review of current diagnosis and treatment. Hepat Res Treat. 2011;2011:390916. [PubMed] |
| 3. | Lüth S, Herkel J, Kanzler S, Frenzel C, Galle PR, Dienes HP, Schramm C, Lohse AW. Serologic markers compared with liver biopsy for monitoring disease activity in autoimmune hepatitis. J Clin Gastroenterol. 2008;42:926-930. [PubMed] [DOI] |
| 4. | Treichel U, McFarlane BM, Seki T, Krawitt EL, Alessi N, Stickel F, McFarlane IG, Kiyosawa K, Furuta S, Freni MA. Demographics of anti-asialoglycoprotein receptor autoantibodies in autoimmune hepatitis. Gastroenterology. 1994;107:799-804. [PubMed] [DOI] |
| 5. | 巫 协宁, 邱 德凯. 临床肝胆系病学. 上海: 上海科学技术文献出版社 2002; 269-273. |
| 6. | Hausdorf G, Roggenbuck D, Feist E, Büttner T, Jungblut PR, Conrad K, Berg C, Klein R. Autoantibodies to asialoglycoprotein receptor (ASGPR) measured by a novel ELISA--revival of a disease-activity marker in autoimmune hepatitis. Clin Chim Acta. 2009;408:19-24. [PubMed] [DOI] |
| 7. | Hajoui O, Debray D, Martin S, Alvarez F. Auto-antibodies to the asialoglycoprotein receptor in sera of children with auto-immune hepatitis. Eur J Pediatr. 2000;159:310-313. [PubMed] [DOI] |
| 8. | Czaja AJ. Autoantibodies as prognostic markers in autoimmune liver disease. Dig Dis Sci. 2010;55:2144-2161. [PubMed] [DOI] |
| 10. | Czaja AJ, Pfeifer KD, Decker RH, Vallari AS. Frequency and significance of antibodies to asialoglycoprotein receptor in type 1 autoimmune hepatitis. Dig Dis Sci. 1996;41:1733-1740. [PubMed] [DOI] |
| 11. | McFarlane BM, Sipos J, Gove CD, McFarlane IG, Williams R. Antibodies against the hepatic asialoglycoprotein receptor perfused in situ preferentially attach to periportal liver cells in the rat. Hepatology. 1990;11:408-415. [PubMed] [DOI] |
| 12. | Guy CS, Rankin SL, Michalak TI. Hepatocyte cytotoxicity is facilitated by asialoglycoprotein receptor. Hepatology. 2011; Jun 7. [Epub ahead of print]. [PubMed] |
| 13. | Chilosi M, Adami F, Lestani M, Montagna L, Cimarosto L, Semenzato G, Pizzolo G, Menestrina F. CD138/syndecan-1: a useful immunohistochemical marker of normal and neoplastic plasma cells on routine trephine bone marrow biopsies. Mod Pathol. 1999;12:1101-1106. [PubMed] |