修回日期: 2011-09-25
接受日期: 2011-10-08
在线出版日期: 2011-10-18
目的: 研究光敏剂-磁性纳米粒子螯合物促进磁性纳米粒子在VX2肝转移癌细胞内的靶向性分布.
方法: 取健康新西兰大白兔40只, 体质量2.5-3.0 kg. 建立VX2肝转移癌模型, 随机分成空白对照组、光敏剂组、磁性纳米粒子组和光敏剂-磁性纳米粒子螯合物组, 在成瘤后的第16、18和20 d, 经兔耳缘静脉分别注射生理盐水、光敏剂、磁性纳米粒子和螯合物. 于第22 d处死试验兔, 剖腹观察肿瘤生长情况, 取正常肝组织和癌结节, 作普鲁氏蓝铁染色、透射电镜检查和原子光谱吸收半定量检测.
结果: (1)普鲁氏蓝染色后, 在螯合剂组癌结节内见到大量蓝染铁颗粒, 明显多于其他各组, 而肝细胞内少见蓝染铁颗粒; (2)电镜检查, 螯合剂组癌细胞内有大量散在的黑色细小颗粒, 主要分布在溶酶体、内质网、线粒体和细胞核内; 而肝细胞内只有少量黑色细小颗粒; (3)原子光谱吸收半定量检测显示, 在癌结节内, 螯合剂组铁含量(9.09 mg/L)明显高于空白对照组、光敏剂组和磁性纳米粒子组(P<0.01), 癌组织内铁含量也明显高于正常肝组织的铁含量(P<0.01).
结论: 光敏剂-磁性纳米粒子螯合剂能够促进磁性纳米粒子在肝转移癌结节内的聚集.
引文著录: 葛海燕, 常卓林, 李淑萍, 刘豫昊, 龚健. 光敏剂-磁性纳米粒子螯合剂对磁性纳米粒子在VX2肝转移癌细胞内靶向性分布的影响. 世界华人消化杂志 2011; 19(29): 3064-3069
Revised: September 25, 2011
Accepted: October 8, 2011
Published online: October 18, 2011
AIM: To investigate the targeted distribution of photosensitizer-manoparticle conjugates in transplanted VX-2 liver tumors in rabbits.
METHODS: Forty healthy New Zealand rabbits were randomly divided into four groups: normal control group, photosensitizer group, nanoparticle group, and conjugate group. A rabbit model of transplanted VX-2 liver tumor was created. On days 16, 18 and 20 after model creation, the animals in each group were injected with saline, photosensitizer, nanoparticles and conjugate solution via the ear vein, respectively. On day 22, animals were sacrificed to observe the growth of tumors and examine pathological changes in liver tissue by Prussian blue staining, transmission electron microscopy and atomic absorption spectroscopy.
RESULTS: Prussian blue staining showed that there were plenty of iron particles stained blue inside cancer cells in the conjugate group, which were much more than those in other groups. There were few iron particles inside normal liver cells. Transmission electron microscopy revealed that there were large quantity of black small particles inside the lysosomes, endoplasmic reticulum, mitochondria and nucleus of cancer cells in the conjugate group, which were much more than those in other groups. There were only few black small particles inside normal liver cells.
CONCLUSION: Photosensitizer-nanoparticle conjugates have cancer-targeted effect and could help nanoparticles enter into transplanted VX-2 liver tumor cells.
- Citation: Ge HY, Chang ZL, Li SP, Liu YH, Gong J. Targeted distribution of photosensitizer-manoparticle conjugates in transplanted VX-2 liver tumors in rabbits. Shijie Huaren Xiaohua Zazhi 2011; 19(29): 3064-3069
- URL: https://www.wjgnet.com/1009-3079/full/v19/i29/3064.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i29.3064
肝转移癌是影响结直肠癌手术预后的主要因素之一, 大约50%-70%的患者在根治性手术后会发生异时性肝转移, 死亡患者中有70%-90%存在肝转移癌. 由于肝转移癌具有多发性、弥漫性分布的特点, 使得对肝转移癌的早期诊断和治疗都缺乏有效的方法[1]. 近年来纳米技术的深入发展使人们看到了诊断、治疗肝转移癌的希望[2]. 一些研究表明, 纳米技术在磁共振成像、细胞内高温热疗等方面都具有独特的优势[3,4]. 但是, 由于纳米粒子本身没有与肿瘤细胞特异性结合的靶向性特点, 单纯的纳米粒子难以在肿瘤细胞内集聚, 因而在肿瘤组织内就难以发挥纳米粒子的生物学作用. 我们先期的研究表明, 光敏剂可以与磁性纳米粒子结合形成螯合剂, 并且这种光敏剂-磁性纳米粒子螯合剂可以进入培养的结肠癌细胞中. 因此, 本研究通过兔VX-2肝移植瘤模型, 观察光敏剂-磁性纳米粒子螯合剂是否能够促进磁性纳米粒子在肝移植瘤细胞内的聚集.
健康清洁级新西兰大白兔, 雌雄各半, 40只, 体质量2.0-2.5 kg, 同济大学实验动物中心以及同济大学附属同济医院动物实验中心提供并饲养, 许可证号: SYXK(沪)2007-0031, 实验动物生产许可证号: SCXK(沪)2004-0007. Vx2鳞癌细胞新西兰大白兔: 由上海中医药大学附属普陀区中心医院放射科李铭、李淼医师惠赠. 光敏剂: 主要成分为血卟啉单甲醚(HMME)(10 g/L), 避光, -20 ℃保存, 由上海第二军医大学红绿光研究所提供. 磁性纳米粒子: 主要成分为葡聚糖4万色包被Fe3O4粒子, 铁离子含量为1.32 mol/L, 水合粒径50 nm, 多分散系数PDI = 0.197, 型号061010磁粒, 由上海交通大学纳米材料研究所古晨宏教授惠赠. 显微镜及成像系统: LEICA DM IRB显微镜, 徕卡仪器有限公司产品. 透射电镜: CM120 Philips 公司产品. 原子吸收光谱仪: 安捷伦科技上海有限公司产品.
1.2.1 光敏剂-纳米磁性螯合剂溶液的制备: 取光敏剂10 μL, 纳米磁性粒子150 μL, 0.9%NaCL溶液10 mL. 等比值取光敏剂溶液、纳米磁性粒子溶液、0.9%NaCL溶液, 避光的条件下混匀, 并在37 ℃下水浴30 min, 分装为10 mL一管. 避光, 4 ℃保存.
1.2.2 兔Vx2肝转移癌模型的建立: 取新西兰大白兔, 体质量2.0-2.5 kg. 取3%戊巴比妥钠溶液1.0 mL/kg, 沿耳缘静脉缓慢推注, 麻醉完全后取仰卧位, 以剑突为中心备皮, 直径约10 cm. 常规消毒. 在剑突下行纵行切口, 长约3 cm, 进腹后显露肝左中央叶, 用组织钳从膈面斜型穿刺肝组织, 长约1 cm左右, 注意切忌穿透肝脏组织脏面. 将预先从荷瘤种兔取下的新鲜瘤组织块(1 mm×1 mm×1 mm)2-3块塞入窦道中, 用纱布压迫窦道口处3-5 min, 再用明胶海棉覆盖表面, 防止种植的肿瘤组织块脱落, 逐层关腹. 待实验兔苏醒后送返动物房, 禁食12 h. 术后于后肢肌注1 mL硫酸庆大霉素,每天1次, 连用3 d.
1.2.3 实验分组及处理: 取40只VX2荷瘤兔, 雌雄各半, 随机分为4组: 空白对照组、光敏剂组、磁性纳米粒子组(粒子组)和光敏剂-磁性纳米粒子螯合剂组(螯合剂组). 成瘤后每天观察体温、心率等生命体征变化及体质量等一般情况, 于第16、18、20 d经耳缘静脉分别注射生理盐水(1 mL/kg), 光敏剂[1 μL/(mL·kg)]、磁性纳米粒子[15 μL/(mL·kg)]和螯合剂[2 μL/(mL·kg)], 于第22 d处死荷瘤兔, 剖腹观察肿瘤生长情况, 并取每组的癌结节和正常肝组织, 分别作普鲁氏铁染色、透射电镜观察以及原子光谱吸收仪检测.
统计学处理 采用SPSS13.0统计学软件对所得结果进行统计学分析, 实验数据用mean±SD表示, P>0.05被认为差异无统计学意义, P<0.05被认为差异有统计学意义, P<0.01被认为差异有显著统计学意义.
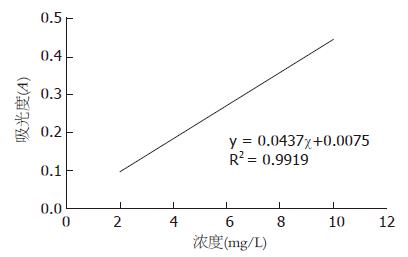
为了客观地验证在不同组别的肝转移癌结节内铁离子的多寡, 实验中采用原子吸收光谱分析技术分析样本中铁离子的含量. 根据对标准浓度的测定结果绘制工作曲线, 并计算出相应的函数关系公式(图1). 在铁离子浓度(mg/L)为2.0, 4.0, 6.0, 8.0, 10.0时, 对应的吸光度(A)分别为0.121, 0.180, 0.269, 0.339, 0.460.
螯合剂组的铁离子相对含量最高, 达到9.09 mg/L, 明显高于纳米粒子组、光敏剂组和空白对照组, 均有非常显著的统计学意义(P<0.01). 纳米粒子组也高于光敏剂组和空白组(P<0.05). 光敏剂组和空白组比较, 无统计学意义(表1).
| 分组 | 肿瘤 | 肝脏 |
| 螯合剂组 | 9.09±2.31 | 4.43±1.10 |
| 纳米粒子组 | 4.97±1.53 | 4.53±1.11 |
| 光敏剂组 | 3.45±0.61 | 4.82±1.94 |
| 空白对照组 | 3.30±0.26 | 4.10±0.70 |
上述结果表明, 通过将磁性纳米粒子与光敏剂螯合的方式, 能够促进磁性纳米粒子进入肿瘤细胞. 单纯的磁性纳米粒子只有极少量能够进入肿瘤细胞内, 但是明显少于螯合剂组, 这也从另一个侧面验证了螯合剂携带铁的能力. 光敏剂因为本身不含铁离子, 所以和空白组对比没有统计学意义. 正常肝组织由于血供丰富, 肝窦内富含枯否氏细胞, 对纳米粒子等颗粒物质具有非特异性吞噬功能, 并且肝细胞和肝窦内的红细胞本身也含有微量的铁离子, 因而在各个组别的正常肝组织内也能测出铁离子含量, 但是没有显著性差异(P>0.05).
癌组织表现为细胞排列紊乱, 失去正常的排列结构、层次或极向, 大量的癌细胞成团状或巢状, 细胞较正常大, 细胞核增大、深染, 有病理性核分裂象. 证实实验中肝组织中增生的结节为癌组织.
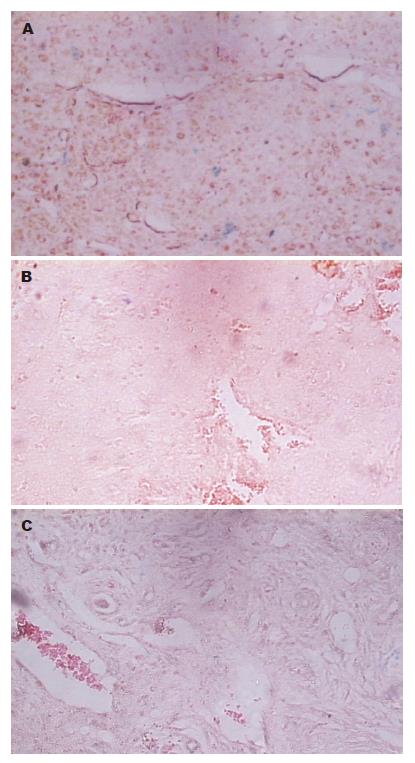
在普鲁士蓝染色切片中, 空白对照组: 无论是肿瘤组织还是正常肝组织, 在其切片中均未发现蓝染颗粒; 螯合剂组可见到在中性红染色的背景下, 大量散在或片状分布的蓝色颗粒(图2A); 光敏剂组的肿瘤组织中几乎未见到蓝染颗粒(图2B); 纳米粒子组的肿瘤组织内偶见到少许的蓝色颗粒(图2C). 从这些图片对比可以看出, 螯合剂组的肿瘤组织内铁离子的含量最多, 纳米粒子组与光敏剂组的肿瘤组织内铁离子的含量极少, 提示螯合剂可以促进更多的磁性纳米粒子进入肿瘤细胞内.
在透射电镜下, 癌细胞的大小和形态很不一致, 尤其是癌细胞核的体积增大, 核浆比例较正常的增大, 核的大小、形状和染色不一, 核染色质深, 呈粗颗粒状, 分布不均, 常堆积在核膜下, 使核膜显得增厚, 常有病理性核分裂象.
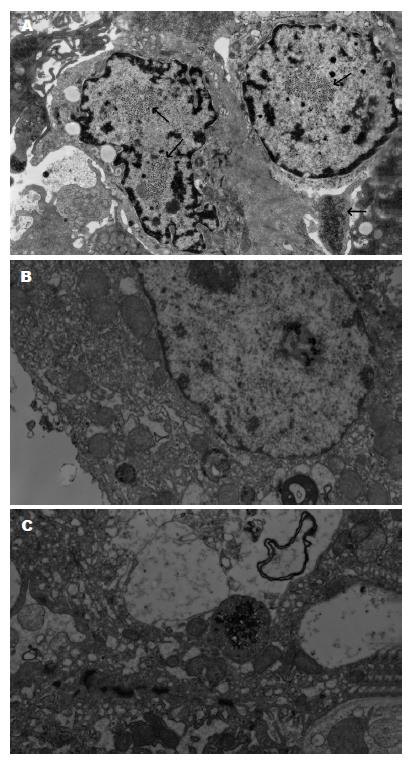
螯合剂组的电镜图像显示, 核内可以清晰地看到大量散在的黑色细小点状颗粒, 为高电子密度影, 在胞核周围也可见到散在的黑色颗粒, 部分颗粒为溶酶体所吞噬. 而在组织间隙内未见到类似颗粒(图3A).
光敏剂组可见到胞核较大, 形状变异. 在胞质内见到溶酶体、内质网、核糖体等细胞器, 未见到黑色细小点状颗粒(图3B). 纳米粒子组在肿瘤细胞核内可见极少量的铁颗粒(图3C). 空白对照组除见到成片的肿瘤细胞, 胞核大小各异, 在胞核与胞质内均未见到黑色点状颗粒.
近年来, 纳米技术在肿瘤研究领域的应用越来越引起关注[2-4]. 其中磁性纳米材料(Fe3O4、γ-Fe2O3)作为一类新材料, 由于其独特的理化性质, 如量子尺寸效应、小尺寸效应、表面与界面效应和宏观量子隧道效应等, 使其在肿瘤诊断、治疗的研究中受到广泛重视. 别彩群等[5]成功制备了抗肝癌单链抗体二聚体高分子免疫纳米颗粒, 初步研究证明对肝癌细胞增殖具有抑制作用. 纳米级Fe3O4粒子作为磁共振造影剂在临床上已经得到应用. 但是, 存在的难题是磁性纳米粒子缺乏靶向性, 它不能特异性地在肿瘤细胞或肿瘤组织内形成浓聚区, 因而影响了其生物学效能的发挥.
光动力疗法(Photodynamic therapy, PDT)是近年来正在快速发展中的肿瘤治疗新方法, 已广泛应用于皮肤表面、口咽部、食管、膀胱等体表或脏腔表面的各种癌前病变、早期肿瘤、癌性梗阻的治疗, 并且都具有较肯定的疗效. PDT的重要特性之一是光敏剂能够选择性地与肿瘤细胞结合, 肿瘤细胞内光敏剂的浓度明显高于周围正常组织, 并且只有被相同波长的激光照射后才能产生光化学反应, 从而进行光动力诊断和光动力治疗[6,7].
近年来以纳米粒子作为载体, 与光敏剂或其他药物相结合的技术逐渐引起研究者们的关注. 燕翔等[8]以纳米沉淀法制备光敏感纳米微球,将负载52盐酸乙酰氨基丙酸(52aminolevulinic acid, 52ALA)的光敏感纳米微球对膀胱癌进行光动力学治疗, 结果显示光敏感纳米微球可以显著提高光动力学杀伤效应. Ma[9]等报道, 利用褐藻酸纳米微球吸附磁性三氧化二铁制成纳米药物SPIO2藻酸盐, 高达90%的SPIO2藻酸盐能迅速到达肝脏及脾脏. Zhang等[10]通过合成"己内酯2聚乙二醇2丙交酯聚合物(PCLLA2PEG2PCLLA)", 并且包埋羟基喜素碱成纳米微球, 通过动物实验显示具有较好的靶向性抗肿瘤效果. 这些研究从不同侧面阐明了纳米修饰技术在光动力学治疗中的美好前景. 我们在本实验中通过对肝转移癌组织的普鲁士蓝铁染色和原子吸收光谱分析技术, 进一步观察了光敏剂-磁性纳米粒子螯合剂在肝转移癌内的实际分布和含量, 为光敏剂-磁性纳米粒子螯合剂在肿瘤组织内的靶向性研究提供实验依据.
普鲁士蓝中性红复染是广泛用来检测组织中铁颗粒的一项技术, 丁军等[11]应用普鲁氏蓝染色结果证实在小鼠尾静脉注射葡聚糖超顺磁性氧化铁纳米颗粒(MSPIO)后, 在小鼠肝脏、脾脏、肾脏等多个脏器的网状内皮系统内均有MSPIO分布. 郑爱萍等[12]应用普鲁士蓝染色法观察皮肤创缘组织中的含铁血黄素巨噬细胞数量变化, 认为这是一种简便易行、经济实用的推断损伤时间的病理形态学方法. 本实验结果显示, 在肝转移癌结节内, 单纯磁性纳米粒子组可见到少量的蓝染颗粒, 空白组和光敏剂组则极少见到蓝染颗粒, 两组之间没有显著差异, 这是因为空白组和光敏剂组的试剂本身不含铁粒子, 所以在相应的组织内不显示蓝染颗粒. 而单纯磁性纳米粒子组的癌结节内少见蓝染颗粒, 提示该组的肿瘤组织内也极少含铁粒子, 其原因可能与磁性纳米粒子缺乏肿瘤细胞的靶向性导入, 因而难以有更多的磁性纳米粒子进入癌组织. 螯合剂组的癌结节内蓝染颗粒明显多于光敏剂组、纳米粒子组和空白对照组, 说明螯合剂组的癌结节内比其他各组有更多的含铁粒子. 结合其他几组的资料, 可以认为这一结果是由于磁性纳米粒子与光敏剂形成螯合剂而获得的, 证明光敏剂-磁性纳米粒子螯合剂具有促进磁性纳米粒子进入肿瘤细胞的能力.
透射电镜观察的资料显示, 螯合剂组的癌细胞内含有大量的细小黑色铁颗粒, 为高电子密度影, 主要分布在细胞核、溶酶体、内质网以及线粒体. 而在光敏剂组、纳米粒子组和空白对照组的电镜照片中, 都很少见到类似高电子密度影的细小黑色颗粒物质. 透射电镜的检查结果从另外一个侧面验证了螯合剂组的癌细胞内铁颗粒的存在.
原子吸收光谱法(AAS)是利用气态原子可以吸收一定波长的光辐射, 使原子中外层的电子从基态跃迁到激发态的现象而建立的. 由于原子吸收光谱法具有检出限低、准确度高、选择性好、分析速度快等优点, 目前已成为无机元素定量分析应用最广泛的一种分析方法, 适用于样品中微量及痕量组分的分析[13,14]. 丁军等[11]采用原子吸收分光光度法检测小鼠尾静脉注射超顺磁性氧化铁纳米颗粒(MSPIO)后铁在小鼠体内各脏器中分布的时间量化关系. 张宏征等[15]以原子吸收光谱分析法检测小鼠肾脏内顺铂含量, 病理切片普鲁士蓝铁染色和扫描电镜检查显示含氧化铁的纳米粒分布于肾脏毛细血管管腔、内皮细胞等部位, 验证了具有超顺磁性的CDDP-MNP在体外磁场作用下能实现体内靶向性分布. 本实验中采用的技术方法与上述文献报道基本一致, 通过对不同组别样本原子吸收光谱的测定, 进一步验证了通过普鲁士蓝中性红复染技术观察到的癌结节内的蓝染颗粒和透射电镜显示的细小黑色颗粒为铁粒子, 并且提示螯合剂组的癌结节内铁粒子含量明显高于其他各组以及正常肝组织.
本研究通过普鲁士铁染色、透射电镜和原子吸收光谱仪分析, 从三个不同角度都验证了光敏剂-磁性纳米粒子螯合剂组肝转移癌结节内的铁粒子含量明显高于光敏剂组、磁性纳米粒子组, 而且也高于正常肝细胞内的铁粒子含量, 证明光敏剂-磁性纳米粒子螯合剂具有促进磁性纳米粒子进入肿瘤细胞的能力. 这一研究成果将为应用光纳米技术诊断或治疗肝转移癌打下重要的实验基础.
本研究中所用磁性纳米粒子由上海交通大学微米/纳米加工技术国家重点实验室, 薄膜与微细技术教育部重点实验室古宏晨教授惠赠, Vx2鳞癌细胞新西兰大白兔由上海中医药大学附属普陀区中心医院放射科李铭、李淼医师惠赠. 特此表示诚挚谢意!
研究表明, 纳米技术在磁共振成像、细胞内高温热疗等方面都具有独特的优势. 但是, 由于纳米粒子本身没有与肿瘤细胞特异性结合的靶向性特点, 单纯的纳米粒子难以在肿瘤细胞内集聚, 因而在肿瘤组织内就难以发挥纳米粒子的生物学作用.
黄培林, 教授, 东南大学
光敏剂可以与磁性纳米粒子结合形成螯合剂, 并且这种光敏剂-磁性纳米粒子螯合剂可以进入培养的结肠癌细胞中.
光燕翔等以纳米沉淀法制备光敏感纳米微球,将负载52盐酸乙酰氨基丙酸(52ALA)的光敏感纳米微球对膀胱癌进行光动力学治疗, 结果显示光敏感纳米微球可以显著提高光动力学杀伤效应.
本研究通过普鲁士铁染色、透射电镜和原子吸收光谱仪分析, 从三个不同角度都证明光敏剂-磁性纳米粒子螯合剂具有促进磁性纳米粒子进入肿瘤细胞的能力.
本研究从不同角度均证明光敏剂-磁性纳米粒子螯合剂具有促进磁性纳米粒子向肿瘤细胞转移的能力, 具有较强创新性和实用性.
编辑: 李军亮 电编:闫晋利
| 1. | Van Cutsem E. A glimpse of the future. new directions in the treatment of colorectal cancer. Eur J Cancer. 1996;32A Suppl 5:S23-S27. [PubMed] [DOI] |
| 2. | Service RF. Materials and biology. Nanotechnology takes aim at cancer. Science. 2005;310:1132-1134. [PubMed] [DOI] |
| 3. | Huh YM, Jun YW, Song HT, Kim S, Choi JS, Lee JH, Yoon S, Kim KS, Shin JS, Suh JS. In vivo magnetic resonance detection of cancer by using multifunctional magnetic nanocrystals. J Am Chem Soc. 2005;127:12387-12391. [PubMed] [DOI] |
| 4. | Sonvico F, Mornet S, Vasseur S, Dubernet C, Jaillard D, Degrouard J, Hoebeke J, Duguet E, Colombo P, Couvreur P. Folate-conjugated iron oxide nanoparticles for solid tumor targeting as potential specific magnetic hyperthermia mediators: synthesis, physicochemical characterization, and in vitro experiments. Bioconjug Chem. 2005;16:1181-1188. [PubMed] [DOI] |
| 5. | 别 彩群, 韩 利民, 王 启章, 范 红梅, 朱 浩峰, 梁 旭竞, 杨 冬华. 抗肝癌免疫纳米颗粒的制备及其对肝癌细胞增殖的影响. 世界华人消化杂志. 2010;18:1326-1330. [DOI] |
| 6. | Gahlen J, Stern J, Laubach HH, Pietschmann M, Herfarth C. Improving diagnostic staging laparoscopy using intraperitoneal lavage of delta-aminolevulinic acid (ALA) for laparoscopic fluorescence diagnosis. Surgery. 1999;126:469-473. [PubMed] [DOI] |
| 9. | Ma HL, Xu YF, Qi XR, Maitani Y, Nagai T. Superparamagnetic iron oxide nanoparticles stabilized by alginate: pharmacokinetics, tissue distribution, and applications in detecting liver cancers. Int J Pharm. 2008;354:217-226. [PubMed] [DOI] |
| 10. | Zhang L, Yang M, Wang Q, Li Y, Guo R, Jiang X, Yang C, Liu B. 10-Hydroxycamptothecin loaded nanoparticles: preparation and antitumor activity in mice. J Control Release. 2007;119:153-162. [PubMed] [DOI] |
| 12. | 郑 爱萍, 胡 金花, 郑 剑, 李 艳红, 许 小明. 含铁血黄素巨噬细胞与损伤时间的相关性研究. 南昌大学学报(医学版). 2010;50:12-14, 37. |
| 15. | Zhang HZ, Xie MQ, Kang Z, Shen H, Wang L. [Targeted distribution of cis-platin magnetic nanoparticles in mice]. Nanfang Yike Daxue Xuebao. 2008;28:1756-1759. [PubMed] |