修回日期: 2011-10-08
接受日期: 2011-10-13
在线出版日期: 2011-10-18
目的: 探讨一氧化氮(NO)在大鼠胰十二指肠移植中缺血再灌注损伤和细胞凋亡中的作用.
方法: 168只大鼠, 72只雄性作为供体, 96只雌性通过腹腔注射四氧嘧啶诱导糖尿病作为受体, 采用双套管法建立糖尿病大鼠胰十二指肠移植动物模型, 随机分为假手术组(n = 24)、对照组(对照组n = 24)、L-Arg组(n = 24)和L-NAME组(n = 24), 再分为1 h、3 h、6 h亚组(n = 8), 检测血清NO和淀粉酶、胰腺组织病理损害评分和胰腺组织中iNOS表达检测、胰腺细胞凋亡.
结果: 再灌注后1 h、3 h、6 h各时间点血清淀粉酶和NO、胰腺病理损害评分逐渐升高各时间点均显著高于假手术组(P<0.01); L-Arg组1 h、3 h、6 h各时间点血清NO均高于对照组(P<0.01), L-Arg组1 h、3 h血清淀粉酶和胰腺病理损害评分都低于对照组(P<0.01), 而6 h则血清淀粉酶高于对照组(P<0.01); L-NAME组1 h、3 h、6h各时间点血清NO均低于对照组(P<0.01), 而血清淀粉酶和胰腺病理损害评分均显著高于对照组(P<0.01). 再灌注后1 h、3 h、6 h各时间点胰腺活细胞均低于假手术组(P<0.01), 早期凋亡细胞高于假手术组(P<0.01), L-Arg组1 h、3 h、6 h各时间点活细胞高于对照组(P<0.01), 而L-NAME组则低于对照组(P<0.01); 早期凋亡细胞L-Arg组6 h、L-NAME组1 h、3 h高于对照组(P<0.01). L-Arg组1 h、3 h、6 h各时间点坏死细胞显著低于对照组(P<0.01), 而L-NAME组各时间点均高于对照组(P<0.01).
结论: NO参与了大鼠胰十二指肠移植中的缺血再灌注损伤和胰腺细胞凋亡, 扮演着保护与损伤的双重角色.
引文著录: 苏艳军, 刘其雨, 刁畅, 张建明, 李立, 段体德, 程若川. NO在大鼠胰十二指肠移植中的作用. 世界华人消化杂志 2011; 19(29): 3015-3022
Revised: October 8, 2011
Accepted: October 13, 2011
Published online: October 18, 2011
AIM: To investigate the role of nitric oxide in ischemia-reperfusion injury and cell apoptosis following pancreas-duodenal transplantation in rats.
METHODS: A total of 168 SD rats were used in the study. Seventy-two female rats with diabetes induced by intraperitoneal injection of alloxan were used as donors, and 96 male rats were used as recipients. A rat model of pancreas-duodenal transplantation was developed using dual cannula technique. The 96 male rats were randomly divided into sham group, control group, L-Arg group, and L-NAME group, with 24 rats in each group. Rats of each group were randomly killed at 1 h, 3 h and 6 h. Serum nitric oxide and amylase levels were examined, and pancreatic injury was evaluated. The expression of iNOS in pancreatic tissue was detected by immunohistochemistry, and pancreatic cell apoptosis was evaluated by flow cytometry.
RESULTS: Serum nitric oxide and amylase, pancreas injury scores were significantly higher in the control group (1 h, 3 h, 6 h) than in the sham group (all P < 0.01). Serum nitric oxide was significantly higher and serum amylase and pancreas injury scores were significantly lower in the L-Arg group than in the control group (1 h, 3 h, 6 h) (all P < 0.01). Serum nitric oxide was significantly lower and serum amylase and pancreas injury scores were significantly higher in the L-NAME group than in the control group (all P < 0.01). The percentage of viable cells was significantly lower and apoptosis rate was significantly higher in the control group than in the sham group (all P < 0.01). The percentage of viable cells was significantly lower and apoptosis rate was significantly higher in the L-Arg and L-NAME groups than in the control group (all P < 0.01). The number of necrotic cells in the L-Arg group was lower than that in the control group but higher than that in the L-NAME group (all P < 0.01).
CONCLUSION: Nitric oxide plays a dual role in ischemia-reperfusion injury and cell apoptosis following pancreas-duodenal transplantation in rats.
- Citation: Su YJ, Liu QY, Diao C, Zhang JM, Li L, Duan TD, Cheng RC. Role of nitric oxide in pancreas-duodenal transplantation in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(29): 3015-3022
- URL: https://www.wjgnet.com/1009-3079/full/v19/i29/3015.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i29.3015
细胞凋亡存在于肾[1]、心[2]、肝[3]、肺[4]等重要脏器的移植中, 也发生于胰腺移植的各环节中, 并可能是缺血再灌注损伤(ischemia-reperfusion injury, I/RI)和移植排斥反应的主要机制[5]. 一氧化氮(Nitric Oxide, NO)是一种反应性极强的自由基, NO是以L-精氨酸(L-arginine, L-Arg)为底物, 由多种形式的NOS催化生成, NOS是NO合成过程中的重要限速因素. NOS共有三种亚型: 神经元型NOS(neuronal NOS, nNOS)、内皮型NOS(endothelial NOS, eNOS)和诱导型NOS(inducible NOS, iNOS), eNOS和nNOS正常情况下呈Ca2+依赖性, 其活性受Ca2+浓度和钙调蛋白(calmodulin, CaM)浓度的调节, 而iNOS是Ca2+非依赖性. 本研究的目的在于探讨内源性NO和iNOS在大鼠胰十二指肠移植缺血再灌注损伤和细胞凋亡中的作用.
健康封闭群SD(Sprague-Dawley)大鼠168只(280-350 g), 由昆明医学院实验动物中心提供, 其中96只♂大鼠通过腹腔注射四氧嘧啶制作糖尿病大鼠模型, 作为受体, 72只♀行胰十二指肠切除作为供体.
1.2.1 移植模型的建立: 采用双套管法建立糖尿病大鼠胰十二指肠移植动物模型[6]. 不阻断体循环, 采用双套管将供胰所带腹主动脉和门静脉分别与受体大鼠的左肾动脉和左肾静脉进行套管吻合完成血管重建; 同时将将供体的十二指肠远端与受体的Treitz韧带下2 cm空肠作端侧吻合完成外分泌引流.
1.2.2 分组: 根据处理因素不同, 完全随机分为4组: (1)假手术组(n = 24): 为糖尿病大鼠, 麻醉下行左肾切除后即关腹; (2)对照组(n = 24): 常规行胰腺十二指肠移植, 不作药物干预; (3)L-Arg处理组(n = 24): 在移植的基础上, 受体在开放肾动脉前5 min静脉注射L-Arg(100 mg/kg); (4)L-硝基精氨酸甲酯(L-NAME)处理组(n = 24): 在移植的基础上, 受体在开放肾动脉前5 min静脉注射L-NAME(10 mg/kg). 以上各组大鼠随机分为1 h、3 h、6 h三个亚组, 各时间点8只.
1.2.3 血清指标: 处死动物时腹主动脉采血7 mL, 分为2 mL、5 mL二管, 分别用于血清NO和淀粉酶测定. 血清淀粉酶于全自动生化分析仪上进行; 血清NO采用硝酸还原酶法测定血清NO2-/NO3-含量, 间接反映NO的生成量, 按南京建成生物工程研究所血清NO测定试剂盒说明书操作.
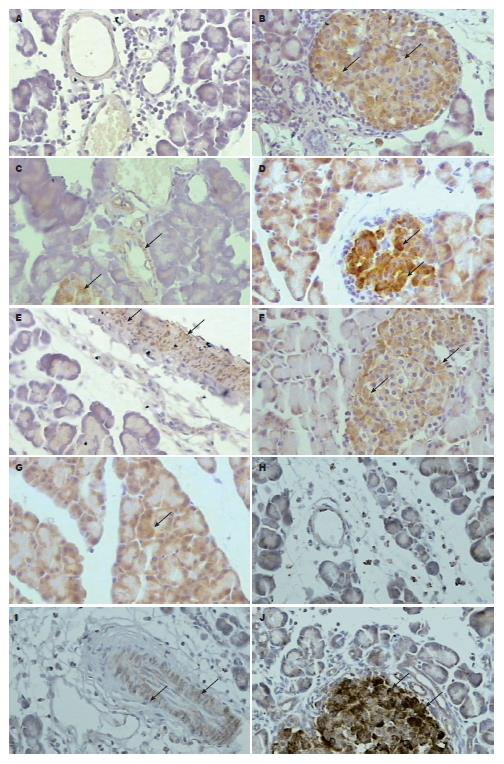
1.2.4 胰腺病理损害评分和iNOS表达检测: 采血完毕, 立即取胰腺组织, 40 g/L甲醛固定, 石蜡包埋, 连续 5 μm切片, HE染色和SABC法iNOS免疫组化染色(兔抗大鼠iNOS多克隆抗体购自美国LabVision公司), 由固定病理医师观察组织病理学改变和iNOS表达情况. 参照Schmidt等[7]的评分标准进行病理学评分.
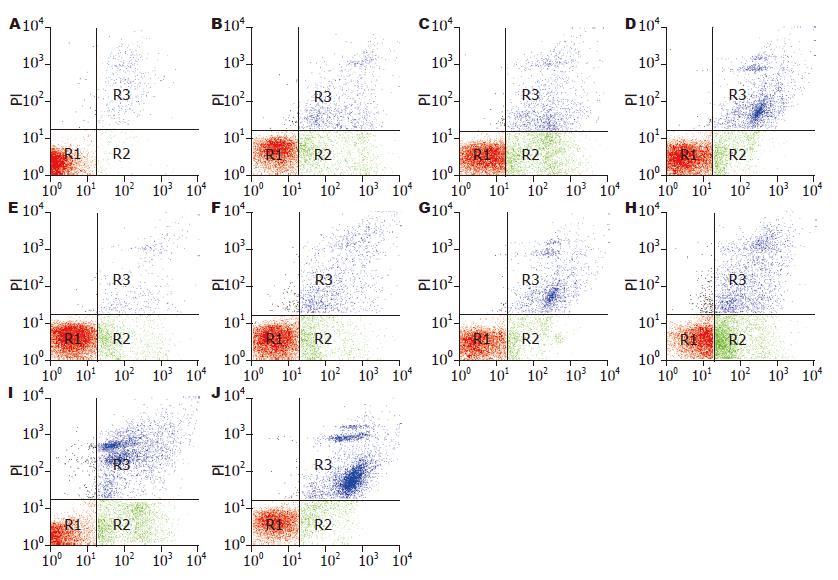
1.2.5 细胞凋亡检测: 取黄豆大小胰腺组织采用研磨法制成单细胞悬液, 按Annexin V/PI凋亡试剂盒说明书(ACT Gene 公司产品)操作, 通过FACSCalibur流式细胞仪(美国Becton Dickinson公司), 收集10 000个细胞, FL1通道检测Annexin V-FITC荧光信号, FL2通道检测PI荧光信号. 结果判定: Annexin V(+)/PI(+)细胞落在右上象限, 为晚期凋亡和坏死细胞; Annexin V(-)/PI(-)细胞落在左下象限, 为活细胞; Annexin V(+)/PI(-)细胞落在右下象限, 为早期凋亡细胞.
统计学处理 采用SPSS统计软件分析. 计量资料以mean±SD表示两组均数的比较, 经方差齐性检验, 采用成组t检验; 多组均数比较, 采用单因素方差分析, P<0.05认为差异有统计学意义.
血清NO和淀粉酶的变化见表1.
| 分组 | NO(µmol/L) | 血清淀粉酶(U/L) | ||||
| 1 h | 3 h | 6 h | 1 h | 3 h | 6 h | |
| 假手术组 | 31.6±5.2b | 31.7±4.8b | 31.1±5.0b | 253.6±37.5b | 248.3±28.7b | 254.3±27.1b |
| 对照组 | 40.8±4.1d | 49.7±5.3 | 60.2±6.7d | 948.9±82.7d | 1769.5±178.0 | 2431.4±239.0d |
| L-Arg组 | 52.3±5.1bd | 61.9±4.9b | 81.1±7.2bd | 517.4±72.9bd | 1241.8±150.6b | 3158.3±234.9bd |
| L-NAME组 | 21.52±1.8bd | 32.4±2.3b | 46.0±8.2bd | 1341.9±189.5bd | 2494.6±220.1b | 3464.4±188.4bd |
假手术组各时间点胰腺组织结构均正常, 无水肿及炎症细胞浸润、出血等. 对照组1 h胰腺组织结构改变轻微, 腺泡轮廓基本清晰, 局部有胰腺小叶间隙增宽, 间质少量炎性细胞浸润, 随再灌注时间延长, 小叶腺泡细胞间水肿加重, 炎症细胞渗出增多, 并可见少量腺泡细胞破坏及出血灶. L-Arg处理后, 与对照组比较可看到1 h、3 h的间质炎症细胞浸润明显减少, 腺泡细胞的破坏也显著减少, 但6 h则炎症细胞浸润及小叶结构破坏等病理损害均明显加重; L-NAME处理后, 与对照组比较可见各时间点胰腺的水肿、炎症细胞浸润及小叶结构破坏、出血等病理损害均显著加重. 胰腺病理损害评分见表2.
胞浆内棕黄色颗粒为阳性, 无着色为阴性. 胰腺组织iNOS免疫组织化学染色发现, 假手术组各时间点的胰腺均无iNOS阳性染色. 对照组再灌注1 h有阳性染色, 主要见于胰岛细胞, 随时间延长逐渐表达于血管平滑肌细胞和胰腺腺泡细胞; L-Arg组1 h除表达于胰岛细胞外, 部分胰腺腺泡细胞、血管平滑肌细胞也有表达, 3 h、6 h表达逐渐增强; L-NAME处理后, 1 h无iNOS阳性染色, 3 h始见血管平滑肌细胞表达; 6 h则可见部分胰岛细胞也有表达, 但可见显著炎症细胞浸润和胰腺小叶结构的破坏(图1).
| 组别 | 再灌注时间 | 活细胞 | 早期凋亡 | 晚期凋亡细胞 |
| 假手术组 | 1 h | 94.6±1.0bd | 1.9±0.3bd | 3.5±0.9bd |
| 3 h | 94.3±1.2 bd | 1.8±0.3bd | 4.1±0.9bd | |
| 6 h | 94.3±0.9 bd | 2.0±0.2bd | 3.7±0.8bd | |
| L-Arg组 | 1 h | 81.0±1.5de | 10.8±1.0a | 8.3±2.3d |
| 3 h | 76.7±1.2d | 14.1±1.7 | 9.4±2.0d | |
| 6 h | 61.6±1.9de | 15.7±1.9d | 22.7±2.4de | |
| 对照组 | 1 h | 75.4±3.2e | 11.0±1.6e | 12.4±4.8 |
| 3 h | 70.2±1.7 | 16.6±2.8 | 13.2±3.7 | |
| 6 h | 72.3±2.2 | 10.5±1.5e | 16.3±3.1 | |
| L-NAME组 | 1 h | 58.4±2.4de | 22.6±2.8de | 17.9±4.3de |
| 3 h | 52.8±2.7d | 20.5±2.1d | 26.8±2.9d | |
| 6 h | 44.3±4.0de | 11.3±1.8e | 44.1±4.5de |
I/RI是胰腺移植中不可回避的问题[8-10]. 胰腺移植后早期胰腺炎的发生率为17%-35%[11], 而I/RI则是引起移植胰腺炎的主要原因. 胰腺的I/RI可进一步导致局部和全身并发症, 严重者引起移植物功能丧失甚至受体死亡. 本研究在大鼠胰十二指肠移植模型中观察到, 再灌注1 h就有血清淀粉酶升高和胰腺病理损害的证据, 并且再灌注3 h、6 h胰腺损害逐渐加重, 表明该模型中胰十二指肠的缺血再灌注同样可导致再灌注性胰腺炎的发生, 移植模型的建立是成功的.
NO在胰腺移植I/RI中所起的作用认识尚未统一, 有的学者认为NO在胰腺I/RI中具有加重损害的作用[12-14], 有的认为有保护作用[15-17]. 我们在该移植模型中观察到胰腺移植后, 血清淀粉酶、胰腺病理损害和血清NO均随再灌注时间延长逐渐增高, 并且各时间点间差异均具有统计学意义(P<0.05). 早期我们的研究认为NO通过氧自由基对移植的胰腺具有损害作用[18]. 由于没有对血清NO水平进行干预, 不能说是NO原发性升高介导胰腺的损害, 还是胰腺损害后继发性NO升高发挥对胰腺的保护作用. 因此, 本研究在胰腺再灌注前静脉注射小剂量L-Arg升高血清NO水平, 发现再灌注1 h、3 h血清淀粉酶水平、胰腺炎症细胞浸润、病理损害评分均显著低于或轻于对照组, 而6 h则血清淀粉酶水平、胰腺炎症细胞浸润及病理损害评分均显著降增高, 高于对照组(P<0.05). 提示胰腺移植缺血再灌注早期(1 h、3 h)产生的内源性NO有减轻I/RI的作用, 这与原春辉等[19]的研究是一致的. 本实验同时采用NOS抑制剂L-NAME进行干预, 各时间点的血清NO水平下降后, 血清淀粉酶及胰腺的病理损害显著加重, 这也从反面说明NO对I/RI的保护作用.
NO是以L-Arg为底物,由多种形式的NOS催化生成. NOS共有三种亚型:神经元型NOS(neuronal NOS, nNOS)、内皮型NOS(endothelial NOS, eNOS)和诱导型NOS(inducible NOS, iNOS), eNOS和nNOS正常情况下呈Ca2+依赖性, 其活性受Ca2+浓度和钙调蛋白的调节. 李柏峰等[14]对大鼠胰腺移植中的胰腺组织NOS亚型的活性检测发现, cNOS在各实验组(空白对照组、移植组和处理组)中无显著性差异, 而移植组iNOS显著高于对照组, 并且发现iNOS表达于胰腺组织的血管内皮细胞、平滑肌细胞和胰岛细胞, 可见胰腺移植中的NO主要来源于iNOS. 而移植再灌注早期产生的内源性NO可能来自于cNOS合成的, 可以改善微循环, 减轻组织水肿和炎症细胞浸润, 适当补充可发挥NO的保护作用[19]. 实验性胰腺炎动物模型研究中发现胰腺和肺组织中均有iNOS过度表达, 由此引起的NO过量产生介导了胰腺和肺组织的氧化损伤[20,21]. 本研究通过免疫组化检测胰腺iNOS的表达, 发现胰腺组织的血管内皮细胞、平滑肌细胞和胰岛细胞都有iNOS表达, 且随时间延长表达逐渐增强. 由iNOS生成的NO适当补充cNOS介导的NO生成的不足可发挥一定的保护作用; 但在6 h可看到胰腺腺泡细胞也广泛表达iNOS, 此时大量NO生成而表现出胰腺的损害作用. 本实验同时也发现, 对照组和L-Arg处理组6 h的NO大量生成对胰腺的缺血再灌注有显著的损害作用, 而应用L-NAME抑制NO生成后, 6 h的血清淀粉酶和病理损害仍较对照组和L-Arg处理组6 h重, 可能为1 h、3 h时NO作为保护因素被抑制, 其他损伤因素占优势而导致严重的胰腺损伤, 而在6 h作为损害因素的NO水平下降并不能显著地改善1 h、3 h所导致的损伤.
目前研究发现胰腺移植的各个环节都有细胞凋亡的参与[5]. 不同器官再灌注后发生细胞凋亡的高峰期不尽相同, 研究认为细胞凋亡是胰腺移植I/RI的早期事件[22]. 李涛等[23]研究发现细胞凋亡与移植胰腺急性排斥反应的严重程度呈正相关, 细胞凋亡指数可作为判断移植物损伤程度的指标. 既往国内外相关文献中报道的检测细胞凋亡最为常用的方法为TUNEL法标记DNA断裂[24], 该法检测到的是凋亡晚期甚至已发生坏死的细胞. Drognitz等[25]发现胰腺移植时的细胞凋亡主要发生在再灌注期, 胰腺再灌注1-2 h就有细胞凋亡, 且均显著高于切取保存同等时间而未移植的胰腺. 张召辉等[21]对大鼠冷缺血2 h的胰腺分别于再灌注1、3、6、9、12 h行细胞凋亡TUNEL检测, 发现再灌注1h就有细胞凋亡, 3 h达凋亡高峰, 随后逐渐下降, 所以认为细胞凋亡是缺血再灌注损伤的早期事件. 本实验通过特异性结合细胞膜的磷脂酰丝氨酸结合蛋白(Annexin V, AV)作为探针检测早期凋亡细胞, 同时利用碘化丙啶(PI)不能透过完整细胞膜的特点, 将两者结合, 应用AV/PI双染法检测早期凋亡细胞、晚期凋亡细胞和活细胞, 发现胰腺冷缺血保存90 min后, 再灌注1 h细胞凋亡就显著增加, 随再灌注时间延长, 早期凋亡细胞在3 h达高峰, 为16.6%±1.5%, 而晚期凋亡和坏死细胞则随再灌注时间延长逐渐增加, 6 h最高达16.3%±3.1%.
本研究也观察到NO对胰腺细胞凋亡的双向调节作用. Xiaoguang等[26]和Tanaka等[27]发现NO介导的细胞凋亡在异基因大鼠胰腺移植急性排斥反应中发挥重要的作用. 他们对发现同基因移植胰腺的腺泡细胞轻度表达iNOS, 并且移植前后无显著性变化, 而异基因移植后的胰腺iNOS表达显著增加, 明显高于同基因移植组和经氨基胍处理的异基因移植胰腺. 另外发现移植后细胞凋亡指数与iNOS表达具有显著相关性. 由此认为, NO介导的细胞凋亡在胰腺移植急性排斥反应中具有重要作用, iNOS抑制剂氨基胍通过减少内源性NO生成而减轻异基因移植的胰腺损伤. 而同基因大鼠胰腺移植中是否也有类似的调节作用, 目前未见报道. 本研究采用SD大鼠进行同基因胰十二指肠移植, 发现移植大鼠血清NO随再灌注时间延长逐渐增加, 而早期凋亡细胞于3 h达高峰, 晚期凋亡细胞于6 h达高峰, 似乎是NO介导了细胞凋亡的发生; 然而我们在再灌注早期使用小剂量的内源性NO供体L-Arg, 使受体血清中NO水平增高, 可显著减少移植物1 h、3 h晚期凋亡细胞数, 显著性提高了其活细胞比例, 而显著增加了6 h的早期凋亡和晚期凋亡细胞比例, 从而使活细胞显著下降. 另一方面, 我们在再灌注早期使用NOS抑制剂(L-NAME)抑制NO生成, 显著增加了1 h、3 h、6 h各时间的早期和晚期凋亡细胞数, 从而显著减少了有功能的活细胞数. 胰腺移植再灌注早期NO不是原发性升高发挥促凋亡作用的, 而是再灌注损伤后继发性升高发挥抗损伤和抗凋亡作用的, 而在6 h异常升高的NO则有促凋亡作用. 可见, NO对胰腺细胞的凋亡也有双向调节作用. 参与胰腺细胞凋亡是因素较多, 目前对胰腺细胞凋亡研究较多的是Fas/FasL系统[28,29]和Bax/Bcl-2系统[30], 他们最终激活caspase家族酶链反应, 导致细胞凋亡的发生, 而NO在胰腺细胞凋亡中的作用目前仍然不清楚.
本研究结果表明大鼠胰十二指肠移植中存在I/RI和细胞凋亡, 再灌注早期产生的NO对I/RI和细胞凋亡有双重的调节作用, 但NO的确切的分子机制仍有待于进一步的深入研究.
缺血再灌注损伤(I/RI)是胰腺移植中不可回避的问题, 也是引起移植胰腺炎和移植失败的主要原因. 目前研究发现胰腺移植的各个环节都有细胞凋亡的参与, 研究认为细胞凋亡是胰腺移植I/RI的早期事件. NO在胰腺移植I/RI中所起的作用认识尚未统一, 有的学者认为NO在胰腺I/RI中具有加重损害的作用, 有的认为有保护作用.
朱亮, 副教授, 大连医科大学生理教研室
一氧化氮(NO)广泛分布于生物体内各组织中, NO是以L-精氨酸(L-arginine, L-Arg)为底物, 由多种形式的NOS催化生成, 是一种新型生物信使分子, 在体内可转化成具有强烈的细胞毒性作用的自由基, 他在胰腺移植中的作用非常复杂, 一方面NO可以改善胰腺炎的微循环, 减轻组织水肿和炎症细胞浸润, 同时NO通过调节BaX、bcl-2等凋亡相关基因, 调控胰腺细胞的凋亡, 另一方面, 大量的NO又加重胰腺的缺血再灌注损伤和细胞凋亡. 可见, NO在胰腺移植缺血/再灌注损伤中的作用复杂, 认识尚未统一. 因此如何有效利用NO的生物学作用已成为NO研究的热点.
李柏峰等利用诱导型NO合酶选择性抑制剂氨基胍在大鼠胰腺移植进行试验干预, 发现对移植的胰腺起到保护作用. 可能是氨基胍抑制NO的过量产生, 减轻其作为自由基的细胞毒性有关.
有关NO在胰腺移植中的作用国内临床和基础研究均有报道, 但同时从提供NO合酶底物L-Arg和NO合酶抑制剂L-NAME研究的文献很少, 体现了文章的创新性.
本研究结果表明大鼠胰十二指肠移植中存在I/RI和细胞凋亡, 再灌注早期产生的NO对I/RI和细胞凋亡有双重的调节作用, 但NO的确切的分子机制仍有待于进一步的深入研究, 如何有效地在恰当的时间进行干预以最大的发挥NO的保护作用而避免损害作用, 也将成为进一步的内容.
本研究选题新颖, 设计科学, 结果可靠, 具有较好的学术价值.
编辑: 李军亮 电编:闫晋利
| 1. | Porter CJ, Ronan JE, Cassidy MJ. fas-fas-ligand antigen expression and its relationship to increased apoptosis in acute renal transplant rejection. Transplantation. 2000;69:1091-1094. [PubMed] [DOI] |
| 2. | Takahashi W, Suzuki JI, Izawa A, Takayama K, Yamazaki S, Isobe M. Inducible nitric oxide-mediated myocardial apoptosis contributes to graft failure during acute cardiac allograft rejection in mice. Jpn Heart J. 2000;41:493-506. [PubMed] [DOI] |
| 3. | Song E, Su F, Chen J, Ou Q, Wang M, Exton MS. Blocking CTL-based cytotoxic pathways reduces apoptosis of transplanted hepatocytes. J Surg Res. 2001;99:61-69. [PubMed] [DOI] |
| 4. | Ng SC, Wan S, Yim A P. Pulmonary Ischemia-Reperfusion Injury: role of apoptosis. Eur Respir J. 2005;25:356-363. |
| 6. | 刘 其雨, 程 若川, 苏 艳军, 张 建明, 刁 畅. 双套管法制作大鼠胰十二指肠移植模型. 中国普外基础与临床杂志. 2007;14:420-422. |
| 7. | Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT, Warshaw AL. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992;215:44-56. [PubMed] [DOI] |
| 8. | Oehmann C, Benz S, Drognitz O, Pisarski P, Hopt UT, Obermaier R. Remote preconditioning reduces microcirculatory disorders in pancreatic ischemia/reperfusion injury. Pancreas. 2007;35:e45-e50. [PubMed] [DOI] |
| 9. | Woeste G, Wullstein C, Meyer S, Usadel KH, Hopt UT, Bechstein WO, von Dobschuetz E. Octreotide attenuates impaired microcirculation in postischemic pancreatitis when administered before induction of ischemia. Transplantation. 2008;86:961-967. [PubMed] [DOI] |
| 10. | Obermaier R, Drognitz O, Benz S, Hopt UT, Pisarski P. Pancreatic ischemia/reperfusion injury: impact of different preservation temperatures. Pancreas. 2008;37:328-332. [PubMed] [DOI] |
| 11. | Drognitz O, Michel P, Koczan D, Neeff H, Mikami Y, Obermaier R, Thiesen HJ, Hopt UT, Loebler M. Characterization of ischemia/reperfusion-induced gene expression in experimental pancreas transplantation. Transplantation. 2006;81:1428-1434. [PubMed] [DOI] |
| 12. | Ayub K, Serracino-Inglott F, Williamson RC, Mathie RT. Expression of inducible nitric oxide synthase contributes to the development of pancreatitis following pancreatic ischaemia and reperfusion. Br J Surg. 2001;88:1189-1193. [PubMed] [DOI] |
| 15. | Benz S, Schnabel R, Weber H, Pfeffer F, Wiesner R, von Breitenbuch P, Nizze H, Schareck W, Hopt UT. The nitric oxide donor sodium nitroprusside is protective in ischemia/reperfusion injury of the pancreas. Transplantation. 1998;66:994-999. [PubMed] [DOI] |
| 16. | Benz S, Obermaier R, Wiessner R, Breitenbuch PV, Burska D, Weber H, Schnabel R, Mayer J, Pfeffer F, Nizze H. Effect of nitric oxide in ischemia/reperfusion of the pancreas. J Surg Res. 2002;106:46-53. |
| 17. | Obermaier R, von Dobschuetz E, Muhs O, Keck T, Drognitz O, Jonas L, Schareck W, Hopt UT, Benz S. Influence of nitric oxide on microcirculation in pancreatic ischemia/reperfusion injury: an intravital microscopic study. Transpl Int. 2004;17:208-214. [PubMed] [DOI] |
| 19. | Yuan CH, Liu YF, Cheng Y, Zhao N, Li GC, Liang J, He SG. Protective effects of L-arginine on reperfusion injury after pancreaticoduodenal transplantation in rats. Hepatobiliary Pancreat Dis Int. 2004;3:349-354. [PubMed] [DOI] |
| 20. | Leindler L, Morschl E, László F, Mándi Y, Takács T, Jármai K, Farkas G. Importance of cytokines, nitric oxide, and apoptosis in the pathological process of necrotizing pancreatitis in rats. Pancreas. 2004;29:157-161. [PubMed] [DOI] |
| 21. | Viola G, al-Mufti RA, Sohail M, Williamson RC, Mathie RT. Nitric oxide induction in a rat model of selective pancreatic ischemia and reperfusion. Hepatogastroenterology. 2000;47:1250-1255. [PubMed] [DOI] |
| 23. | 李 涛, 罗 军, 温 浩. 细胞凋亡在大鼠胰腺移植急性排斥反应中的作用. 中国普外基础与临床杂志. 2007;14:59-62. |
| 24. | Obermaier R, von Dobschuetz E, Drognitz O, Hopt UT, Benz S. Ischemic preconditioning attenuates capillary no-reflow and leukocyte adherence in postischemic pancreatitis. Langenbecks Arch Surg. 2004;389:511-516. [PubMed] [DOI] |
| 25. | Drognitz O, Von Dobschuetz E, Kissler H, Liu X, Obermaier R, Neeff H, Hopt UT, Benz S. Organ procurement in experimental pancreas transplantation with minimal microcirculatory impairment. Eur Surg Res. 2004;36:185-191. [PubMed] [DOI] |
| 26. | Xiaoguang N, Zhong L, Hailong C, Ping Z, Xiaofeng B, Fenglin G. The relation between apoptosis of acinar cells and nitric oxide during acute rejection of pancreas transplantation in rats. Transpl Immunol. 2003;11:15-21. [PubMed] [DOI] |
| 27. | Tanaka S, Kamiike W, Ito T, Uchikoshi F, Matsuda H, Nozawa M, Kumura E, Shiga T, Kosaka H. Generation of nitric oxide as a rejection marker in rat pancreas transplantation. Transplantation. 1995;60:713-717. [PubMed] [DOI] |
| 28. | Kornmann M, Ishiwata T, Maruyama H, Beger HG, Korc M. Coexpression of FAS and FAS-ligand in chronic pancreatitis: correlation with apoptosis. Pancreas. 2000;20:123-128. [PubMed] [DOI] |
| 29. | Hsu PN, Lin HH, Tu CF, Chen NJ, Wu KM, Tsai HF, Hsieh SL. Expression of human Fas ligand on mouse beta islet cells does not induce insulitis but is insufficient to confer immune privilege for islet grafts. J Biomed Sci. 2001;8:262-269. [PubMed] [DOI] |
| 30. | Fiorina P, Torriani G, Gremizzi C, Davalli AM, Orsenigo E, Bruno Ventre M, Dell'Antonio G, Carlo VD, Rossini S, Secchi A. Selective intra-graft apoptosis and down-regulation of lymphocyte bcl-2, iNOs and CD95L expression in kidney-pancreas transplanted patients after anti-Thymoglobulin induction. Transpl Int. 2004;17:603-608. [PubMed] [DOI] |