修回日期: 2011-10-02
接受日期: 2011-10-06
在线出版日期: 2011-10-08
目的: 探讨CCT亚基γ在人肝细胞癌组织中的表达和意义.
方法: 用免疫组织化学一步法检测35例肝癌及癌旁组织、12例正常肝组织中的CCT亚基γ表达.
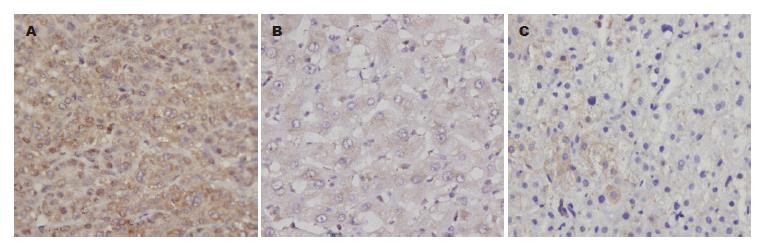
结果: CCT亚基γ在肝癌组织的阳性表达率为88.57%(31/35), 在癌旁组织中的阳性表达率为62.86%(22/35), 在正常肝组织中的阳性表达率为41.67%(5/12). CCT亚基γ在肝癌组织中的表达明显高于癌旁组织和正常肝组织, 具有显著性差异(P<0.05). CCT亚基γ的表达与肝癌患者年龄、乙肝表面抗原、有无门静脉癌栓、AFP水平、肿瘤直径及临床分期均不相关(P>0.05), 但CCT亚基γ的过度表达与肝癌患者肿瘤细胞分化程度相关(P<0.05) , 肿瘤细胞分化程度越低, CCT亚基γ的表达越高.
结论: CCT亚基γ在人肝细胞癌组织中表达增高可能与肝细胞的癌变有关.
引文著录: 谭晓虹, 曹骥, 欧超, 汪多平. CCT亚基γ在人肝细胞癌组织中的表达及意义. 世界华人消化杂志 2011; 19(28): 2987-2990
Revised: October 2, 2011
Accepted: October 6, 2011
Published online: October 8, 2011
AIM: To evaluate the significance of expression of CCT subunit γ in human hepatocellular carcinoma (HCC).
METHODS: The expression of CCT subunit γ was detected by immunohistochemistry in 35 cases of HCC and tumor adjacent tissue and 12 cases of normal liver tissue.
RESULTS: The positive rate of CCT subunit γ expression in HCC was significantly higher than those in tumor adjacent and normal liver tissues (88.57% vs 62.86%, 41.67%, both P < 0.05). The expression of CCT subunit γ was not correlated with age, hepatitis B surface antigen, portal venous tumor emboli, AFP level, tumor size or clinical stage (all P > 0.05), but was negatively correlated with tumor differentiation (P < 0.05).
CONCLUSION: CCT subunit γ is overexpressed in HCC, and CCT overexpression may be related with HCC carcinogenesis.
- Citation: Tan XH, Cao J, Ou C, Wang DP. Significance of expression of CCT subunit γ in human hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(28): 2987-2990
- URL: https://www.wjgnet.com/1009-3079/full/v19/i28/2987.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i28.2987
肝细胞癌(hepatocellular carcinoma, HCC)是一种常见的恶性肿瘤, 严重危害着人类健康. 2002年世界卫生组织发表的全球肿瘤统计分析报告表明, 全世界新患肝癌人数约为626 000, 死亡人数约为598 000; 新患肝癌病例中的55%发生在中国[1]. 肝癌的发生和发展是一个多因素、多步骤、多基因作用的复杂过程, 分子伴侣蛋白可能参与了肝癌的发生发展过程[2,3]. 伴侣蛋白携带t复合多肽1(the chaperonin containing tailless complex polypeptide 1, CCT), 是存在于真核细胞胞质中重要的分子伴侣[4], 主要功能是能够特异地帮助细胞内新生的肌动蛋白、微管蛋白、周期蛋白E等折叠[5,6]. 哺乳动物CCT由7-9种不同的亚基组成, 而且每个亚基的作用互不相同[7]. 目前国内外关于CCT亚基γ和肝细胞癌的研究报道很少, 本实验通过免疫组化检测人HCC、癌旁组织和正常肝组织中CCT亚基γ的表达, 初步探讨CCT亚基γ在HCC发生和发展过程中的作用.
收集广西医科大学附属肿瘤医院2006-2010年初治, 经手术切除, 有完整临床背景资料的肝细胞癌及癌旁组织石蜡标本各35例. 男33例, 女2例, 年龄24-60(平均年龄47)岁, 术后均经病理证实为肝细胞性肝癌. 12例正常肝组织作为对照. 兔抗CCT3(CCT亚基γ)多克隆抗体购自美国Proteintech Group, Inc, 鼠抗兔IgG购自天津津脉基因测绘技术有限公司, DAB显色试剂盒购自福州迈新公司, 磷酸盐缓冲液(0.01 mol/L, pH7.5)、柠檬酸盐抗原修复液(0.01 mol/L, pH6.0)为国产分析纯试剂, 用双蒸水配置.
常规制片, 按免疫组织化学一步法进行染色, 用已知标准片作为阳性对照, 以磷酸缓冲液代替一抗作阴性对照. 由两名经验丰富的病理科医师对结果进行判断定. 随机采集10个具有代表性的视野进行计数, 取平均数值. 结果判断标准: 细胞质出现棕黄色颗粒为阳性细胞, (-) 为无阳性细胞, 弱阳性(+)为阳性细胞数≤25%, 中等阳性(++)为阳性细胞数25%-50%, 强阳性(+++)为阳性细胞数≥50%.
统计学处理 实验结果采用SPSS16.0统计软件进行统计分析, 计数资料的差异性分析使用χ2检验, P<0.05为差异具有统计学意义.
CCT亚基γ阳性表达定位于细胞质(图1). 肝癌组织中CCT亚基γ阳性细胞呈弥漫性或小巢状分布, CCT亚基γ阳性表达率(88.57%)明显高于癌旁组织(62.86%)及正常肝组织(41.67%)(表1).
| 分组 | n | +++ | ++ | + | - | 阳性表达率(%) | χ2值 | P值 |
| 肝癌组织 | 35 | 11 | 17 | 3 | 4 | 88.57 | ||
| 癌旁组织 | 35 | 2 | 10 | 10 | 13 | 62.86 | ||
| 正常肝组织 | 12 | 0 | 0 | 5 | 7 | 41.67 | 11.3258 | 0.0035 |
CCT亚基γ的过度表达与肝癌患者年龄、乙肝表面抗原、有无门静脉癌栓、AFP水平、肿瘤直径及临床分期均不相关(P>0.05), 但CCT亚基γ的过度表达与肿瘤细胞分化程度相关(P<0.05), 即肿瘤细胞分化越低, CCT亚基γ的过度表达率就越高(表2).
| 临床特征 | n | (++)-(+++)表达 | (-)-(+)表达 | P值 |
| 年龄(岁) | 0.689 | |||
| ≤47 | 22 | 17(77.3) | 5(22.7) | |
| >47 | 13 | 11(84.6) | 2(15.4) | |
| HBsAg | 0.381 | |||
| 阳性 | 25 | 21(84.0) | 4(16.0) | |
| 阴性 | 10 | 7(70.0) | 3(30.0) | |
| 分化程度 | 0.008 | |||
| 高分化 | 3 | 1(33.3) | 2(66.7) | |
| 中分化 | 21 | 16(76.2) | 5(23.8) | |
| 低分化 | 11 | 11(100.0) | 0(0.0) | |
| 门静脉癌栓 | 0.383 | |||
| 有 | 13 | 9(69.2) | 4(30.8) | |
| 无 | 22 | 19(86.4) | 3(13.6) | |
| AFP水平(µg/L) | 0.415 | |||
| <400 | 19 | 14(73.7) | 5(26.3) | |
| ≥400 | 16 | 14(87.5) | 2(12.5) | |
| 肿瘤直径 | 0.381 | |||
| <5cm | 10 | 7(70.0) | 3(30.0) | |
| ≥5cm | 25 | 21(84.0) | 4(16.0) | |
| 临床分期 | 0.415 | |||
| Ⅰ-Ⅱ | 16 | 14(87.5) | 2(12.5) | |
| Ⅲ-Ⅳ | 19 | 14(73.7) | 5(26.3) |
分子伴侣素或称分子伴侣蛋白(chaperonin)是一类能特异地结合和释放底物蛋白的蛋白分子, 他们帮助底物蛋白实现正确折叠、寡聚体组装、向特定细胞器转运或变换活化/去活化构象等. 分子伴侣素是进化上最为保守的蛋白之一, 从结构上可以分为两类, 一类见于原核细胞和真核细胞器, 以GroEL和HSP60为代表; 另一类见于古细菌和真核细胞, 以thermosome和CCT为代表. CCT是一种广泛存在于真核细胞胞质中的异型杂合寡聚蛋白, 由8个亚基CCT α, β, γ, δ, ε, ζ, η和θ组成, 在肌动蛋白、微管蛋白的组装和折叠中发挥重要的作用[8-10].
目前国内外对分子伴侣蛋白与肿瘤关系的研究陆续均有报道, 陈志芬等[11]报道HSP60在胃腺癌中的阳性率和过表达率均明显高于胃癌前病变, 因此认为HSP60可能与胃腺癌的发生、发展有关. Coghlin等[12]采用比较蛋白组学检测到CCT亚基β和亚基ε在结直肠癌中过表达, 并且CCT亚基β的表达与病人的预后有关. 王廷峰等[13]报道CCT6A在结直肠癌组织中高表达, 与肿瘤浸润深度和肿瘤大小有关, 认为CCT6A可作为诊断结直肠癌的潜在标志物. 王葵等[14]用cDNA芯片研究人原发性肝癌伴和不伴门静脉癌栓形成的基因表达差异, 结果发现CCT亚基γ基因表达共同上调. Yokota等[15]通过免疫组化检测发现肝细胞癌和结肠癌组织高表达CCT亚基β, 并与癌旁组织表达存在显著性差异.
本实验发现肝癌组织中CCT亚基γ表达明显高于癌旁组织及正常肝组织, 并呈现正常肝组织、癌旁组织、肝癌组织表达逐渐增高的趋势, 这提示CCT亚基γ有可能参与了肝细胞癌的发生发展. CCT亚基γ的过度表达与肝癌细胞分化程度相关, 细胞分化越低, CCT亚基γ的过度表达率就越高. 推测CCT亚基γ有可能通过影响细胞肌动蛋白、微管蛋白的组装和折叠, 导致微管蛋白和微丝蛋白失去正常构象而参与细胞的恶性转化[16].
本研究通过免疫组织化学检测发现肝癌组织中CCT亚基γ表达增高并与肿瘤细胞分化程度呈负相关, 初步表明CCT亚基γ可能参与肝癌的分子发病机制, 但具体机制尚待深入研究.
肝癌是一种常见的恶性肿瘤, 严重危害着人类健康. 肝癌的发生和发展是一个多因素、多步骤、多基因作用的复杂过程, 找出肝癌中具有异常表达的基因或蛋白并对其进行研究, 对肝癌的诊断与治疗具有重要的意义. 研究表明分子伴侣蛋白可能参与了肝癌的发生发展过程.
周晓武, 副主任医师, 中国人民解放军空军总医院普通外科
研究发现肝癌、胃癌、结直肠癌等肿瘤组织中出现分子伴侣蛋白的异常表达, 但具体机制尚不明了.
王葵等用cDNA 芯片研究人原发性肝癌伴和不伴门静脉癌栓形成的基因表达差异, 结果发现CCT亚基γ基因表达共同上调.
本文应用免疫组织化学初步研究了CCT亚基γ在肝癌组织中的表达及意义, 具有一定的新颖性, 有一定的临床实用价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 2. | Pang R, Tse E, Poon RT. Molecular pathways in hepatocellular carcinoma. Cancer Lett. 2006;240:157-169. [PubMed] [DOI] |
| 4. | Frydman J. Folding of newly translated proteins in vivo: the role of molecular chaperones. Annu Rev Biochem. 2001;70:603-647. [PubMed] [DOI] |
| 5. | Won KA, Schumacher RJ, Farr GW, Horwich AL, Reed SI. Maturation of human cyclin E requires the function of eukaryotic chaperonin CCT. Mol Cell Biol. 1998;18:7584-7589. [PubMed] |
| 6. | McCallum CD, Do H, Johnson AE, Frydman J. The interaction of the chaperonin tailless complex polypeptide 1 (TCP1) ring complex (TRiC) with ribosome-bound nascent chains examined using photo-cross-linking. J Cell Biol. 2000;149:591-602. [PubMed] [DOI] |
| 7. | 常 晓燕, 陈 杰. 伴侣素CCT的结构及与肌动蛋白、微管蛋白的作用机制. 国外医学·生理病理科学与临床分册. 2003;23:596-598. |
| 8. | Fares MA, Wolfe KH. Positive selection and subfunctionalization of duplicated CCT chaperonin subunits. Mol Biol Evol. 2003;20:1588-1597. [PubMed] [DOI] |
| 9. | Valpuesta JM, Martín-Benito J, Gómez-Puertas P, Carrascosa JL, Willison KR. Structure and function of a protein folding machine: the eukaryotic cytosolic chaperonin CCT. FEBS Lett. 2002;529:11-16. [PubMed] [DOI] |
| 10. | Kubota H. Function and regulation of cytosolic molecular chaperone CCT. Vitam Horm. 2002;65:313-331. [PubMed] [DOI] |
| 12. | Coghlin C, Carpenter B, Dundas SR, Lawrie LC, Telfer C, Murray GI. Characterization and over-expression of chaperonin t-complex proteins in colorectal cancer. J Pathol. 2006;210:351-357. [PubMed] [DOI] |
| 15. | Yokota S, Yamamoto Y, Shimizu K, Momoi H, Kamikawa T, Yamaoka Y, Yanagi H, Yura T, Kubota H. Increased expression of cytosolic chaperonin CCT in human hepatocellular and colonic carcinoma. Cell Stress Chaperones. 2001;6:345-350. [PubMed] [DOI] |